TLR7通过NF-κB炎症通路调控ION-CCI模型大鼠三叉神经痛的机制
张宏伟,沈 莲,吴贝贝,王元银,王烈成
三叉神经痛(trigeminal neuralgia,TN)是发生在三叉神经分布区可引起剧烈的面部疼痛。卡马西平作为TN的一线药物治疗[1-2],长期使用具有药物依赖性和相关并发症的发生[3]。因此,需要对这种病理机制不明且痛感强烈的疾病有更好的治疗方案。Toll样受体7(Toll-like receptor 7,TLR7)是Toll样家族成员之一,通过增加感觉神经元的兴奋性参与疼痛和瘙痒[4-5]。TLR7在受损背根神经节中表达水平升高并促进神经性疼痛[6-7],但TLR7是否参与三叉神经病理性疼痛尚不清楚。有证据[8]表明,核因子-κB(nuclear factor kappa-B,NF-κB)在神经性疼痛发生中起关键作用。哺乳动物NF-κB家族由5种转录因子组成:p65(也称为RelA)、RelB、c-Rel、p105/p50和p100/p52,其中RELA(p65)-p50异二聚体最常被检测到,并且负责最多的转录活性[9]。同时,炎症因子如TNF-α、IL-1β也是产生和维持神经病理性疼痛的原因[10]。
该研究建立大鼠TN模型,通过检测TLR7、p65、p-p65及炎症因子(TNF-α、IL-1β)水平的变化验证TLR7通过激活感觉神经元中的NF-κB而调控神经病理性疼痛。
1 材料与方法
1.1 主要试剂、仪器Von Frey hair纤毛刺激丝购自美国Stoelting科技有限公司(货号:N5210);高速低温组织研磨仪购自武汉赛维尔生物科技有限公司(货号:KZ-Ⅲ-F);实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪购自美国BIO-RAD公司(货号:9700);PrimeScript RT reagent Kit、TB Green Premix Ex TaqⅡ(Tli RNaseH Plus)购自日本TaKaRa生物科技有限公司;qRT-PCR引物购自上海生工生物工程科技有限公司;SDS-PAGE凝胶配制试剂盒、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;TLR-7抑制剂Hydroxychloroquine Sulfate购自上海蓝木化工公司 (货号:NSC 4375);TLR7 Antibody购自美国Affinity Biosciences公司(货号:DF6173);Phospho-NF-κB p65 Antibody 购自合肥千俞生物科技有限公司(货号:S536);NF-κB p65 Antibody购自上海磐超生物科技有限公司(货号:YM3111);TNF-α Antibody购自武汉塞维尔生物科技有限公司(货号:GB11188);IL-1β Antibody购自北京博奥森生物科技有限公司(货号:BS-0812R)。
1.2 实验动物及TN模型的构建
1.2.1实验动物 选用由安徽医科大学实验动物中心提供的成年雄性Sprange-Dawley(SD)大鼠,体质量(180~200)g ,常规饲料饲养,饲养温度控制在(23~28)℃,12 h/12 h明暗交替光照,自由饮水饮食。动物实验通过安徽医科大学实验动物伦理委员会批准(批号:LLSC20190705)。
1.2.2TN模型的构建 选用颧骨下入路眶下神经缩窄术(infraorbital nerve-chronic constriction injury,ION-CCI)建立TN动物模型。为了最大限度地减少行为结果测量的个体内和个体间的变异性,实验分组前对大鼠适应性训练一周,剔除对Von Frey纤毛刺激丝反应过于敏感或迟钝的大鼠。大鼠称重后腹腔注射10%水合氯醛,剂量按每100 g体质量0.35 ml计算。
待大鼠睫毛反射消失后,在左侧眶下颧弓和鼻骨结合处、大鼠触须垫下方作一长约6 mm切口,用血管钳钝性分离肌肉周边筋膜,再用玻璃分针分离眶下神经使其暴露出3 mm左右。手术组(CCI组)大鼠用两根5-0缝合线结扎眶下神经,结扎线前后间距约2~3 mm。结扎时注意力度适中,使眶下神经受到压迫直径略微变细,但未阻断其传导及血液循环为宜。结扎完成后用3-0缝合线缝合皮肤创口。假手术(Sham)组大鼠使用同样的操作手法,仅暴露眶下神经无需结扎。
1.3 实验分组
1.3.1TLR7在TN大鼠三叉神经节(trigeminal ganglion,TG)中的表达 将SD大鼠随机分成2组,即CCI 组及Sham组,6只/组。采用Von Frey hair 纤毛刺激丝分别测试大鼠术前1、0 d和术后8个时间点(1、3、5、7、9、12、14、16 d)术侧触须垫区域的机械痛阈,记录阈值并对大鼠不同时间点的机械痛阈进行统计分析。通过qRT-PCR及免疫印迹法(Western blot)检测术侧三叉神经节(TG)内TLR7和NF-κB p65、p-p65及炎症因子(TNF-α、IL-1β)表达变化。
1.3.2抑制TLR7表达后对TN大鼠的影响 将眶下神经损伤后的SD大鼠随机分成3组,即CCI组、CCI + NS组(CCI +生理盐水组)及CCI +羟基氯喹(hydroxychloroguine, HCQ)组,6只/组。CCI组造模当天(0 d)开始灌胃给药,药物现配现用,连续14 d,每天给药1次,剂量为100 mg/kg。使用Von Frey hair纤毛刺激丝进行机械痛阈测定。通过qRT-PCR和Western blot方法对各组大鼠TG中TLR7和NF-κB p65、p-p65及炎症因子(TNF-α、IL-1β)表达量进行检测及对比。
1.4 机械痛阈测定和阳性标准判定术后或每次HCQ给药后4 h,使用Von Frey hair纤毛刺激丝进行机械痛阈测定。每日测定机械痛阈时间为上午10:00—12:00,将大鼠置于安静环境中用Von Frey hair纤毛刺激丝刺激大鼠术侧触须垫(刺激强度从小到大依次进行,分别为(0.008、0.02、0.04、0.07、0.16、0.40、0.60、1.00、1.40、2.00 g),每根毛刷重复刺激5次,每次刺激间隔时间大于30 s,刺激标准是使纤维细丝刚好弯曲,直到某一毛刷激发大鼠重复出现阳性反应3次。
动物的阳性行为主要包括:① 快速缩头、躲避毛刷避开刺激;② 连续搔抓触须垫部;③ 快速抓咬毛刷的攻击行为。此时记录该毛刷所对应的克数即为机械痛阈。
1.5 qRT-PCR将大鼠采用10%水合氯醛腹腔注射过量麻醉致死,麻醉剂量以每100 g体质量0.7 ml的比例计算,采集大鼠术侧TG,采用Tissue RNA Purification Kit Plus提取mRNA ;PrimeScript TM RT Rea- gent Kit、TB Green Premix Ex TaqTM Ⅱ进行cDNA的合成和PCR的扩增;荧光定量PCR仪检测TG中TLR7及炎症因子TNF-α、IL-1β的表达情况。使用2-ΔΔCt计算其相对表达水平。实验所用荧光定量 PCR基因引物序列见表1。
千朵明霞万绿扶,迎风舞遍绣罗襦。 为看国色天香品,喜读青松红杏图。 花好偏教开绀宇,诗清不异饮冰壶。 莫嫌九十韶光老,天付繁华与鼠姑。[4]299
1.6 Western blot以上述同样方法采集不同组大鼠术侧TG组织编号称重后,每1 mg组织加入含1% PMSF的10 μl RIPA裂解液,置于KZ-Ⅲ-F高速低温组织研磨仪中研磨。于4 ℃、12 000 r/min 条件下离心10 min,吸取上清液并且按照比例加入蛋白上样缓冲液,100 ℃加热10 min使蛋白充分变性,放置于-20 ℃下保存待用。使用10% SDS-PAGE凝胶配制试剂盒制备凝胶,上样行SDS凝胶电泳后将目的蛋白转移到PVDF膜上,TBST溶液漂洗3次,每次约10 min后,将PVDF膜置于5%脱脂牛奶中,室温下摇床封闭2 h。置于一抗稀释液中(TLR-7 Antibody 1 ∶3 000;Phospho-NF-κB p65 Antibody 1 ∶3 000; NF-κB p65 Antibody 1 ∶3 000;TNF-α Antibody 1 ∶3 000;IL-1β Antibody 1 ∶3 000)4 ℃下孵育过夜。PVDF膜充分漂洗后置于已稀释好的二抗中室温孵育1.2 h。将PVDF膜充分漂洗后放置于显影机内设置条件曝光成像,最后使用Image J软件对曝光后的蛋白条带图灰度值进行统计分析,检测TLR7和NF- κB p65 、p-p65及炎症因子(TNF-α、IL-1β)蛋白的相对表达水平。
1.7 统计学处理应用GraphPad Prism 8.0对数据进行统计分析。机械痛阈测定结果采用双因素方差分析,CCI组及Sham组两组间qRT-PCR实验及Western blot实验数据比较采用独立样本t检验,CCI组、CCI+NS组及CCI+HCQ组qRT-PCR实验和Western blot实验数据采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 行为学实验结果由Von Frey hair纤毛刺激丝检测不同组大鼠机械痛阈测定结果显示:术后3~16 d CCI组大鼠的机械痛阈均低于Sham组大鼠,见图1。术后3 d CCI组大鼠机械痛阈即开始降低(t=1.581,P<0.05),于造模后14 d疼痛达到最高峰(t=13.572,P<0.001)。CCI组术前及术后0、1 d机械痛阈与Sham组比较,差异无统计学意义。
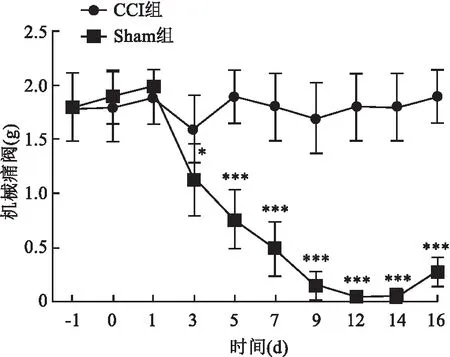
图1 两组大鼠术侧不同时间点机械痛阈的变化与Sham组比较:*P<0.05,***P<0.001
2.2 TLR7、NF-κB p65、p-p65及TNF-α、IL-1β在大鼠术侧TG中的表达变化
2.2.1术后TLR7表达量变化 qRT-PCR结果显示术后第14天CCI组大鼠TG中TLR7 mRNA表达较Sham组升高(t= 6.724,P<0.01),见图2A。Western blot结果显示术后第14天CCI组大鼠TG中TLR7蛋白表达较Sham组升高(t= 8.27,P<0.01),见图2B。
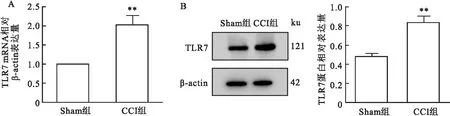
图2 TLR7在CCI组大鼠术侧TG中的表达变化A:TLR7在两组大鼠术侧TG内mRNA表达;B:TLR7在两组大鼠术侧TG内蛋白表达;与Sham组比较:**P<0.01
2.2.2术后p65及p-p65表达量变化 Western blot结果显示术后第14天CCI组大鼠p65表达量与Sham组相比差异无统计学意义(t=0.533,P>0.05),见图3A。术后第14天CCI组大鼠TG中p-p65蛋白表达较Sham组升高(t=3.785,P<0.05),见图3B。
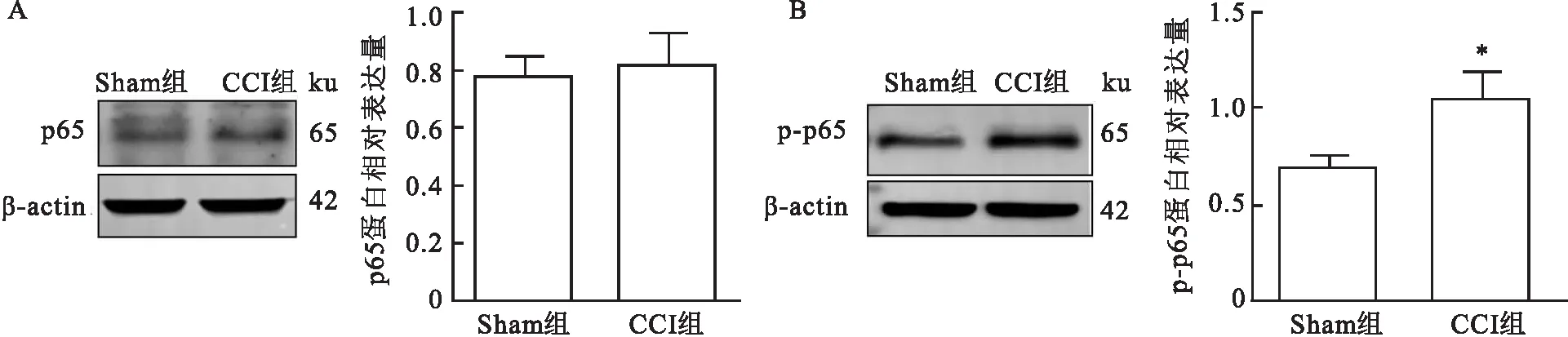
图3 p65及p-p65在CCI组大鼠术侧TG中的表达变化A:p65在两组大鼠术侧TG内蛋白表达;B:p-p65在两组大鼠术侧TG内蛋白表达;与Sham组比较:*P<0.05
2.2.3术后TNF-α、IL-1β表达量变化 qRT-PCR结果显示术后第14天CCI组大鼠TG中IL-1 mRNA 表达较Sham组升高(t=16.64,P<0.001),见图4A。Western blot结果显示术后第14天CCI组大鼠TG中IL-1蛋白表达较Sham组升高(t=4.411,P<0.05),见图4B。 qRT-PCR结果显示术后第14天CCI组大鼠TG中TNF-α mRNA表达较Sham组升高(t=15.38,P<0.001),见图4C。Western blot结果显示术后第14天CCI组大鼠TG中TNF-α 蛋白表达较Sham组升高(t=4.605,P<0.01),见图4D。
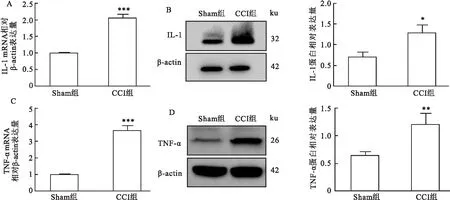
图4 IL-1及TNF-α在 CCI组大鼠术侧 TG 中的表达变化A:IL-1在两组大鼠术侧TG内mRNA表达;B:IL-1在两组大鼠术侧TG内蛋白表达;C:TNF-α在两组大鼠术侧TG内mRNA表达;D:TNF-α在两组大鼠术侧TG内蛋白表达;与Sham组比较:*P<0.05,**P<0.01,***P<0.001
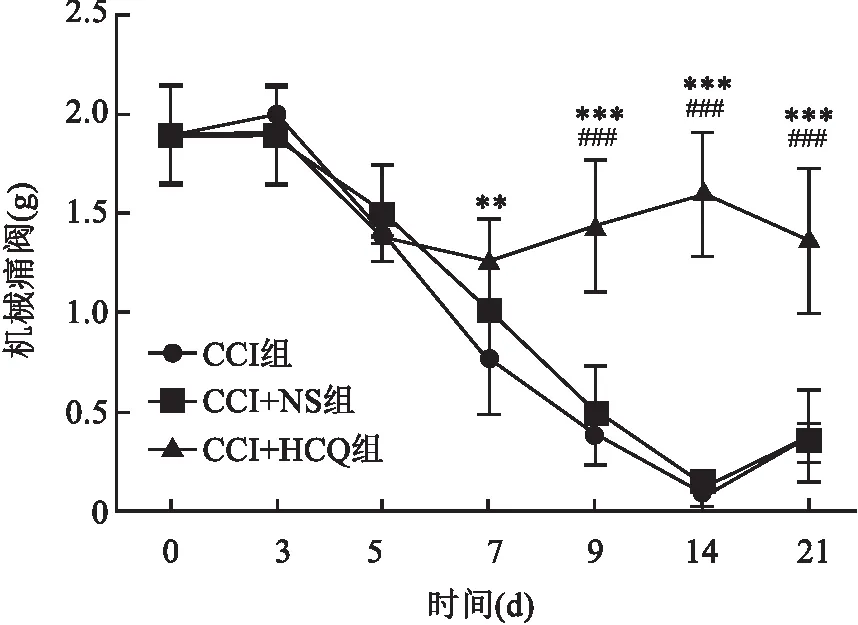
图5 各组大鼠在给予TLR7抑制剂HCQ后不同时间点机械痛阈的变化与CCI组比较:**P<0.01,***P<0.001;与CCI+NS组比较:###P<0.001
2.4 HCQ对大鼠TG中p-65、p-p65及TNF-α、IL-1β表达的影响
2.4.1HCQ对TLR7表达量变化影响 与CCI组及CCI+NS组相比,qRT-PCR结果显示,给药后第14天CCI+HCQ组大鼠TG中TLR7 mRNA表达下降(F= 40.79,P<0.001),见图6A。Western blot结果显示,给药后第14天,与CCI组及CCI+NS组相比,CCI + HCQ组大鼠TG中TLR7蛋白表达下降(F= 6.394,P<0.05),见图6B。

图6 TLR7在不同组大鼠术侧TG中的表达变化A:TLR7在各组大鼠术侧TG内mRNA表达;B:TLR7在各组大鼠术侧TG内蛋白表达;a:CCI组;b:CCI+NS组;c.CCI+HCQ组;与CCI组比较:*P<0.05,***P<0.001;与CCI+NS组比较:#P<0.05,###P<0.001
2.4.2HCQ对p65及p-p65表达量变化影响 Western blot结果显示给药后第14天与CCI 组及CCI+NS组相比,CCI+HCQ组大鼠TG中p65蛋白表达无统计学差异(F=0.162,P>0.05),见图7A。与CCI组及CCI+NS组相比,Western blot结果显示给药后第14天CCI+HCQ组大鼠TG中p-p65表达下降(F=6.835,P<0.05),见图7B。
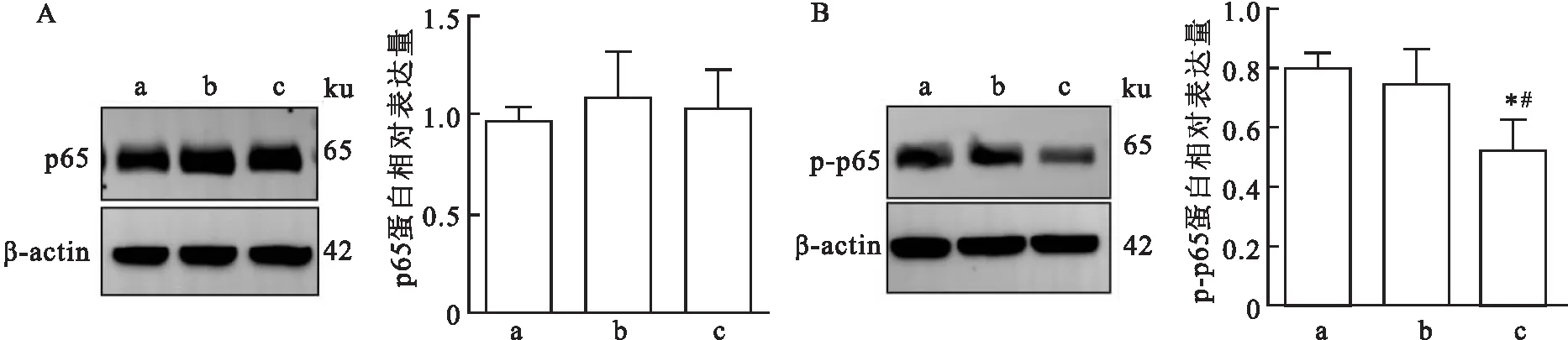
图7 p65及p-p65在不同组大鼠术侧TG中的表达变化A:p65在各组大鼠术侧TG内蛋白表达;B:p-p65在各组大鼠术侧TG内蛋白表达;a:CCI组;b:CCI+NS组;c:CCI+HCQ组;与CCI组比较:*P<0.05;与CCI+NS组比较:#P<0.05
2.4.3HCQ对TNF-α、IL-1β表达量变化影响 与CCI组及CCI+NS组相比, qRT-PCR结果显示术后第14天CCI+HCQ组大鼠TG中IL-1β mRNA表达下降(t=43.74,P<0.001),见图8A。Western blot结果显示给药后第14天CCI+HCQ组大鼠TG中IL-1蛋白表达下降(F=13.58,P<0.01),见图8B。CCI组及CCI+NS组相比,qRT-PCR结果显示给药后第14天CCI+HCQ组大鼠TG中TNF-α mRNA表达下降(t=12.57,P<0.01),见图8C。Western blot结果显示给药后第14天CCI+HCQ组大鼠TG中TNF-α蛋白质表达下降(F=5.291,P<0.05),见图8D。
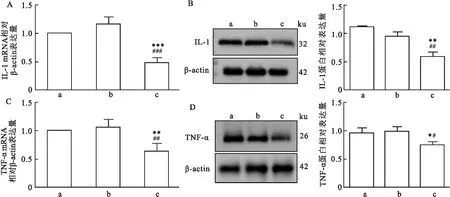
图8 IL-1及TNF-α在不同组大鼠术侧TG中的表达变化A:IL-1在各组大鼠术侧TG内mRNA表达;B:IL-1在各组大鼠术侧TG内蛋白表达;C:TNF-α在各组大鼠术侧TG内mRNA表达;D:TNF-α在各组大鼠术侧TG内蛋白表达;a:CCI组;b:CCI+NS组;c:CCI+HCQ组;与CCI组比较:*P<0.05,**P<0.01,***P<0.001;与CCI+NS组比较:#P<0.05,##P<0.01,###P<0.001
3 讨论
Toll样受体(TLRs)家族通过识别病原体相关分子模式和危险相关分子模式、在感染性病原体入侵或组织损伤时启动炎症信号级联反应信号,在先天免疫反应中发挥关键作用。TLRs在中枢神经系统(CNS)的非神经元和神经元细胞类型中表达,调节疼痛和瘙痒的信号加工过程[11]。鉴于慢性疼痛患病率以及受影响人群的痛苦,深入了解神经系统中的TLR信号将为临床疼痛的治疗开辟新的途径。
TLR7表达于背根神经节(DRG)神经元,结扎第四腰(L4)脊神经(SNL)所致周围神经损伤或坐骨神经慢性损伤后,小鼠背根神经节TLR7在mRNA和蛋白水平的表达显著增加。通过向同侧L4 DRG微量注射表达TLR7 shRNA的腺相关病毒(AAV)5来阻断这种增加,减轻SNL诱导的雄性和雌性小鼠的机械、热和冷痛过敏[7]。TLR7/8均通过MyD88发出信号,包括IL-1受体相关激酶-4(IRAK-4)的募集,分别通过NF-kB和IRF7介导IFN的产生,促进促炎细胞因子的信号转导[12]。Toll样受体7(TLR7)通过其识别ssRNA的能力触发抗病毒免疫反应。TLR7蛋白的蛋白水解裂解是其在内体区室中功能成熟所必需的。结构研究表明,TLR7的N和C端结构域在裂解后连接并参与配体结合。羟基氯喹(hydroxychloroquine,HCQ)是一种抗疟药物,已被研究其抗病毒作用。HCQ可增加酸性细胞器的pH值,据报道可有效抑制内体TLR7活化[13]。
越来越多的数据表明,将受体介导的信号转移到细胞核以调节促痛因子和抗痛因子的NF-κB与神经性疼痛的过程有关[10]。NF-κB在周围神经损伤后在DRG神经元中被激活,相关研究表明[14]鞘内注射NF-κB抑制剂(PDTC),减少促炎细胞因子(TNF-α、IL-1β和IL-6)和神经生长因子在DRG中的表达,缓解神经性疼痛。此外,有学者[15]发现在腰椎间盘突出症(LDH)诱导的神经性疼痛中出现DRG中的NF-κB激活,而p65抑制剂PDTC对NF-κB的下调显着减轻LDH诱导的大鼠机械异常性疼痛和热痛觉过敏。
本实验结果表明,与Sham组相比,CCI组术后第3天机械痛阈开始降低,术后第14天达到最低值;术后第14天CCI组TG中TLR7 mRNA及蛋白表达升高,提示TLR7参与了TN的发生。为进一步了解TLR7表达变化对TN大鼠的影响,在CCI术后第1天后,当大鼠TN模型稳定构建时,对CCI+HCQ组及CCI+NS组大鼠经灌胃方式给予HCQ或生理盐水,连续给药14 d。实验结果显示HCQ抑制TLR7后,TN大鼠机械痛阈升高,TG内TLR7表达降低。此外,p-p65、TNF-α、IL-1β的表达量也下降,缓解CCI诱导的TN,从而确定了TLR7可能是TN潜在的治疗靶点。TLR7虽然参与了TN,然而TLR7抑制剂HCQ抑制CCI诱导的TLR7/NF-κB通路的激活,这一交错分子途径的更多细节,仍需要完成更严格和详细的实验设计。
综上,TLR7是TN潜在的治疗靶点,该实验为TN的相关病因机制探究和临床治疗提供了新方向。

