茶多酚对茶食品中还原糖检测方法的影响
盛政,杜文凯,王崇崇,张博安,张海华*,杜琪珍*
茶多酚对茶食品中还原糖检测方法的影响
盛政1,杜文凯2,王崇崇1,张博安1,张海华1*,杜琪珍1*
1. 浙江农林大学食品与健康学院,浙江 杭州 311300;2. 浙江省粮油产品质量检验中心,浙江 杭州 310012
为寻找准确测定茶面制品消化产物中还原糖含量的方法,选取了表没食子儿茶素没食子酸酯(EGCG)、没食子酸、原花青素和阿魏酸4种典型酚类物质,分别以单独的酚类、酚类与葡萄糖共混、酚类与淀粉酶解物共混体系为样品,研究酚类物质对3,5-二硝基水杨酸(DNS)法、葡萄糖氧化酶/过氧化物酶(GOPOD)法和荧光辅助糖电泳(FACE)法定量测定还原糖的影响。结果发现,阿魏酸对DNS法无影响,EGCG、没食子酸和原花青素可与DNS反应显色,表明其会影响DNS法的准确性;4种酚类物质均显著降低了GOPOD法测定的葡萄糖结果,而FACE法不受酚类影响且能直观表征淀粉酶解物中低聚还原糖分布。因此,FACE法在测定茶面制品及其酶解消化物中还原糖含量方面有较好的应用价值。
茶食品;茶多酚;EGCG;还原糖含量;荧光辅助糖电泳
茶是世界上消费量最大的饮料之一,因其含有丰富的茶多酚、矿物质、膳食纤维等营养素,可预防肥胖、代谢综合征、糖尿病、癌症等慢性疾病而被广泛关注[1-4]。茶面制品是茶或茶的功能成分融入以粮食为主料加工而成的食品[5]。茶面制品作为一种新型复合食品,是发挥茶的保健功能的重要方式,契合人们对于食品的健康功能性新需求。
茶多酚良好的生理活性使其在健康食品的开发和功能强化方面表现出较高的应用潜力,尤其是在预防糖尿病,以及防控餐后高血糖反应等方面是目前研究的热点[6],而准确检测还原糖含量是这方面研究工作科学性的关键和前提。当前测定食品还原糖广泛使用的化学方法有3,5-二硝基水杨酸(DNS)法和葡萄糖氧化酶/过氧化物酶试剂盒(GOPOD)法[7-8],具有快速便捷、价格低、易操作的优点。例如,采用DNS法测定还原糖含量用于表征基于淀粉酶抑制的茉莉花茶拼配效果[9];采用DNS法测定文冠果芽茶与叶茶的还原糖和可溶性多糖[10];GOPOD法则常被用于测定绿茶面条、EGCG-木薯淀粉等茶面食品中淀粉的消化率[11-12]。此外,还有荧光辅助糖电泳法(FACE),可测定单糖和寡糖分布[13]。但在尝试采用DNS法和GOPOD法测定含有茶多酚的还原糖体系时发现茶多酚的存在可能干扰了还原糖测定结果的准确性。因此,有必要评估多酚类物质对DNS法、GOPOD法和FACE法测定还原糖的影响,以期找到适用于多酚共存体系中还原糖的检测方法。
基于此,本研究选取茶多酚中没食子酸、阿魏酸、表没食子儿茶素没食子酸酯(EGCG)、原花青素4种单体,分别对应羟基苯甲酸类酚酸、羟基肉桂酸类酚酸、单体黄烷醇类和聚合黄烷醇类4种类型多酚(图1[14-15]),研究其对DNS法、GOPOD法和FACE法测定还原糖的影响,并分析其可能的原因,以期找到适用的还原糖测定方法。
图1 4种类型酚类物质分子结构
1 材料与方法
1.1 材料与试剂
小麦淀粉(含量≥87%)食品级,购于山东渠风食品科技有限公司;EGCG(纯度≥98%)食品级,购于江苏德和生物科技有限公司;葡萄糖(≥99%)、麦芽糖(≥95%)、麦芽三糖(≥95%)、麦芽四糖(≥98%)、麦芽五糖(≥95%)、麦芽六糖(≥95%)、麦芽七糖(≥90%)和麦芽八糖(≥90%)8种还原糖标准品,-淀粉酶(货号S31769,2 U·mg-1),三羟甲基氨基甲烷盐酸盐和磷酸二氢钠,购于上海源叶生物科技有限公司;阿魏酸(≥99%)、没食子酸(≥99%)、原花青素(≥95%)、,′-亚甲基双丙烯酰胺(NAPP,≥99%)、,,,-四甲基乙二胺(TEMED、≥99%)、丙烯酰胺(≥99%)、8-氨基1,3,6-萘三磺酸二钠盐(ANTS,≥98%)、过硫酸铵(≥99%)和氰基硼氢化钠(NaCNBH3,≥95%),购于上海麦克林生化科技有限公司;葡萄糖氧化酶/过氧化物酶试剂盒购于南京建成生物工程研究所。
1.2 仪器与设备
真空冷冻干燥机(北京博医康实验仪器有限公司),PHS-920型pH计(上海骋克仪器有限公司),JY04S-3C凝胶成像分析系统(北京君意东方电泳设备有限公司),DYY-6C电泳仪电源和DYCZ-24EN型双垂直电泳仪(北京六一生物科技有限公司),SYC-C型电热恒温调速振荡器(上海新苗医疗器械制造有限公司),HBS-1096A酶标仪(南京德铁实验设备有限公司),UV-6100A紫外分光光度计(上海Metash仪器有限公司)。
1.3 淀粉酶解物的制备
将5.0 g小麦淀粉分散在150 mL磷酸盐缓冲液中(0.2 mol·L-1,pH 5.2),混合均匀后在37 ℃恒温振荡水浴锅中预热5 min。随后向淀粉溶液中加入1 mL-淀粉酶,于37 ℃水浴20 min。然后,将淀粉溶液沸水浴5 min以灭活-淀粉酶。冷却至室温后,在4 ℃、8 000转速下离心5 min,保留上清液。
1.4 还原糖测定方法
1.4.1 DNS比色法
以单独葡萄糖溶液(0.2 mg·mL-1)、多酚-葡萄糖混合液(多酚质量浓度依次为0、1、5、10 mg·mL-1,葡萄糖质量浓度为0.2 mg·mL-1)和多酚-淀粉酶解物混合溶液(多酚质量浓度依次为0、1、5、10 mg·mL-1)为样品,分别标记为G、PG、PS;葡萄糖溶液(质量浓度为0.2、0.4、0.6、0.8、1.0 mg·mL-1)为还原糖标准品。
取1.0 mL样品与0.5 mL DNS溶液均匀混合后,置于沸水浴5 min转至冰水冷却后,加水4 mL,以水为空白在540 nm下测定吸光度[16],采用线性回归法拟合回归曲线。
1.4.2 GOPOD法
使用葡萄糖氧化酶/过氧化物酶试剂盒,按试剂盒说明,在505 nm处测定0.2 mg·mL-1葡萄糖溶液和多酚-葡萄糖混合溶液(多酚质量浓度依次为0、1、5、10 mg·mL-1,葡萄糖质量浓度为0.2 mg·mL-1)吸光值。
1.4.3 荧光辅助糖电泳法(FACE)
分别配制葡萄糖、麦芽糖、麦芽标准品系列溶液,配制的质量浓度都为1、2、3、4 mg·mL-1;配制酚类物质-淀粉酶解液样品,配制的酚类物质质量浓度依次为1、5、10 mg·mL-1。
按照FACE法流程处理[17],具体操作如下:
样品衍生处理:用NaCNBH3和ANTS溶液各10 μL在37 ℃下衍生样品16 h后进行冷冻干燥。使用时用250 μL甘油水溶液(1︰4,︰)复溶。
分离胶的制备:制备60%(/)丙烯酰胺、1.6%(/),′-亚甲基双丙烯酰胺的凝胶贮存液,微孔滤膜过滤。储备凝胶缓冲溶液为pH 8.8、1.5 mol·L-1的Tris-HCl。每10 mL分离胶由5 mL凝胶贮存液,2.5 mL储备凝胶缓冲溶液,2.5 mL去离子水,50 μL过硫酸铵,10 μLTEMED组成。凝胶长13 cm,厚1.0 mm,孔宽为0.5 cm。
电泳条件:使用垂直凝胶电泳仪,加入pH 8.8的Tris-HCl电泳缓冲溶液,然后每个泳道上样2 μL衍生样品。在10 ℃循环冷却水、150 V电压中,电泳到荧光前沿移动至凝胶底部。
凝胶成像:电泳后采用凝胶成像仪的透射紫外模式,可视化记录后,使用配套软件(Gelpro32)扫描凝胶荧光强度。
1.5 数据处理
所有试验结果均为3次平行试验的平均值。采用Origin 2021软件画图,采用SPSS 25软件在<0.05水平下进行单因素方差分析(ANOVA)确定统计显著性。
2 结果与分析
2.1 酚类对DNS法测定还原糖含量的影响
DNS法测定还原糖的本质是利用氧化还原反应原理,即3,5-二硝基水杨酸的硝基被还原糖还原为氨基显色,而还原糖被氧化成糖酸(图2A)。当用酚类物质替代还原糖与DNS反应时,发现除阿魏酸以外,其他3种酚类物质均会与DNS发生显色反应(图2B),且等浓度下显色强度顺序为原花青素>EGCG>没食子酸,这可能与酚类型尤其是酚羟基数量有关[18-20]。阿魏酸属于羟基肉桂酸类酚酸,其与DNS试剂无显色反应的原因,可能是其结构中邻位甲氧基对酚羟基活性产生了影响[21]。3种显色的酚类物质与葡萄糖相比,等浓度下吸光度都要弱一些,说明葡萄糖更优先与DNS反应。进一步分别对EGCG、没食子酸和原花青素的DNS显色反应进行浓度-吸光度线性相关性拟合,得出EGCG、没食子酸和原花青素浓度与吸光度的相关系数(2)分别为0.980、0.896、0.996,这说明EGCG、没食子酸和原花青素与DNS反应存在较高的浓度线性依赖。
当酚类物质与葡萄糖共存时,没食子酸(羟基苯甲酸类酚酸)、EGCG(单多酚)和原花青素(聚合多酚)都提高葡萄糖的吸光度值(图2D),说明共存体系中3种酚类物质仍与DNS发生了显色反应。将酚类物质浓度与吸光度进一步线性拟合,发现EGCG、没食子酸仍保持较高的浓度线性相关,EGCG、没食子酸浓度与吸光度的相关系数(2)分别为0.995和0.947,但原花青素由于是聚合多酚,容易发生络合反应,导致浓度线性关系不强,相关系数(2)仅为0.783。当酚类物质与淀粉酶解物(不同聚合度的还原糖)共存时,吸光度变化与葡萄糖共混体系相似,即EGCG、没食子酸保持浓度线性相关性,EGCG、没食子酸浓度与吸光度的相关系数(2)分别为0.994和0.987,原花青素相关系数(2)仅为0.778(图2E)。
从3类不同样品体系与DNS显色反应结果看,EGCG、没食子酸、原花青素代表的3类酚类物质都会与DNS发生显色反应且具有浓度依赖性,根据单色光吸光度具有线性加和特性,在线性浓度范围内可通过调整试验参比排除酚类影响。
2.2 酚类对GOPOD法测定还原糖含量的影响
如图3A所示,GOPOD法的原理是葡萄糖经过葡萄糖氧化酶作用生成葡萄糖酸和过氧化氢,进一步过氧化氢在过氧化酶的作用下,将还原性的4-氨基安替比林与酚偶联缩合成红色的醌亚胺类化合物质[22]。如图3B所示,采用GOPOD法检测EGCG、原花青素、没食子酸和阿魏酸分别与葡萄糖共混体系中还原糖含量,发现吸光度都会显著降低,这说明4种酚类物质参与了GOPOD反应过程。而EGCG和原花青素质量浓度为10 mg·mL-1时,与葡萄糖相比,吸光度显著增加(<0.05),这是由于高浓度EGCG或原花青素与试剂盒反应产生悬浊物。
从GOPOD法的反应原理上可知,多酚可能通过3种途径参与葡萄糖试剂盒反应:(1)酚类物质影响葡萄糖氧化酶氧化葡萄糖的生成物(过氧化氢)[23];(2)酚类物质与试剂盒中的4-氨基安替比林反应,从而抑制显色物质的生成[20];(3)酚类物质直接抑制葡萄糖氧化酶和过氧化氢酶的活性[24]。因此,GOPOD法并不适用于茶食品中还原糖的直接测定。
2.3 酚类对FACE法测定还原糖含量的影响
FACE法的原理是还原糖与ANTS发生衍生化形成不稳定亚胺,然后通过氰基硼氢化钠选择性还原亚胺形成稳定胺,再通过聚丙烯酰胺凝胶将反应样品电泳分离出不同聚合度的还原糖ANTS衍生物[25],如图4A所示。从原理上推测,多酚无醛基,因此不能参与ANTS衍生反应。
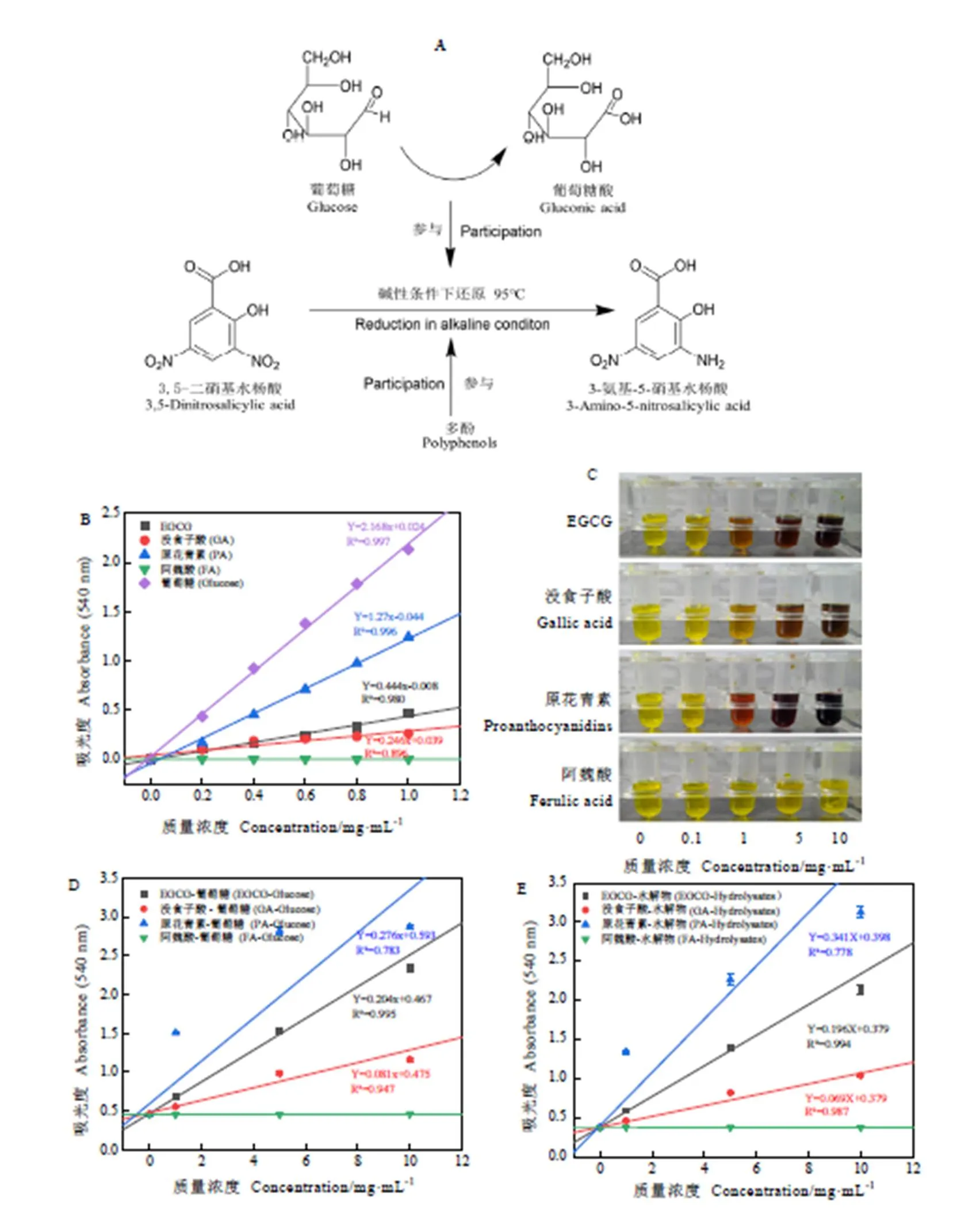
注:A为DNS反应示意图,B为酚类体系,C为酚类与DNS试剂反应的实物图,D为酚类-葡萄糖体系,E为酚类-水解物体系
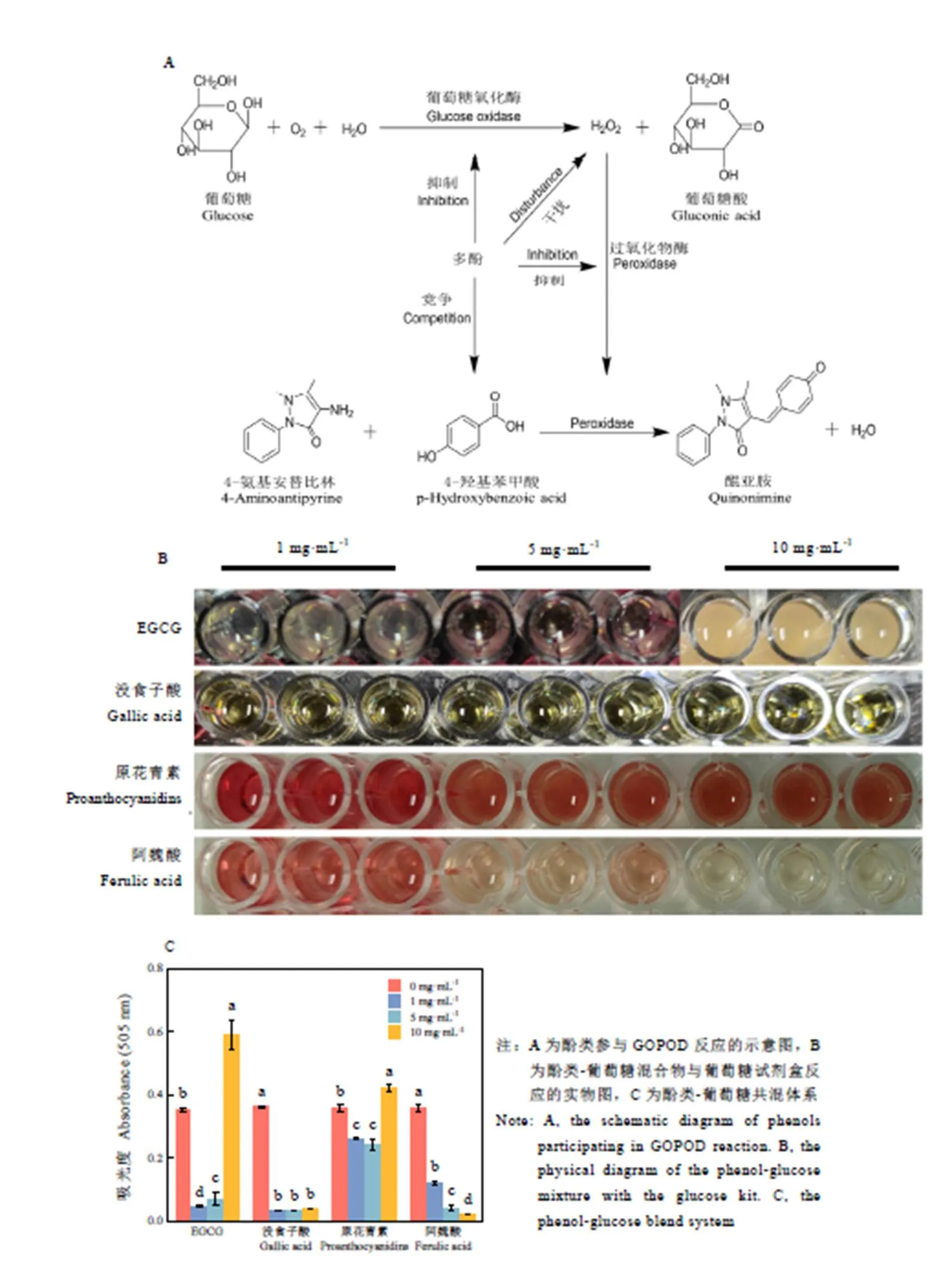
注:A为酚类参与GOPOD反应的示意图,B为酚类-葡萄糖混合物与葡萄糖试剂盒反应的实物图,C为酚类-葡萄糖共混体系
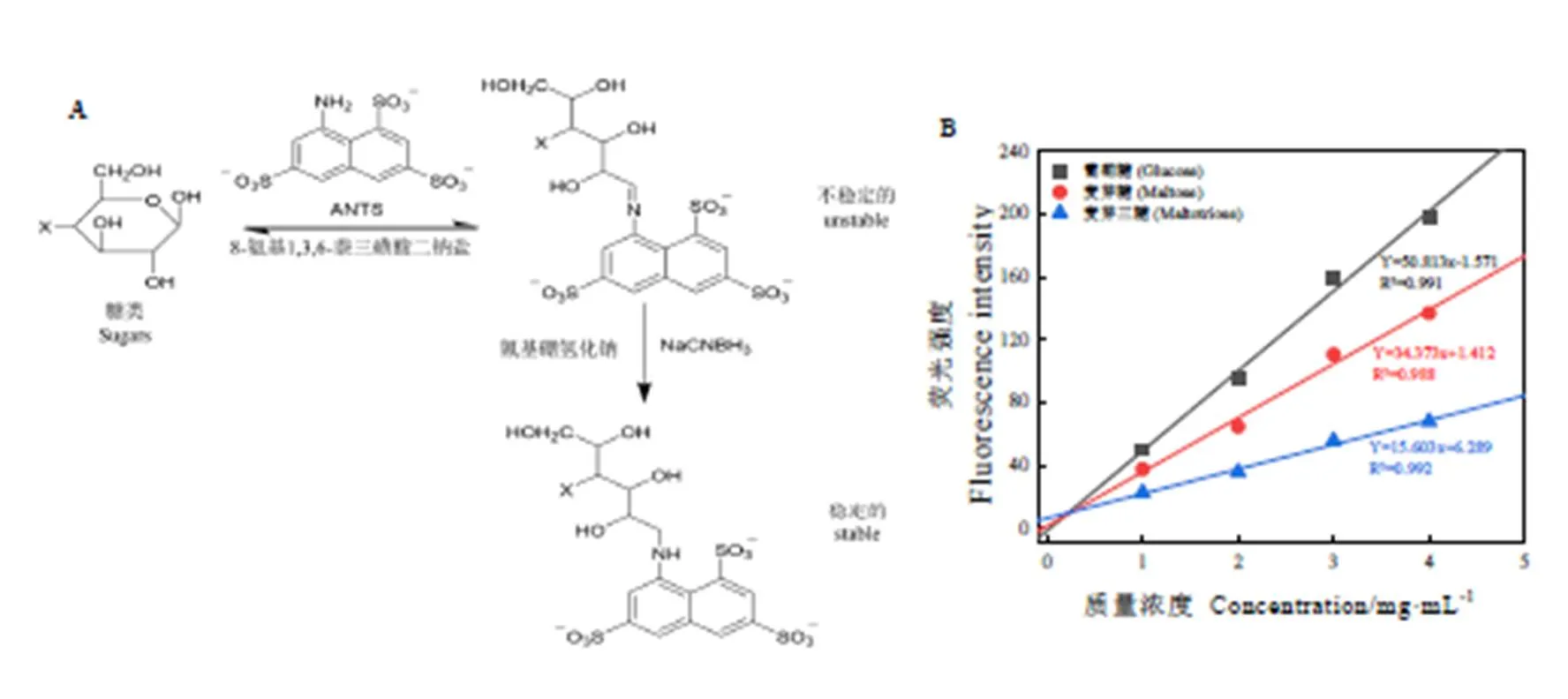
注:A为FACE法的反应示意图;B为葡萄糖、麦芽糖、麦芽三糖与荧光强度的关系
如图4B所示,葡萄糖、麦芽糖和麦芽三糖的浓度与荧光强度显示出良好的线性关系,2分别为0.991、0.988、0.992,表明可以利用荧光强度计算糖浓度。FACE法能分离葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖、麦芽七糖、麦芽八糖,并且在4种酚类物质对应的泳道上无荧光条带(图5A),试验验证了EGCG、没食子酸、原花青素、阿魏酸不参与ANTS衍生反应。进一步采用不同浓度的酚类物质与淀粉酶解物(低聚还原糖)共混,研究共混样品的FACE荧光显色情况,发现酚类-淀粉酶解物的荧光条带分布及强度与对照淀粉酶解物无显著差异,说明酚类不影响低聚还原糖的测定(图5B~5D)。因此,采用FACE法测定还原糖是科学可行的。
此外,与DNS法和GOPOD法相比,FACE法还可同时获得淀粉酶解物中低聚糖的分布情况,有助于阐释酚类物质对淀粉酶的酶解特性及酶解产物的影响。
3 结论
本文通过将EGCG、没食子酸、原花青素和阿魏酸4种类型酚类物质单独、与葡萄糖共混、与淀粉酶解物共混3类样品体系,研究了酚类物质对还原糖测定常用的DNS法、GOPOD法和FACE法的影响。结果表明,对DNS法而言,阿魏酸无影响,而EGCG、没食子酸和原花青素能够与DNS发生显色反应且呈浓度线性相关性,增加了DNS法测定的吸光度,意味着酚类物质的存在可能会使常规DNS法测定结果偏高,建议通过更换参比进行方法改良;对GOPOD法来说,EGCG、没食子酸、原花青素和阿魏酸能参与酶促反应生成显色物质,导致测定结果偏离真值,因此该方法应用时需考虑去除体系中的酚类物质再测定还原糖;4种酚类物质均对FACE方法无干扰,且FACE方法还能同时获得低聚还原糖的分布信息,是定量测定含酚类物质体系中还原糖含量的良好方法。

注:A为低聚还原糖标品和4种酚类物质,B、C、D分别为1、5、10 mg·mL-1的酚类物质-淀粉酶解物;各图泳道1为低聚糖标准品;泳道2为空白;泳道3—6分别为EGCG、没食子酸、原花青素、阿魏酸
[1] Zhang Z Y, Liu C W, Fang W W, et al. Research progress on the lipid-lowering and weight loss effects of tea and the mechanism of its functional components [J]. The Journal of Nutritional Biochemistry, 2023, 112: 109210. doi: 10.1016/j.jnutbio.2022.109210.
[2] Jalaludin I, Kim J. Comparison of ultraviolet and refractive index detections in the HPLC analysis of sugars [J]. Food Chemistry, 2021, 365: 130514. doi: 10.1016/j.foodchem.2021.130514.
[3] Fang J, Sureda A, Silva A S, et al. Trends of tea in cardiovascular health and disease: a critical review [J]. Trends in Food Science & Technology, 2019, 88: 385-396. doi: 10.1016/j.tifs.2019.04.001.
[4] Yang C S, Wang H, Sheridan Z P. Studies on prevention of obesity, metabolic syndrome, diabetes, cardiovascular diseases and cancer by tea [J]. Journal of Food and Drug Analysis, 2018, 26(1): 1-13.
[5] 张士康. 茶面制品的产业前景[J]. 茶博览, 2018(2): 76-77. Zhang S K. The industrial prospects of tea noodle products [J]. Tea Times, 2018(2): 76-77
[6] Lai W F, Baig M, Wong W T, et al. Epigallocatechin-3-gallate in functional food development: from concept to reality [J]. Trends in Food Science & Technology, 2020, 102: 271-279. doi: 10.1016/j.tifs. 2020. 04. 001.
[7] Salelign K, Duraisamy R. Sugar and ethanol production potential of sweet potato () as an alternative energy feedstock: processing and physicochemical characterizations [J]. Heliyon, 2021, 7(11): e08402. doi: 10.1016/j.heliyon.2021.e08402.
[8] 张雅琦, 阮长青, 张东杰, 等. 抗性淀粉的分析方法研究进展[J]. 中国粮油学报, 2023, 38(3): 188-195. Zhang Y Q, Ruan C Q, Zhang D J, et al. Research progress on analysis methods of resistant starch [J]. Journal of the Chinese Cereals and Oils Association, 2023, 38(3): 188-195.
[9] 曾文治, 雷郑延, 周欢, 等. 基于α-淀粉酶活性抑制率的茉莉花茶拼配研究[J]. 食品工业, 2019, 40(1): 163-168. Zeng W Z, Lei Z Y, Zhou H, et al. Study on optimization of jasmine tea blending process for inhibiting α-amylase activity [J]. The Food Industry, 2019, 40(1): 163-168.
[10] 杨眷俪, 许雪蓉, 张振军, 等. 文冠果芽茶与叶茶主要营养功能成分分析及抗氧化活性评价[J]. 食品工业科技, 2022, 43(15): 366-373. Yang J L, Xu X R, Zhang Z J, et al. Main nutritional and functional ingredients and antioxidant evaluation ofbunge bud tea and leaf tea [J]. Science and Technology of Food Industry, 2022, 43(15): 366-373.
[11] Zhu S, Liu B, Wang F, et al. Characterization and in vitro digestion properties of cassava starch and epigallocatechin-3-gallate (EGCG) blend [J]. LWT, 2021, 137: 110398. doi: 10.1016/j.lwt.2020.110398.
[12] 魏香玉, 于鲲, 吴迪, 等. 绿茶粉对高粱挂面品质及消化特性的影响[J]. 食品与发酵工业, 2022: 1-9[2023-03-02]. doi: 10.13995/j.cnki.11-1802/ts.032210. Wei X Y, Yu K, Wu D, et al. Effect of green tea powder on the quality and digestibility of sorghum noodles [J]. Food and Fermentation Industries [J]. Food and Fermentation Industries,2022: 1-9[2023-03-02]. doi: 10.13995/j.cnki. 11- 1802/ts.032210.
[13] Xu S Y, Kan J, Hu Z, et al. Quantification of neoagaro-oligosaccharide production through enzymatic hydrolysis and its anti-oxidant activities [J]. Molecules, 2018, 23(6): 1354. doi: 10.3390/molecules23061354
[14] Kraithong S, Teerapattarakan N, Balasubramanian B, et al. Bioactive compounds in tea: effect of imbalanced intake on digestive enzymes activity, cytochrome inhibition and drug interaction [J]. South African Journal of Botany, 2022, 150: 58-68.
[15] Cianciosi D, Forbes-Hernández T Y, Regolo L, et al. The reciprocal interaction between polyphenols and other dietary compounds: impact on bioavailability, antioxidant capacity and other physico-chemical and nutritional parameters [J]. Food Chemistry, 2022, 375: 131904. doi: 10.1016/j.sajb. 2022. 07.003.
[16] 郭有辉, 周娟, 胡露, 等. DNS光度法测定风味鱿鱼中淀粉、还原糖和蔗糖的含量[J]. 理化检验(化学分册), 2019, 55(4): 463-466. Guo Y H, Zhou J, Hu L, et al. Determination of starch, reduceing sugar and sucrose in flavored squid by DNS photometric method [J]. Physical Testing and Chemical Analysis (Part B: Chemical Analysis), 2019, 55(4): 463-466.
[17] Jackson P. High-resolution polyacrylamide gel electrophoresis of fluorophore-labeled reducing saccharides [J]. Methods in Enzymology, 1994, 230: 250-265. doi: 10.1016/0076-6879(94)30017-8.
[18] Platzer M, Kiese S, Tybussek T, et al. Radical scavenging mechanisms of phenolic compounds: a quantitative structure-property relationship (QSPR) study [J]. Frontiers in Nutrition, 2022, 9: 882458. doi: 10.3389/fnut.2022.882458.
[19] Olszowy M. What is responsible for antioxidant properties of polyphenolic compounds from plants? [J]. Plant Physiology and Biochemistry, 2019, 144: 135-143.
[20] Lim J, Zhang X W, Ferruzzi M G, et al. Starch digested product analysis by HPAEC reveals structural specificity of flavonoids in the inhibition of mammalian-amylase and-glucosidases [J]. Food Chemistry, 2019, 288: 413-421.
[21] Yang B, Chen F, Hua Y L, et al. Prooxidant activities of quercetin,-courmaric acid and their derivatives analysed by quantitative structure–activity relationship [J]. Food Chemistry, 2012, 131(2): 508-512.
[22] 李兵, 肖香兰, 杨永红, 等. 国内外淀粉含量的检测标准现状及检测方法研究进展[J]. 食品安全质量检测学报, 2021, 12(9): 3830-3839. Li B, Xiao X L, Yang Y H, et al. Current situation of standard methods and research progress of starch content determination at China and abroad [J]. Journal of Food Safety & Quality, 2021, 12(9): 3830-3839.
[23] Tama A, Bartosz G, Sadowska-Bartosz I. Is hydrogen peroxide generated in wine? [J]. Food Bioscience, 2022, 45: 101487. doi: 10.1016/j.fbio.2021.101487.
[24] Khan M R, Volpe S, Salucci E, et al. Active caseinate/guar gum films incorporated with gallic acid: physicochemical properties and release kinetics [J]. Journal of Food Engineering, 2022, 335: 111190. doi: 10.1016/j.jfoodeng.2022.111190.
[25] O’Shea M G, Samuel M S, Konik C M, et al. Fluorophore-assisted carbohydrate electrophoresis (FACE) of oligosaccharides: efficiency of labelling and high-resolution separation [J]. Carbohydrate Research, 1998, 307(1): 1-12.
Effect of Tea Polyphenols on the Determination of Reducing Sugar in Tea Food
SHENG Zheng1, DU Wenkai2, WANG Chongchong1, ZHANG Boan1, ZHANG Haihua1*, DU Qizhen1*
1. College of Food and Health, Zhejiang Agriculture and Forestry University, Hangzhou 311300, China;2. Zhejiang Quality Inspection Center of Grain and Oil Products, Hangzhou 310012, China
In order to find an accurate method to determine the content of reducing sugar in the digestive products of tea noodle products, phenolic acid, phenolic and glucose blending systems and phenolic and amylenzymeate blending systems alone were used to study the effects of four typical phenols including epigallocatechin gallate (EGCG), gallic acid, proanthocyanidin and ferulic acid on the quantitative determination of reducing sugars by 3,5-dinitrosalicylic acid (DNS) method, glucose oxidase/peroxidase (GOPOD) method and fluorescence-assisted sugar electrophoresis (FACE) method. The results show that ferulic acid had no effect on the DNS method, while EGCG, gallic acid and proanthocyanidin could react with DNS, indicating that they would affect the accuracy of the DNS method. All four phenolic substances significantly reduced the glucose results determined by GOPOD method, while the FACE method was not affected by phenols and could visually characterize the distribution of oligo reducing sugar in the amylase hydrolysate. Therefore, the FACE method has a good application value in determining the content of reducing sugars in tea noodle products and their enzymatic digestion products.
tea food, tea polyphenols, EGCG, reducing sugar content, fluorescence-assisted sugar electrophoresis
S571.1;Q946.3
A
1000-369X(2023)04-567-09
2023-03-02
2023-05-11
浙江农林大学科研发展基金人才启动项目(203402000601)
盛政,男,硕士研究生,主要从事食品加工与营养强化方面的研究。*通信作者:18758884373@163.com;Qizhendu@163.com

