枣疯病植原体胸苷激酶基因的克隆、序列分析与原核表达
宋传生,康晓飞,樊庆忠,王俊刚,石 雪,张子汝,谭青青,曾小娇,刘 芳,李英赛,侯常跃
(菏泽学院 农业与生物工程学院,山东 菏泽 274015)
枣树(ZiziphusjujubaMill.)是原产于我国且极具特色的干鲜果果树,也是我国第一大干果树种[1]。枣树在我国分布极其广泛,在北起内蒙古包头,南至广东豫南,西自新疆喀什,东到辽宁和台湾省的广大范围内均有分布[1]。我国枣树资源丰富,正式发表的品种达700余种[2]。枣树耐干旱瘠薄,适种范围极广,具有重要的经济、生态和观赏价值。然而,由病原原核生物植原体侵染导致的枣疯病给我国枣树栽培和枣产业造成了严重危害[3]。枣疯病俗称枣树的“癌症”,由刺吸式昆虫和嫁接传播,枣树患病后,最快当年便可死亡。目前,枣疯病等植原体病害可通过注射四环素或土霉素药剂、选育抗病品种、田间综合管理等措施进行防治[4-5],虽然上述措施均能起到一定的效果,但该病依然难以根治。因此,探索新的防控措施防治植原体病害具有重要意义。
植原体隶属细菌界(Bacteria)软壁菌门(Tenericutes)柔膜菌纲(Mollicutes)无胆甾原体目(Acholeplasmatales)无胆甾原体科(Acholeplasmataceae)植原体暂定属(Candidatusgenus Phytoplasma)[6-7],无细胞壁,目前依然难以分离培养[8]。研究表明,寄主植物中的植原体增殖到一定浓度是植原体病害发生的基础[9]。植原体细胞增殖离不开其自身DNA的合成,植原体DNA的合成缺少从头合成途径,仅含补救途径[10]。在补救途径中,细胞通常以核苷和游离碱基为原料在多种酶的催化下合成dNTP,用于DNA的合成和修复。胸苷激酶是仅存在于dTTP补救合成途径中的酶,也是该途径中的关键酶[10]。
胸苷激酶(thymidine kinase)简称TK,在原核生物中简称TDK,国际系统命名EC 2.7.1.21。在Mg2+的参与下,该酶能催化2′-脱氧胸苷(2′-dT)磷酸化形成2′-脱氧胸苷-5′-单磷酸(dTMP)[11]。迄今,已报道了2种胸苷激酶,即细胞质中的胸苷激酶1(TK1)和线粒体中的胸苷激酶2(TK2)[12]。TK1几乎存在于所有的生物中,而TK2多存在于动物中,原核生物中仅有TK1。在哺乳动物中,TK1与细胞增殖有关,其基因的表达在细胞周期中被严格控制,在细胞周期的G1/S期表达增加,在其他时期不表达[13]。水稻(OryzasativaL.)中,TK1的表达似乎与细胞周期无关,其转录物存在于所有发育阶段[14]。肿瘤细胞中,TK1可持续表达,因此在临床实践中,TK1作为多种癌症的预测标志物[15],用于癌症的筛查和化疗效果检测[16-18],同时也是一些癌症的抗癌新靶点[19]。
目前,未有关于植原体胸苷激酶及其基因的相关研究报道。本研究首次克隆了枣疯病胸苷激酶基因,构建了其蛋白质原核表达载体,诱导表达并纯化了胸苷激酶融合蛋白,为后续体外测定酶活性和抗体制备等研究奠定了基础,也为筛选植原体的药物治疗靶点提供了依据。
1 材料与方法
1.1 材料
枣疯病样品JWB-Heze采自山东菏泽。大肠埃希菌(Escherichiacoli)DH5α感受态细胞(天根公司)用于质粒的转化与克隆,E.coliBL21(DE3)感受态细胞用于蛋白质的原核表达。pET-28a载体用于基因的克隆、测序与蛋白质的原核表达。
1.2 方法
1.2.1 基因克隆与载体构建策略
根据NCBI中枣疯病植原体JWB-nky基因组内tdk基因的核苷酸序列设计引物并PCR扩增该序列,PCR产物与经过BamH Ⅰ和XhoⅠ限制性内切酶线性化的pET-28a载体进行重组反应,把反应产物转化E.coliDH5α感受态细胞,挑取多个单菌落测序,选取序列正确的克隆提取质粒用于后续的蛋白质表达实验。依据此策略,可在JWB-Heze TDK蛋白的N端融合32个氨基酸,其中包括6×His标签和T7标签。
1.2.2 引物设计与PCR扩增
正向引物JWBtdk28aReFBam:5′-ATGGGTC-GCGGATCCATGGTTTTAAAAAAAGAAGGTTTT-3′,斜体标注的序列为pET-28a载体中BamH Ⅰ酶切位点及左侧部分核苷酸序列,下划线标注的序列为BamH Ⅰ限制酶识别序列;反向引物JWBtdk28aRe-RXho:5′-GGTGGTGGTGCTCGAGTTAATTTATAAA-TTTATGACATTT-3′,斜体标注的序列为pET-28a载体中XhoⅠ酶切位点及右侧部分核苷酸序列,下划线标注的序列为XhoⅠ限制酶识别序列。引物由生工生物工程(上海)股份有限公司合成。
PCR反应体系25 μL,含2×TaqMix 12.5 μL,正向引物JWBtdk28aReFBam 0.3 μL,反向引物JWBtdk28aReRXho 0.3 μL,JWB-Heze基因组DNA 1 μL,ddH2O 10.9 μL。PCR反应条件:94 ℃ 4 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。
1.2.3 原核表达载体构建
利用DNA琼脂糖凝胶回收试剂盒纯化回收目标片段。利用BamH Ⅰ和XhoⅠ限制酶将pET-28a载体线性化,120 μL酶切反应体系中含BamH Ⅰ 6μL、XhoⅠ 6μL、10×K buffer 12 μL、pET-28a质粒60 μL、ddH2O 36 μL。酶切反应条件为37 ℃水浴4 h。酶切的pET-28a线性化载体片段进行琼脂糖凝胶回收。
将回收的JWB-Hezetdk目标片段与pET-28a线性化载体进行重组反应,5 μL反应体系中含5×In-Fusion Enzyme Premix 1 μL、pET-28a线性化载体3 μL、JWB-Hezetdk目标片段1 μL。反应条件为50 ℃、15 min。
将重组反应产物全部转化E.coliDH5α感受态细胞,培养后挑取多个单菌落送中美泰和生物技术(北京)有限公司测序,选取序列正确的克隆提取质粒保存于-20 ℃备用,为便于描述,将该质粒命名为pET-28a-JWB-Heze-tdk。
1.2.4 JWB TDK融合蛋白的表达
将载体转化E.coliBL21(DE3)感受态细胞,平板培养后挑取单菌落摇菌,待D600约0.4时加入IPTG,在不同的温度、转速和不同浓度的IPTG条件下进行诱导,摇菌诱导约8 h后,取1 mL菌液用于检测蛋白质表达效果,其余菌体收集到50 mL离心管中,每管收集约100 mL菌液的菌体,-20 ℃保存备用。
1.2.5 大量大肠埃希菌菌体非变性蛋白质提取
于1.2.4节中含有菌体的50 mL离心管中加入40 mL菌体裂解液(50 mmol·L-1Tris-HCl,0.5 mol·L-1NaCl,5%甘油,10 mmol·L-1咪唑,1% NP-40,0.25%吐温-20,pH值8.0),充分漩涡振荡混匀;加入40 μL 100×蛋白酶抑制剂[不含乙二胺四乙酸(EDTA)]、40 mg溶菌酶粉末、25 mg·mL-1RNaseA 40 μL、10 mg·mL-1DNase I 40 μL,充分漩涡振荡混匀;冰浴1~2 h,期间多次漩涡振荡混匀,直至溶液澄清透明;4 ℃,13 000×g离心30 min;将上清液转到新的50 mL离心管中,冰浴备用。
1.2.6 蛋白质纯化
利用蛋白质纯化缓冲液(50 mmol·L-1Tris-HCl、0.5 mol·L-1NaCl、5%甘油、0.25%吐温-20,pH值7.8)和500 mmol·L-1咪唑分别配制咪唑浓度为10、20、50、60、100、150、200、250、400 mmol·L-1的蛋白质洗脱缓冲液,备用。
在体积为15 mL的柱子中加入2 mL Ni-IDA 6 FF琼脂糖树脂;用10 mL蒸馏水清洗柱子,用10 mL菌体裂解液平衡柱子,将蛋白质上清液过柱2次,再用60 mL的菌体裂解液过柱清洗杂蛋白质;然后依次用4 mL含有不同咪唑浓度的蛋白质洗脱缓冲液过柱洗脱目标蛋白质。取少量上述各步洗脱液用于SDS-PAGE电泳检测,其余保存于-20 ℃。
1.2.7 蛋白质SDS-PAGE电泳分析
配制浓缩胶为5%和分离胶为12%的SDS聚丙烯酰胺凝胶。蛋白质与2×蛋白质上样缓冲液等体积混合后沸水浴变性,上样量为10 μL,100 V电压电泳,待溴酚蓝移动至玻璃板底端。将凝胶放于染色液中充分染色,然后放于脱色液中充分脱色。
1.2.8 生物信息学分析
利用DNAMAN 6.0软件分析和比对序列;利用MEGA 7.0软件进行多序列比对、遗传距离计算和进化树构建;利用ProtParam在线预测蛋白质分子量、理论等电点、正负电荷残基数、不稳定系数、脂肪族氨基酸指数、亲水性系数等;利用SignalP 5.0软件预测信号肽;利用THMM 2.0软件分析跨膜结构域;利用Cell-Ploc 2.0软件预测亚细胞定位;利用Pfam和NCBI CD research软件分析保守功能域;利用SOPMA软件分析蛋白质二级结构;利用SWISS-MODEL软件预测蛋白质三维结构。
2 结果与分析
2.1 JWB-Heze tdk基因的克隆与原核表达载体构建
利用引物JWBtdk28aReFBam/JWBtdk28aReRXho从枣疯病JWB-Heze材料总DNA中扩增到约600 bp的目标条带,而健康枣树中未扩增到任何条带。目的条带切胶纯化后重组到pET-28a载体并测序,测序结果表明,JWB-Hezetdk基因的ORF长度为576 bp。序列比对结果显示,JWB-nky和JWB-Hebei-2018植原体tdk基因的ORF序列一致,而JWB-Heze与二者的tdk仅有1个碱基差异,但JWB-Hezetdk基因可正常编码蛋白质,且JWB-Heze、JWB-nky、JWB-Hebei-2018枣疯病植原体TDK的氨基酸序列无差异,表明我们成功克隆了JWB-Hezetdk基因并成功构建了其原核表达载体。
2.2 JWB-Heze TDK蛋白质的生物信息学分析
JWB-Hezetdk基因ORF长度为576 bp,编码191个氨基酸。ProtParam在线预测结果显示,JWB-Heze TDK蛋白质的分子式为C982H1590N258O277S10,分子量为21.76 ku,理论等电点为9.06,带负电荷残基总数为23,带正电荷残基总数为30,不稳定系数为21.93,表明该蛋白质性质较为稳定。脂肪族氨基酸指数为101.99,亲水性平均系数为-0.110,表明该蛋白质为亲水蛋白质。
SignalP 5.0软件分析表明,JWB-Heze TDK蛋白质不含信号肽;THMM 2.0在线分析表明,该蛋白质无跨膜结构域;Cell-Ploc 2.0软件预测显示,该蛋白质定位于细胞质。Pfam和NCBI的CD Search分析保守功能域分析结果表明,该蛋白质属于胸苷激酶超级家族。
SOPMA在线预测表明,该蛋白质二级结构中,α螺旋、β折叠和无规则卷曲分别占氨基酸残基的36.65%、20.42%和34.03%。以蛋白质结构数据库(Protein Data Ban,PDB)中金黄色葡萄球菌(Staphylococcusaureus)胸苷激酶(PDB:3e2i.1.A)的三维结构为模板,用SWISS-MODEL软件预测JWB-Heze TDK蛋白质三维结构,预测结果如图1所示。

图1 预测的JWB-Heze TDK蛋白质三维结构Fig.1 Predicted three-dimensional structure of JWB-Heze TDK protein
利用DNAMAN 6.0软件对不同16Sr组植原体和金黄色葡萄球菌(S.aureus)的TDK,以及智人(Homosapiens)、牛痘病毒(Vacciniavirus)、拟南芥(Arabidopsisthaliana)的TK1蛋白质序列进行多序列比对和相似性分析,结果如图2所示。a、b、c、d 4个区域较为保守,这些保守区域尤其是其中的不变氨基酸残基可能是胸苷激酶维持其酶活性所必需的。序列相似分析结果显示,16SrV组的JWB与其他组植原体的胸苷激酶氨基酸序列相似性为47.2%~68.3%,与金黄色葡萄球菌、牛痘病毒、智人的TK1相似性分别为38.50%、29.84%、22.51%,与拟南芥atTK1a和atTK1b的相似性分别为23.27%和21.80%。
2.3 基于tdk基因序列的植原体分类分析
为明确tdk基因序列是否可用于植原体的分子分类,在NCBI公布的植原体基因组中截取tdk基因的ORF序列和16S rDNA序列,共获得了12个16Sr组内46个植原体的相应序列。在查找tdk基因时还发现,所有植原体基因组中的tdk基因均为单拷贝。基因序列比对和遗传距离计算结果表明,除个别16Sr组内的少数植原体外,绝大多数植原体tdk基因间的遗传距离都大于其16S rDNA序列间的遗传距离,这表明,相比于16S rDNA序列,植原体tdk基因的变异程度更高。而进化树分析结果显示(图3),基于植原体tdk基因序列和16S rDNA序列构建的进化树高度一致,表明植原体tdk基因序列可较好地用于植原体的分子分类研究。

A,基于植原体tdk序列构建的进化树;B,基于植原体16S rDNA序列构建的进化树。▲所注为本研究中克隆的JWB-Heze tdk;进化树构建方法为NJ法,bootstrap重复次数为500。A, Phylogenetic tree based on the tdk sequences of Phytoplasmas; B, Phylogenetic tree based on the 16S rDNA sequences of phytoplasmas. ▲ shows the JWB-Heze tdk cloned in this study; NJ method was used to construct the phylogenetic tree and the number of bootstrap repeats was 500.图3 基于植原体tdk和16S rDNA序列构建的进化树Fig.3 Phylogenetic trees based on phytoplasma tdk sequence and 16S rDNA sequence
2.4 JWB-Heze TDK融合蛋白的表达
为明确IPTG浓度对JWB-Heze TDK融合蛋白诱导表达效果的影响,IPTG浓度分别为0、0.1、1.0 mmol·L-1时,28 ℃、140 r·min-1诱导表达约8 h,结果如图4所示。在IPTG诱导下,E.coliBL21(DE3)成功表达了JWB-Heze TDK融合蛋白,并且1.0 mmol·L-1IPTG诱导表达的JWB-Heze TDK融合蛋白的量高于0.1 mmol·L-1IPTG。

M,蛋白质分子量标准;1~3,pET-28a-JWB-Heze-tdk载体;4~6,pET-28a空载体。1、4,未经IPTG诱导;2、5,IPTG浓度为1.0 mmol·L-1;3、6,IPTG浓度为0.1 mmol·L-1。2、3,泳道中最粗的条带为目标蛋白质;箭头所指为目标蛋白质的位置。M, Protein marker; 1-3, pET-28a-JWB-Heze-tdk vector; 4-6, pET-28a empty vector. Lanes 1 and 4, not induced by IPTG; Lanes 2 and 5, induced by 1.0 mmol·L-1 IPTG; 3 and 6, induced by 0.1 mmol·L-1 IPTG. The thickest band in lanes 2 and 3 were the target proteins; The arrow indicated the location of the target protein.图4 JWB-Heze TDK融合蛋白诱导表达结果Fig.4 Expression of the JWB-Heze TDK fusion protein
2.5 可溶性JWB-Heze TDK融合蛋白的纯化
收集1.0 mmol·L-1IPTG、28 ℃、140 r·min-1条件下诱导的菌体,将菌体裂解液离心后,取上清液过柱纯化,结果未纯化到可溶性的JWB-Heze TDK融合蛋白(结果未展示)。用同样的方法,从0.1 mmol·L-1IPTG、28 ℃、140 r·min-1条件诱导的菌体裂解液上清液中纯化目标蛋白质,结果如图5所示,纯化到了微量的可溶性JWB-Heze TDK融合蛋白。从图5可知,SF泳道即蛋白质上清液中的可溶性JWB-Heze TDK融合蛋白含量极低,远低于图2菌体总蛋白质(图2泳道2和3中最粗的条带)中JWB-Heze TDK的含量,这表明在上述条件下,诱导表达的JWB-Heze TDK蛋白可能主要以包涵体沉淀的形式存在。

M,蛋白质分子量标准;SF,菌体裂解液上清液;FT,过柱流穿液;E1~E9,不同浓度咪唑的蛋白质洗脱液洗脱的蛋白质,蛋白质洗脱液中咪唑的浓度分别为10、20、50、60、100、150、200、250、400 mmol·L-1;箭头所指为目标蛋白质的位置。图7同。M, Protein marker; SF, Cell lysate supernatant; FT, Flow-through liquid; E1-E9, Proteins eluted by eluates containing 10, 20, 50, 60, 100, 150, 200, 250 and 400 mmol·L-1 imidazole respectively; The arrow indicated the location of the target protein. The same as in figure 7.图5 0.1 mmol·L-1 IPTG、28 ℃、140 r·min-1条件下诱导表达的JWB-Heze TDK融合蛋白的纯化结果Fig.5 Purification of JWB-Heze TDK fusion protein induced by 0.1 mmol·L-1 IPTG at 28 ℃ and 140 r·min-1
将上述菌体裂解后离心获得的沉淀用包涵体清洗液清洗,清洗液离心后将沉淀用含有高浓度尿素的包涵体裂解液裂解,离心后将上清和沉淀进行SDS-PAGE检测,结果如图6所示,诱导表达的JWB-Heze TDK融合蛋白的确主要以包涵体形式存在,且8 mol·L-1的尿素很难将该包涵体裂解。
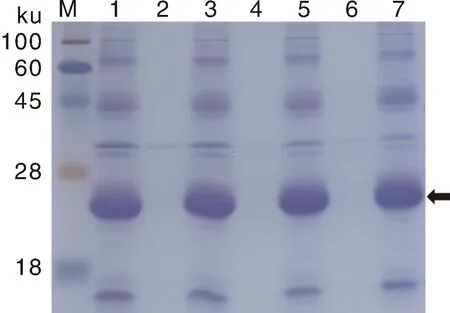
M,蛋白质分子量标准;1,未经处理的菌体裂解液沉淀;2、3,分别为菌体裂解液沉淀经蒸馏水洗涤后离心获得的上清液和沉淀;4、5,分别为菌体裂解液沉淀在20 ℃ 8 mol·L-1尿素溶液中处理后离心获取的上清液和沉淀;6、7,分别为菌体裂解液沉淀在50 ℃ 8 mol·L-1尿素溶液中处理后离心获得的上清液和沉淀;箭头所指为目标蛋白质的位置。M, Protein marker; 1, Bacterial lysate precipitation without treatment; 2 and 3, Obtained from the distilled water used for washing the bacterial lysate precipitation; 4 and 5, Obtained from the 8 mol·L-1 urea solution used for dissolving the bacterial lysate precipitation at 20 ℃;6 and 7, Obtained from the 8 mol·L-1 urea solution used for dissolving the bacterial lysate precipitation at 50 ℃. The arrow indicated the location of the target protein.图6 JWB-Heze TDK融合蛋白质包涵体的鉴定和裂解结果Fig.6 Identification and lysis of inclusion bodies of the JWB-Heze TDK fusion protein
为获得较高浓度的可溶性JWB-Heze TDK融合蛋白,在0.1 mmol·L-1IPTG、20 ℃、140 r·min-1的条件下再次诱导表达后纯化,结果如图7所示。SF泳道JWB-Heze TDK融合蛋白的浓度明显高于图5中SF泳道JWB-Heze TDK融合蛋白的浓度,这表明较低的温度有利于诱导可溶性JWB-Heze TDK融合蛋白的形成。图7还显示,高于150 mmol·L-1的咪唑容易将JWB-Heze TDK蛋白从Ni-IDA琼脂糖树脂中洗脱下来。此次纯化获得了较高浓度的可溶性JWB-Heze TDK融合蛋白,虽然纯化的蛋白质溶液中含有杂蛋白质或目标蛋白质发生了降解,但利用ImageJ软件分析表明,在洗脱的蛋白质溶液中,完整的可溶性JWB-Heze TDK融合蛋白的比例高于75%。
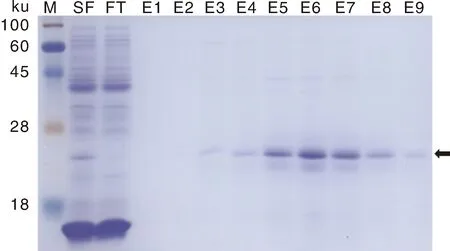
图7 0.1 mmol·L-1 IPTG、20 ℃、140 r·min-1条件下诱导表达的JWB-Heze TDK融合蛋白的纯化结果Fig.7 Purification of JWB-Heze TDK fusion protein induced by 0.1 mmol·L-1 IPTG at 20 ℃ and 140 r·min-1
3 结论与讨论
本研究从枣疯病植原体中克隆了胸苷激酶基因tdk,其ORF长度为576 bp,编码191个氨基酸,与已知枣疯病植原体JWB-nky和JWB-Hebei-2018基因组中tdk的ORF长度一致且各有1个碱基差异[20],但三者编码的氨基酸序列完全相同。对JWB-Heze TDK蛋白质序列的电荷、不稳定系数、信号肽、跨膜结构域、亚细胞定位等分析和预测表明,该蛋白质为植原体细胞质中性质相对稳定的亲水蛋白质,这可能与该蛋白质行使的功能相吻合。因为在生物中,TK1发挥着合成和修复DNA等生命所必需的基础功能[11],一旦该酶失活,生物将无法存活。例如,拟南芥基因组包含2个TK1,即AtTK1a和AtTK1b,二者均编码具有TK活性的酶,虽然AtTK1a和AtTK1b基因的T-DNA插入突变体能正常生长,但双突变体发育不良,植株在早期便死亡[21]。本研究通过比对分析植原体和金黄色葡萄球菌TDK,以及牛痘病毒、智人、拟南芥TK1的氨基酸序列还发现,胸苷激酶中存在多个保守区域,在这些区域内,上述物种的一些氨基酸残基完全一致,推测这些保守区域尤其是其内的不变氨基酸残基可能是胸苷激酶所必需的,当然这需要严格的实验证明。
由于植原体无法分离培养,其分类主要依靠16S rDNA序列相似性和其限制性酶切片段长度多态性(RFLP)的分子分类[6,22]。由于16S rDNA非常保守,探寻保守程度适宜的基因进行多基因分类则可使分类结果更为细致和可靠[23-24]。本研究中,搜集了NCBI数据库中几乎所有的植原体tdk基因ORF序列和对应植原体的16S rDNA序列,并进行了遗传距离分析和进化树构建,相比于植原体16S rDNA序列,植原体tdk基因的变异程度更高,而基于tdkORF序列和16S rDNA序列的进化树结果高度相似,因此,tdk基因适于植原体的分子分类。
为后续JWB-Heze TDK体外酶活性测定和抗体制备等功能研究需要,制备具有天然构象的可溶性JWB-Heze TDK蛋白质非常有必要。原核细胞是快速有效表达和制备蛋白质的手段,但该体系有时易于形成包涵体沉淀,这给制备具有天然构象的蛋白质带来了困难。目前,虽然包涵体形成机制尚不十分清晰[25],但已有的研究表明,有利于蛋白质不溶性聚集的因素通常都利于包涵体的形成,尤其是蛋白质中长的疏水性肽段、高诱导温度和诱导物浓度等关键因素[26-27]。较高的诱导温度和诱导物浓度会使蛋白质表达过快,肽链来不及正确折叠而形成不溶性聚集[28-29]。另外,包涵体的形成还与表达菌株、表达载体、培养基等因素有关[30]。本研究中,利用E.coliBL21(DE3)菌株和pET-28a载体在28 ℃、140 r·min-1、1.0 mmol·L-1或0.1 mmol·L-1IPTG条件下,诱导表达的JWB-Heze TDK蛋白质含量均较高,但IPTG浓度为1.0 mmol·L-1时,表达的JWB-Heze TDK几乎全为包涵体,而IPTG浓度为0.1 mmol·L-1时,可溶性JWB-Heze TDK蛋白质的比例有所提高;在20 ℃、140 r·min-1、0.1 mmol·L-1IPTG诱导条件下,可溶性JWB-Heze TDK蛋白质的比例获得了大幅提高。因此,较低的温度和较低的诱导物浓度同样有利于可溶性JWB-Heze TDK蛋白质的形成。
综上所述,本研究克隆了枣疯病植原体的胸苷激酶基因,对其胸苷激酶氨基酸序列进行了多种生物信息学分析,进行了基于tdk基因序列的植原体分子分类分析,构建了原核表达载体并进行了可溶性蛋白的诱导表达与纯化。该研究结果为枣疯病植原体胸苷激酶体外酶活性测定和抗体制备奠定了基础,为深入研究其功能并用于筛选抑制剂以控制植原体病害提供了依据。

