转cry1Ab-vip3Af2和cp4-epsps基因的抗虫耐除草剂水稻的研究
张思雨,林朝阳,2,叶雨轩,2,沈志成,*
(1.浙江大学 昆虫科学研究所,浙江 杭州 310058; 2.浙江大学 新农村发展研究院,浙江 杭州 310058)
水稻(OryzasativaL.)在中国乃至世界范围内都是主要粮食作物之一[1-2]。全球至少有95个国家种植水稻,其中亚洲占到90%以上[3]。在水稻的生产过程中,全球每年因生物胁迫造成水稻产量和品质损失的比例高达52%,其中,仅虫害造成的损失已达到25%[4-6]。在众多水稻害虫中,以鳞翅目的螟蛾科危害最为普遍[7-8]。此外,杂草也是影响水稻产量和品质的主要因素之一[9]。在过去的50年中,人们多利用化学方法来防治各类病虫草害问题[10],虽然经济有效,同时也导致抗药性产生、环境污染、农药残留等新的问题[11-12]。近年来对抗病、虫、草害等常规品种的研究呈下降趋势[13],因此培育转基因作物作为一种经济有效且环保的综合管理措施逐渐受到越来越多的关注[12]。
转基因技术至今已有30多年的历史,利用转基因技术可以将性状优良的外源基因转入植株体内并使其稳定遗传[14],为人们带来了巨大的经济收益[15],当前已在玉米、大豆、棉花等作物上广泛应用。我国已为华恢1号和Bt汕优63等较为成熟的转基因抗虫水稻转化体颁发了生物安全证书[16-17],这些转化体拥有较好的抗虫效果,但早期的水稻转化体仅表达单个Bt蛋白,容易使害虫进化出抗性[18],抗虫效果也存在较大的提升空间。目前国际上出现的害虫对Bt作物产生抗性的事件持续增加[19],其中产生实际抗性的案例累计已有26例[20]。应对害虫抗性产生的两种治理方法“高剂量/庇护所”策略和“基因叠加”策略虽有一定成效[21-22],但在具体的实施过程中仍存在诸如表达量失衡、遗传转化难度高、蛋白活性降低或缺失等困难。目前,全球开发出的耐除草剂作物中以耐草甘膦的转基因作物种类最多,可见耐草甘膦作物仍然是转基因作物的主要研究方向之一[23]。应用耐草甘膦的转基因水稻,可以有效减少田间杂草的治理成本,降低杂草对产量的影响,提高水稻生产效率。
本研究综合考虑转基因水稻的杀虫效果、抗性治理、杂草管理、可持续发展等方面,优化转化载体,将抗虫融合基因cry1Ab-vip3Af2与耐草甘膦基因cp4-epsps转入水稻中,使转基因水稻能够同时表达两种杀虫蛋白来应对鳞翅目害虫的威胁,一定程度上可以减缓水稻上鳞翅目害虫抗性的发展,同时也大大缩短了转化体筛选、杂交繁育等环节的研究时间[24-25]。本研究旨在研发出一种能够稳定遗传并应用于产业化的转基因抗虫耐除草剂水稻,为我国的粮食安全生产和农业现代化发展提供新的水稻种质资源。
1 材料与方法
1.1 试验材料
大肠埃希菌(Escherichiacoli)菌株TG1由本实验室保存,基因型为:F-mcrAΔ(mrr-hsdRMS-mcrBC)φ80lacZΔM15ΔlacX74nupGrecA1araD139Δ(ara-leu)7697galE15galK16rpsL(StrR)endA1λ-。大肠埃希菌表达菌株Transetta购自北京全式金生物技术(TransGen Biotech)有限公司(目录号:CD801)。根癌农杆菌(Agrobacteriumtumefaciens)菌株LBA4404由本实验室保存。粳稻(Oryzasativassp.japonica)品种秀水134来源于浙江省嘉兴农业科学院。pCAMBIA1300质粒(ACCESSION: AF234296)由本实验室保存。cry1Ab-vip3Af2抗虫融合基因由本实验室自行合成并保存。
1.2 试验方法
1.2.1 载体构建
以pCAMBIA1300为基础载体(简称1300载体),将Bt抗虫融合基因cry1Ab-vip3Af2和抗草甘膦基因cp4-epsps(UniProtKB: Q9R4E4)导入1300载体中,使转化载体同时含有抗草甘膦基因和抗虫基因的表达框。cry1Ab-vip3Af2基因由玉米泛素启动子pZmUbi启动,由农杆菌NOS终止子和Heat shock protein terminator组成的复合终止子THsp终止转录;cp4-epsps基因由玄参花叶病毒35S启动子pFMV启动,由花椰菜花叶病毒35S终止子终止转录;烟草RB7核基质结合区调控序列MAR作为间插序列用于载体构建。外源T-DNA结构如图1所示。
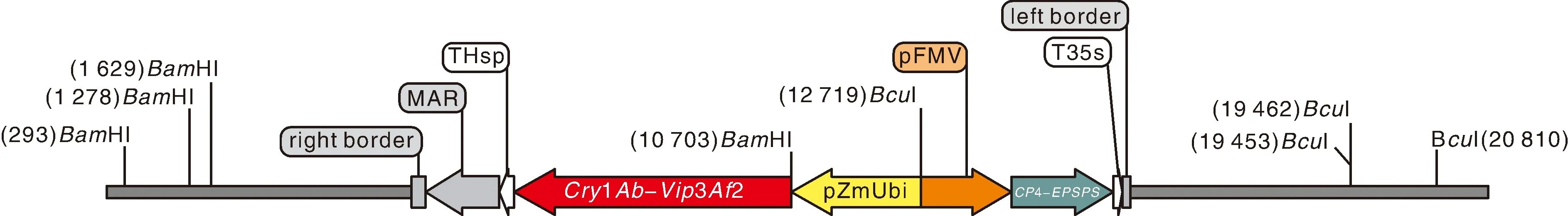
图1 T-DNA结构示意图Fig.1 Diagram of the T-DNA structure
1.2.2 水稻遗传转化
利用农杆菌侵染法[26],选用粳稻品种秀水134,先后进行水稻播种、农杆菌单克隆培养、共培养、筛选抗性愈伤组织、分化培养、生根培养等过程,获得水稻转化体。
1.2.3 酶联免疫吸附试验
提取水稻组织中的蛋白,并利用酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测试剂盒对水稻转化体中外源蛋白Cry1Ab-Vip3Af2和CP4-EPSPS的表达量进行测定,试验方法参照相应的ELISA定量检测试剂盒说明书。ELISA定量检测试剂盒QuanliPlate Kit for Cry1Ab/Cry1Ac购自Envirologix公司,CP4-EPSPS酶联免疫定量检测试剂盒购自上海佑隆生物科技有限公司。该试验的样品均采自浙江省湖州市长兴县泗安镇浙江大学农业试验站。
1.2.4 特异性PCR
使用CTAB法[27]提取水稻基因组,针对目的基因分别设计特异性引物进行PCR扩增,将反应产物电泳分离。该试验使用到的Premix ExTaqDNA聚合酶购自TaKaRa公司,用到的引物序列如表1所示。
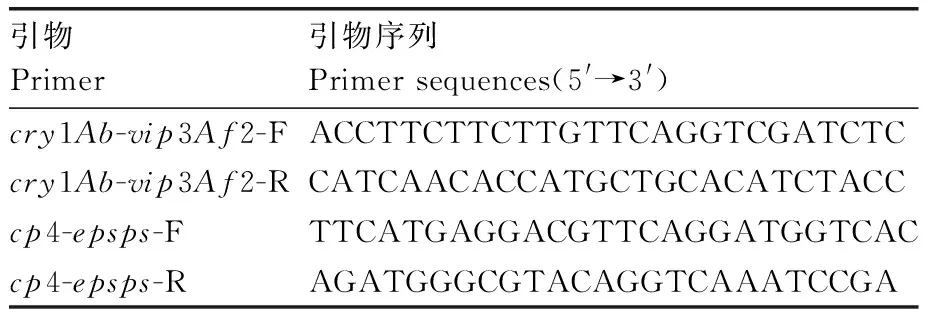
表1 特异性PCR用到的引物及序列Table 1 Primers of PCR
1.2.5 High efficiency TAIL-PCR
使用CTAB法[27]提取水稻基因组,将基因组浓度稀释至100 ng·μL-1,进行三轮的巢式PCR[28]。将PCR反应产物分别电泳分离,回收第三轮的目的条带并测序。测序结果与T-DNA边界序列比对,将水稻基因组序列在Phytozome13.0数据库中BLAST分析T-DNA的插入位点。建立T-DNA和水稻基因组的整合模型,预测另一端边界位置并设计引物验证。该试验使用到的LATaq酶购自TaKaRa公司,用到的引物和序列如表2所示。
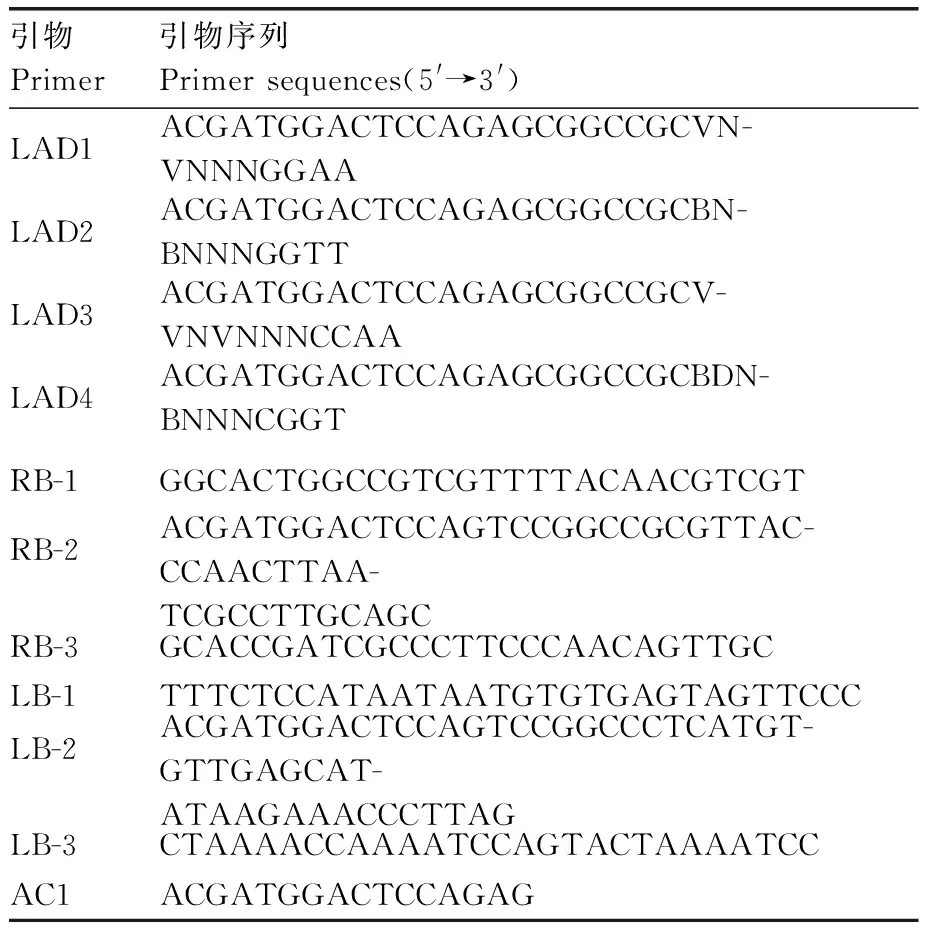
表2 Hi-Tail PCR用到的引物及序列Table 2 Primers of Hi-Tail PCR
1.2.6 DNA印迹法(Southern blotting)
Labeling and Detection Starter Kit购自Roche公司。
CTAB法[27]提取VB3水稻基因组,选择BamH I和BcuI限制性内切酶对其进行充分酶切,1%琼脂糖凝胶电泳分离酶切获得的DNA片段,将其变性并转移至尼龙膜上,分别与地高辛标记的cry1Ab和cp4-epsps基因的全长DNA片段作为的探针进行杂交,化学发光显影后得到杂交条带的数量。该试验使用的DIG-High Prime DNA
1.2.7 蛋白质印迹法(Western blotting)
分别称取适量T1、T2代水稻的叶片、茎秆和籽粒,在液氮条件下破碎提取蛋白,蛋白样品中加入5×蛋白上样缓冲液(含β-巯基乙醇),沸水煮10 min,使用4%~20%的SurePageTMGels(购自金斯瑞生物科技有限公司)进行聚丙烯酰胺凝胶电泳。使用eBlotTML1快速转膜装置进行转膜,PVDF膜分别于一抗(1∶1 000)、二抗(1∶8 000)中孵育1 h,随后曝光显影。使用的一抗分别是兔抗Cp4和鼠抗Cry1Ab血清,二抗分别是辣根过氧化物酶标记的羊抗兔IgG抗体和辣根过氧化物酶标记的羊抗鼠IgG抗体,均购自金斯瑞生物科技有限公司。
1.2.8 靶标害虫室内生物流程测定
选用大螟、二化螟、稻纵卷叶螟的初孵幼虫为被试昆虫(由北京绽诺思特生物科技有限公司提供),以非转基因的秀水134水稻作为阴性对照。采集水稻各生长时期的新鲜叶片,将叶片放在装有湿润滤纸的培养皿中,每个培养皿中接入20头初孵幼虫,随后密封放入28 ℃培养箱中,每24 h观察一次昆虫的生长情况,每种昆虫做3次重复。处理水平见表3。

表3 靶标害虫室内生物活性测定Table 3 The laboratory bioassay of target pests
1.2.9 草甘膦耐受性能测定
使用农达41%草甘膦异丙胺盐水剂(推荐剂量为13.3~26.7 mL·hm-2),对除草剂的剂量设置4个梯度:清水、农药登记推荐中剂量(20 mL·hm-2)、中剂量的2倍量(40 mL·hm-2)、中剂量的4倍量(80 mL·hm-2)。用水量为2.67 L·hm-2。待水稻长至3~5叶幼苗期,在水稻的茎叶上依次喷施上述剂量的草甘膦,以非转基因秀水134水稻作为对照,一周左右观察水稻的生长情况。处理水平见表4。

表4 草甘膦耐受性能测定Table 4 Glyphosate tolerance determination
2 结果与分析
2.1 水稻转化体的获得与初步筛选
利用农杆菌侵染的方法,获得了水稻转化体。在温室培育的过程中,筛除部分长势较差或畸形的T0代转化体,利用ELISA的检测方法,对剩余T0代水稻转化体进行初步筛选(采摘新鲜叶片组织)。结合水稻转化苗在温室培育中的表现型以及此前相关的研究数据[17, 29],本研究筛选到10个表现型与非转基因水稻秀水134相比无显著差异且外源蛋白表达量较高的水稻转化体(图2)。
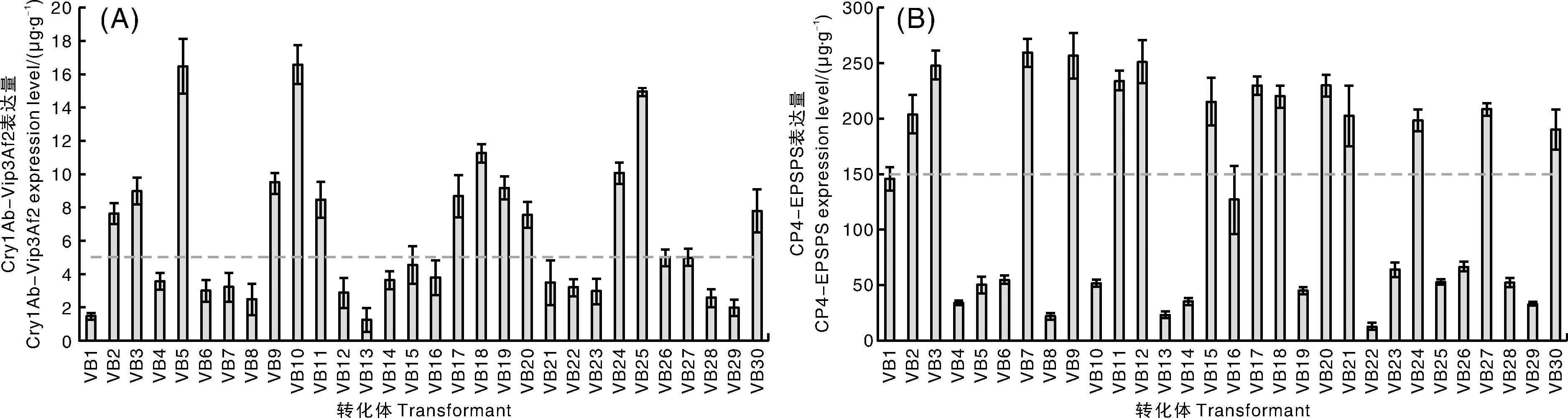
A,Cry1Ab-Vip3Af2蛋白的表达量,图中虚线所示Cry1Ab-Vip3Af2的表达量为5 μg·g-1,以此为筛选标准;B,CP4-EPSPS蛋白的表达量,图中虚线所示CP4-EPSPS的表达量为150 μg·g-1,以此为筛选标准。A, The expression level of Cry1Ab-Vip3Af2, the dotted line showed the Cry1Ab-Vip3Af2 expression level was 5 μg·g-1, which was used as the screening standard; B, The expression level of CP4-EPSPS, the dotted line showed the CP4-EPSPS expression level was 150 μg·g-1, which was used as the screening standard.图2 T0代水稻转化体中外源蛋白的表达量Fig.2 The expression level of exogenous proteins in T0 transformants of rice
获得上述10个转化体的T1代水稻植株后,对其喷施草甘膦,统计阳性和阴性转基因植株的比例,结合孟德尔遗传定律筛选出4个分离比接近3∶1的水稻转化体VB3、VB11、VB17和VB20。
利用Hi-Tail PCR的方法进一步分析4个转化体中外源基因的插入位点及边界序列,结果表明,4个水稻转化体中VB17转化体的外源基因的插入位点位于水稻功能基因上,将其筛除,其余3个转化体的插入位点没有破坏水稻基因组上原有的注释基因。本研究对Cry1Ab-Vip3Af2抗虫蛋白表达量最高的转化体VB3进行具体的分析。
2.2 VB3转化体的分子特征研究
2.2.1 外源基因的整合分析
通过设计特异性引物,利用特异性PCR方法对VB3转化体的外源T-DNA整合结果进行分析。特异性PCR检测结果表明,在T1、T2代的VB3水稻基因组中均获得cry1Ab-vip3Af2和cp4-epsps基因预期大小的扩增条带,而阴性对照组未观察到相应条带(图3),由此可得,外源基因整合稳定。
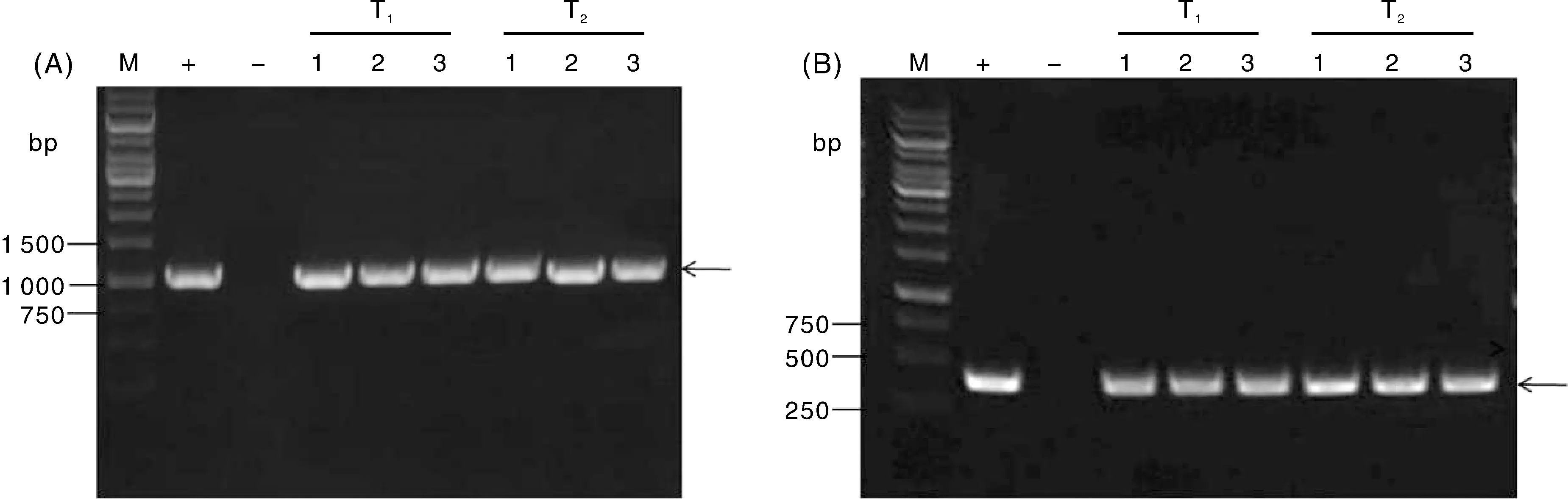
A,cry1Ab-vip3Af2基因的PCR检测结果;B,cp4-epsps基因的PCR检测结果;M,DNA分子量标准;+,阳性质粒;-,非转基因水稻对照;1~3,VB3的T1代和T2代样品。A, PCR analysis of cry1Ab-vip3Af2; B, PCR analysis of cp4-epsps; M, DNA molecular marker;-, Non-transgenic rice control;+, Positive plasmids; 1-3, Samples of T1 and T2 generations of VB3.图3 T1、T2代VB3水稻转化体的PCR检测结果Fig.3 PCR analysis of T1, T2 generations of VB3
2.2.2 外源T-DNA在VB3中的插入位点及边界序列鉴定
利用Hi-Tail PCR方法分析VB3转化体中外源基因的插入位点及边界序列,通过对扩增的条带进行比对和验证,结果表明,VB3转化体的T-DNA插入位点位于水稻第11号染色体[使用Oryzasativav7.0 (Phytozome genome ID: 323/NCBI taxonomy ID: 39947)数据库],未插入水稻功能基因上,且边界序列较完整(图4)。
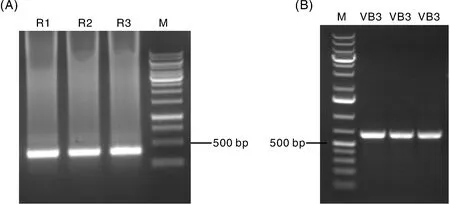
A,对VB3边界的三轮Hi-Tail PCR电泳结果。R1,第一轮PCR反应产物;R2,第二轮PCR反应产物;R3,第三轮PCR反应产物;M,DNA分子量标准。B,VB3边界的PCR鉴定结果。M,DNA分子量标准。A, The electrophoresis result of Hi-Tail PCR about VB3 border sequences. R1, Round 1 products; R2, Round 2 products; R3, Round 3 products; M, DNA molecular marker. B, The identification of VB3 border sequences. M, DNA molecular marker.图4 VB3边界序列鉴定及分析Fig.4 Identification and analyzation of VB3 border sequences
2.2.3 外源基因cry1Ab-vip3Af2和cp4-epsps在VB3基因组中的拷贝数鉴定
利用Southern blotting的方法对VB3转化体中外源基因cry1Ab-vip3Af2和cp4-epsps的拷贝数进行分析,使用的限制性内切酶为BamH I和BcuI。杂交结果表明,转化体VB3经cry1Ab全长基因和cp4-epsps全长基因探针杂交后,均显示为单一条带,且条带大小符合预期,证明VB3转化体的外源基因以单拷贝的形式整合在水稻基因组中(图5)。
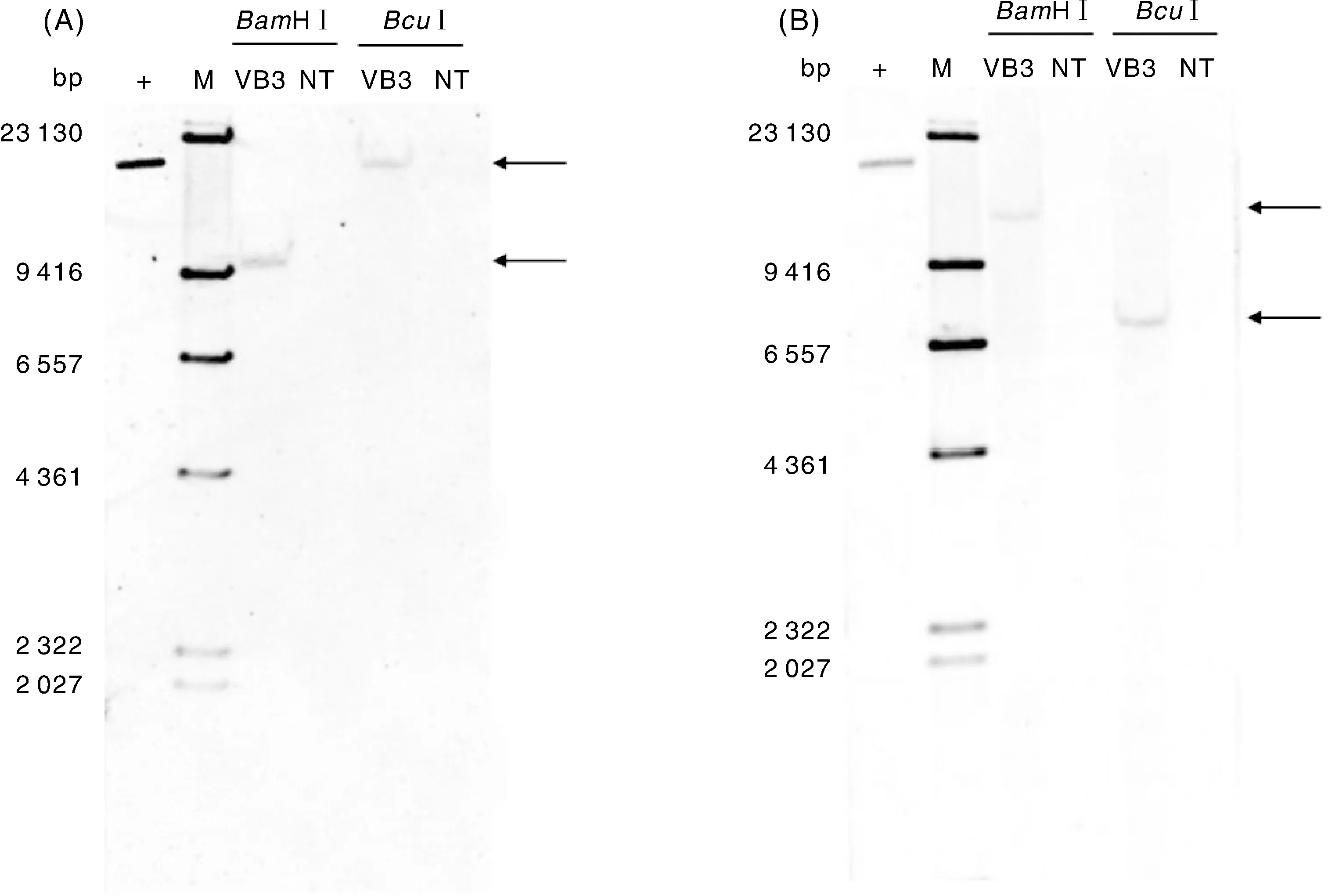
A,以cry1Ab全长DNA序列为探针的杂交图;B,以cp4-epsps全长DNA序列为探针的杂交图;+,阳性质粒;NT,以相同酶切的阴性水稻对照组;M,DNA分子量标准。A, Hybridization with cry1Ab full-length gene as probe; B, Hybridization with cp4-epsps full-length gene as probe;+, Positive plasmids; NT, Non-transgenic rice control digested with the same enzyme; M, DNA molecular maker.图5 VB3的Southern blot杂交结果Fig.5 Southern bloting of transgenic rice VB3
2.2.4 外源蛋白表达量的测定
利用ELISA的检测方法,对T1、T2代VB3水稻转化体的叶片、茎秆、根和籽粒中外源蛋白的表达量进行测定。结果表明,在T1、T2代VB3水稻转化体中,所选的植物组织中均能检测到Cry1Ab-Vip3Af2抗虫蛋白和CP4-EPSPS耐除草剂蛋白的表达,且两种蛋白的表达量均在叶片组织中最高,分别达到了16.38~16.91 μg·g-1、218.55~220.43 μg·g-1(图6)。T1、T2代VB3水稻中两种蛋白的表达量没有显著的差异,表明Cry1Ab-Vip3Af2抗虫蛋白和CP4-EPSPS耐除草剂蛋白表达稳定。
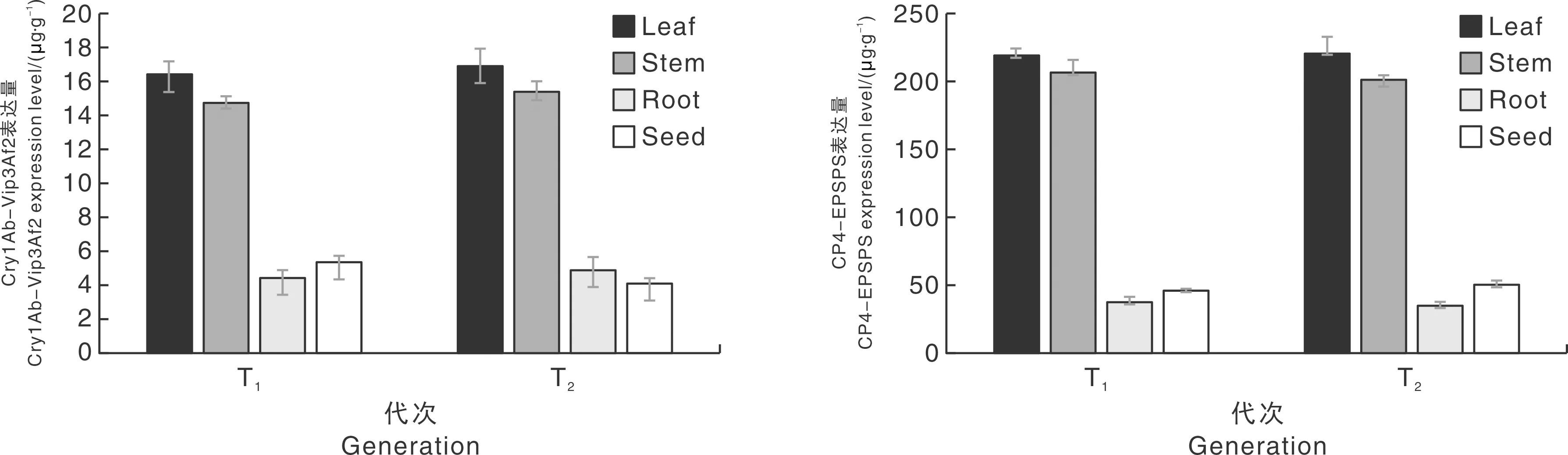
A,VB3各组织中Cry1Ab-Vip3Af2蛋白的表达量;B,VB3各组织中CP4-EPSPS蛋白的表达量。A, The expression level of Cry1Ab-Vip3Af2 in different tissues of VB3; B, The expression level of CP4-EPSPS in different tissues of VB3.图6 VB3各组织中外源蛋白的表达量Fig.6 The expression level of exogenous proteins in different tissues of VB3
2.2.5 蛋白质印迹法
利用Western blotting的方法对T1、T2代VB3转化体的叶片、茎秆、籽粒中目的蛋白的表达情况进行检测。结果表明,在T1、T2代VB3水稻的不同组织中均检测到目的蛋白的表达,且电泳结果符合预期:Cry1Ab-Vip3Af2蛋白的条带大小约为161 ku,CP4-EPSPS蛋白的条带大小约为47 ku(图7),证明Cry1Ab-Vip3Af2抗虫蛋白和CP4-EPSPS耐除草剂蛋白表达稳定。
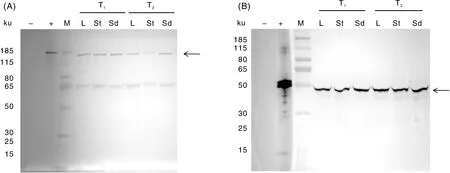
A,Cry1Ab-Vip3Af2蛋白的Western blotting检测结果;B,CP4-EPSPS蛋白的Western blotting检测结果;M,标准蛋白分子量;+,原核表达的蛋白;-,非转基因水稻对照组;L,叶片组织;St,茎秆组织;Sd,籽粒。A, Western blotting of Cry1Ab-Vip3Af2; B, Western blotting of CP4-EPSPS; M, Protein pageruler;+, Protein expressed by E.coli;-, Non-transgenic rice control; L, Leaves; St, Stem; Sd, Seed.图7 T1、T2代VB3水稻中Cry1Ab-Vip3Af2蛋白和CP4-EPSPS蛋白的Western blotting检测Fig.7 Western blotting about Cry1Ab-Vip3Af2 and CP4-EPSPS in T1 and T2 generations of VB3
2.3 VB3水稻抗虫性能分析
在VB3水稻的不同生长时期对大螟、二化螟、稻纵卷叶螟进行生物活性测定,判定其抗虫能力。生测结果表明,VB3水稻使三种昆虫的幼虫在48 h的死亡率达到90%左右,72 h达到100%,而对照组秀水134水稻上的幼虫在72 h后死亡率低于10%,处理组各个时间段幼虫的死亡率都显著高于对照组(表5)。由此可得,VB3水稻对大螟、二化螟、稻纵卷叶螟均表现出较高的抗性效果。
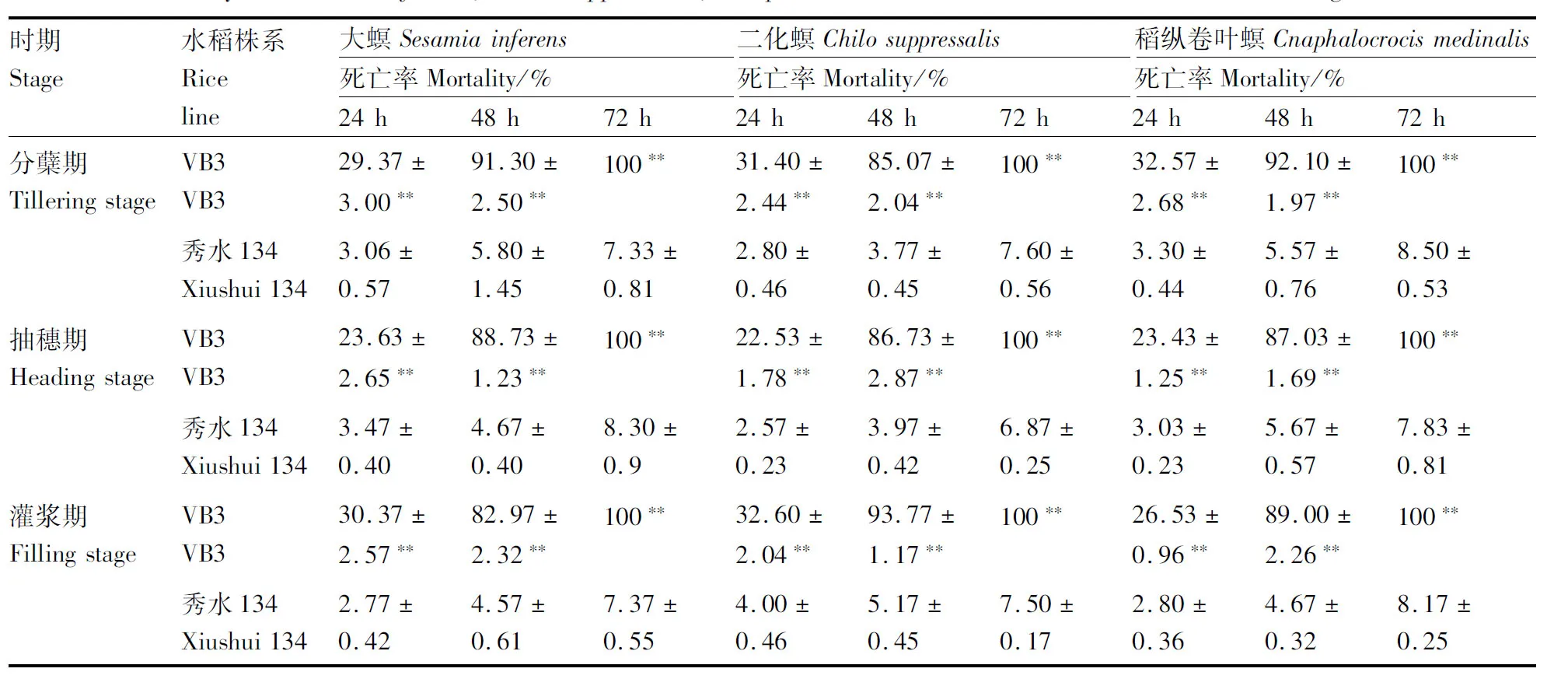
表5 大螟、二化螟、稻纵卷叶螟幼虫取食VB3和非转基因水稻叶片的死亡率Table 5 Mortality of Sesamia inferens, Chilo suppressalis, Cnaphalocrocis medinalis fed on VB3 and non-transgenic rice leaves
2.4 VB3水稻草甘膦耐受性分析
通过向3~5叶期的VB3水稻上喷施不同剂量的草甘膦,分析其对草甘膦的耐受能力。结果表明,喷施清水的VB3水稻生长状况与非转基因水稻秀水134相比无显著差异,而喷施推荐中剂量、2倍中剂量、4倍中剂量草甘膦的VB3水稻与喷施相同剂量非转基因水稻相比差异显著,喷施草甘膦的非转基因水稻叶片均发黄或枯死,而VB3水稻在喷施不同剂量草甘膦后长势均正常(图8)。由此得知,VB3对草甘膦有较高的耐受能力,可耐受4倍推荐中剂量的草甘膦。

图8 温室条件下VB3对草甘膦的耐受能力测定Fig.8 The glyphosate tolerance of VB3 in green house
3 讨论
我国在转基因水稻领域已有二十多年的研究历史,也成功获得了具备商业化应用前景的抗虫水稻株系。然而,水稻上的鳞翅目害虫种类繁多[30],单一的Bt抗虫蛋白杀虫谱较窄;其次,转基因水稻的抗虫性能与其组织中Bt蛋白的表达量息息相关,低剂量的Bt蛋白对抗虫转基因水稻的使用年限、抗性害虫的控制都将产生负面影响[18];此外,具有优良耐草甘膦性状的转基因水稻也亟待发展[23]。
本实验室在前期的研究中获得了表达Cry1Ab-Vip3Da蛋白的水稻转化体,但其抗虫蛋白的表达量相对较低,仅有4.8~5.4 μg·g-1[31];同时,Vip3Da蛋白对二化螟等水稻害虫的杀虫活性有限。因此,本研究选用了对鳞翅目害虫杀虫谱更广的Vip3Af2蛋白,将其编码基因与cry1Ab进行基因融合,同时,在转化载体中引入耐除草剂基因cp4-epsps,使其具备对草甘膦的抗性。
Cry1Ab蛋白对水稻螟蛾科害虫如二化螟、稻纵卷叶螟等具有良好的杀虫效果,但对夜蛾科害虫如大螟等的效果不佳[32];Vip3Af2是一种营养期杀虫蛋白,对螟蛾科和夜蛾科的害虫都有较高的杀虫活性[33]。Cry蛋白与Vip3蛋白的氨基酸序列同源性低,在昆虫中肠上的特异性受体也完全不同[34],二者之间不存在交互抗性[35-36]。目前水稻上已有表达抗虫融合蛋白的研究[31],但尚未有成功表达Vip3Af2或相关蛋白的报道,也没有发现害虫对Vip3A类蛋白产生实际抗性的案例[37]。此外,应用耐草甘膦的转基因水稻可以使用草甘膦清除田间杂草,为水稻杂草防治提供新的选择,具有重要的经济价值和生态意义[38]。
本研究利用农杆菌侵染的方法获得了水稻转化体,并将与常规水稻表型差异显著的转化体筛除。经过对转化体的分子特征、抗虫耐除草剂性能等方面综合测定分析,从中筛选出具有较高抗虫耐除草剂能力、分子特征明确的VB3转化体。Hi-Tail PCR的分析结果表明,VB3转化体中外源基因的插入位点未编码已知或预测的功能基因,边界序列较为完整;Southern blotting的检测结果显示,VB3转化体的外源T-DNA以单拷贝的形式整合在水稻基因组中;ELISA和Western blotting的试验结果表明VB3转化体的抗虫蛋白和耐草甘膦蛋白表达稳定,其中抗虫蛋白的表达水平显著高于此前的相关研究[17, 31];抗虫性能测定结果显示,VB3转化体高抗重要水稻害虫大螟、二化螟和稻纵卷叶螟,三种靶标昆虫的幼虫取食VB3植物组织后,48 h的死亡率达到90%左右,72 h的死亡率达到100%;草甘膦耐受性能测定结果表明VB3转化体可以较好地耐受4倍推荐中剂量的草甘膦,对该转化体喷施不同剂量的草甘膦后,植株的长势与喷施清水的非转基因水稻相比无显著差异。综上认为,本研究筛选出的VB3转化体具有较好的生产应用潜能,可以为抗虫耐除草剂水稻新品种的培育提供优质种质资源。

