磁性纳米复合纤维材料的制备及对甲基橙染料的吸附动力学研究
杨建安,文焱炳,林本旺
(1.贵州省化工研究院,贵州 贵阳 550002;2.上海申丰地质新技术应用研究所有限公司,上海 201700;3.贵州黔香园油脂有限公司,贵州 黎平 557300)
随着工业化和城市化的快速发展,水污染问题日益突出。纺织工业产生的染料废水是污水的主要来源之一,尤其是偶氮染料具有芳香环结构,很难被降解。相关研究表明,即使染料废水的浓度低至1.0mg・L-1也高度可见,且会对环境产生严重危害,比如某些小分子物质具有诱变﹑致癌和致畸作用,严重威胁人类健康和生命安全。因此,对染料废水进行排放前处理,降低有害物质的种类和含量,对促进纺织工业的可持续发展尤为重要。当前脱除偶氮染料的常用方法有膜分离﹑吸附﹑絮凝﹑过滤﹑电离﹑氧化等,其中吸附法因应用简单﹑成本低﹑易设计等优点而备受青睐。
纤维素是地球上产量最丰富的可再生资源之一,具有成本低﹑生物相容性好﹑可生物降解等优点,且含有大量的活性羟基结构,容易进行表面改性和表面修饰等操作,因此具有很大的应用潜力。前期研究发现,以纤维素作为基底材料,负载具有超顺磁性的磁性粒子用于染料废水的处理,可有效吸附有机偶氮染料组分,降低染料废水对环境的潜在危害[1]。另外,磁性吸附材料具有独特的物理结构和化学性质,对有机污染物和多种无机离子具有很强的吸附能力,并能迅速从固液溶液中分离出来,因此成为水处理最有前景的研究方向之一。
本研究采用共沉淀法,制备了具有明显磁效应且比表面积大的磁性Fe3O4纳米材料,将其在低温溶解的纤维素体系中混匀后,逐滴加入无水乙醇中,经固-液分离后制得了Fe3O4@cellulose 复合材料。再以戊二醛为交联剂,用聚乙烯亚胺(PEI)对纤维素材料进行表面改性,制备了磁性纳米复合纤维材料(FC-PEI)[2-6]。采用多种分析手段,对FC-PEI 的物化性质进行表征,进行了阴离子有机染料甲基橙(MO)的吸附实验,分析了不同的pH 值﹑吸附时间﹑染料初始浓度等对FC-PEI 吸附特性的影响。
1 试剂与仪器
1.1 材料与试剂
FeCl3・6H2O﹑FeCl2・4H2O﹑聚乙烯吡咯烷酮(PVP)﹑NaOH﹑尿素﹑纤维素﹑Fe3O4﹑无水乙醇﹑乙烯亚胺(PEI)﹑戊二醛﹑甲基橙﹑HCl(均为分析纯)。
1.2 仪器与设备
HHS-21-8 型数显电热恒温水浴锅,Nicoleti S10 型傅立叶变换红外光谱仪,UV-5200 紫外分光光度计,NIM-500C 自动磁滞回线测试仪。
2 Fe3O4@cellulose 复合材料的制备
2.1 共沉淀法制备Fe3O4 纳米颗粒
称 取2.164g 的FeCl3・6H2O﹑8.756g 的FeCl2・4H2O(即nFe3+∶nFe2+=1∶4)溶于200mL 蒸馏水中,置于三颈烧瓶中,恒温水浴30℃,搅拌30min。待两者充分混合后,在30℃恒温搅拌下,加入2g 聚乙烯吡咯烷酮(PVP),将水浴锅的温度升至50℃,缓慢加入1mol・L-1NaOH 溶液,调节pH 约为12。继续在50℃下恒温搅拌2h,抽滤分离出黑色物质,依次用去离子水﹑无水乙醇洗至中性。60℃下真空干燥12h,研磨得到黑色磁性纳米粒子(将其置于永磁铁旁边,可观察到明显的磁场变化),标记为Fe3O4NPS[7-8]。
2.2 低温溶解纤维素
称取7g 的NaOH 固体和12g 尿素于锥形瓶中,加入81g 去离子水,振荡。待其完全溶解后,再加入4g 纤维素粉,振荡使其分散均匀无块状,于-12℃的低温下放置1h,然后移至常温下搅拌,得到澄清的纤维素溶液(4wt%)[9]。
2.3 Fe3O4@cellulose 复合材料的制备
量取50 mL 纤维素溶液于85℃下恒温水浴30min,加 入0.25g 的Fe3O4纳 米 颗 粒,电 动 搅 拌30min 至分散均匀。待混合物冷却至25℃,将其缓慢滴加至100mL 无水乙醇溶液中,抽滤分离,并用蒸馏水洗掉产品表面残留的无水乙醇,得到磁性纤维素湿珠子,标记为FC,贮藏备用[10-11]。
2.4 Fe3O4@cellulose 复合材料的表面改性
称取4g 的FC 于200mL 蒸馏水中,逐滴加入4g聚乙烯亚胺(PEI)和6g 戊二醛(25wt%),45℃下恒温搅拌4h。抽滤分离,用蒸馏水冲洗,60℃下真空干燥过夜,产物标记为FC-PEI,研磨备用[12-13]。
2.5 吸附动力学实验
2.5.1 pH 对吸附容量的影响
称取50mg 的FC-PEI 于不同的100mL 锥形瓶中,加入5mL﹑1g・L-1的甲基橙溶液和45mL 蒸馏水(即0.1g・L-1甲基橙溶液),用0.1g・L-1NaOH 溶液或0.1g・L-1HCl 溶液调节溶液的pH 分别为3﹑4﹑5﹑6﹑7﹑8﹑9,吸附8h 后离心,取表层清液测定吸光度。根据甲基橙(MO)的标准曲线拟合出的线性回归方程,计算吸附后的染料浓度和吸附容量。最高吸附容量所对应的pH 值为最佳[14]。
2.5.2 时间对吸附容量的影响
称取50mg 的FC-PEI 于不同的100mL 锥形瓶中,加入5mL﹑1g・L-1的甲基橙溶液和45mL 蒸馏水(即0.1g・L-1的甲基橙溶液),将pH 调至最佳(pH=4),分别吸附0.5h﹑1h﹑2h﹑4h﹑6h﹑8h。达到吸附时间后离心,取表层清液测定吸光度,根据甲基橙(MO)标准曲线得到的线性回归方程,计算吸附后的染料浓度和吸附容量,最高吸附容量所对应的吸附时间为最佳[15]。
2.5.3 染料浓度对吸附容量的影响
称取50mg 的FC-PEI 于100mL 锥形瓶中,用移液管分别吸取1g・L-1甲基橙溶液0.5﹑1.0﹑1.5﹑2.0﹑2.5﹑3.0﹑3.5﹑4.0mL 加入锥形瓶中,依次加入49.5﹑49.0﹑48.5﹑48.0﹑47.5﹑47.0﹑46.5﹑46.0mL 蒸 馏 水,将pH 调至最佳(pH=4),分别在染料浓度为0.01﹑0.02﹑0.03﹑0.04﹑0.05﹑0.06﹑0.07﹑0.08g・L-1时进行吸附实验,吸附到平衡时间即6h 后,取表层清液测定吸光度,根据甲基橙(MO)标准曲线所得的线性回归方程,计算吸附后的染料浓度和吸附容量,最高吸附容量所对应的吸附时间为最佳[16-17]。
2.5.4 吸附容量的计算
使用紫外可见分光光度计,测定不同的pH﹑不同的吸附时间﹑不同的初始染料浓度下,经FC-PEI吸附处理后的甲基橙溶液的吸光度,根据MO 标准曲线,计算甲基橙溶液经吸附后的染料浓度,采用式(1)和式(2)计算去除率R 和吸附容量qe[18]。
式中,R 为去除率,%;qe为复合材料对甲基橙的吸附容量,mg・g-1;C0为甲基橙染料的初始浓度,g・L-1;Ce为甲基橙染料的最终浓度,g・L-1;V 为反应溶液的体积,mL;M 为吸附剂的质量,g。
3 结果与讨论
3.1 磁性纳米复合纤维材料的表征
3.1.1 磁性纳米复合纤维材料的红外光谱
Fe3O4NPS﹑Fe3O4@cellulose﹑Fe3O4@cellulose-PEI 的红外光谱图见图1。以Fe3O4NPS 的红外光谱为基准,对比Fe3O4@cellulose和Fe3O4@cellulose-PEI 的曲线后可以看出,3434 cm-1是-OH强而宽的吸收带,说明Fe3O4@cellulose 和Fe3O4@cellulose-PEI表面有活性羟基。2900cm-1为-CH2的反对称伸缩振动峰,2345cm-1为Fe3O4NPS 中的Fe-O键的振动峰。Fe3O4@cellulose-PEI的红外光谱上,1637cm-1﹑1062cm-1处的特征吸收峰,分别为聚乙烯亚胺的氨基和C-O-C 基团。C-O-C 的出现说明聚乙烯亚胺和纤维素结合得较好。
3.1.2 Fe3O4纳米颗粒的磁性能分析
物质的磁性常用磁滞回线来表征。Fe3O4纳米颗粒的磁滞回线见图2。由图2 可知,其磁滞回线呈现“S”型,饱和磁化强度约为205emu・g-1,没有磁滞环出现,说明所有的纳米粒子均没有剩磁,且矫顽力几乎为0,表现出良好的超顺磁性,表明Fe3O4纳米粒子在外加磁场的作用下,可以快速吸附并团聚在小磁铁的附近,从而达到富集﹑分离的目的。同时,在外加磁场的作用下,Fe3O4纳米颗粒也能从染料中分离。
3.2 实验条件对吸附容量的影响
3.2.1 甲基橙(MO)标准曲线
称取0.5g 甲基橙粉末,用少量去离子水溶解于500mL 烧杯中,然后转移至500mL 容量瓶中定容,振荡,配制成1g・L-1甲基橙溶液。将1g・L-1的甲基橙溶液稀释一定的倍数,配制成浓度分别为0.002﹑0.004﹑0.006﹑0.008﹑0.010﹑0.012﹑0.014﹑0.016g・L-1的甲基橙溶液。设置最大吸收波长为463nm,采用紫外可见分光光度计测定相应的吸光度,绘制甲基橙染料的标准曲线(图3),其线性相关性达到0.99989。
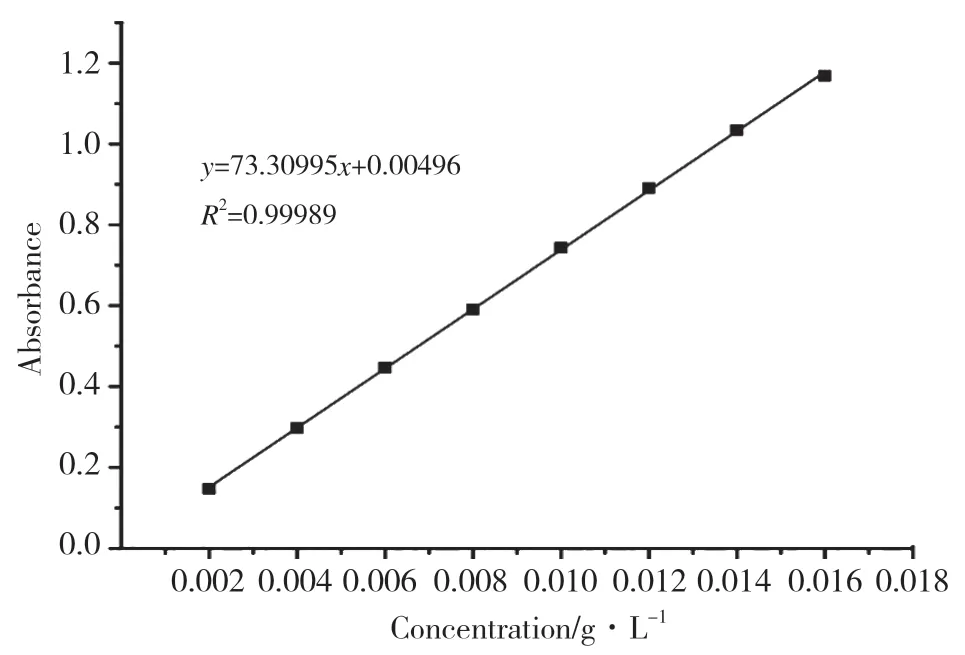
图3 MO 的标准曲线
3.2.2 pH 对吸附容量的影响
移取50mL 初始浓度为1g・L-1的甲基橙溶液于不同的锥形瓶中,加入50mg 吸附剂进行吸附,分别调节pH 为3﹑4﹑5﹑6﹑7﹑8﹑9,吸附8h 后取表层清液测定吸光度,考察pH 对吸附容量的影响,结果见图4。由图4 可知,pH=4 时,吸附容量最大。pH >4 时,Fe3O4@cellulose-PEI 纳米粒子的吸附能力随着pH 的增大而降低。原因是pH 较低时,吸附体系中存在较多的质子,使得Fe3O4@cellulose-PEI 吸附剂的氨基发生了质子化,形成的铵根阳离子与阴离子染料甲基橙会产生静电吸引现象,有利于复合吸附剂对甲基橙的吸附。随着pH 增大,更多的氢氧根离子与复合吸附剂的氨基结合,而铵根阳离子逐渐减少,静电吸附作用减弱甚至消失,因此pH >4时,吸附容量不断减少。

图4 pH 对吸附容量的影响
3.2.3 吸附时间对吸附容量的影响
移取50mL 初始浓度为1g・L-1的甲基橙溶液,加入50mg 吸附剂,将pH 调至最佳(pH=4),分别吸附0.5h﹑1h﹑2h﹑4h﹑6h﹑8h 后,取表层清液测定吸光度,吸附时间对吸附容量的影响见图5。从图5 可以看出,Fe3O4@cellulose-PEI 吸附剂对甲基橙溶液的吸附容量,随着吸附时间的延长逐渐增大,吸附时间达到6h 时,吸附容量趋于稳定,说明此时吸附容量已达到最大值。原因可能是在吸附初期,吸附剂表面存在着大量的吸附位点,甲基橙溶液与吸附剂表面的浓度梯度较大,因此甲基橙的吸附速率较快;随着吸附时间增加,吸附剂表面的吸附位点逐渐被填满,甲基橙开始进入阻力较大的Fe3O4@cellulose-PEI 复合物内部孔隙,其扩散速度因此减慢,吸附速度也随之减慢,因此吸附容量在6h 后呈现出稳定的趋势,即吸附达到了平衡[19-20]。
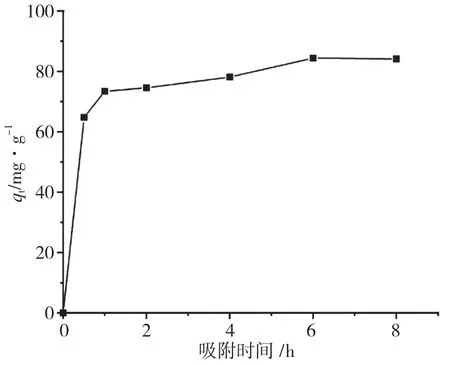
图5 吸附时间对吸附容量的影响
3.3 吸附动力学
分别用一级动力学和二级动力学模型拟合复合吸附剂对甲基橙溶液的吸附过程,其线性方程如式(3)﹑式(4)所示:
式中,qt为t 时刻的吸附容量,mg・g-1;qe为达到平衡后的吸附容量,mg・g-1;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g・(mg・min)-1。
分别用式(3)﹑式(4)对吸附数据进行拟合,结果见图6﹑图7 和表1。从表1 的数据可以看出,准二级吸附速率方程的线性相关性R2=0.99829,大于准一级吸附速率方程的线性相关性0.84249,说明拟合结果与实验数据非常吻合,表明复合吸附剂对甲基橙的吸附动力学用准二级动力学模型描述最佳。
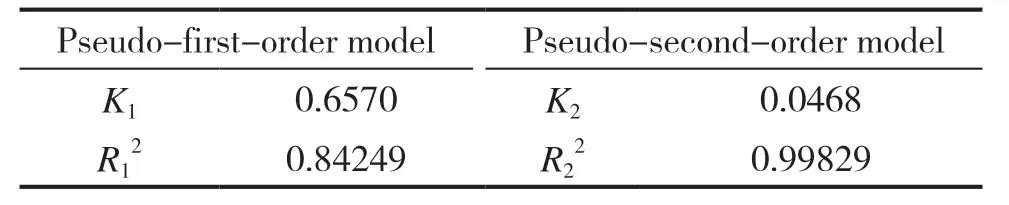
表1 复合吸附剂对甲基橙的吸附动力学参数

图6 复合吸附剂对甲基橙的准一级吸附动力学曲线
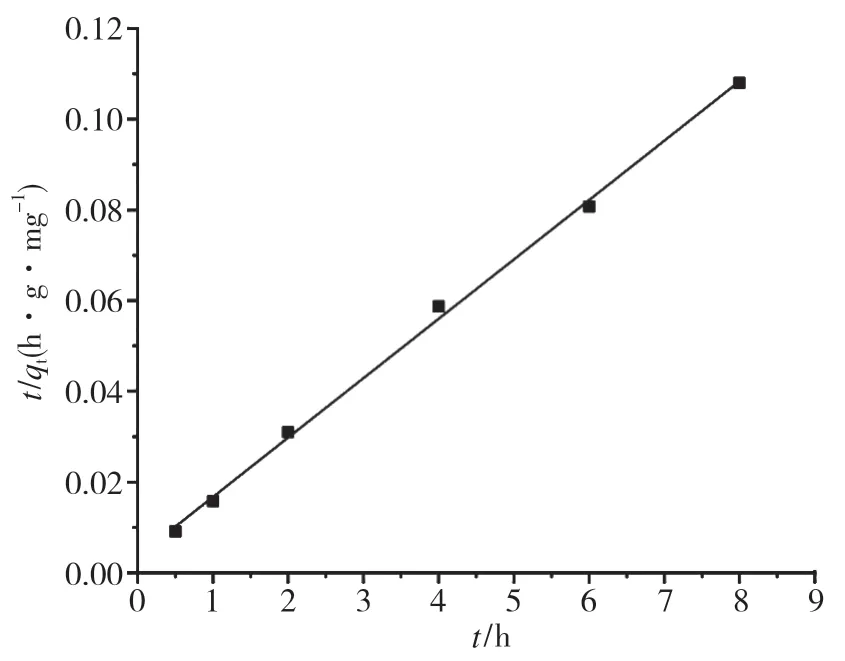
图7 复合吸附剂对甲基橙的准二级吸附动力学曲线
3.4 吸附等温线
分 别 取0.01﹑0.02﹑0.03﹑0.04﹑0.05﹑0.06﹑0.07﹑0.08g・L-1的甲基橙溶液各50mL 于锥形瓶中,加入50mg 吸附剂,吸附6h 后,测定上层清液的吸光度值,考察吸附剂对不同初始浓度的甲基橙溶液的吸附容量,结果见表2。
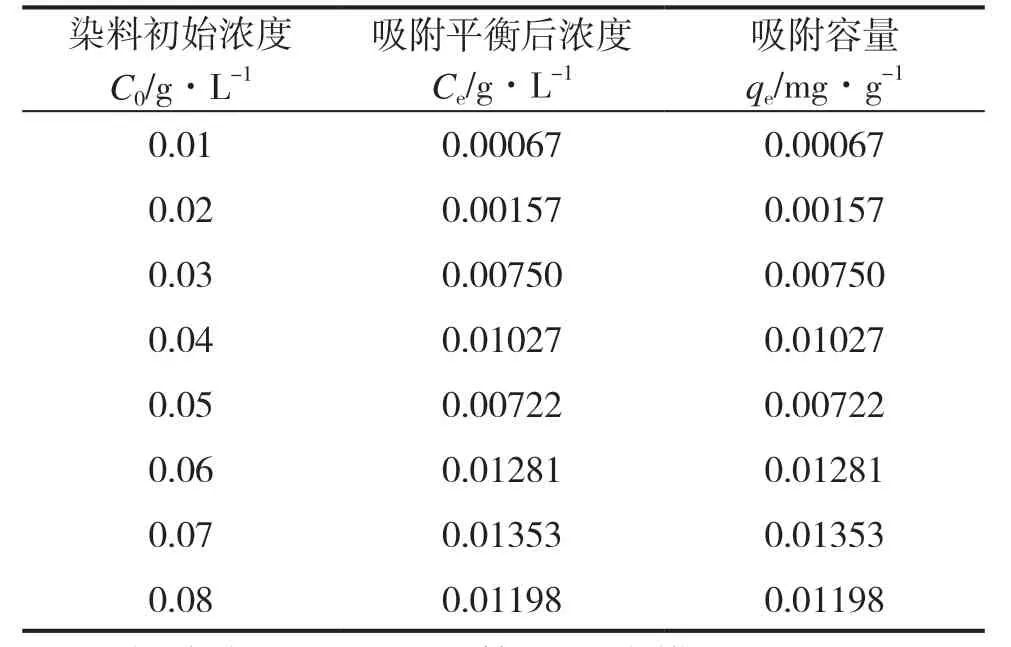
表2 不同的染料初始浓度对吸附容量的影响
分别采用Langmuir 等温吸附模型和Freundlich等温吸附模型,对上述实验数据进行拟合,拟合方程见式(5)﹑式(6):
式中,qm为单分子层的饱和吸附量,mg・g-1;KL为Langmuir 的吸附常数;n 为Freundlich 的吸附常数;KF为Freundlich 的吸附常数;Ce为平衡后的染料浓度,g・L-1。
分 别 以Ce/qe对Ce,以 及lnqe对lnCe作 图,拟 合 结 果 见 图8﹑图9 和 表3。 由 表3 可 知,Langmuir 吸附等温式的相关系数R12=0.45254,小于Freundlich 吸附等温式的相关系数R22=0.80922,同时Freundlich 吸附等温式拟合的理论最大吸附容量,与实验测定的最大吸附容量十分接近,理论值与实验结果吻合较好,表明复合吸附剂对甲基橙的吸附过程,更符合Freundlich 等温模型,属于多分子层吸附。
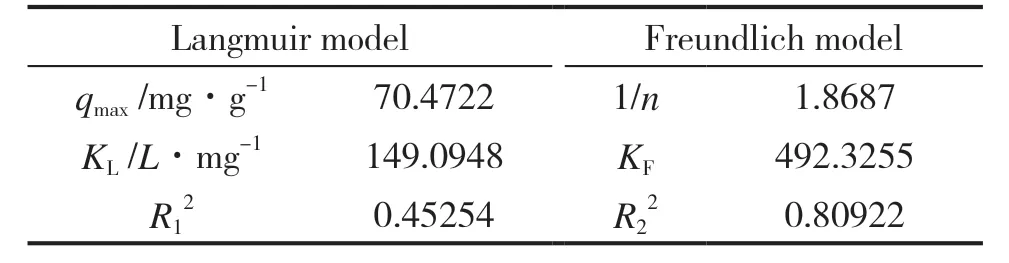
表3 复合吸附剂对甲基橙的吸附等温线参数
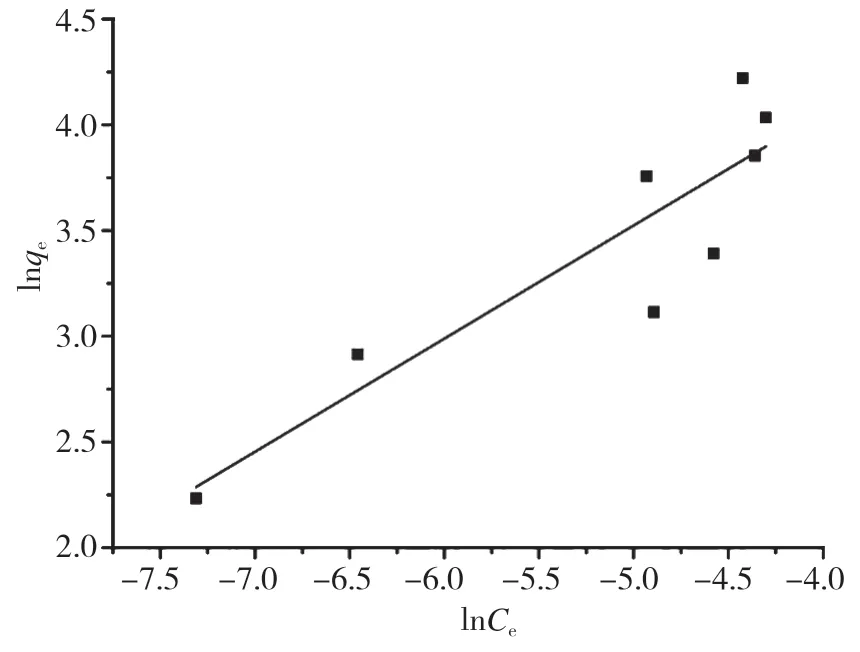
图9 复合吸附剂对甲基橙的Freundlich 吸附等温线
4 结论
本研究用聚乙烯亚胺改性Fe3O4磁性纳米颗粒和纤维素复合材料,制备了易分离回收的染料废水吸附剂。Fe3O4@cellulose-PEI 吸附甲基橙染料的实验结果表明,在pH=4 的条件下处理6h 后,材料的吸附容量高达84.4mg・g-1,吸附过程符合准二级吸附速率方程和Freundlich 等温吸附模型。该研究可为磁性纳米复合纤维材料在工业废水治理中的应用提供重要的数据参考。

