普通烟草NtIAA13b基因的克隆及功能分析
喻奇伟,朱紫童,何轶*,曹廷茂,康俊,罗贞宝,李磊磊,戴彬,李鹏志,高冬冬,吴学巧,贾宏昉*
1.贵州省烟草公司毕节市公司,贵州省毕节市七星关区南岭路519号 551700
2.河南农业大学烟草学院,郑州市郑东新区平安大道218号 450002
钾作为植物生长过程中不可或缺的矿质营养元素,能够参与碳、氮代谢等生命活动,同时,植物对钾的吸收水平会影响自身的抗病和抗逆能力[1]。烟草是中国重要的经济作物。然而,中国烟叶的钾含量普遍低于优质烟叶钾含量的最低标准,故在农业生产中适当提高烟草中的钾含量不仅能够满足其生长发育的需求,提高烟叶品质,而且能够有效降低烟草中焦油及其他有害物质的含量[2]。植物主要通过钾转运蛋白和钾离子通道蛋白实现对钾的吸收与利用,目前在烟草中已有多个钾转运蛋白基因(HAK11、HAK5等)和钾离子通道蛋白基因(AKT1、TPK1等)被鉴定发现并且已经进行了功能验证[3-6]。除了钾转运蛋白和钾离子通道蛋白基因以外,还有许多上游基因通过调控钾转运蛋白和钾离子通道蛋白基因的表达参与钾的吸收与利用过程[7-8],如拟南芥中生长素响应因子AtARF2可通过调控HAK5基因的表达影响钾吸收[9],说明生长素相关基因在钾的吸收与利用过程中可能也发挥着重要作用。
Aux/IAA基因家族是生长素诱导相关基因家族,其编码的蛋白质能够通过与生长素响应因子(Auxin response factors,ARFs)结合调控ARF家族基因的表达。关于Aux/IAA基因家族成员的研究主要集中在拟南芥、水稻和小麦3种植物中[10],目前已分别鉴定出29个[11]、31个[12]和84个[13]Aux/IAA家族成员,但大多数成员的功能都与植物根、茎、叶和果实的生长发育有关,只有少部分成员的功能与植物响应非生物胁迫有关。如Jung等[14]通过转基因技术创制过表达株系,同时对野生型株系与过表达株系进行干旱胁迫处理,发现OsIAA6基因过表达株系的抗旱能力明显增强;Salehin等[15]通过基因编辑技术创制基因敲除株系,同时对野生型株系与基因敲除株系进行干旱胁迫处理,发现AtIAA5、AtIAA6或AtIAA19基因敲除后植株的抗旱能力均明显下降;Jain等[16]通过对水稻进行盐胁迫处理,发现水稻OsIAA9基因和OsIAA20基因的表达量在高盐胁迫条件下明显上调。然而,目前对Aux/IAA家族基因在植物对钾吸收与利用过程中作用的研究还鲜见报道,烟草中已经鉴定出了77个Aux/IAA家族成员,但大多数成员的功能还尚不明确[17]。因此,克隆Aux/IAA家族基因NtIAA13b,利用qRT-PCR、亚细胞定位和转基因等技术对该基因进行系统分析,旨在进一步探究Aux/IAA家族基因响应非生物胁迫的功能,揭示烟草NtIAA13b基因在钾吸收与利用过程中的作用。
1 材料与方法
1.1 供试材料
1.1.1 供试材料培养
将普通烤烟品种K326采用Hoagland水培法培养在人工气候箱内,光照强度、光照周期、相对湿度和温度分别设置为300 μmol·m-2·s-1、16 h/8 h(光/暗)、60%、28℃/22℃(光/暗),培养14 d,选取长势一致的烟株。
1.1.2 不同营养液配方
全营养液:5 mmol/L NaNO3;1 mmol/L NaH2PO·42H2O;1 mmol/L K2SO4;0.75 mmol/L CaCl2·2H2O;0.5 mmol/L MgSO4·7H2O;9 µmol/L MnCl2·4H2O;0.03µmol/L(NH4)2MoO4;46µmol/L H3BO3;8µmol/L ZnSO4·7H2O;3 µmol/L CuSO4·5H2O;20 µmol/L FeSO4·7H2O和Na2-EDTA螯合物。低氮处理营养液:将全营养液中NO3-浓度调整为0.25 mmol/L;低磷处理营养液:将全营养液中PO43-浓度调整为0.05 mmol/L;低钾处理营养液:将全营养液中K+浓度调整为0.1 mmol/L;低钙处理营养液:将全营养液中Ca2+浓度调整为0.05 mmol/L;低镁处理营养液:将全营养液中Mg2+浓度调整为0.05 mmol/L。
1.2 样品采集方法
将1.1.1中长势一致的烟株进行不同非生物胁迫(低氮、低磷、低钾、低钙、低镁)处理,并以全营养液处理作为对照(CK),7 d后不同处理分别选取3株幼苗,重复3次,用于检测NtIAA13b基因的表达量。不同处理分别选取3株幼苗,将根、茎、叶3个部位分别取样,重复3次,用于分析NtIAA13b基因的组织表达特性。
1.3 目的基因的克隆
使用Eastep®Super Total RNA Extraction Kit试剂盒(上海普洛麦格公司)提取烟草的总RNA,测定所提总RNA的OD260/280值,并用1.2%(质量分数)琼脂糖凝胶电泳检测其完整性。使用HiScript®Ⅲ1st Strand cDNA Synthesis Kit(+gDNA wiper)试剂盒(南京诺唯赞公司)进行反转录试验,获得cDNA产物。采用Primer Premier 5.0软件设计试验所需要的扩增引物,以反转录得到的cDNA为模板进行PCR扩增,PCR扩增目的基因的条件如下:94℃预变性4 min;94℃变性1 min,58℃退火1 min,72℃延伸1 min,35个循环;72℃保温10 min。再利用DNA连接酶把扩增得到的目的片段与中间载体pMD19-T相连,测序验证工作由武汉伯远生物科技有限公司完成,最终得到全长cDNA序列信息。
1.4 序列分析方法
使用NCBI网站的ORF finder在线分析工具(https://www.ncbi.nlm.nih.gov/orffinder/)进行基因序列的蛋白质翻译;使用NetPhos 2.0在线分析工具(http://www.cbs.dtu.dk/services/NetPhos/)预测NtIAA13b蛋白质的磷酸化位点;使用DNAMAN软件将NtIAA13b与拟南芥、白桦、番茄等植物中已鉴定出的Aux/IAA家族蛋白做同源性比对;使用MEGA 6.0软件构建系统进化树[18]。
1.5 启动子分析
登录茄科网站(https://solgenomics.net/),以烟草NtIAA13b基因全长序列作为探针,使用Blast在线工具搜索基因全长序列,选取NtIAA13b基因起始密码子(ATG)上游2 000 bp的核苷酸序列用于启动子分析,通过PlantCARE网站(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对目标基因启动子区的顺式作用元件进行鉴定分析。
1.6 亚细胞定位分析
将没有末端密码子的NtIAA13b cDNA融合到pBWA(V)HS载体中绿色荧光蛋白(GFP)基因的N末端,获得融合载体pBWA(V)HS-NtIAA13b-GLosgfp,将未插入NtIAA13b基因的pBWA(V)HS-GLosgfp空载体作对照。通过注射法导入叶片组织,然后将转化的烟草表皮样品在25℃避光保存16 h。通过共聚焦激光扫描显微镜监测GFP的瞬时表达部位[19]。
1.7 基因表达分析
根据RealMasterMix(SYBR Green)试剂盒(美国赛默飞公司)的说明书逐步进行实时荧光定量PCR试验,实时荧光定量的试验数据使用烟草组成型表达基因NtL25(GenBank:L18908.1)作为内参基因进行3次重复试验,并使用2-ΔΔCT算法加以分析。假定胁迫处理后目的基因表达量是CK处理的N倍,N=2-ΔΔCT,ΔΔCT=Treat(CT样品-CTL25)-CK(CT样品-CTL25)[20]。
1.8 pCAMBIA13.5 -NtIAA13b过表达载体构建及遗传转化
基于基因克隆测序无误的NtIAA13b基因序列,设计并构建NtIAA13b基因过表达载体(NtIAA13b-OX)的引物,并利用测序无误的NtIAA13b cDNA克隆为模板扩增NtIAA13b基因的完整序列(XM_016607561.1),在pCAMBIA1305载体上接入PCR产物,获得过表达载体pCAMBIA1305-NtIAA13b。采用电转化的方法,将过表达载体转入农杆菌GV3101感受态细胞中,筛选出阳性克隆,并使用筛选结果为阳性的菌液侵染烟草K326植株[21]进行收种,获得转基因材料T0代种子,继续繁育获得T2代纯合种子。
1.9 NtIAA13b基因过表达株系的生理功能验证
将1.8中获得的过表达(OX)T2代纯合烟草种子和过表达材料的野生型烟草(K326)种子经Hoagland水培法培养30 d后,各取3株幼苗并将所有叶片剪下,检测叶片中的钾含量,将剩余幼苗进行盆栽培养,现蕾期进行打顶,打顶后7 d分别取过表达植株(15株)和烟草K326植株(15株)的上部叶、中部叶和下部叶,杀青后测定钾含量。
1.10 数据分析
使用DPS 7.0软件进行完全随机单向测试的试验统计分析,采用LSD法进行多重对比分析,并对结果进行不同标记,综合数据与分析结果运用Origin 2018软件作图。
2 结果与分析
2.1 NtIAA13b基因的PCR扩增结果
以烟草根系的cDNA为模板,通过琼脂糖电泳检测PCR扩增产物,结果如图1所示。该基因全长在750~1 000 bp之间,使用NCBI网站ORF finder在线工具分析,发现该基因全长879 bp,可编码292个氨基酸,暂将其命名为NtIAA13b。
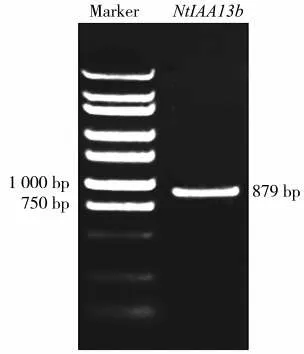
图1 NtIAA13b全长基因的PCR扩增电泳图谱Fig.1 Electrophoretogram of PCR amplification of full-length NtIAA13b
2.2 NtIAA13b蛋白质生物信息学分析
由图2可见,NtIAA13b基因全长879 bp,编码292个氨基酸,相对分子质量为31.71 kD,理论等电点为6.48。编码酸性氨基酸41个,碱性氨基酸40个。分子式为C1371H2200N390O445S14,NtIAA13b蛋白的不稳定指数为24.90,属于稳定蛋白,该蛋白二级结构中α螺旋结构占28.08%,延伸链占21.92%,无规则卷曲占40.07%,β折叠结构占9.93%。NtIAA13b蛋白的氨基酸序列中包含16个丝氨酸、12个苏氨酸和3个酪氨酸,在这些位点可能发生磷酸化。
2.3 NtIAA13b基因同源序列比对及进化分析
通过NCBI网站查询烟草、番茄和拟南芥等植物Aux/IAA家族的蛋白质序列,并通过DNAMAN软件进行氨基酸序列比对(图3),发现克隆得到的NtIAA13b与拟南芥AtIAA13的同源性为48.31%,与SlIAA13的同源性为83.11%。通过MEGA 6.0软件构建系统进化树,发现NtIAA13b与番茄SlIAA13的亲缘关系最近(图4)。
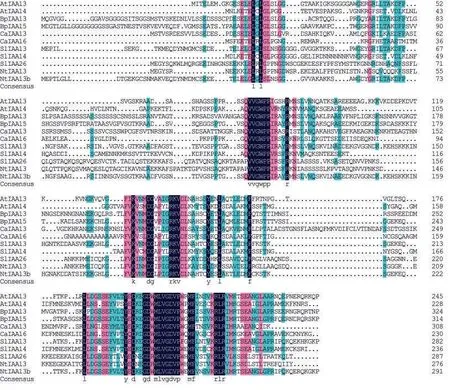
图3 氨基酸序列同源性分析Fig.3 Homology analysis of amino acid sequences
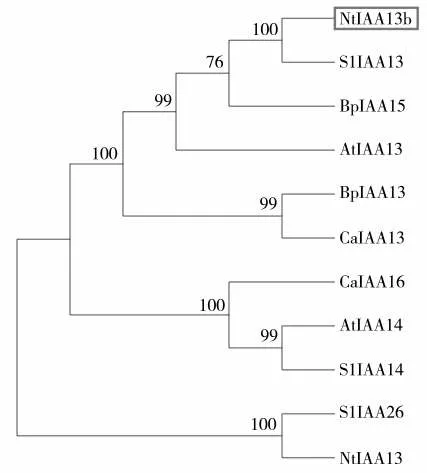
图4 系统进化树Fig.4 Phylogenetic tree
2.4 NtIAA13b基因启动子元件分析
由图5可知,NtIAA13b基因启动子区域除了包含基本元件TATA-box和CAAT-box外,还有1个参与防御和应激响应的顺式作用元件(TC-rich repeats)、3个防卫和胁迫响应顺式作用元件(MYB)、1个赤霉素响应元件(P-box)、1个生长素响应元件(TGA-element)和1个参与厌氧诱导的调控元件(ARE)。其中,植物生长素响应元件(TGA-element)可以促进或抑制植物生长素诱导基因的表达。此外,在胁迫条件下防卫和胁迫响应元件(MYB)能够诱导胁迫相关基因表达,导致相关基因的瞬时表达量上调。

图5 NtIAA13b基因的启动子元件分析Fig.5 Sequence element analysis of promoters of NtIAA13b
2.5 NtIAA13b亚细胞定位分析
通过共聚焦激光扫描显微镜监测GFP的瞬时表达,发现NtIAA13b蛋白定位于细胞核中(图6)。
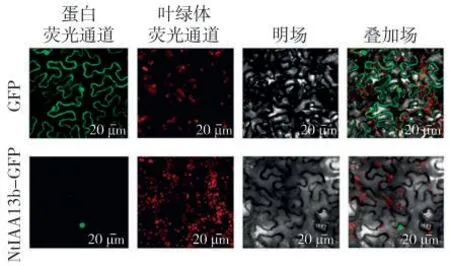
图6 NtIAA13b蛋白的亚细胞定位Fig.6 Subcellular localization of NtIAA13b
2.6 NtIAA13b基因的表达特性
2.6.1 不同非生物胁迫下NtIAA13b基因的表达特性分析
为检测NtIAA13b基因在不同非生物胁迫处理下的表达情况,分别用低氮、低磷、低钾、低钙和低镁5种非生物胁迫对烟草K326幼苗进行处理采样,qRT-PCR结果(图7A)表明,NtIAA13b基因在低钾胁迫下的相对表达量极显著高于CK条件下的相对表达量,说明低钾胁迫可以使NtIAA13b基因的表达量上调。
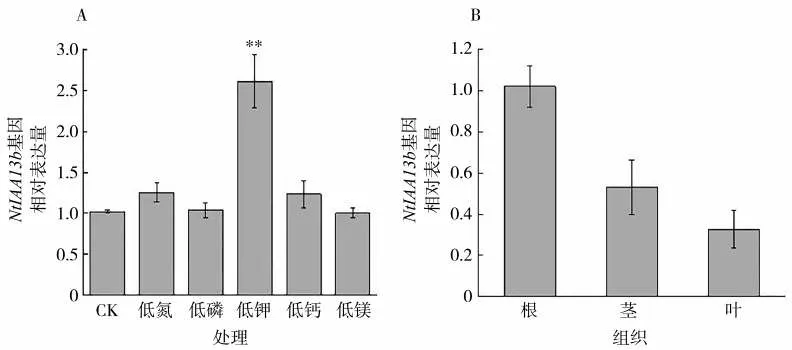
图7 NtIAA13b基因在不同非生物胁迫和不同组织中的表达模式Fig.7 Expression patterns of NtIAA13b in different tissues under different abiotic stresses
2.6.2 NtIAA13b基因的组织表达特性分析
为分析NtIAA13b基因在烟株不同部位的表达特性,通过qRT-PCR技术检测正常处理下不同组织部位NtIAA13b基因的相对表达量,发现NtIAA13b基因在烟草根、茎、叶中均有表达,其中根中表达量最高(图7B)。
2.7 NtIAA13b基因过表达对植株叶片钾含量的影响
通过转基因技术获得10个过表达的烟草株系,从中筛选两个NtIAA13b基因表达量较高的植株(OX1和OX9),观察OX1和OX9的表型,发现其烟株发育表型与烟草K326(WT)无显著差异(图8B)。检测烟草K326植株与NtIAA13b基因过表达烟草植株在正常供钾条件下叶片中的钾含量,发现在正常供钾条件下,NtIAA13b基因过表达烟草植株叶片中的钾含量显著高于烟草K326植株(图8C),说明过表达NtIAA13b基因可以增加烟草叶片中的钾含量,提高烟草对钾的吸收与利用水平。为进一步明确NtIAA13b基因在钾吸收与利用中的作用,通过盆栽试验,分析了OX1和OX9打顶后上、中、下3个部位叶片的钾含量(图8D),结果显示NtIAA13b基因过表达烟草植株在正常供钾生长条件下,其上、中、下部位叶片钾含量均高于烟草K326植株。
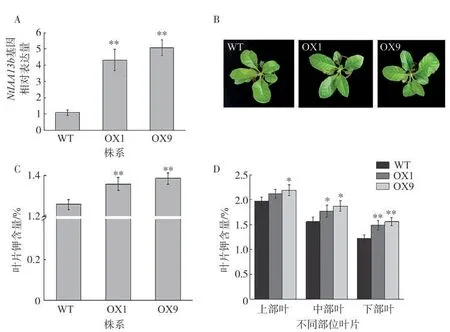
图8 NtIAA13b基因过表达植株的表型及其叶片中的钾含量Fig.8 Phenotype of NtIAA13b-overexpressed plants and potassium content in their leaves
3 讨论
首次从烟草K326中克隆出NtIAA13b基因,该基因全长879 bp,编码292个氨基酸。通过生物信息学分析发现,NtIAA13b基因编码的蛋白质NtIAA13b与番茄SlIAA13的亲缘关系最近,推测二者可能具有相似的功能。NtIAA13b基因启动子包含多个防卫、防御、胁迫响应和应激响应的顺式作用元件,生长素、赤霉素响应元件和参与厌氧诱导的调控元件,推断该基因可能响应非生物胁迫,并且能够影响生长素相关基因表达。亚细胞定位结果显示,NtIAA13b基因编码蛋白主要定位在细胞核,植物蛋白质的亚细胞定位结果可以暗示其功能特性[22]。由于转录因子调控基因转录的过程发生在细胞核中,故推测定位于细胞核上的NtIAA13b蛋白属于转录调控因子。
对NtIAA13b基因在烟草不同组织中的表达水平进行分析,结果显示,NtIAA13b基因在根、茎和叶中均有表达,其中根中表达量最高,叶中最低,各组织表达量之间存在差异。通过进一步分析NtIAA13b基因在烟草缺钾条件下的表达量水平,结合启动子顺式作用元件分析结果,推测NtIAA13b基因参与了低钾胁迫下钾的吸收与利用。通过对比烟草K326植株与NtIAA13b基因过表达植株在正常供钾条件下叶片中的钾含量,发现过表达植株中的钾含量更高,说明过表达该基因能够显著增强叶片中的钾含量。推测NtIAA13b基因可能通过和ARF家族基因成员互作,间接调控下游钾吸收相关靶基因,从而参与烟草钾的吸收与利用。因此,在后续的研究中,可以通过酵母双杂交、BiFC等技术进一步深入解析NtIAA13b基因的互作蛋白,明晰NtIAA13b基因调控钾吸收与利用的分子机制。
4 结论
在烟草中克隆了NtIAA13b基因,研究了NtIAA13b的蛋白质结构、同源性和亚细胞定位,发现该蛋白定位在细胞核,可能是一个转录调控因子。启动子顺式元件分析与基因的表达模式分析结果显示NtIAA13b基因的启动子区域含有与响应非生物胁迫相关的顺式作用元件,NtIAA13b基因能够响应低钾胁迫表达量上调至正常条件下的2.5倍,且NtIAA13b基因在不同组织部位的表达量存在差异,在根中表达量较高。过表达NtIAA13b基因能够提高叶片中的钾含量,结合启动子元件分析结果,可以说明NtIAA13b基因能够响应非生物胁迫反应并且参与烟草中钾的吸收与利用过程。

