QuEChERS-超高效液相色谱-三重四极杆质谱法检测茶叶中250种农药残留
袁荷芳 宋淑文 高蕙文 耿成钢
摘要:建立了QuEChERS-超高效液相色谱-串联质谱法测定茶叶中250种农药残留及代谢物的分析方法。前处理采用QuEChERS方法,样品用含有1%乙酸-乙腈振荡提取,经十八烷基硅胶(C18)、N-丙基乙二胺(PSA)、石墨化碳黑(GCB)和无水硫酸镁混合型净化剂固相分散萃取净化。采用2 mmol/L甲酸铵+0.01%甲酸水溶液-2 mmol/L甲酸铵+0.01%甲酸甲醇溶液作为流动相,以0.3 mL/min的流速进行梯度洗脱,采用ACQUITY HSS T3色谱柱(2.1 mm×100 mm,1.8 ?m)分离,在ESI正离子模式下,采用动态反应监测S-MRM(Scheduled-MRM)模式进行扫描,外标法定量。结果表明,250种农药在各自质量浓度范围内均呈现良好线性关系,相关系数>0.994,定量限为0.01 mg/kg,在3个添加水平(0.01、0.02、0.05 mg/kg)下回收率在71.3%~107.1%之间,相对标准偏差小于10%。由此可得,该新方法快速、灵敏、准确,适用于茶叶中农药残留检测。
关键词:QuEChERS;超高效液相色谱-串联质谱;农药残留;茶叶
中图分类号:TS272.3;TS201.6 文獻标识码:A 文章编号:1000-3150(2023)08-39-10
Determination of 250 Pesticide Residues in Tea by
QuEChERS Method Coupled with High Performance
Liquid Chromatography Tandem Mass Spectrometry
YUAN Hefang, SONG Shuwen, GAO Huiwen, GENG Chenggang
Changzhou Center for Food Drug and Fibre Control, Changzhou 213000, China
Abstract: A multi residue analysis was developed for the simultaneous determination of 250 pesticide residues belonging to different chemical classes in tea by QuEChERS-high performance liquid chromatography tandem mass spectrometry. The samples were prepared by the modified QuEChERS method, extracted with acetonitrile containing 1% acetic acid, salted out with anhydrous magnesium sulphate and anhydrous sodium acetate and purified by Octadecylsilane (C18), primary secondary amine (PSA) and graphitized carbon black (GCB).The compounds were separated on an ACQUITY HSS T3 (2.1 mm×100 mm,1.8 ?m) column using 2 mmol/L ammonium formate containing 0.01% acetic acid methanol solution and 2 mmol/L ammonium formate containing 0.01% acetic acid as mobile phase. The gradient elution was performed at a flow rate of 0.3 mL/min, analyzed by positive electrospray ionization tandem mass spectrometry under scheduled multiple reaction monitoring(S-MRM) mode. The external standard method was used for quantitative analysis. Two hundred kinds of pesticides showed good linear relationships in their respective mass concentration range, with correlation coefficients(r)?0.994, with the limits of quantitation (LOQ) of 0.01 mg/kg. Recoveries ranged from 71.3% to 107.1% at spiked levels of 0.01, 0.02 and 0.05mg/kg, with relative standard deviations (n=6) of less than 10%. The method is rapid, sensitive and accurate, and could be used in the screening and determination of 250 pesticide residues in tea.
Keywords: QuEChERS, high performance liquid chromatography tandem mass spectrometry, pesticide residues, tea
茶叶是我国重要的农产品之一,富含茶多酚、生物碱、黄酮等生化成分,具有醒脑提神、抗衰老等保健功效,对人体健康益处颇多,广受消费者喜爱[1-3]。农药在防治病虫害,提高茶叶产量上有着重要作用,然而,因其被过量使用所带来的残留,可能对环境和人体健康产生威胁,因此茶叶中的农药残留问题已经成为茶叶质量安全关注的焦点之一[4-6]。为了保证茶叶质量安全,2021年9月实施的《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2021)规定了茶叶中106项农药最大残留限量要求[7]。茶叶中含有的大量茶多酚、生物碱、色素等物质会严重干扰痕量农药残留的分析,因此针对茶叶中的复杂基质,必须进行有效的前处理净化工序,以降低基质对农药残留检测的干扰[8-9]。
当前,农药残留样品检测的前处理技术主要包括传统的液液萃取(LLE)、固相萃取(SPE)、基质固相分散(MSPD)、凝胶色谱(GPC)和QuEChERS法[10-17]。传统前处理方法存在操作复杂耗时、有机溶剂用量较大、净化效果不理想等不足,QuEChERS法作为近年来新发展起来的一种主要用于农药残留分析的前处理方法,选择性地运用了凈化剂组合形式,能高效除去样品中的多种杂质,因其具有简单、快速、高效、绿色等优点而广泛应用于食品中农药残留的检测[18]。农药残留分析方法主要包括液相色谱法、气相色谱法、气相色谱-质谱联用法、液相色谱-质谱联用法等,其中液相色谱-质谱联用法具有高灵敏度、高选择性、定量准确等优点[19-20]。因此本研究采用QuEChERS方法进行前处理,结合液相色谱-质谱联用法对茶叶中250种农药残留进行快速测定,旨在为茶叶风险评估和监管部门日常监督提供技术参考。
1 材料与方法
1.1 仪器与设备
液相色谱-串联质谱仪QTRAP 4500(SCIEX)且配有电喷雾离子源(ESI);高速冷冻离心机X4 PRO(ThermoFisher);Milli-Q超纯水仪(美国Millipore公司);IKA MS3漩涡混合器(德国IKA公司);KQ-500DE超声波清洗仪(昆山超声波仪器有限公司);Gd16Plus高速研磨均质机(深圳市新锐科技发展有限公司);WT-5002K 电子天平(常州万泰天平仪器有限公司);色谱柱:Waters ACQUITY HSS T3(2.1 mm×100 mm,1.8 ?m)。
1.2 试剂及耗材
色谱纯乙腈(Merck公司);甲酸(安谱,HPLC);氯化钠、无水硫酸镁(分析纯,国药集团化学试剂有限公司);N -丙基乙二胺(PSA)固相吸附剂(安捷伦公司);液体农药残留标准品(均购自振翔公司),质量浓度均为50 ?g/mL。茶叶样品均为市售。
1.3 标准溶液配制
混标中间溶液Ⅰ:分别准确移取质量浓度均为50 ?g/mL的各农药混标80 ?L,至1 mL棕色进样瓶中,再准确吸取120 ?L乙腈定容,配制成质量浓度为4 ?g/mL的标准中间溶液Ⅰ。
混标中间溶液Ⅱ:准确移取250种农药混标中间溶液Ⅰ 250 ?L,至1 mL棕色进样瓶中,再准确吸取750 ?L乙腈定容,质量浓度为1 ?g/mL。
混标中间溶液Ⅲ:准确移取250种农药混标中间溶液Ⅰ 25 ?L,至1 mL棕色进样瓶中,再准确吸取875 ?L乙腈定容,质量浓度为0.1 ?g/mL。
基质标准工作曲线:选择与被测样品性质相同或相似的空白样品按照对应的前处理步骤进行前处理,得到空白基质溶液。分别准确吸取混标中间溶液Ⅲ 26.6、53.2、133.4 ?L,混标中间溶液Ⅱ 26.68、66.7 ?L,混标中间溶液Ⅰ 33.4、66.7 ?L,用空白基质液定容至2 mL,标准曲线质量浓度分别为1.33、2.67、6.67、13.34、33.35、66.7、133.4 ng/mL,现用现配。
1.4 样品前处理
提取:取2 g(精确至0.01 g)粉粹后的茶叶于50 mL塑料离心管中,加入10 mL水涡旋混匀,静置30 min。加人1颗陶瓷均质子及15 mL含1%乙酸的乙腈溶液,刷烈振荡1 min,加入6 g无水硫酸镁、1.5 g乙酸钠,剧烈振荡1 min后4 200 r/min离心5 min。
净化:吸取8 mL上清液至15 mL塑料离心管中,加入1 200 mg无水硫酸镁、400 mg十八烷基硅胶(C18)、400 mg PSA和200 mg石墨化碳黑(GCB),涡旋混匀1 min。4 200 r/min离心5 min,吸取上清液过0.22 μm滤膜,待测定。
1.5 检测条件
液相条件:Waters ACQUITY HSS T3色谱柱(2.1 mm×100 mm,1.8 ?m),流速0.3 mL/min;柱温40 ℃;进样量2 μL;流动相:A相为2 mmol/L甲酸铵+0.01%甲酸水溶液,B相为2 mmol/L甲酸铵+0.01%甲酸甲醇溶液。
梯度洗脱程序为:0~1.0 min,A为97%;1.0~1.5 min,A降为85%;1.5~2.5 min,A降为50%;2.5~18.0 min,A降为30%;18.0~23.0 min,A降为2%;23.0~27.0 min,A保持2%;27.0~27.1 min,A增加至97%;27.1~30 min,A保持97%不变。
质谱条件:动态多反应监测模式(S-MRM);电喷雾离子源;扫描方式为正离子扫描;正离子离子化电压:+5 500 V;离子源温度:350 ℃;气帘气:40 psi;喷雾气GS1:50 psi;辅助加热气GS2:50 psi。
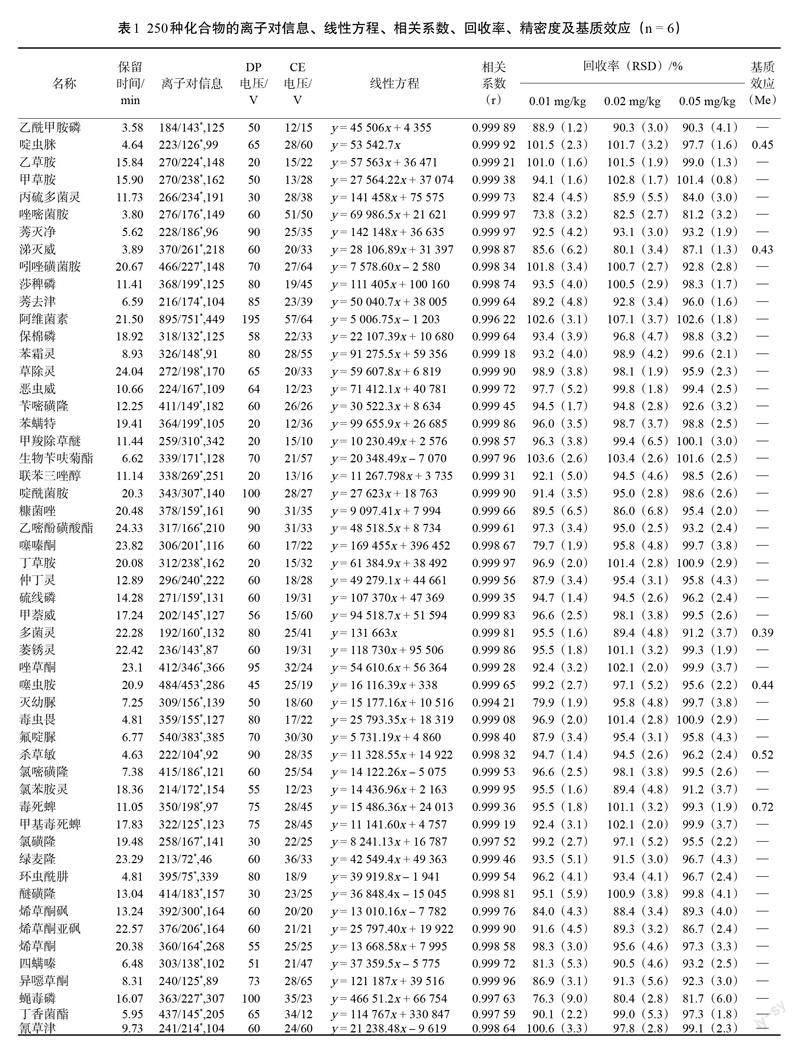
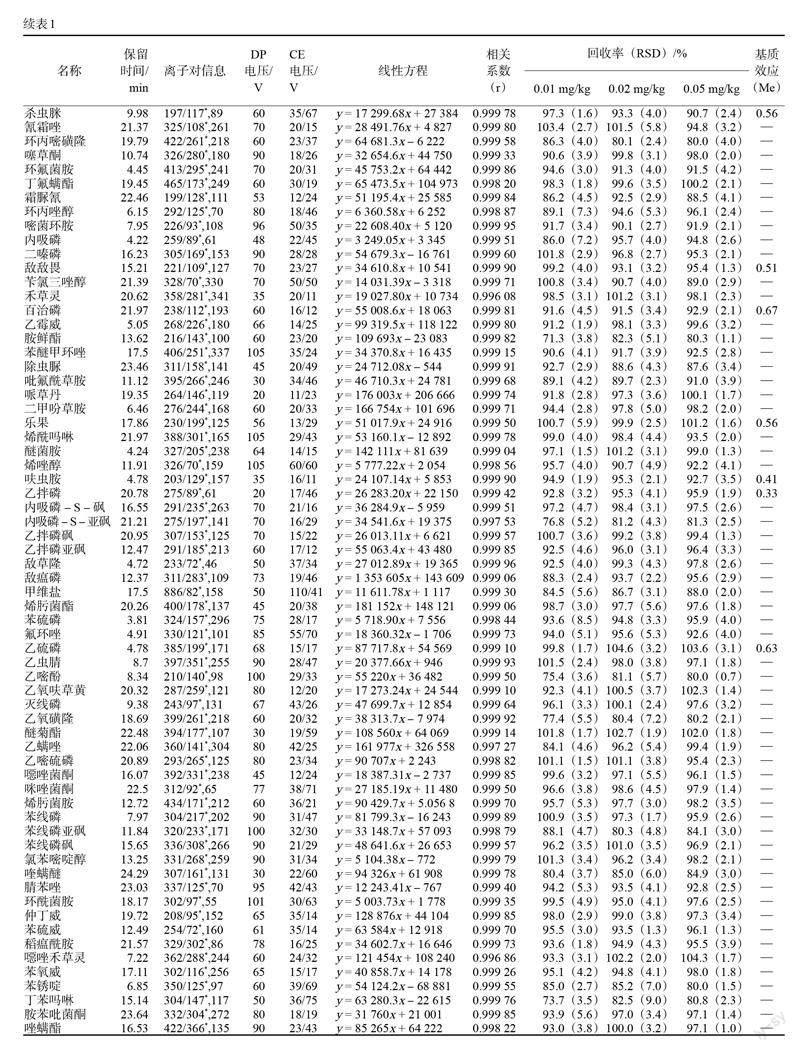
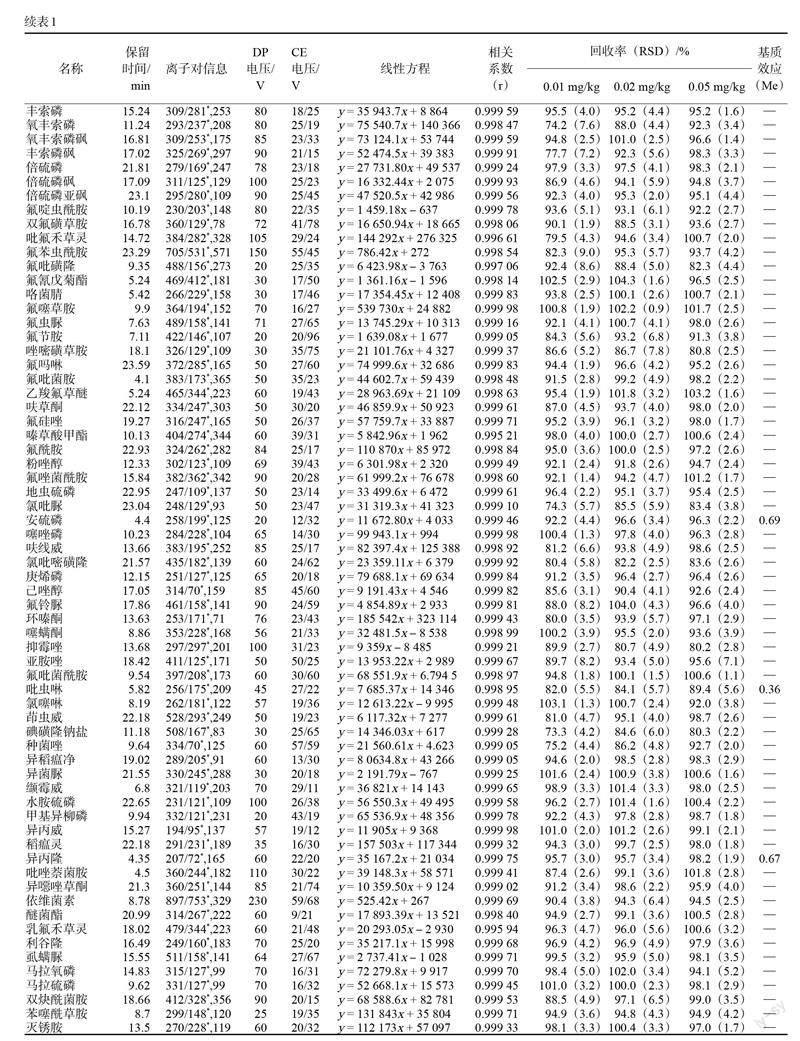
2 结果与分析
2.1 质谱条件的优化
将质量浓度为0.1 ?g/mL的250种农药残留混合标准品溶液,采用针泵进样方式注入离子源,分别在ESI正离子模式下进行一级质谱分析,得到每个化合物的母离子,再对母离子进行二级质谱分析,得到碎片离子信息和二级质谱图。选择丰度较大、丢失合理的子离子分别作为定性和定量离子,分别再对去簇电压及碰撞能量等参数进行优化,确定碎片离子有最大响应强度时的最佳碰撞电压值。250种农药化合物的母离子、子离子、响应的锥孔电压(DP)及碰撞电压(CE)见表1。为了保证每个分析物的色谱峰至少有15个数据点,且尽量提高化合物的响应,根据化合物的保留时间,采用分时段多反应检测S-MRM方式进行采集,设定窗口时间为40 s。混合标准品的总离子流图如图1所示,250种农药在色谱柱上峰型良好,无明显峰拖尾和峰展宽,保留时间也比较理想。
2.2 液相条件的优化
由于本试验检测的250种农残化合物性质差异较大,本试验分别采用乙腈—水、甲醇—水、甲醇—甲酸溶液、甲醇—甲酸铵溶液、甲酸+甲酸铵甲醇溶液—甲酸+甲酸铵水溶液作流动相,结果表明其中大部分目标物在2 mmol/L甲酸铵+0.01%甲酸水溶液-2 mmol/L甲酸铵+0.01%甲酸甲醇溶液流动相条件下有较高的响应值且峰形尖锐对称。正离子模式下,向流动相中添加甲酸铵有助于分析物预形成[M+H]+和[M+NH4]+,并且可以提高保留时间的稳定性及形成良好的峰形,同时也能提高分析的灵敏度。加入一定量的甲酸有利于化合物的分离度及离子化效率。同时,有机相和水相中的盐浓度及甲酸浓度相等,保证了梯度变化过程中盐的浓度和离子化氛围稳定。
因此,本试验最终采用2 mmol/L甲酸铵+0.01%甲酸水溶液-2 mmol/L甲酸铵+0.01%甲酸甲醇溶液作为流动相体系。本研究采用Waters ACQUITY HSS T3色谱柱,与常规的液相色谱柱相比,粒径更小,在提供更高分离度、高灵敏度的同时,可以获得更快的分析速度,缩短分析时间。
2.3 采集方式的优化
本试验一次测定250种化合物,使用传统的MRM采集方式难以保证每个化合物都有足够的数据点,所以采用新的S-MRM(Scheduled-MRM)采集方式。传统的MRM 采集方式仅能够在整个分析时间内监测所有离子对,如同时分析超过30个以上的化合物时,监测MRM离子需要更长的循环时间,由于每个色谱峰上没有采集到足够多的数据点,导致峰型变差及定量结果差。相比于传统的MRM采集方式,S-MRM可以根据每对离子的保留时间设置较窄的时间窗口,在一次进样中能够监测更多的MRM离子对,在色谱峰上获得比传统MRM方法更多的数据点,从而改善峰的认定和峰积分,能够有效地提高目标化合物的响应值,从而保证定量分析的重现性和数据的可靠性,最终获得更低的变异系数和更低的检测限。
2.4 提取溶剂的优化
本研究分别考察了甲醇、乙腈、乙酸乙酯作为提取溶剂。比较发现,甲醇作为提取试剂时,盐析效果比较差,需要加大量的氯化钠,否则容易出现不分层的现象。乙酸乙酯作为提取液时,最后上机前需要进行氮吹来转换溶剂,过程相对繁琐。乙腈作为提取液极性较强,对大部分化合物具有较高的提取效率,盐析效果也比较好。茶叶水分含量低,即使采用极性较强的有机试剂,也不能完全提取,必须向试样中加入适量的水,让样品充分浸泡后,再加入有机试剂进行提取,这样能够大大提高农药提取的回收率。大多数农药为酸性、弱酸性或中性,这些农药在碱性环境中容易分解,比如说有机磷类、氨基甲酸酯类农药,因为这些农药分子结构中都含有酯类的结构,所以在碱性条件下易分解。因此,大部分农药对碱性环境敏感,在碱性基质中极易降解,所以考虑在提取溶液中加入乙酸,从而提高碱性敏感农药的回收率。分别考察了甲醇、乙腈、乙酸乙酯、0.5%乙酸-乙腈、1%乙酸-乙腈、2%乙酸-乙腈的提取效果,对250种农药在茶叶基质中的加标(0.02 mg/kg)回收率进行对比,结果见表2。从表中可以看出,使用1%乙酸-乙腈溶液作为提取溶剂具有较高的提取效率,更适合于茶叶样品中多农药残留的提取。
2.5 净化剂用量的优化
PSA是一种常用的吸附剂,其有效成分为表面键合的氨基,有较强的离子交换能力。同时PSA可与金属离子产生鳌合作用,可用于提取金属离子。对于样品中的金属离子、糖类、脂肪酸等极性物质具有良好的净化作用,但是对色素的净化作用不理想,尤其对于茶叶、蔬菜等色素含量较高的样品净化效果较差。因此,本研究在净化试剂包中加入一定量的PSA试剂。
GCB对色素具有较强的吸附能力,能有效去除茶叶中叶绿素、类胡萝卜素、茶黄素等。但GCB表面的六元环结构会吸附一些平面及对称结构的农药,影响部分农药的回收率。需要优化净化过程中GCB的用量,使其在起到净化作用的同时不会对农药的回收率产生较大的影响。本研究分别考察了GCB用量为10、15、25、35、45、55 mg时对部分农药回收率的影响。由图2可知,当GCB用量为25 mg時,综合回收率较高,且提取液澄清透明,所以对于此类基质使用25 mgGCB净化。
2.6 方法学验证
2.6.1 线性关系和定量限
为了验证本方法的可行性和准确性,称取2 g空白基质样品,按照上述样品前处理方法进行前处理,用空白样品基质溶液配制成1.33、2.66、6.67、13.34、33.35、66.70、133.40 ng/mL混合基质,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线。各组分在1.33~133.4 ng/mL范围内线性关系良好,相关系数均大于0.994,定量限均为0.01 mg/kg。
2.6.2 回收率和精密度
取基质空白茶叶样品,选择3个含量水平(0.01、0.02、0.05 mg/kg)进行加标,每个加标水平进行6次平行试验,计算平均回收率和相对标准偏差(RSD)。结果显示,所有目標化合物的回收率在71.3%~107.1%之间,RSD为0.5%~9.6%,满足《实验室质量控制规范食品理化检测》(GB/T 27404—2008)中的标准要求,该方法可用于茶叶样品中农药残留的检测分析。
2.6.3 基质效应
基质效应(Me)指样品分析液中分析物以外的混杂组分改变分析物响应值,使定量分析准确度的重现性受到影响的现象。采用标准曲线斜率比值(sloperatio)来评价基质效应Me。当Me在0.8~1.2之间表示基质效应可以接受,Me越接近1基质效应越弱;当Me小于1时为基质抑制效应,当Me大于1时为基质增强应[21]。本试验以乙腈溶剂和茶叶空白基质液分别配制农药混合标准溶液,测得各农药在1.33~133.4 ng/mL质量浓度范围内,茶叶空白基质中校正曲线斜率(A)及纯溶剂标准工作液中校正曲线斜率(B),考察基质效应强弱(Me=A/B)。本研究考察了250种农药的基质效应,如表1显示,其中24种农药Me在0.13~0.72之间,茶叶基质减弱效应比较明显。其余农药的基质效应在0.80~1.20之间,基质效应可以接受。综合考虑,本研究用茶叶基质匹配标准工作液来绘制标准曲线进行校准,尽可能消除基质效应对定量的影响。
2.7 实际样品测定
对市场上购买的30批茶叶样品进行检测,磨碎后充分混匀,称取制备好的茶叶样品2 g,按照1.4样品前处理进行检测。共检出15种农药,其中啶虫脒、杀虫脒、苯醚甲环唑、呋虫胺、噻嗪酮、多菌灵检出率较高,检出含量在0.072~0.890 mg/kg之间。13批次茶叶检出农药残留,其中,5批次茶叶仅检出1种农药,8批次茶叶检出2种或2种以上农药,单批次样品最多检出7种农药成分;其余17批次茶叶均未检出农药。此外,值得关注的是嘧菌酯、杀虫脒及氟环唑在GB 2763—2021中还未有具体限值,其中杀虫脒检出率比较高。
3 小结
本研究在QuEChERS方法的基础上对前处理过程中提取和净化等条件进行了优化,建立了超高效液相色谱-三重四极杆质谱法测定茶叶中250种农药残留的快速检测方法。该方法在3个添加水平下回收率在71.3%~107.1%之间,相对标准偏差小于10%,定量限为0.01 mg/kg,30 min内即可完成茶叶样品中农药残留的高通量检测。该方法具有操作简单、灵敏度高、高通量等特点,能满足农药残留日常风险监测的需求,为农药残留定性定量分析提供了可靠的技术手段,为高效和准确地评价茶叶的质量安全提供了新的参考。
参考文献
[1] 丁亦男, 童小麟, 赖国银, 等. 国内外茶叶农药残留限量标准与出口茶叶安全研究[J]. 食品安全质量检测学报, 2019, 10(23): 8140-8145.
[2] 陈宗懋, 刘仲华, 杨亚军, 等. 2019年中国茶叶科技进展[J]. 中国茶叶, 2020, 42(5): 1-12, 20.
[3] 王金鑫. 基于欧盟官网通报不合格茶叶信息分析茶叶农药残留现状及应对措施[J]. 中国茶叶, 2018, 40(1): 37-39.
[4] 黄云霞, 孟志娟, 赵丽敏, 等. 快速滤过型净化结合气相色谱-串联质谱法同时检测茶叶中10种拟除虫菊酯农药残留[J].色谱, 2020, 38(7): 798-804.
[5] HANG J, ZHANG R R, SHI X Z, et al. A novel sample-preparation method for the generic and rapid determination of pesticides and mycotoxins in tea by ultra-performance liquid chromatography-tandem mass spectrometry[J/OL]. J Chromatogr A, 2021, 1636: 461794. https://doi.org/10.1016/j.chroma.2020.461794.
[6] HUO F F, TANG H, WU X, et al. Utilizing a novel sorbent in the solid phase extraction for simultaneousdetermination of 15 pesticide residues in green tea by GC/MS[J]. Journal of Chromatography B, 2016,1023/1024: 44-54.
[7] 国家卫生健康委员会, 国家市场监督管理总局, 农业农村部. 食品安全国家标准 食品中农药最大残留限量: GB 2763—2021[S]. 北京: 中国农业出版社, 2021.
[8] 徐倩, 刘静明, 诸思燕, 等. 茶叶有机磷及菊酯类农药残留检测中净化处理的研究[J]. 食品科学, 2005, 26(8): 299-302.
[9] LI C, ZHU H, LI C, et al. The present situation of pesticide residues in China and their removal and transformation during food processing[J/OL]. Food Chemistry, 2021, 354(2): 129552. https://doi.org/10.1016/j.foodchem.2021.129552.
[10] 武源, 覃慧丽, 黄婞焱, 等. PRiME HLB固相萃取柱结合气相色谱-串联质谱法快速测定茶叶中200种农药残留[J]. 食品安全質量检测学报, 2022, 13(2): 650-656.
[11] 杨菊芬, 张新军. QuEChERS技术在食用农产品农药残留检测中的应用与研究[J]. 食品安全导刊, 2021, 11(32): 173-175.
[12] 钟青, 黎洪霞, 罗逢健, 等. 超高效液相色谱-串联质谱法测定茶叶和茶汤中茚虫威对映体及7种降解产物[J]. 质谱学报, 2021, 42(2): 140-153.
[13] 邵丽, 王晓, 徐淑飞, 等. QuEChERS-三重四极杆液相色谱质谱联用法快速筛查花生中52种农药残留[J]. 食品安全质量检测学报, 2021, 12(15): 6077-6083.
[14] 陈思敏, 林腾奕, 李星星, 等. QuEChERS结合液相色谱-串联质谱法检测茶叶中34种农药残留[J]. 食品安全质量检测学报, 2020, 11(2): 507-515.
[15] 王家磊, 曾海英, 李思思, 等. 三重四极杆气相色谱质谱联用法测定茶叶中31种农药残留[J]. 食品安全质量检测学报, 2021, 12(7): 2582-2590.
[16] 王冬伟, 刘畅, 周志强, 等. 新型农药残留快速检测技术研究进展[J]. 农药学学报, 2019, 21(5/6): 852-864.
[17] 黄芬, 夏文斌, 李雄伟, 等. 蔬菜中多种有机磷农药残留的固相萃取-气相色谱测定方法研究[J]. 实用预防医学, 2017, 24(5): 627-629.
[18] 黄田田, 汤桦, 董晓倩, 等. 多壁碳纳米管QuEChERS–气相色谱法测定茶叶中23种有机磷农药残留量[J]. 食品科学, 2018, 39(6): 315-321.
[19] HOU X, LEI S R, QIU S T, et al. A multi-residue method for the determination of pesticides in tea using multi-walled carbon nanotubes as a dispersive solid phase extraction absorbent[J]. Food Chemistry, 2014, 153: 121-129.
[20] HUANG Y S, SHI T, LUO X, et al. Determination of multi-pesticide residues in green tea with a modified QuEChERS protocol coupled to HPLC-MS/MS[J]. Food Chemistry, 2019, 275: 255-264.
[21] 李同宾, 李红, 孙丰收, 等. QuEChERS-超高效液相色谱-串联质谱法测定玉米粉中41种农药残留[J]. 农药学学报, 2021, 23(1): 154-161.
基金项目:食用农产品中农药残留的非靶向筛查应用研究(CE2022029)
作者简介:袁荷芳,女,高级工程师,长期从事食品中污染物检测,E-mail:335001631@qq.com

