高毒力肺炎克雷伯菌毒力特性及其对RAW264.7细胞炎症反应的影响
毕建蝶?刘淑敏?何秋月?韩睿辉?杜艳


摘要:目的 對收集的肺炎克雷伯菌进行高毒力鉴定,探讨其对鼠源巨噬细胞RAW264.7炎症相关因子表达的影响。方法 收集临床分离的高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae,HVKP)疑似菌株,首先回顾性分析患者临床情况,再结合拉丝试验、PCR扩增毒力质粒相关基因和药敏试验鉴定其高毒力特性及耐药情况。然后将细菌分别感染RAW264.7细胞4 h和24 h后,黏附与抗吞噬试验检测细菌免疫逃避能力,ELISA法检测细胞培养上清中细胞因子TNF-α、IL-6、IL-1β的表达。结果 两株临床菌株均为高黏液表型、携带毒力质粒相关基因及患者病情严重复杂,判定为HVKP,并且出现了多重耐药(Muiti-drug resistant,MDR)且对碳青霉烯类耐药的HVKP(MDR-HVKP)。在感染4 h和24 h后,巨噬细胞胞外细菌黏附数及胞内活菌数都为:标准菌株>HVKP临床>MDR-HVKP临床,差异均有统计学意义。在感染4 h内TNF-α的表达水平显著升高,而IL-6和IL-1β的表达水平均较低。与标准菌株相比,HVKP临床(P=0.007)和MDR-HVKP临床(P=0.009)更能增加TNF-α的表达水平。当感染达到24 h时,IL-6和IL-1β的表达水平上升较明显,同样高毒力菌株感染引起IL-6和IL-1β表达水平增加的程度大于标准菌株,差异均有统计学意义。结论 本研究的HVKP具有高黏液表型、携带毒力质粒相关基因及免疫逃避能力强的特性,易对免疫力低下的重症患者造成严重感染。在感染鼠源巨噬细胞RAW264.7后,主要通过释放促炎因子TNF-α、IL-6和IL-1β来加剧炎症反应。
关键词:高毒力肺炎克雷伯菌;多重耐药;免疫逃避;炎症因子
中图分类号:R9,R517.6文献标志码:A
Virulence characteristics of hypervirulent Klebsiella pneumoniae and its effect on the inflammatory cytokine response of RAW264.7 cells
Bi Jian-die, Liu Shu-min, He Qiu-yue, Han Rui-hui, and Du Yan
(Department of Clinical Laboratory, the First Affiliated Hospital of Kunming Medical University, Yunnan Key Laboratory of Laboratory Medicine, Yunnan Province Clinical Research Center for Laboratory Medicine, Kunming 650032)
Abstract Objective To identify the hypervirulence of collected Klebsiella pneumoniae and to explore the effect of Klebsiella pneumoniae on the expression of RAW264.7 inflammatory cytokines in mouse macrophages. Methods The suspected strains of hypervirulent Klebsiella pneumoniae (HVKP) were collected. Firstly, the clinical situation of the patients was analyzed retrospectively, and then the high virulence characteristics and drug resistance were identified by the string test, PCR amplification of virulence plasmid related genes, and the drug sensitivity test. Then, the bacteria were infected with RAW264.7 cells for 4 h and 24 h, respectively. The immune escape ability of bacteria was detected by adhesion and anti-phagocytosis tests, and the expression of cytokines, TNF-α, IL-6, and IL-1β in the supernatant of cell culture was detected by ELISA. Results The two clinical strains had hypermucoid phenotype, carried virulence plasmid related genes, and patients with serious and complicated conditions, identified as HVKP, and showed carbapenem resistance and multiple-drug resistance (MDR-HVKP). At 4 h and 24 h after infection, the number of extracellular bacterial adhesion and intracellular viable bacteria of macrophages were as follows: standard strain > HVKP clinical > MDR-HVKP clinical, and the difference was statistically significant. Within 4 hours of infection, the expression of TNF-α was significantly increased, while the expression of IL-6 and IL-1β was low. Compared with the standard strains, the HVKP clinical (P=0.002) and MDR-HVKP clinical (P=0.009) strains could increase the expression level of TNF-α in clinic. When the infection reached 24 hours, the expression level of IL-6 and IL-1β increased significantly. The increase of IL-6 and IL-1β expression caused by the hypervirulent strain was higher than that of the standard strain, and the difference was statistically significant. Conclusion The HVKP in this study has the characteristics of hypermucoid phenotype, virulent plasmid-related genes, and strong immune escape ability. It is easy to cause serious infection in critically ill patients with low immunity. After infection with mouse macrophage RAW264.7, the inflammatory response was aggravated mainly by releasing pro-inflammatory factors TNFα, IL-6, and IL-1β.
Key words Hypervirulent Klebsiella pneumoniae; Multidrug-resistant; Immune escape; Cytokines
肺炎克雷伯菌可引起多种感染,包括肺炎、尿路感染、菌血症和肝脓肿等[1],通常在免疫低下的人群中引起严重感染,但高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae,HVKP)的出现和传播则扩大了易感人群,该菌既是医院感染相关的原因也是社区获得性感染的原因[2]。在临床微生物学实验室没有对HVKP进行常规检测且近年来碳青霉烯耐药的HVKP、多粘菌素耐药的HVKP和多重耐药(muiti-drug resistant,MDR)的HVKP正在出现的情况下[3-5],使得这类感染的治疗非常具有挑战性。巨噬细胞作为人体的主要效应细胞,通过识别、吞噬和杀死微生物,在宿主防御中起着基础性的作用[6]。当机体被肺炎克雷伯菌感染后,大量中性粒细胞和巨噬细胞能够募集至感染部位,导致促炎因子TNF-α、IL-6和IL-1β的大量产生、释放和激活增加[7-8]。目前HVKP菌株直接作用于免疫细胞方面的研究较少,其确切作用和相关机制仍有待进一步探索。为了进一步了解HVKP的临床特征、毒力特点和耐药性,并改善患者护理和预后,所以本研究将从患者临床情况、分子水平和细胞水平对源于临床的两株HVKP疑似菌株進行鉴定及毒力特性分析,初步探讨其对鼠源巨噬细胞RAW264.7炎症相关因子表达的影响。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞株来源
本研究应用的两株肺炎克雷伯菌分离自昆明医科大学第一附属医院的两名重症住院患者,经MALDI-TOF MS质谱仪进行鉴定。因两位患者病情严重且检出的肺炎克雷伯菌疑似HVKP,故纳入本研究。肺炎克雷伯菌标准菌株ATCC BAA-1706、鼠源巨噬细胞RAW264.7购自美国ATCC公司。
1.1.2 主要试剂
哥伦比亚血琼脂平板购自郑州安图生物工程股份有限公司;革兰阴性细菌药敏卡(AST-GN16卡)购自法国BioMérieux公司;2×Taq PCR MasterMix购自北京博迈德生物公司;细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司;DMEM培养基、胎牛血清、胰蛋白酶消化液购自Biological Industries公司;TritonX-100购自Sigma Aldrich公司;庆大霉素液购自索莱宝公司;Mouse TNF-α、 IL-6、IL-1β ELISAKit 购自杭州联科生物技术有限公司。
1.2 实验方法
1.2.1 患者临床情况、拉丝试验和PCR试验相结合进行高毒力鉴定及药敏试验
临床信息收集:菌株携带者的临床信息利用LIS系统回顾性分析。
拉丝试验检测细菌高黏液表型:用接种环轻触培养基上的单个菌落后向外拉,能够形成≥5 mm的黏液丝判断为拉丝试验阳性[9]。
参照文献[10],PCR扩增毒力质粒相关基因(rmpA、rmpA2、HI1B、iroN、iutA)以判定毒力质粒的携带情况:使用基因组试剂盒进行菌株DNA提取,PCR反应采用25 μL反应体系:基因组DNA模板1 μL;Taq Master Mix 12.5 μL;ddH2O 9.5 μL;上下游引物各1 μL,毒力基因引物序列及扩增片段长度见表1。反应条件:94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,30 cycles;72℃,5 min。1.5%琼脂糖凝胶电泳PCR产物,阳性产物送至北京博迈德生物公司测序,测序结果于NCBI网站进行BLAST比对。
药敏试验:VITEK-2 全自动细菌鉴定药敏仪和AST-GN16药敏卡测定美罗培南、亚胺培南、厄他培南、头孢他啶、头孢唑林、头孢吡肟、头孢曲松、哌拉西林、阿莫西林/克拉维酸、氨曲南、庆大霉素、阿米卡星、四环素、环丙沙星、左氧氟沙星和复方磺胺甲恶唑的药敏结果和ESBLs产生情况。ESBLs确证采用纸片扩散法克拉维酸抑制实验:将菌液均匀涂布于MH琼脂平板上,分别将头孢噻肟、头孢他啶单药及其与克拉维酸复合药的药敏纸片贴于平板上,任何一对药物中复合药的抑菌圈直径大于单药直径5 mm即可确认为产ESBLs的肺炎克雷伯菌。药敏结果判读依据2020年CLSI M100 S30文件进行。
1.2.2 HVKP菌株与RAW264.7细胞共培养
(1)细菌黏附试验
将培养至对数生长周期的细菌用PBS悬浮并利用细菌比浊仪调节菌悬液浓度为1×108 CFU/mL备用。将RAW264.7细胞以每孔1×105个细胞的密度接种到12孔板中37℃、5%CO2条件下培养12 h,于倒置显微镜下观察约90%细胞贴壁生长后3组细菌按感染复数MOI=100:1比例与RAW264.7细胞分别共培养4 h和24 h,PBS洗涤3次,然后每孔加入200 ?L胰蛋白酶消化细胞,用800 ?L培养基终止消化。最后将1 mL细胞悬液稀释合适倍数后(4 h稀释10倍,24 h稀释100倍)取10 ?L涂布于哥伦比亚血琼脂平板上进行培养以计数菌落。
(2)细菌抗吞噬试验
如上所述进行细菌细胞共培养4 h和24 h后PBS洗涤3次,然后加入 DMEM-10%胎牛血清-庆大霉素(终浓度100 ?g/mL)500 ?L,并将反应混合物孵育1 h杀死细胞外细菌。无菌PBS再洗涤3次,加入200 ?L0.5%的Triton-X100,于37℃条件下裂解细胞5 min,加入800 ?L无菌PBS,吹打混匀后悬液(除标准菌株需稀释2倍,其余均不稀释)取10 ?L涂布于哥伦比亚血琼脂平板上进行培养以计数菌落。
(3)细胞因子检测
如上所述进行细菌细胞共培养4 h和24 h后取细胞培养上清,4 ℃下10000 r/min离心10 min,参照联科生物ELISA试剂盒说明书检测细胞上清液中的TNF-α、IL-6、IL-1β含量。
1.2.3 统计学处理
每次试验独立重复3次,使用 SPSS 25. 0 软件进行统计学分析。定量资料表示为均数±标准差(x±s),多组均值間采用单因素方差分析,方差齐用LSD 法进一步作多重比较;方差不齐则采用非参数秩和检验,P<0.05,认为差异有统计学意义。
2 结果
2.1 高毒力菌株的鉴定及药敏结果
2.1.1 菌株携带患者情况
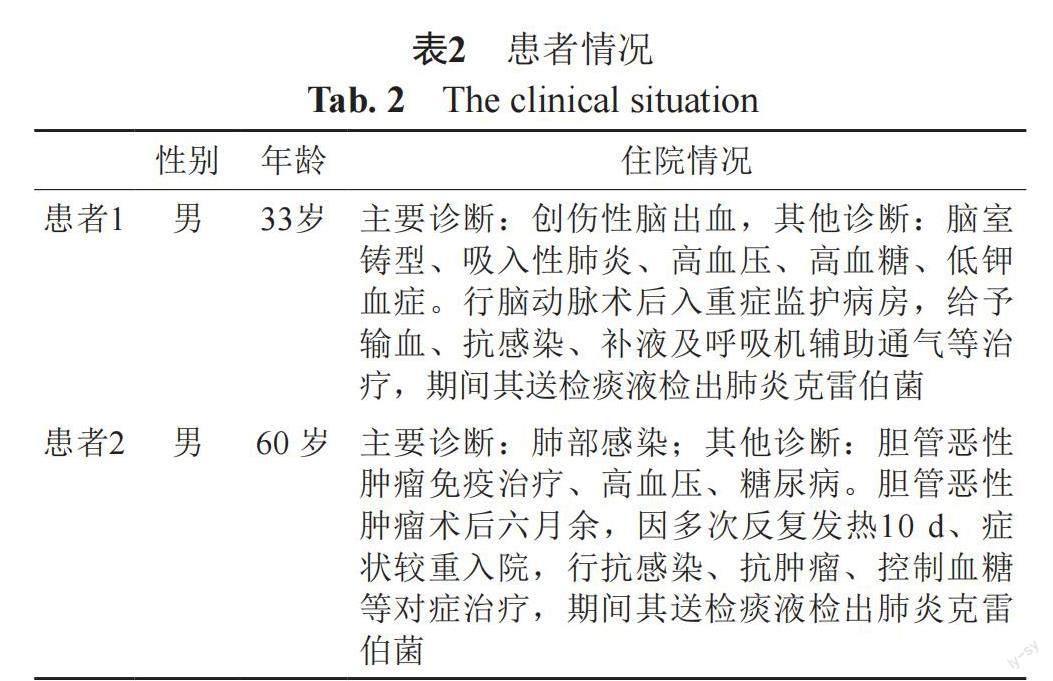
两株菌分别分离于肿瘤和脑部疾病患者,两位患者均有肺部感染且患有高血压等基础疾病,具体情况见表2。
2.1.2 两株临床菌株判定为高黏液型HVKP
与标准菌株相比,本研究中的两株临床分离株拉丝试验阳性,具有高黏液表型,且PCR扩出毒力质粒相关基因rmpA、rmpA2、iroN、iutA 和质粒复制子相关基因HI1B,提示携带毒力质粒,如图1~2。
2.1.3 两株临床HVKP菌株具有不同的抗生素敏感性
其中一株对检测的16种抗生素均表现为敏感且ESBLs检测为阴性,而另一株除了对碳青霉烯类抗生素(亚胺培南、美罗培南、厄他培南)耐药,还对头孢菌素类抗生素(头孢他啶、头孢唑林、头孢曲松)、青霉素类抗生素(哌拉西林、阿莫西林/克拉维酸)、单环β-内酰胺酶类抗生素(氨曲南)及磺胺类抗生素(复方磺胺甲恶唑)耐药,ESBLs确证实验为阴性,表现出MDR。根据抗生素敏感性的差异将两株菌标识为HVKP临床和MDR-HVKP临床继续后续研究。
2.2 HVKP临床株和MDR-HVKP临床株的免疫逃避能力远强于标准菌株
黏附试验显示:3株菌在RAW264.7细胞外的黏附数4 h和24 h都为标准菌株>HVKP临床>MDR-HVKP临床,
差异均有统计学意义。在抗吞噬试验中,当这些菌株被RAW264.7吞噬时,观察到类似的趋势,如表3。只有少部分的HVKP临床和MDR-HVKP临床株被吞噬,提示高毒力菌株有较强的抗吞噬特性。
2.3 HVKP临床株和MDR-HVKP临床株感染能促进RAW264.7细胞促炎性细胞因子的表达
在感染4 h内,与标准菌株相比,TNF-α的表达水平在HVKP临床(P=0.007)和MDR-HVKP临床(P=0.009)感染后显著升高。当感染到达24 h时,TNF-α表达的水平均升高较少,且整体趋势和4h时相似。对于IL-6的表达水平,与标准菌株相比4h内在HVKP临床(P=0.004)和MDR-HVKP临床(P=0.124)感染后略微升高。当感染达到24 h时,IL-6的表达水平较4 h时明显升高,整体趋势与4 h时相似。IL-1β的表达水平在感染4 h内较低,在3株菌中均无显著差异,但当感染达到24 h时,与标准菌株相比,HVKP临床株(P<0.001)和MDR-HVKP临床(P<0.001)株感染更能增加IL-1β的表达水平。本研究两株HVKP在4 h、24 h诱导的IL-6、IL-8和TNF-α的产生均显著高于标准菌株,如图3。提示高毒力菌株在感染鼠源巨噬细胞RAW264.7细胞后,4 h内主要通过释放促炎因子TNF-α引起更严重的炎症反应,而4~24 h主要通过释放IL-6和IL-1β来加剧炎症反应。
3 讨论
HVKP在社区和医院获得性肺炎患者中普遍存在[11],特别会对免疫功能低下的人(糖尿病或恶性肿瘤患者)引起严重感染,如肺炎、菌血症或脑膜炎,临床进展迅速,最终预后不良[2]。本研究中两株HVKP分离自脑部疾病和肿瘤患者,患者分别进行过侵入性操作和免疫治疗,可能造成局部免疫力薄弱而更易诱发HVKP肺部感染[2]。早期的研究将高黏液表型作为HVKP菌株的定义特征,然而并非所有的HVKP菌株都具有高黏液表型,且一些CKP菌株也具有这一特征[12],因此需要结合其他指标来进行判断。HVKP毒株最具特征性的毒力因子是由毒力质粒上的荚膜调节基因(rmpA或rmpA2)、沙门菌素(iroBCDN)和气杆菌素(iucABCD-iutA)铁载体合成基因簇等编码,这些基因在毒力过程中起着至关重要的作用,临床上常用于检测HVKP菌株[13]。本研究综合考虑患者临床情况、高黏液表型和毒力质粒的携带,将菌株鉴定为HVKP,对于警示临床防治HVKP的暴发感染具有重要意义。
巨噬细胞对细菌有较强的吞噬杀伤作用,细菌的抗吞噬能力越强则证明毒力越强[14]。在本研究中,初步判定为HVKP的两个临床分离株抵抗巨噬细胞RAW264.7吞噬杀伤的能力明显强于标准菌株,表明其拥有比标准菌株更强的毒力。已知荚膜在感染过程中对细菌具有多种保护作用,作为一种抗吞噬因子能够阻止细菌与哺乳动物细胞的黏附[1]。rmpA或rmpA2协调荚膜和高黏液表型[15],丢失可降低荚膜产量、黏液黏度和毒力[16]。本研究中两株高黏液HVKP均携带rmpA和rmpA2基因,而在非高黏液的标准菌株中则没有,说明rmpA和rmpA2是与高黏性相关的基因。据报道:与非高黏液分离株相比,高黏液肺炎克雷伯菌具有较低的黏附能力和较强的抗吞噬能力,但引起宿主细胞损伤和凋亡的程度较严重,高黏液表型能够影响细菌与宿主细胞间的联系[17-19]。高黏液表型似乎是免疫逃避更关键的决定因素。在本研究中高黏液型的两株HVKP同样具有黏附能力低而抗吞噬能力强的特性,与以上研究结果一致,提示高黏液HVKP菌株有较强的免疫逃避能力。另外推测肺炎克雷伯菌的快速黏附能够促进细胞对其进行吞噬杀伤,因为巨噬细胞胞内吞噬的活菌数总是与胞外细菌黏附数成正比关系。尽管高黏液表型对HVKP很重要,但荚膜与高黏液表型之间的联系仍在阐明中,高黏液表型并不一定依赖于荚膜合成[18]。高黏液表型也可能影响药敏试验,随着MDR菌株的增加,这可能成为一个更常见的问题[13]。
病原体与宿主细胞的黏附是致病性的初始阶段,而随后进入宿主细胞,如果宿主细胞被病原体激活或者凋亡延迟,则会释放大量自由基等有害物质会引起机体的过度炎症反应,甚至迁延全身[20]。 TNF-α、IL-6、IL-1β是抗肺炎克雷伯菌感染的主要效应因子,Cheng等[17]用乳腺炎奶牛分离的两株肺炎克雷伯菌感染牛微血管内皮细胞,结果显示两株菌均能促进IL-6、IL-1β和TNF-α产生,且高黏液分离株激發了更明显的促炎反应。另一研究同样显示高黏液HVKP对视网膜色素上皮细胞的致炎性较非高黏液的经典的肺炎克雷伯菌更强[14]。在本研究中得到了同样的趋势,两株具有高黏液表型的HVKP菌株在4 h和24 h都引起了更严重的炎症反应。TNF-α是革兰阴性菌急性炎症反应的主要介质,出现在感染的最初几个小时内,主要由激活的巨噬细胞产生然后刺激中性粒细胞和单核细胞募集到感染部位,并激活这些细胞以清除微生物[4]。在与TNF-α的联合作用中,IL-1β被认为对自然免疫和炎症起作用,它的产生可能是由细菌产物如脂多糖,以及其他细胞因子如TNF-α本身诱导的[21]。Friedrich等[22]的肺炎克雷伯菌小鼠脓毒症模型中描述到感染病灶中IL-1β水平升高出现在TNF-α升高之后,特别是在细菌滴注72 h之后。然而,本研究结果显示在高毒力菌株感染最初的4 h TNF-α基本达到最大释放量,感染4 h之后到达24 h主要通过释放IL-6和IL-1β来加剧炎症反应,3种炎症因子的释放均出现较早,可能是感染模型与菌株毒力的不同造成的差异。
综上所述,本研究分离的高毒力菌株具有高黏液表型、表达毒力质粒相关基因及免疫逃避能力强的特性,且感染鼠源巨噬细胞RAW264.7细胞后,可释放促炎因子TNF-α、IL-6和IL-1β引起严重感染。虽然目前由于敏感性和特异性问题拉丝试验作为高毒力筛查方法存在缺陷,但因操作简单用于临床初步筛查高毒力菌株还是非常具有参考意义的。必要时要充分考虑将患者临床情况、菌株表型、毒力基因携带情况及免疫逃避能力等结合起来判断菌株是否为HVKP,然后对分离的HVKP菌株及时给予高度关注并采取适当治疗措施。本院的MDR-HVKP菌株很可能是由经典的MDR菌株获得了一个毒力质粒进化而来,MDR-HVKP菌株具备经典多重耐药菌株拥有的高耐药性和高传播能力,这应当引起相关科室的足够重视。然而本研究标本源于临床存在较多未知因素,量少不足以代表绝大多数HVKP,在进一步的研究中将进行全基因组测序完善菌株信息,以比较这两个分离株的不同而在细胞水平做更加深入的机制研究。
参 考 文 献
Paczosa M K, Mecsas J. Klebsiella pneumoniae: Going on the offense with a strong defense[J]. Microbiol Mol Biol Rev, 2016, 80(3): 629-661.
Russo T A, Marr C M. Hypervirulent Klebsiella pneumoniae[J]. Clin Microbiol Rev, 2019, 32(3): e00001-19.
Gu D X, Huang Y L, Ma J H, et al. Detection of colistin resistance gene mcr-1 in hypervirulent Klebsiella pneumoniae and Escherichia coli isolates from an infant with diarrhea in China[J]. Antimicrob Agents Chemother, 2016, 60(8): 5099-5100.
Shu L, Dong N, Lu J, et al. Emergence of OXA-232 carbapenemase-producing Klebsiella pneumoniae that carries a plvpk-like virulence plasmid among elderly patients in China[J]. Antimicrob Agents Chemother, 2019, 63(3): 1-13.
Zhang Y, Jin L, Ouyang P, et al. Evolution of hypervirulence in carbapenem-resistant Klebsiella pneumoniae in China: A multicentre, molecular epidemiological analysis[J]. J Antimicrob Chemother, 2020, 75(2): 327-336.
Saha P, Xiao X, Yeoh B S, et al. The bacterial siderophore enterobactin confers survival advantage to Salmonella in macrophages[J]. Gut Microbes, 2019, 10(3): 412-423.
Probst J J, Martins G H C, Dos Santos Sumar A H, et al. Pulmonary and muscle profile in pneumosepsis: A temporal analysis of inflammatory markers[J]. Cytokine, 2019, 114: 128-134.
徐方明, 苏丛, 伍婷, 等. CRISPR/Cas9技术敲除RAW264.7细胞的GPR43基因抑制其对肺炎克雷伯菌的吞噬功能[J]. 细胞与分子免疫学杂志, 2020, 36(6): 481-486.
Zhan L, Wang S, Guo Y, et al. Outbreak by hypermucoviscous Klebsiella pneumoniae ST11 isolates with carbapenem resistance in a tertiary hospital in China[J]. Front Cell Infect Microbiol, 2017, 7: 182.
Yu F, Lv J, Niu S, et al. Multiplex PCR analysis for rapid detection of Klebsiella pneumoniae carbapenem-resistant (sequence type 258 [ST258] and ST11) and hypervirulent (ST23, ST65, ST86, and ST375) strains[J]. J Clin Microbiol, 2018, 56(9): e00731-18.
Liu C, Du P, Xiao N, et al. Hypervirulent Klebsiella pneumoniae is emerging as an increasingly prevalent K. pneumoniae pathotype responsible for nosocomial and healthcare-associated infections in Beijing, China[J]. Virulence, 2020, 11(1): 1215-1224.
Yang Q, Jia X, Zhou M, et al. Emergence of ST11-K47 and ST11-K64 hypervirulent carbapenem-resistant Klebsiella pneumoniae in bacterial liver abscesses from China: A molecular, biological, and epidemiological study[J]. Emerg Microbes Infect, 2020, 9(1): 320-331.
Choby J E, Howard-Anderson J, Weiss D S. Hypervirulent Klebsiella pneumoniae-clinical and molecular perspectives[J]. J Intern Med, 2020, 287(3): 283-300.
惠靖雯, 倪焰, 欒洁, 等. 肺炎克雷伯菌的毒力特性及其对视网膜色素上皮细胞炎症相关因子表达的影响. 眼科新进展[J]. 眼科新进展, 2018, 38(9): 829-831.
陈辞言, 杜艳. 高毒力肺炎克雷伯菌研究进展[J]. 中华实验和临床感染病杂志(电子版), 2019, 13(2): 89-92.
Hsu C R, Lin T L, Chen Y C, et al. The role of Klebsiella pneumoniae rmpA in capsular polysaccharide synthesis and virulence revisited[J]. Microbiology (Reading), 2011, 157(Pt 12): 3446-3457.
Cheng J, Zhang J, Han B, et al. Klebsiella pneumoniae isolated from bovine mastitis is cytopathogenic for bovine mammary epithelial cells[J]. J Dairy Sci, 2020, 103(4): 3493-3504.
Walker K A, Miner T A, Palacios M, et al. A Klebsiella pneumoniae regulatory mutant has reduced capsule expression but retains hypermucoviscosity[J]. mBio, 2019, 10(2): e00089-19.
Palacios M, Miner T A, Frederick D R, et al. Identification of two regulators of virulence that are conserved in Klebsiella pneumoniae classical and hypervirulent strains[J]. mBio, 2018, 9(4): e01443-18.
Chen W, Liu Y, Zhang L, et al. Nocardia cyriacigeogica from bovine mastitis induced in vitro apoptosis of bovine mammary epithelial cells via activation of mitochondrial-caspase pathway[J]. Front Cell Infect Microbiol, 2017, 7: 194.
Wajant H, Pfizenmaier K, Scheurich P. Tumor necrosis factor signaling[J]. Cell Death Differ, 2003, 10(1): 45-65.
Friedrich O, Reid M B, Van den Berghe G, et al. The sick and the weak: Neuropathies/myopathies in the critically Ill[J]. Physiol Rev, 2015, 95(3): 1025-1109.

