西伯利亚Gudzhirganskoe盐湖土壤放线菌多样性、新颖性及抗菌活性研究
杨芹?郭普宇?Elena Y. Abidueva?刘少伟?李飞娜?薛春梅?孙承航

摘要:目的 探究西伯利亞Gudzhirganskoe盐湖土壤放线菌多样性、新颖性和活性菌株的次级代谢产物,为放线菌新物种和新抗生素的发现储备菌种资源。方法 采用10种分离培养基,利用稀释涂布法进行放线菌的分离纯化;通过PCR扩增和测序,比对16S rRNA序列进行放线菌多样性和新颖性分析;采用纸片扩散法对潜在放线菌新物种发酵液的酯相萃取物、水相和菌体相进行抗菌活性筛选;采用反相柱层析、葡聚糖凝胶Sephadex LH-20和半制备HPLC方法分离纯化菌株Hoyosella sp. S15b3-3粗提物的活性成分,通过ESI-MS、NMR波谱数据,并结合文献确定化合物的结构;采用微量稀释法评价化合物1和2的抗菌活性。结果 从15份样品中分离获得1343株放线菌,分属于10目23科42属,其中涅斯捷连科菌属、拟诺卡菌属和链霉菌属为优势菌属;15株放线菌与近缘菌株的16S rRNA基因的最高相似度≤98.65%;5株潜在新物种对至少1株检定菌表现出抗菌活性;从Hoyosella sp. S15b3-3中分离鉴定2个已知化合物1(3-吲哚甲醛)和2(2-羟基-1-(3-吲哚)乙酮),化合物1对2株鲍曼不动杆菌(2799和ATCC19606)有一定的抑制作用,MIC值分别为64和32 μg/mL。结论 西伯利亚Gudzhirganskoe盐湖土壤含有丰富的放线菌资源,且新颖性较高,具有从中发现放线菌新物种和新抗生素的潜力,值得深入研究。
关键词:盐湖;放线菌;多样性;新颖性;次级代谢产物
中图分类号: R978.1 文献标志码:A
Diversity, novelty, and antimicrobial activity of actinobacterial strains
isolated from soils in Gudzhirganskoe Saline Lake in Siberia
Yang Qin1, Guo Pu-yu1, 2, Elena Y. Abidueva3, Liu Shao-wei1, Li Fei-na4, Xue Chun-mei2, and Sun Cheng-hang1,5
(1 Department of Microbial Chemistry, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100000; 2 College of Life Sciences, Jiamusi University, Jiamusi 154000; 3 Institute of General and Experimental Biology, Siberian Branch, Russian Academy of Sciences, Russia 670047; 4 Laboratory of Respiratory Diseases, Beijing Key Laboratory of Pediatric Respiratory Infection Diseases, Beijing Pediatric Research Institute, Beijing Childrens Hospital, Capital Medical University, Key Laboratory of Major Diseases in Children, Ministry of Education, National Clinical Research Center for Respiratory Diseases, National Center for Childrens Health, Beijing 100045; 5 Beijing Key Laboratory of Antimicrobial Agents, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences Peking Union Medical College, Beijing 100050)
Abstract Objective To explore the diversity, novelty and active secondary metabolites of culturable actinobacteria from soils of Gudzhirganskoe Saline Lake in Siberia,and lay the foundation of finding new actinobacterial taxa and antibiotics. Methods Actinobacteria were isolated by using serial dilution plating method with 10 different media. The diversity and novelty of actinobacteria were analyzed by 16S rRNA gene sequences. The potential new species were selected to evaluate their antimicrobial activities by paper-disk diffusion method. The secondary metabolites produced by Hoyosella sp. S15b3-3 were isolated and purified by reversed-phase silica column chromatography, sephadex LH-20 and semi-preparation HPLC. The chemical structures were elucidated by ESI-MS, NMR spectral analysis and compared with the literature. The antibacterial activity of compound 1 and 2 was evaluated by micro-dilution method. Results Totally, 1,343 actinobacterial strains affiliated with 42 genera in 23 families of 10 orders were obtained from 15 soil samples. The predominant genera were Nesterenkonia, Nocardiopsis and Streptomyces. Fifteen strains showed relatively low 16S rRNA similarities (≤98.65%) with validly described species. Five strains showed inhibitory activity against at least one of the indicator strains. Two known compounds were isolated and identified as 1 (1H-indole-3-carboxaldehyde) and 2 (2-hydroxy-1-(1H-indol-3-yl)ethanone). Compound 1 exhibited inhibitory activities against Acinetobacter baumannii 2799 and A. baumannii ATCC19606 with MIC value of 64 and 32 μg/mL, respectively. Conclusion The study demonstrates that the soil in Gudzhirganskoe saline lake is rich of cultivable actinobacteria, which deserved to be further explored for the discovery of new actinobacterial species and antibiotics.
Key words Saline lake; Actinobacteria; Diversity; Novelty; Secondary metabolites
细菌耐药已成为全球公共卫生面临的重大挑战,除了规范抗生素的使用,亟待研发抗耐药菌新抗生素。放线菌,尤其是链霉菌,是抗生素的重要来源[1]。
由于独特的基因类型和代谢机制,特殊生态环境的放线菌具有产生独特代谢产物的潜力,从其次级代谢产物中发现新抗生素是当前的一个研究热点。
盐湖,是不同于海洋的一类含盐水体,作为内陆咸水的一部分,其水体随季节和雨量等发生变化,形成大小不等的盐湖和盐沼。Gudzhirganskoe盐湖位于西伯利亚巴尔古津区,面积约0.3平方公里,湖水的pH值从8.7到9.9不等,湖水一年冻结长达6个月[2]。作为特殊生态环境,Gudzhirganskoe盐湖微生物的研究较少,仅Lavrentyeva等[3]应用16S rRNA基因扩增片段研究其微生物多样性,结果显示该湖中含有放线菌,但没有开展放线菌多样性及纯培养研究。另外,Karlyshev等[4]对Gudzhirganskoe盐湖来源的1株细菌Alg18-2.2的全基因组进行了分析。除此之外,没有关于该盐湖可培养放线菌和次级代谢产物的研究。
本实验室前期与俄罗斯科学院西伯利亚分院实验与普通生物研究所合作,从Gudzhirganskoe盐湖采集同一地点不同深度的8份样品,对其中的可培养放线菌进行多样性、新颖性和抗菌活性的研究,从其中的1株链霉菌S6b3-1的次级代谢产物中分离鉴定了1个吩嗪類化合物LG-1,LG-1对金黄色葡萄球菌 ATCC33591具有较强抑制作用[2]。鉴于前期较好的研究结果,本文进一步对15份Gudzhirganskoe盐湖土壤开展了放线菌多样性、新颖性和抗菌活性研究,并对1株具有活性的新物种进行了次级代谢产物研究,以期深入了解西伯利亚Gudzhirganskoe盐湖可培养放线菌,为从中发现放线菌新物种和新抗生素奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
2×EasyTaq SuperMix、引物、萘啶酮酸等均购自上海生工生物工程股份有限公司,Chelex-100树脂购于Bio-Rad公司,放线菌酮购买自北京全式金生物技术有限公司,BHI(脑心浸液肉汤培养基)和TSB(胰酪大豆胨液体培养基)培养基购买于北京奥博星生物,其它合成培养基均购买于英国Oxoid公司。甲醇(色谱纯)和乙腈(色谱纯)购买自迪马科技有限公司,分析纯甲醇和乙酸乙酯等均来自通广精细化工公司。分离纯化色谱柱为SilGreen HPLC COLUMN-C18柱,250 mm×10 mm,5 ?m。
超净工作台(YT-CJ-1ND,北京亚泰科隆仪器有限公司);高压蒸汽灭菌锅(HVA-110型,日本Hirayama公司);恒温培养箱(Friocell,德国MMM Medcenter公司);PCR扩增仪(Veriti 96 well Thermal Cycler,美国Thermofisher);高效液相色谱仪(LC-20AT,岛津企业管理有限公司)和液相-质谱联用仪(LCMS-2020,岛津企业管理有限公司);核磁共振仪(Bruker AV Ⅲ-600 NMR Instrument,布鲁克科技有限公司)。
1.1.2 培养基
(1)分离培养基:M1(PYG琼脂培养基[5],g/L):甘油10.0,酵母粉5.0,蛋白胨3.0,丙酮酸钠1.25,甜菜碱1.25,琼脂粉15.0;M2:高斯氏合成培养基;M3(10%营养琼脂培养基[6],g/L):NaCl 10.0,甜菜碱1.25,丙酮酸钠1.25,蛋白胨1.0,牛肉膏0.5,琼脂粉15.0;M4(改良ISP2培养基[7],g/L):麦芽浸粉10.0,葡萄糖4.0,酵母粉4.0,添加1%(V/V)微量盐和1%(V/V)复合维生素,琼脂粉15.0,微量盐(g/L):MnCl2·4H2O 0.1,ZnSO4·7H2O 0.1,FeSO4·7H2O 2.0;复合维生素(g/L):硫胺素(VB1)1.0,核黄素(VB2)1.0,烟酸(VB3)1.0,吡哆醇(VB6)1.0,生物素1.0;M5(改良纤维素酪素培养基[8],g/L):KNO3 2.0,K2HPO4 0.2,MgSO4·7H2O 0.05,CaCO3 0.02,FeSO4·7H2O 0.01,NaCl 10.0,纤维素10.0,干酪素0.3,琼脂粉15.0;M6(棉籽糖组氨酸培养基[6],g/L):组氨酸0.1,棉子糖1.0,Na2HPO4 0.5,KCl 1.7,MgSO4·7H2O 0.05,FeSO4·7H2O 0.1,CaCO3 0.02,琼脂粉15.0;M7:R2A固体培养基;M8(CMKA培养基[7],g/L):NaCl 100.0,KCl 30.0,MgCl2 10.0,KNO3 1.0,(NH4)2SO4 2.0,K2HPO4 0.5,CaCO3 0.5,酸水解酪蛋白0.5,甘露醇1.5,琼脂粉15.0;M9(甘油-精氨酸琼脂培养基[7, 9],g/L):NaCl 50.0,K2HPO4 2.0,MgSO4·7H2O 0.05,FeSO4·7H2O 0.01,CuSO4·5H2O 0.001,ZnSO4·7H2O 0.001,MnSO4·H2O 0.001,精氨酸2.0,甘油12.5,琼脂粉15.0;M10(GW1琼脂培养基[9],
g/L):NaCl 50.0,KNO3 2.0,NaHCO3 2.0,(NH4)2SO4 2.0,MgSO4·7H2O 2.0,K2HPO4·3H2O 1.0,CaCO3 0.2,FeSO4·7H2O 0.01,甘露醇1.0,干酪素0.3,添加1%微量盐,琼脂粉15.0。调节pH8.0左右。
(2)纯化培养基:TSB固体培养基。
(3)发酵培养基:除特殊标注外,均使用TSB液体培养基。
(4)活性测试培养基:MH或BHI(2株真菌)培养基。
1.1.3 抑制剂
抑制剂的种类和终浓度分别为萘啶酮酸25 mg/L、
放线菌酮40 mg/L和重铬酸钾50 mg/L。
1.1.4 检定菌
12株“ESKAPE”菌(每种菌有2株,前者为敏感菌,后者为耐药菌)为粪肠球菌(ATCC33186;310682)、金黄色葡萄球菌(ATCC29213;ATCC33591)、肺炎克雷伯菌(ATCC10031;ATCC700603)、鲍曼不动杆菌(ATCC2799;ATCC19606)、铜绿假单胞菌(ATCC27853;ATCC2774)和大肠埃希菌(ATCC25922;ATCC35218)。2株真菌为白念珠菌CCTCC93025和罗伦隐球菌CCTCC91013。以上菌株保存于中国医学科学院医药生物技术研究所。
1.2 方法
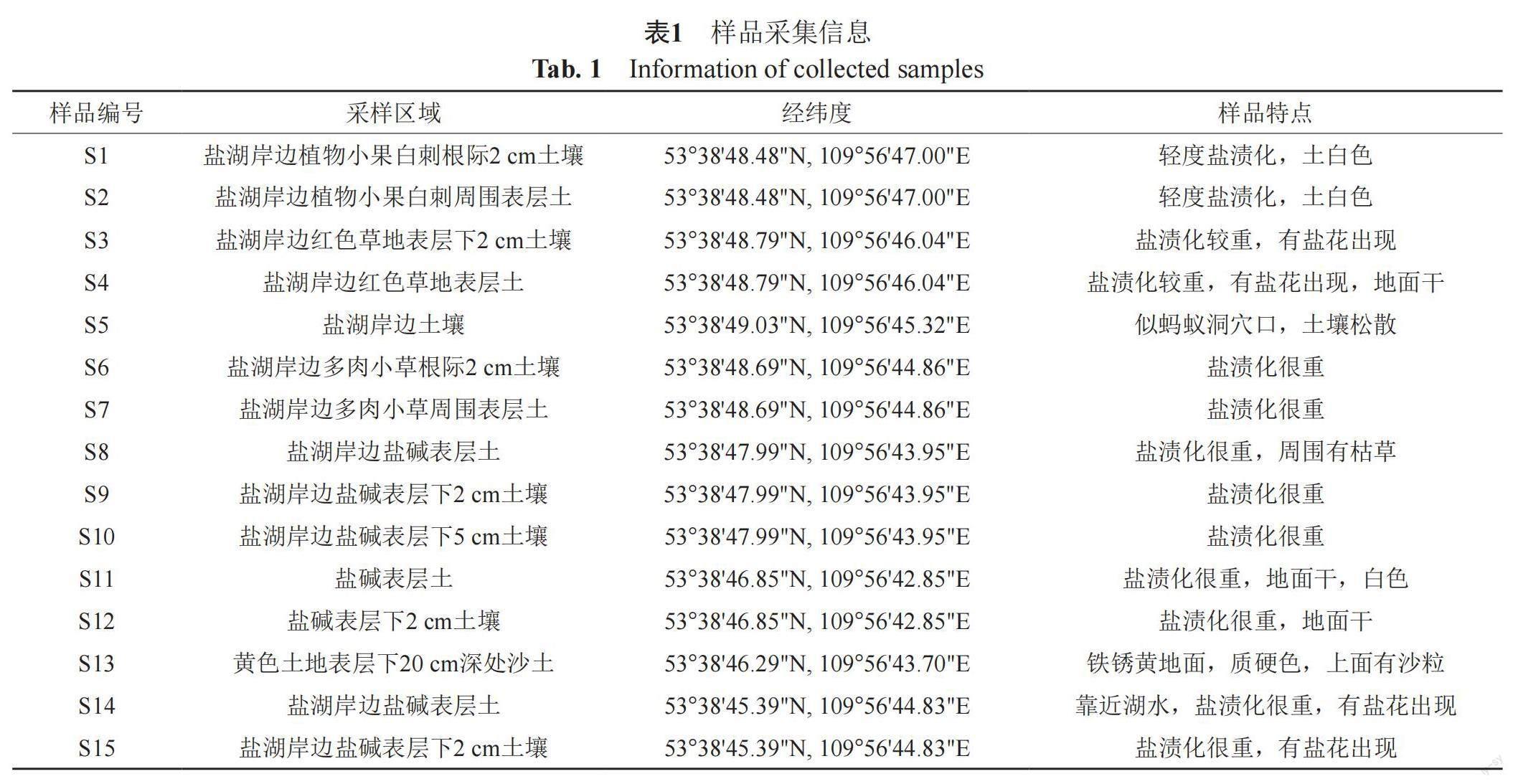
1.2.1 样品的采集与处理
采样时,Gudzhirganskoe盐湖几乎是干涸的,只有少量湖水,湖水的pH为9.4,阴离子中钠离子的浓度为43856.9 mg/L,硫酸盐离子的浓度为83820.0 mg/L。
如表1所示,15份(S1~S15)样品均采集自西伯利亚Gudzhirganskoe盐湖土壤,分别装入10 mL无菌离心管中,于4℃冰箱中保存,备用。15份样品风干后,分别取1 g样品至9 mL的溶液中(g/L,NaCl 7.5,KCl 0.1,CaCl2 0.1,NaHCO3 0.2,焦磷酸钠1.0,酵母粉60.0),30℃,180 r/min振荡2 h,之后用无菌水10倍梯度稀释,分别取200 μL的10-1、10-2和10-3(g/mL)的土壤悬液涂布于10种分离培养基(M1~M10)上,28℃培养1~4周。
1.2.2 菌株的分离纯化与保藏
观察每个平板上的菌落形态,根据菌落形态,排除相近菌落,挑取单菌落,采用三区划线法接种到TSA平板上,直至获得纯培养的菌株。挑取适量纯化后的菌株于20%(V/V)的甘油中,-80℃保藏。
1.2.3 基于16S rRNA基因序列的分子鉴定
利用Chelex-100法提取菌株基因组DNA[10],扩增引物为27F和1492R[11]。扩增体系(50 μL):25 μL 2×supermix、1.5 μL引物、1.5 μL的DNA和20.5 μL ddH2O。扩增条件:95℃预变性3 min;94℃变性
1 min;60℃退火1 min;72℃延伸1 min;30个循环;72℃后延伸10 min。扩增产物经上海生工生物工程有限公司测序,登录EzBioCloud网站(https://www.ezbiocloud.net/)上进行序列比对。采用MEGA X[12]软件以邻接法[13](neighbor-joining)构建系统发育树。
1.2.4 菌株的发酵及抗菌活性筛选
活化15株16S rRNA序列基因相似性小于98.65%的放线菌,挑取适量于TSB(5×100 mL)液体培养基,28℃,180 r/min,培养7~10 d。发酵结束后,发酵液4500 r/min离心25 min,取上清液用等体积的乙酸乙酯萃取3次,减压浓缩后,用5 mL的甲醇溶解获得酯相,备用。菌丝体用丙酮浸泡,超声浸提后,离心,上清液浓缩后用3 mL甲醇溶解,获得菌体相,备用。取水相60 mL挥干后,用3 mL甲醇水溶解备用。
14株检定菌活化后,制备菌悬液,按照0.8%
(V/V)的量将菌悬液加入温度50℃左右灭菌的MH或BHI琼脂培養基中,摇匀后倒入培养皿中,冷却后获得检定板,备用。采用纸片扩散法进行活性筛选,分别吸取60 μL的上述酯相、水相和菌体相的样品于滤纸片(7 mm)上,挥干后,将滤纸片贴于检定板上,37℃培养16~20 h,观察并记录抑菌圈直径。
1.2.5 稀有放线菌Hoyosella sp. S15b3-3次级代谢产物研究
Hoyosella sp. S15b3-3在利用TSB培养基进行活性筛选时,没有表现出抗菌活性,但是在利用多相分类的方法确定该菌株的分类地位时,发现菌株S15b3-3耐受盐浓度的范围是0~10%(V/V)[14],且在进行盐浓度优化实验时,发现利用BHI培养基(添加3%海盐)发酵的产物对鲍曼不动杆菌ATCC19606有抑制作用(抑菌圈直径10.0 mm)。目前,该属仅有5株菌株,且没有次级代谢产物相关研究报道。并且本研究活性筛选结果显示,多数菌株活性较弱。因此,首先对S15b3-3的活性次级代谢产物进行研究。
菌株S15b3-3活化后接种于BHI(添加3%海盐)培养基,30℃,180 r/min培养3 d获得种子液。将种子液按照5%(V/V)的接种量,接种到40瓶含有1 L的BHI(添加3%海盐)液体培养基的5 L的三角瓶中,相同条件下培养7~9 d。发酵结束后,上清液用乙酸乙酯萃取,减压浓缩,得到4.1 g(油状)粗提物。粗提物经过反相硅胶柱层析,甲醇-水梯度洗脱(10%、30%、50%、70%、90%和100%,V/V),共得到7个馏分(Fr.G1~Fr.G7)。每个馏分采用纸片扩散法以鲍曼不动杆菌ATCC19606为指示菌测活。活性结果显示,馏分Fr.G3为活性组分,Fr.G3(610 mg)经过LH-20凝胶柱层析,以甲醇为洗脱剂,共得到63个馏分,经过TLC展开合并相似馏分,共获得8个组分(Fr.G3-1~Fr.G3-8)。每个组分测活,结果显示Fr.G3-5和Fr.G3-8表现出抗菌活性。Fr.G3-5组分通过HPLC制备(28%乙腈-水)纯化得到化合物1(3.1 mg,tR=35.6 min)。Fr.G3-8组分利用HPLC制备(25%乙腈-水),得到化合物2(3.9 mg,tR=38.9 min)。
1.2.6 抗菌活性评价
按照CLSI[15]标准,采用微量稀释法测定化合物1和2的最小抑菌浓度(MIC),12株“ESKAPE”菌为指示菌,设置左氧氟沙星为阳性对照,DMSO作为阴性对照,样品最大浓度为256 μg/mL,37℃恒温培养16~20 h,孔内微生物完全被抑制的浓度即MIC。
2 结果与分析
2.1 放线菌多样性分析
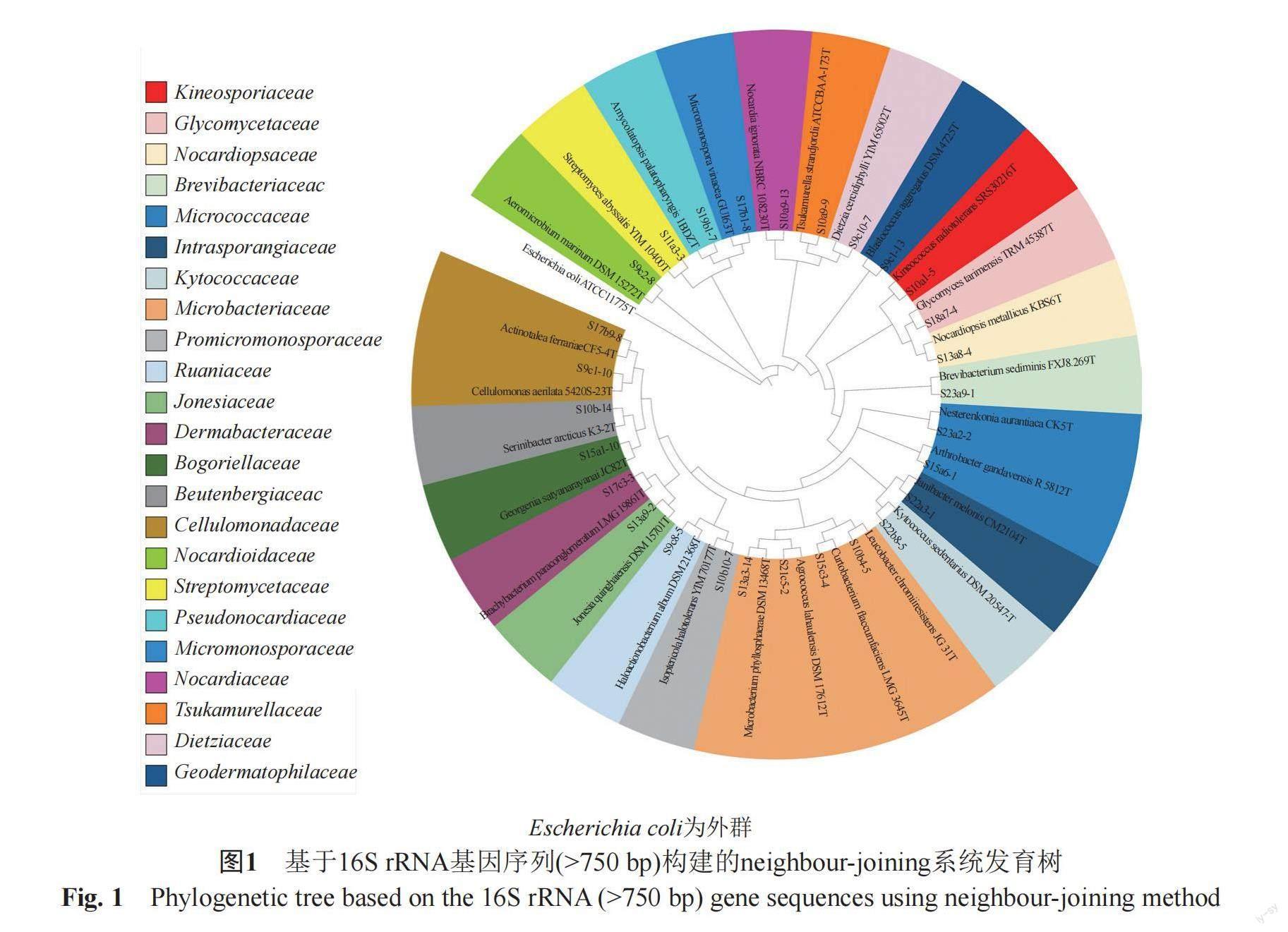
如表2所示,通过菌落排重和16S rRNA基因序列比对分析,15份样品经过10种培养基分离,共获得1343株放线菌,分属于10目23科42属,涅斯捷连科菌属(Nesterenkonia)、拟诺卡菌属(Nocardiopsis)和链霉菌属(Streptomyces)为优势菌属,分别占分离放线菌总数的21.3%、20.5%和20.2%。除此之外,还包括其他一些稀有放线菌,例如气微菌属(Aeromicrobium)、迪茨菌属(Dietzia)、诺卡菌属(Nocardia)、小单孢菌属(Micromonospora)、动球菌属(Kineococcus)、皮革球菌属(Kytococcus)、无色杆菌属(Leucobacter)和短小杆菌属(Curtobacterium)等,其多样性分布见图1。
如图2a所示,15份样品中,从S1(轻度盐渍化土壤)中分离获得的放线菌数量最多(187株),样品S2(轻度盐渍化土壤)分离的放线菌的多样性最高(22属),样品S4(盐渍化较重土壤)获得的放线菌的种属和数量最少(24株,4属)。由图2b可知,10种分离培养基中,M1和M9分离获得的放线菌菌属种类最多(23属),M3(20属)次之,M10中分离的放线菌种属最少(12属)。另外,还有一些放线菌仅在特定的培养基中生长,例如拟无枝菌酸菌属(Amycolatopsis)、动球菌属(Kineococcus)、丝氨酸杆菌属(Serinibacter)和圣格奥尔根村菌属(Georgenia)仅在M1培养基生长,短小杆菌属(Curtobacterium)、短状杆菌属(Brachybacterium)和两面神菌属(Janibacter)仅在M3培养基中发现,棍状杆菌属(Clavibacter)只在M7中生长,嗜盐放线杆菌属(Haloactinobacterium)和皮革球菌属(Kytococcus)仅在M8培养基中出现,壤霉菌属(Agromyces)、盐水杆菌属(Salinibacterium)和冢村氏菌属(Tsukamurella)仅在M9培养基获得。
2.2 放线菌新颖性分析
根据放线菌16S rRNA基因序列相似性小于98.65%的菌株属于不同物种的归类原则[16],对15份盐湖土壤来源放线菌进行新颖性研究,结果显示,15株(表3)放線菌的16S rRNA(>1319 bp)基因序列相似性低于98.65%,初步判断隶属于10个属的不同新物种。菌株S13a10-8和S18c9-1的最高同源性菌株均为Streptomyces xinghaiensis S187T,相似度分别为98.02%和97.13%,这两株菌之间的相似性为97.28%,这说明这2株菌分别代表链霉菌属的2个新物种;并且根据抗菌活性筛选结果发现S13a10-8发酵液具有抗菌活性,而S18c9-1没有表现出抗菌活性,进一步说明2株菌代表链霉菌属的2个新物种。另外,1株稀有放线菌S15b3-3的16S rRNA基因序列相似性低于97.0%,该菌株经过多相分类学研究确定其为Hoyosella属的新物种,命名为Hoyosella lacisalsi[14]。
2.3 抗菌活性筛选结果
如图3所示,15株潜在新物种中有5株菌对至少一株检定菌有抑制作用,其中4株为链霉菌属,1株为稀有放线菌纤维单胞菌属Cellulomonas sp. S9c1-10。
2.4 结构鉴定
化合物1:白色无定形粉末,溶于甲醇和二氯甲烷,ESI-MS给出准分子离子峰m/z 146.13[M+H]+和144.21[M-H]-,提示分子量为145。1H NMR
(600 MHz,CD3OD)给出6个质子信号,13C NMR
(150 MHz,CD3OD)提示化合物含有9个碳。在δH 9.87(1H,s)显示分子中含有一个醛基质子,δH 7.27(1H,td,J=7.2,1.2 Hz),δH 7.23(1H,td,J=7.2,1.2 Hz),δH 8.15(1H,d,J=7.2 Hz)和δH 7.47(1H,d,J=7.8 Hz)提示分子中含有一个邻位取代的苯环,δH 8.07(1H,s)是一个烯氢质子信号。通过文献查阅,该化合物的核磁数据与文献数据一致[17-18],为3-吲哚甲醛,化学结构式如图4所示。13C NMR:δC 187.4、139.7、138.9、125.7、125.0、123.6、122.4、120.1和113.1。
化合物2:白色无定形粉末,ESI-MS给出准分子离子峰m/z 176.23[M+H]+。1H NMR(600 MHz,CD3OD)和13C NMR(150 MHz,CD3OD)谱与化合物1类似,都含有一个吲哚结构,与化合物1不同之处在于化合物2不含醛基氢质子信号,1H NMR显示化合物2在δH 4.73(2H,s)处有一个亚甲基质子信号,13C NMR中δC 66.3的信号提示亚甲基可能与羰基和羟基相连,通过与文献数据比对[19],确定化合物2为2-羟基-1-(3-吲哚)乙酮,结构如图4所示。13C NMR:δC195.9、138.2、134.0、126.9、124.3、123.3、122.6、114.8、112.9和66.3。1H NMR:δH 8.23(1H,m)、8.18(1H,m)、7.45(1H,m)、7.22(2H,m)和4.73(2H,s)。
2.5 化合物1~2的抗菌活性評价
利用微量稀释法对化合物1和2进行活性评价,结果显示,化合物1对鲍曼不动杆菌2799和ATCC19606有一定的抑制作用,最小抑菌浓度分别为64和32 μg/mL,对金黄色葡萄球菌ATCC29213和ATCC33591的MIC均为256 μg/mL,其余检定菌的MIC值均大于256 μg/mL,化合物2对所有检定菌均无明显的抑制作用,MIC值均>256 μg/mL。
3 讨论与结论
本课题组前期从Gudzhirganskoe盐湖同一地点不同深度的8份样品中分离获得635株放线菌,分属于7目12科21属[2]。本文从该盐湖采集的15份不同土壤样品中,共分离鉴定1343株放线菌,分属于10目23科42属,相比之下,本文分离的放线菌不仅多样性更加丰富,而且获得了该盐湖未曾报道的21属,极大地丰富了Gudzhirganskoe盐湖菌株的多样性。为了获得不同菌属的放线菌,本文选择10种分离培养基,根据分离结果发现,4株菌仅在M1培养基中分离获得,另外,在M3、M7、M8和M9中也分别获得3、1、2和3株特有的放线菌,这说明选择不同成分的培养基获得的放线菌类群也会不同。因此,为了更加全面地反应盐湖生境的微生物种类,应该设计不同种类的培养基,进而更好地获得放线菌新类群。
根据新颖性结果分析,前期从该盐湖获得7株16S rRNA基因最高相似度≤98.65%的放线菌,归属于同一个属的新物种;而本文获得15株潜在的新物种,分属于9属,新颖性更高。目前,已确定S15b3-3为Hoyosella属的新物种,其它潜在新物种会继续开展多相分类研究。
对15株潜在新物种进行抗菌活性筛选,其中5株菌对至少1株检定菌表现出抗菌活性,活性菌株主要为链霉菌,仅1株稀有放线菌对大肠埃希菌表现出较弱的抑制作用。Hoyosella sp. S15b3-3在利用TSB培养基进行活性筛选时,没有表现出抗菌活性,但是在进行盐浓度优化实验时,发现该菌株在BHI培养基(添加3%海盐)发酵的产物对鲍曼不动杆菌ATCC19606有抑制作用(抑菌圈直径10.0 mm),这也说明,改变培养基可以刺激菌株产生不同的次级代谢产物。后续拟对这些潜在新物种进行基因组测序,发现天然产物生物合成基因簇,通过OSMAC(单菌多产物)策略优化发酵条件,诱导沉默基因的表达,进而增加发现新化合物的几率。另外,在基因层面发现含有特定结构片段的次级代谢产物,进而指导新化合物的发现。除15株潜在新物种之外,其余1000余株放线菌后续会继续进行抗菌活性筛选,活性菌株采用基于质谱可视化的代谢组学和分子网络进行排重分析,快速找到有潜在新抗生素的目标菌株进行次级代谢产物研究[20]。
本文从Gudzhirganskoe盐湖来源的稀有放线菌Hoyosella sp. S15b3-3的次级代谢产物中分离了2个吲哚类化合物,抗菌活性评价结果显示,化合物1对鲍曼不动杆菌ATCC19606具有一定抑制作用。文献调研发现,化合物1和2主要从海绵中分离得到[21],也有报道来自放线菌,例如小单胞菌属[18,22]和鸟氨酸微菌属[23]等,另外有文献报道从盐土来源的拟诺卡菌属放线菌YIM 90087发酵液中分离获得化合物2[24],本文首次报道从Hoyosella属分离获得吲哚化合物1~2。
综上所述,本文从西伯利亚Gudzhirganskoe盐湖土壤中分离获得的放线菌物种多样性丰富,新颖性较高,这为Gudzhirganskoe盐湖放线菌研究奠定了基础,为新抗生素的发现提供了候选药用放线菌资源。同时丰富了Hoyosella属放线菌的次级代谢产物的类型和数量,为后续研究盐湖的菌株提供参考。
参 考 文 献
Berdy J. Thoughts and facts about antibiotics: where we are now and where we are heading[J]. J Antibiot, 2012, 65(8): 385-395.
Yang Q, Guo P, Abidueva Y E, et al. A pilot survey on antimicrobial activity and diversity of soil-derived actinobacteria from different depths in Gudzhirganskoe Saline Lake in Eastern Siberia[J]. J Oceanol Limnol, 2022. 10.1007/s00343-022-2127-9.
Lavrentyeva E V, Erdyneeva E B, Banzaraktsaeva T G, et al. Prokaryotic diversity in the biotopes of the Gudzhirganskoe Saline Lake (Barguzin Valley, Russia)[J]. Microbiology, 2020, 89(3): 359-368.
Karlyshev A V, Kudryashova E B, Ariskina E V, et al. Whole-genome sequencing of Xanthomonadaceae strain Alg18-2.2, isolated from the Saline Lake Gudzhirganskoe in the Republic of Buryatia, Russia[J]. Microbiol Resour Announc, 2019, 8(46): e1112-e1119.
Sun H M, Zhang T, Wei Y Z, et al. Tenggerimyces mesophilus gen. nov., sp. nov., a member of the family Nocardioidaceae[J]. Int J Syst Evol Microbiol, 2015, 65(10): 3359-3364.
董艳萍, 郭琳, 旭格拉·哈布丁, 等. 塔克拉玛干沙漠南麓土壤放线菌资源勘探及抗菌活性筛选[J]. 中国抗生素杂志, 2013, 38(4): 241-247.
李小俊, 吴越, 张伟铭, 等. 河北九莲城淖尔可培养放线菌多样性及抗菌活性筛选[J]. 微生物学通报, 2016, 43(7): 1473-1484.
Tang S K, Zhi X Y, Wang Y, et al. Haloactinospora alba gen. nov., sp. nov., a halophilic filamentous actinomycete of the family Nocardiopsaceae[J]. Int J Syst Evol Microbiol, 2008, 58(9): 2075-2080.
关统伟, 腾芸, 车振明. 罗布泊盐湖放线菌分离培养基比较研究[J]. 生物技术, 2013, 23(3): 56-60.
周双清, 黄小龙, 黄东益, 等. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报, 2010, (2): 123-125.
Delong E F. Archaea in coastal marine environments[J]. Proc Natl Acad Sci U S A, 1992, 89(12): 5685-5689.
Kumar S, Stecher G, Li M, et al. MEGA X: Molecular evolutionary genetics analysis across computing platforms[J]. Mol Biol Evol, 2018, 35(6): 1547-1549.
Saitou N, Nei M. The neighbor-joining method: A new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(4): 406-425.
Yang Q, Guo P, Abidueva E Y, et al. Hoyosella lacisalsi sp. nov., a halotolerant actinobacterium isolated from the Lake Gudzhirganskoe[J]. Int J Syst Evol Microbiol, 2021, 71(12): 5145-5153.
CLSI. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically[S]. CLSI standard M07 11 th ed. Wayne, PA, USA, Clinical and Laboratory Standards Institute. 2018.
Kim M, Oh H S, Park S C, et al. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J]. Int J Syst Evol Microbiol, 2014, 64(2): 346-351.
厉学, 宋少江, 朴淑娟, 等. 辽宁海绵Aplysinopsis sp.的化学成分研究[J]. 中国海洋药物, 2009, 28(04): 21-25.
Teresa M, Lugo G, Woldemichael G M, et al. Isolation of three new naturally occurring compounds from the culture of Micromonospora sp. P1068[J]. Nat Prod Res, 2005, 19(7): 645-652.
B?hlendorf B, Bedorf N, Jansen R, et al. Antibiotics from gliding bacteria, LXXIII indole and quinoline derivatives as metabolites of tryptophan in myxobacteria[J]. Eur J Org Chem, 2015, 1996(1): 49-53.
Lu Q P, Huang Y M, Liu S W, et al. Metabolomics tools assisting classic screening methods in discovering new antibiotics from mangrove Actinomycetia in Leizhou Peninsula[J]. Mar Drugs, 2021, 19(12): 688-718.
Wang R P, Lin H W, Li L Z, et al. Monoindole alkaloids from a marine sponge Mycale fibrexilis[J]. Biochem Syst Ecol, 2012, 43: 210-213.
謝萌, 熊子君, 赵立兴, 等. 雷公藤植物内生Micromonospora sp. M66生产的一组吲哚生物碱[J]. 微生物学通报, 2016, 43(1): 51-59.
张岗, 庄玲萍, 许莉, 等. 海洋来源放线菌HN-E31次生代谢产物的分离与鉴定[J]. 江西农业大学学报, 2018, 40(5): 1055-1061.
张孝龙, 潘芸, 李铭刚, 等. 拟诺卡氏放线菌YIM 90087的发酵液化学成分研究[J]. 天然产物研究与开发, 2016, 28: 184-187.

