基于FAERS数据库对玛巴洛沙韦安全警戒信号的挖掘与分析
潘辛梅?马攀


摘要:目的 基于FAERS数据库对新型抗流感病毒药物玛巴洛沙韦(baloxavir marboxil)相关不良事件进行挖掘与分析,探索其不良事件发生的特点及与药物关联的强度,为临床用药提供一定的参考。方法 检索并提取FAERS数据库2018年第一季度—2021年第三季度收录以目标药物通用名“baloxavir marboxil”及商品名“Xofluza?”为首要怀疑对象的不良事件报告,利用报告比值比法(ROR)和贝叶斯置信度递进神经网络法(BCPNN)对玛巴洛沙韦的相关报告进行数据挖掘和分析,并利用MedDRA医学用语词典进行汉化及系统归类。结果 纳入分析10,608,503份不良事件报告中,以玛巴洛沙韦为首要怀疑药物的AEs报告1428份,发现该药不良反应信号涉及多个系统,具有临床参考意义的高风险信号包括黑便(ROR下限=12.97,IC-2SD=2.96),与神经精神症状相关的意识状态改变(ROR下限=9.66,IC-2SD=2.49)、谵妄(ROR下限=4.92,IC-2SD=1.82)、异常行为(ROR下限=4.31,IC-2SD=1.79),速发过敏反应性休克(ROR下限=12.27,IC-2SD=2.89)、速发过敏反应(ROR下限=9.20,IC-2SD=2.80)以及嚴重皮肤不良反应多形性红斑(ROR下限=15.90,IC-2SD=2.74);另检测出高风险且说明书中未提及的缺血性结肠炎(ROR下限=23.81,IC-2SD=3.01)及横纹肌溶解(ROR下限=5.65,IC-2SD=2.13)的安全警戒信号。结论 基于FAERS不良事件信号检测显示,玛巴洛沙韦在临床使用中应密切关注相关不良反应的发生,尤其是缺血性结肠炎、神经精神症状、过敏反应、严重皮肤不良反应及横纹肌溶解等不良事件,及时采取干预措施,保证用药安全。
关键词:流感病毒;药物安全;玛巴洛沙韦;信号检测;FDA不良事件报告系统
中图分类号:R978.1文献标志码:A
Detection and analysis of the safety signals of baloxavir marboxil based on
FAERS database
Pan Xin-mei and Ma Pan
(Department of Pharmacy, the First Affiliated Hospital of Army Medical University, Chongqing 400038)
Abstract Objective To mine and analyze the adverse events related to the new anti-influenza drug, baloxavir marboxil, based on the FAERS database, and to explore the characteristics of adverse events including occurrence, correlation strength between adverse events and drugs, to provide reference for clinical use. Methods The FAERS database was searched and extracted from Q1 of 2018 to Q3 of 2021, and the adverse event reports with the target drug generic name "baloxavir marboxil" and brand name "Xofluza?" as the primary suspects were collected. Data mining and analysis were carried out on relevant reports of the drug using the reporting odds ratio (ROR) and the Bayesian Confidence Progressive Neural Network (BCPNN), and the MedDRA medical terminology dictionary was used for localization and systematic classification. Results Among the 10,608,503 adverse events reports in the analysis, 1,428 adverse events were reports with baloxavir marboxil as the primary suspected drug, which involved in multiple systems, and the high-risk signals with clinical significance included: Melena (lower limit of ROR =12.97, IC-2SD=2.96); altered state of consciousness associated with neuropsychiatric symptoms (ROR lower limit=9.66, IC-2SD=2.49); delirium (ROR lower limit=4.92, IC-2SD=1.82); abnormal behavior (ROR Lower limit=4.31, IC-2SD=1.79); anaphylactic shock (ROR lower limit=12.27, IC-2SD=2.89); anaphylaxis (ROR lower limit=9.20, IC-2SD=2.80); and severe skin disorders erythema multiforme (lower limit of ROR=15.90, IC-2SD=2.74). Ischemic colitis (lower limit of ROR=23.81, IC-2SD=3.01) and rhabdomyolysis (ROR lower limit=5.65, IC-2SD=2.13) were also detected as high risk safety signals but not mentioned in the instructions. Conclusion Based on the FAERS adverse event signal detection, baloxavir marboxil must be paid close attention to for occurrence of related adverse reactions in clinical use, especially ischemic colitis, neuropsychiatric symptoms, allergic reactions, severe skin adverse reactions and rhabdomyolysis, etc. Timely intervention measures must be employed to ensure the safety of the drug.
Key words Baloxavir marboxil; Influenza virus; Drug safety; Signal detection; FDA adverse event reporting system
人类流感是一种主要由甲型和乙型流感病毒引起的呼吸道疾病,该类病毒变异率高[1],每年造成大量的严重病例和死亡病例,严重威胁人类生命健康[2]。及时诊断及使用抗病毒药物治疗可减少相关抗生素的使用、症状持续时间、住院时间和死亡率[3]。目前,国际上预防与治疗流感的主要措施有疫苗接种和药物治疗[4],与疫苗接种相比,药物使用更方便、见效更快,在防治流感方面发挥了重要作用。神经氨酸酶抑制剂(neuraminidase inhibitors, NAIs)是目前常用的抗流感药物[5],如奥司他韦,但由于流感病毒变异快以及NAIs药物广泛使用,逐渐出现NAIs耐药毒株[6],为流感病毒感染的治疗增添严重障碍。因此,迫切需求研发新型抗流感药物。
玛巴洛沙韦(baloxavir marboxil)是近20年来首个全新机制抗流感药,通过抑制聚合酶酸性蛋白的核酸内切酶活性从而抑制流感病毒復制[7],对NAIs耐药株的B型病毒具有活性,是一个非常有前景的抗流感病毒药物。2018年2月玛巴洛沙韦在日本首次获批上市,商品名Xofluza?,已于2021年中国上市,用于12岁及以上、症状不超过48 h、急性无并发症流感患者的治疗。由于上市时间较短,目前很少有研究评估玛巴洛沙韦潜在的副作用,说明书指出药物上市后使用期间发生的不良反应有速发过敏反应、皮疹、黑粪症、结肠炎等,有文献报道玛巴洛沙韦亦可引起药物相关急性缺血性结肠炎[8],但目前尚无对其不良反应进行系统报道的文献,需要有研究对该全新机制的抗流感药物可能引发的不良反应进行分析总结。
美国FDA不良事件报告系统(adverse events reporting system,FARES)是一个用于收集自发呈报的药物不良事件(adverse events,AEs)信息的数据库,是进行上市后不良反应信号挖掘研究的重要数据来源[9]。FARES数据库每年能收到约150万份不良事件报告,不仅能挖掘出潜在的不良反应,也能发现新的或罕见不良反应[10-11]。本文将通过FARES数据库进行回顾性药物警戒研究,挖掘玛巴洛沙韦潜在的安全信号,以评估其安全性,以期为临床合理用药提供参考。
1 资料与方法
1.1 数据来源
本研究数据来源于FDA公众健康项目(openFDA)数据库[12],OpenVigilFDA是FDA不良事件报告系统(Adverse Event Reporting System,AERS)数据库的基于web的用户界面,用于使用openFDA在线API提取和分析药物/AEs安全报告,其AEs原始数据由FAERS导入[13]。FAERS数据库中所有AEs均采用国际医学用语词典(Medical Dictionary for Drug Regulatory Activities,MedDRA)的首选语(preferred terms,PT)编码[14]。MedDRA术语集主要是为药事管理的整个过程提供一个经过医学确认的医学术语集,共5个层级,包括PT、高位语(high level term,HLT)、高位组语(high level group term,HLGT)、系统器官分类(system organ class,SOC)编码及相关中文术语,开发者设计的术语集结构使数据输入更特异、更全面,数据检索也更方便。
1.2 数据处理
本研究数据提取采用OpenVigil分析工具,该分析站点通过对接应用程序接口直接提取FAERS数据库中结构化的AEs报告信息[15]。本研究参考玛巴洛沙韦上市时间,限定检索时间为“2018年第一季度”至“2021年第三季度”,限定目标药物通用名为“baloxavir marboxil”及商品名为“Xofluza?”得到目标药物玛巴洛沙韦为首要怀疑药物的AEs报告,并评价其关联性。
1.3 信号检测方法
不良事件的信号挖掘本质上是判断目标药物的目标不良事件的报告频率是否高于预期值,从而建立起该药物和该目标不良事件之间的统计学联系。本研究采用报告比值比法 (reporting odds ratio,ROR)和贝叶斯置信度递进神经网络法(bayesian confidence propagation neural network,BCPNN)两种方法进行信号检测,当两种算法均呈阳性,则判断为可疑信号。频数法(如ROR 法)公式简单,其算法基于四格表(表1)[16],计算方便且容易理解,但容易产生假阳性信号,贝叶斯法(如BCPNN法)计算复杂、不易理解,但即使在有数据缺失的情况下也能获取有效的结果,可以减少假阳性信号的产生。算法的具体计算公式及信号检测标准如下(表2)[17]。
2 结果
2.1 AE上报基本情况
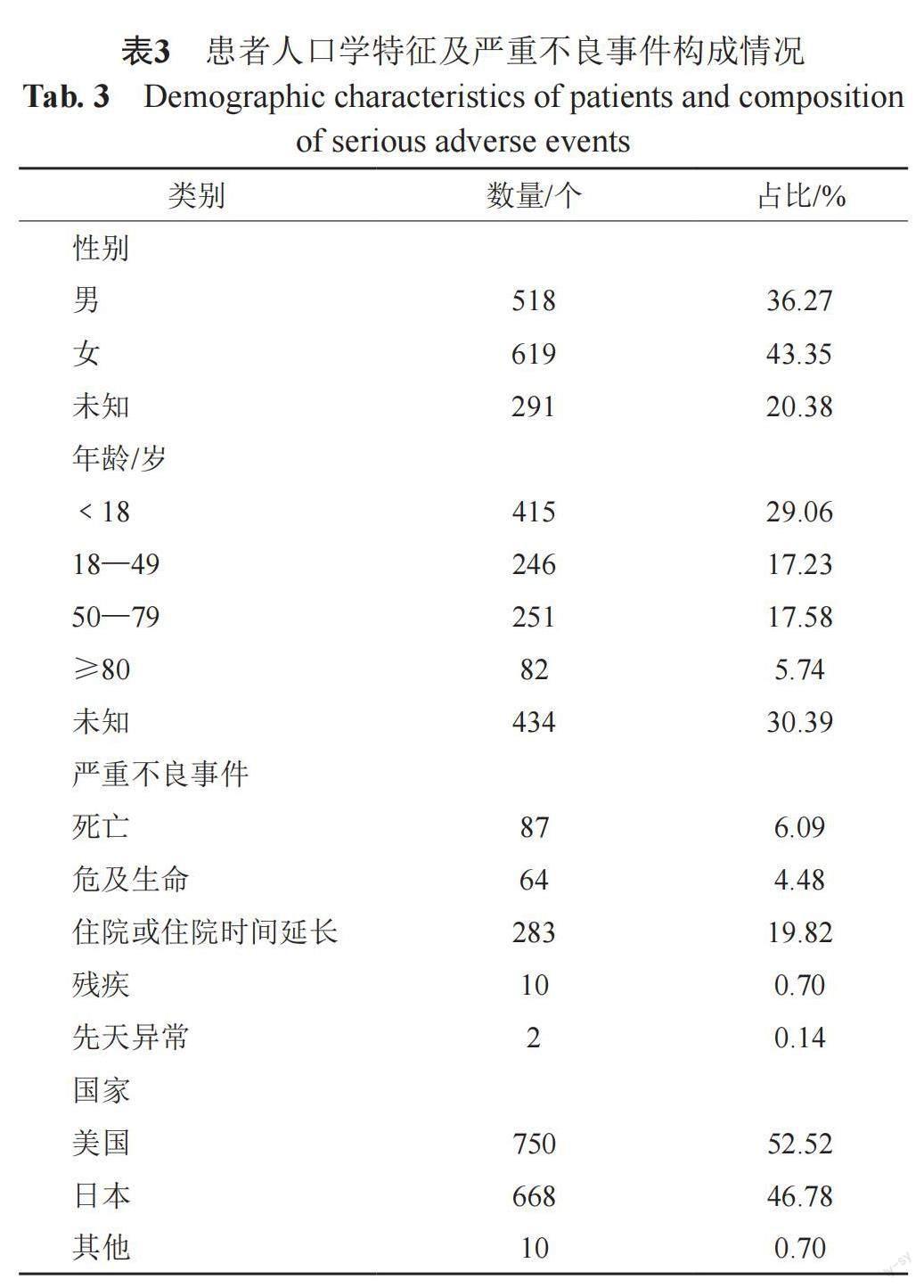
限定时间段“2018年第一季度至2021年第三季度”,从FAERS共检索到10,608,503份AEs报告,其中玛巴洛沙韦为首要怀疑药物的AEs报告共1428份。部分报告有信息的缺失,在性别构成上,女性(43.35%)多于男性(36.27%);年龄集中在18岁以下的未成年人(29.06%);玛巴洛沙韦严重不良事件的报告占比较高(446例,31.23%),其中以住院或住院时间延长报告数最多(283例,19.82%)。从上报的国家看,主要来自美国和日本的报告。玛巴洛沙韦的1428份AE报告的人口学特征及严重不良事件构成情况见表3。
2.2 不良事件信号分析结果
统计1428份AEs报告中经ROR和BCPNN两种方法共检测出42个安全信号,使用MedDRA系统器官分类(SOC)对所有信号的PT进行分类,由于 MedDRA是多轴AE分类系统,1个PT可能同时属于多个SOC,但MedDRA定义了每一个PT的主SOC,因此本研究采用主SOC对生成信号的PT进行分类。结果显示,玛巴洛沙韦的安全信号累及14个SOC,包括胃肠系统,泌尿系统,呼吸系统,免疫系统及神经系统等,具有临床参考意义的高风险信号包括胃肠系统的黑便(ROR下限=12.97,IC-2SD=2.96);肝胆系统的肝功能异常(ROR下限=4.50,IC-2SD=1.73);免疫系统的速发过敏反应性休克(ROR下限=12.27,IC-2SD=2.89)及速发过敏反应(ROR下限=9.20,IC-2SD=2.80);与神经精神症状相关的意识状态改变(ROR下限=9.66,IC-2SD=2.49)、谵妄(ROR下限=4.92,IC-2SD=1.82)、异常行为(ROR下限=4.31,IC-2SD=1.79);以及严重皮肤不良反应多形性红斑(ROR下限=15.90,IC-2SD=2.74);另检测出高风险且说明书中未提及的缺血性结肠炎(ROR下限=23.81,IC-2SD=3.01)、横纹肌溶解(ROR下限=5.65,IC-2SD=2.13)等安全警戒信号,详见表4。
3 讨论
本研究结果显示玛巴洛沙韦的不良事件上报国家主要是日本和美国,因其首先在日本上市,同年获批美国上市,在日本和美国使用时间更长且应用广泛。玛巴洛沙韦于2021年4月在中国上市,12月进入《国家基本医疗保险、工伤保险和生育保险药品目录(2021年版)》[18],本次数据分析结果可以帮助中国患者和医生更好的了解和使用玛巴洛沙韦。
临床试验和荟萃分析表明,玛巴洛沙韦与奥司他韦临床疗效一致,但有更好的病毒学反应,常见不良反应包括腹泻、恶心、支气管炎和鼻窦炎[7]。本研究基于FAERS数据库,采用ROR和BCPNN进行信号检测,在1428份AEs报告中,挖掘出42个玛巴洛沙韦安全信号,主要涉及胃肠道、神经、免疫和皮肤/皮下组织系统。
一项使用FAERS和WebMD数据库挖掘奥司他韦安全信号的研究发现,最常见的AEs包括胃肠道疾病和精神疾病[19]。缺血性结肠炎是由于结肠血管闭塞性或非闭塞性原因,导致结肠血流灌注严重减少,不能满足代谢需求的一组疾病,病情严重者可发生肠梗阻或者肠坏死,需要外科手术干预[20]。其主要症状包括腹痛、腹泻和便血等,常见的危险因素包括血栓、便秘和肠易激综合征或低血容量等[21]。本研究检测到缺血性结肠炎的安全信号,也检测到与缺血性结肠炎症状相关的安全信号包括腹泻、便血、呕吐,以及与缺血性结肠炎相关的危险因素安全信号包括弥散性血管内凝血(形成血栓)[22]、低血压、速发过敏反应性休克(引起低血压)。提示服用玛巴洛沙韦后可能会引起缺血性结肠炎。玛巴洛沙韦是一种前药,通过水解转化为活性代谢产物巴洛沙韦发挥抗病毒作用,巴洛沙韦结构中存在羟基和酮基,这可能与肠道中的金属离子形成螯合物,提高渗透压,导致水向肠道运动,增加肠道压力并出现低血容量,引起缺血性结肠炎[23]。文献和安全信号均提示服用玛巴洛沙韦后可能出现缺血性结肠炎[8],药品说明书中上市后经验的不良事件中包括结肠炎、便血、呕吐,但未提及缺血性结肠炎,在临床应用中应根据患者体征关注缺血性结肠炎,及时诊断及时治疗,避免发生肠梗阻或者肠坏死。
本次玛巴洛沙韦安全信号中同样检测到意识状态改变、谵妄、异常行为、幻觉等与神经精神症状相关的信号。神经精神症状与脑部神经相关,血脑屏障是保护脑部神经的一道屏障,能够阻止某些有害物质进入脑组织,对维持中枢神经系统正常生理状态具有重要意义[24]。玛巴洛沙韦本身没有中枢抑制作用,可能是由于代谢物巴沙洛韦酸在联合用药或者血脑屏障不成熟或受损时,通过血脑屏障诱发神经精神疾病。一项玛巴洛沙韦上市后监测研究发现12岁以下的儿童比成人更容易发生发谵妄和惊厥[4]。可能由于儿童血脑屏障不成熟或合并用药,导致巴沙洛韦酸较易通过血脑屏障,诱发神经精神疾病。
药物作为过敏反应诱导剂与过敏反应[25]的严重程度相关,可能引起致命性的过敏反应。报道称,药物引起的致命性过敏反应占过敏反应相关死亡的58.8%[26]。大多数药物过敏由药物本身引起,但辅料也会引起过敏反应,比如乳糖[27]。玛巴洛沙韦片剂辅料中包含乳糖,可能导致过敏。一项针对日本不良事件报告数据库的分析檢测到玛巴洛沙韦与过敏反应相关[28],对美国FDA不良事件数据库的分析也检测到玛巴洛沙韦速发过敏反应、速发过敏反应性休克、类速发过敏反应、唇部肿胀的安全信号,以及与皮肤/皮下组织相关的多形性红斑、荨麻疹的安全信号。玛巴洛沙韦说明书中也新增了上市后免疫系统和皮肤/皮下组织不良事件警告。在临床中应仔细询问过敏史,根据患者个体特征选择药物,减少过敏反应以及相关的致死率。尤其是信号较高的严重皮肤不良反应多形性红斑应引起临床的重视,严重的多形性红斑可发生继发感染甚至致死[29]。
横纹肌溶解是指肌肉稳态和完整性遭破坏,导致肌肉分解和肌肉胞质内容物释放到循环中,可引起严重的并发症,临床症状包括肌无力、肌痛、血肌酸磷酸激酶升高和出汗等[30],少数患者的临床过程呈暴发性,可能导致严重的高钾血症,急性肾损伤,弥散性血管内凝血,甚至多器官衰竭和死亡[31]。治疗严重横纹肌溶解发作的关键是通过积极的静脉输液避免肾损伤,限制电解质紊乱引起的并发症,并防止进一步的肌肉损伤[31]。众所周知,他汀类药物易引起横纹肌溶解的不良反应,可能是与线粒体功能障碍引起氧化应激导致细胞受损相关[32]。在玛巴洛沙韦安全信号中,发现了横纹肌溶解以及与横纹肌溶解相关的弥散性血管内凝血、血肌酸磷酸激酶升高、肾损害、多器官功能障碍等安全信号,提示服用后可能发生横纹肌溶解,但目前具体机制尚不清楚,需要进一步的临床研究进行分析。药品说明书中未提及横纹肌溶解,但其安全信号强,临床应用中应特别关注,避免引起严重并发症,影响患者健康。
基于药物AEs自发呈报系统,采用数据挖掘信号检测方法,可以挖掘出许多潜在的、迟发的不良反应。本研究检测出胃肠道、神经、免疫等系统的安全信号,其中缺血性结肠炎、神经精神症状、过敏反应予以重点关注。但本研究检测出的安全信号仅表示玛巴洛沙韦与该AE在统计学上具有相关性,并不能代表该药物与该AE在生物学上有因果联系,尚需进一步的临床试验进行探究。此外,由于FAERS 数据库中的数据没有药物使用人群的总数,因此只能对药物与不良事件之间的关联强度进行测算,而无法统计不良事件的发生率。 并且,该数据库存在自发呈报数据库的本身局限,如无法获知患者的既往史、疾病严重程度等相关信息,且给药剂量,给药途径及用药疗程等信息缺失严重等内容不完整的情况[33],因此,FAERS数据库挖掘出的信号仅供参考,需要进行更广泛的随机对照研究以验证挖掘结果。尽管如此,利用自发呈报系统数据库进行药物安全警戒信号的挖掘与分析,可为临床提供一定参考信息,提高用药的安全性。
参 考 文 献
陈本川. 抗流感病毒新药——巴洛沙韦玛波西酯(Baloxavir marboxil)[J]. 医药导报, 2019, 38(4): 533-539.
Thompson M G, Mu?oz-Moreno R, Bhat P, et al. Co-regulatory activity of hnRNP K and NS1-BP in influenza and human mRNA splicing[J]. Nat Commun, 2018, 9(1): 2407.
Uyeki T M, Bernstein H H, Bradley J S, et al. Clinical practice guidelines by the infectious diseases society of america: 2018 update on diagnosis, treatment, chemoprophylaxis, and institutional outbreak management of seasonal influenzaa[J].Clin Infect Dis, 2019, 68(6): 895-902.
Nakazawa M, Hara K, Komeda T, et al. Safety and effectiveness of baloxavir marboxil for the treatment of influenza in Japanese clinical practice: A postmarketing surveillance of more than 3000 patients[J]. J Infect Chemo Ther, 2020, 26(7): 729-735.
Angie L, Besselaar T G, Daniels R S, et al. Global update on the susceptibility of human influenza viruses to neuraminidase inhibitors and status of novel antivirals, 2016—2017[J]. Antivir Res, 2018(157): 38-46.
Yacine A, Guy B. A review of clinical influenza A and B infections with reduced susceptibility to both oseltamivir and zanamivir[J]. Open Forum Infect Dis, 2017(3): x105.
Abraham G M, Morton J B, Saravolatz L D. Baloxavir: A novel antiviral agent in the treatment of influenza[J]. Clin Infect Dis, 2020, 71(7):1790-1794.
Kanai N, Hashimoto T, Fukuda M, et al. Acute ischemic colitis with hematochezia related to baloxavir marboxil treatment for influenza A[J]. J Infect Chemother, 2019, 25(12): 1040-1042.
Subeesh V, Maheswari E, Singh H, et al. Novel Adverse Events of Iloperidone: A disproportionality analysis in US Food and Drug Administration Adverse Event Reporting System (FAERS) database[J].Cur Drug Saf, 2019, 14(1): 21-26.
Revol B, Jullian-Desayes I, Tamisier R, et al. Ticagrelor and centralsleep apnea[J]. J Am Coll Cardiol, 2018, 71(20): 2378-2379.
Colman E, Szarfman A, Wyeth J, et al. An evaluation of a data mining signal for amyotrophic lateral sclerosis and statins detected in FDA's spontaneous adverse event reporting system[J]. Pharmacoepidem Dr S, 2008, 17(11): 1068-1076.
包旭. 美國OpenFDA公众健康项目介绍[J]. 中国执业药师, 2015, 12(10): 18-22.
Xu R, Wang Q. Large-scale combining signals from both biomedical literature and the FDA Adverse Event Reporting System (FAERS) to improve post-marketing drug safety signal detection[J]. BMC Bioinformatics, 2014, 15: 17.
卜擎燕, 熊宁宁, 邹建东, 等. ICH国际医学用语词典(MedDRA): 药事管理的标准医学术语集[J]. 中国临床药理学与治疗学, 2007(5): 586-590.
OpenFDA[EB/OL]. [2022-5-30]. https://open.fda.gov/apis/paging/.
E van Puijenbroek, W Diemont, K van Grootheest. Application of quantitative signal detection in the dutch spontaneous reporting system for adverse drug reactions[J]. Drug Safety, 2003, 26(5): 293-301.
Bate A, Lindquist M, Edwards I R, et al. A Bayesian neural network method for adverse drug reaction signal generation[J]. Eur J Clin Pharmacol, 1998, 54(4): 315-321.
国家医疗保障局.《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》[EB/OL].(2021-12-03) [2022-05-26]http://www.nhsa.gov.cn/art/2021/12/3/art_37_7429.html.
Han N, Oh J M, Kim I W. Assessment of adverse events related to anti-influenza neuraminidase inhibitors using the FDA adverse event reporting system and online patient reviews[J]. Sci Rep, 2020, 10(1): 3116.
邓衍部, 刘有理, 贺道兴. 缺血性结肠炎研究进展[J]. 中国临床研究, 2018, 31(5): 701-704.
Brandt L J, Feuerstadt P, Longstreth G F, et al. ACG clinical guideline: Epidemiology, risk factors, patterns of presentation, diagnosis, and management of colon ischemia (CI)[J]. Am J Gastroenterol, 2015, 110(1): 18-45.
林静, 李启欣. 凝血检验指标在弥漫性血管内凝血诊断中的应用研究[J]. 血栓与止血学, 2022, 28(1): 11-13.
Koshimichi H, Tsuda Y, Ishibashi T, et al. Population pharmacokinetic and exposure-response analyses of baloxavir marboxil in adults and adolescents including patients with influenza[J]. J Pharm Sci, 2019, 108(5): 1896-1904.
杜仁峰, 余波, 潘丹红, 等. 缺血性脑卒中血脑屏障受损及修复的神经炎性机制研究进展[J]. 华西医学, 2022, 37(4): 622-626.
Zhao Y, Sun S, Li X, et al. Drug-induced anaphylaxis in China: A 10year retrospective analysis of the Beijing Pharmacovigilance Database[J]. Int J Clin Pharm, 2017(40): 1349-1358.
Jerschow E, Lin R Y, Scaperotti M M, et al. Fatal anaphylaxis in the United States, 1999—2010: Temporal patterns and demographic associations[J]. J Allergy Clin Immunol, 2014, 134(6): 1318-1328.
Morikawa M, Kanemitsu Y, Tsukamoto H, et al. A case of anaphylaxis in the pediatric patient with milk allergy due to traces of milk protein in the lactose used as an excipient of inavir inhalation[J]. Arerugi, 2016, 65(3): 200-205.
Tanaka H, Ohyama K, Horikomi Y, et al. Association between anaphylaxis and anti-influenza drug use: An analysis of the Japanese Adverse Drug Event Report database[J]. Drug Disc Ther, 2021, 15(3):150-155.
曹潔, 蔡方成. 儿童多形性红斑的临床特征[J]. 实用儿科临床杂志, 2002, (6): 625-627.
Lopes Abath Neto O, Medne L, Donkervoort S, et al. MLIP causes recessive myopathy with rhabdomyolysis, myalgia and baseline elevated serum creatine kinase[J]. Brain, 2021, 144(9): 2722-2731.
Kruijt N, den Bersselaar L V, Snoeck M, et al. RYR1-related rhabdomyolysis: A spectrum of hypermetabolic states due to ryanodine receptor dysfunction[J]. Curr Pharm Design, 2022, 28(1): 2-14.
Ramachandran R, Wierzbicki A S, et al. Statins, muscle disease and mitochondria[J]. J Clin Med, 2017, 8(6): 75.
马攀, 龚莉, 张妮, 等. 基于FDA不良事件数据库对洛匹那韦/利托那韦安全信号的检测与分析[J]. 中国现代应用药学, 2020, 37(4): 406-413.

