影响非洲猪瘟病毒对培养细胞感染性的因素分析
冯永智,龚 婷,吴东东,高 琦,郑晓宇,张桂红,3,4,孙彦阔,4*
(1.华南农业大学兽医学院国家非洲猪瘟区域实验室(广州),广州 510642;2.广东省动物源性人兽共患病预防与控制重点实验室,广州 510642;3.岭南现代农业科学与技术广东省实验室茂名分中心,茂名 525000;4.农业农村部人畜共患病重点实验室,广州 510642)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒感染(African swine fever virus,ASFV)引起的野猪和家猪的一种急性高度致死性疾病[1]。ASFV属于非洲猪瘟病毒科家族唯一成员,也是目前唯一已知的DNA虫媒病毒[2]。作为一种大型的双链DNA病毒,其基因组长度为170~193 bp,分为左侧可变区、中央保守区和右侧可变区[3]。ASFV病毒粒子呈二十面体对称结构,直径为260~300 nm,有150多个开放阅读框[4]。目前,ASFV已被鉴定出68种结构蛋白和100多种非结构蛋白,但是对于大部分蛋白功能的研究是有限的[5]。ASF自1921年出现以来已有百年历史,2018年我国首次报道ASF疫情,给全国养猪业造成了巨大的损失[6]。由于对病毒粒子的研究有限,应用于临床的商业化疫苗仍在研制中[7]。
病毒生物学特性的研究及生物制品(如疫苗)制备均需要良好的体外细胞系,家猪为ASFV的终末宿主,因此研究病毒与宿主的互作机制通常使用猪源细胞作为体外模型。在猪体内,ASFV具有高度限制的细胞嗜性,原代单核细胞和猪肺泡巨噬细胞(porcine alveolar macrophage,PAMs)是ASFV的主要靶细胞[8]。体外试验中用到的PAMs感染模型,通常由约4周龄的SPF猪的肺泡灌洗液获得[9]。猪肺泡巨噬细胞(3D4/21)则是由长白猪的肺中分离后经过Psv3neo转化的SV40大T抗原永生化细胞系[10],而猪肾上皮细胞(PK15)是由猪肾上皮细胞癌变而来的一种传代细胞系[11],这两种细胞系对多种猪源病毒均具有良好的感染能力,但未曾报道过3D4/21和PK15为ASFV的体外易感细胞系。
基于此,本研究通过对ASFV感染PAMs、3D4/21以及PK15细胞的全基因转录谱进行分析,并根据差异基因的GO功能富集与KEGG通路分析结果,分别对3D4/21和PK15细胞的生物学功能进行调节,初步探究了影响ASFV体外感染的主要因素,为建立并完善ASFV体外细胞培养体系奠定了基础。
1 材料与方法
1.1 主要实验材料
ASFV GZ/2018毒株、3D4/21和PK15细胞系均由华南农业大学传染病教研室保存,PAMs通过4周龄仔猪的肺泡灌洗液获得[12]。G1/S期抑制剂诺考哒唑(nocodazole)、G2/M期抑制剂帕比司他(panobinostat)和硫酸长春新碱(vincristine sulfate)均购自于Sigma公司。谷氨酰胺抑制剂BPTES、乙酰辅酶A羧化酶-α的变构抑制剂TOFA、脂肪酸合成酶抑制剂C75、糖酵解抑制剂2-脱氧-D-葡萄糖(2-deoxy-D-glucose)均购自MCE。胎牛血清(FBS)、RPMI 1640培养基和高糖DMEM培养基购自Thermo Fisher Scientific公司。NunclonTMSpheraTM细胞培养皿购自Thermo Fisher Scientific公司。Cell Counting Kit-8购自新赛美公司。ASFVB646L特异性引物和探针由生工生物工程(上海)股份有限公司合成。
1.2 ASFV全基因转录谱分析
获得有效的数据后与参考序列GCF_000 003 025.6_Sscrofa11.1(NCBI)进行比对。此后,进行差异表达分析以确定各比较组的差异表达基因(DEGs)。Fold change>2且P≤0.05的单基因被认为是明显的差异表达。使用BGI的Dr.Tom多组学数据挖掘系统,进行聚类热图和KEGG分析以及差异基因结果显示。利用GO和KEGG数据库对DEGs进行功能注释和通路分析,并将结果图示出来。
1.3 病毒感染
将PAMs、3D4/21、PK15接种于细胞培养皿,待细胞生长完全后,以MOI=1接种ASFV,放置于37 ℃,5%CO2培养箱中2 h,然后用PBS洗涤3次,PAMs在10% FBS RPMI 1640培养基中维持,3D4/21和PK15在10%FBS DMEM培养基中维持。
1.4 细胞周期的调控与感染
应用G1/S期抑制剂诺考哒唑(nocodazole)、G2/M期抑制剂帕比司他(panobinostat)和硫酸长春新碱(vincristine sulfate)分别调控3D4/21、PK15细胞周期的同时并感染病毒,2 h后使用PBS洗涤3次,然后在含有药物的培养基中维持。
1.5 细胞代谢的调控与感染
应用谷氨酰胺抑制剂BPTES、乙酰辅酶A羧化酶-α的变构抑制剂TOFA、脂肪酸合成酶抑制剂C75、糖酵解抑制剂2-deoxy-D-glucose调控3D4/21、PK15细胞代谢的同时并感染病毒,2 h后使用PBS洗涤3次,然后在含有药物的培养基中维持培养。
1.6 用于检测ASFV基因组拷贝数的实时定量PCR
使用DNA提取试剂盒提取ASFV感染细胞的DNA,使用SYBY qPCR Master Mix(Vazyme)在95 ℃,30 s进行预变性,然后在95 ℃ 10 s,60 ℃ 30 s进行40个循环,最后在95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s生成熔解曲线。所使用B646L引物为中国动物疾病预防控制中心(CADC)推荐,正向引物:5′-ATAGAGATACAGCTCTTCCAG-3′,反向引物:5′-GTATGTAAGAGCTGCAGAAC-3′,探针:5′-FAM-TATCGATAAGATTGAT-MGB-3′。
1.7 目的蛋白Western blot分析
细胞经裂解液充分裂解后取上清与上样缓冲液混合均匀,煮沸10 min。将样品进行SDS-PAGE凝胶电泳,然后将蛋白转移到NC膜上,转膜完毕后用5%脱脂乳封闭1 h,分别使用抗ASFV p30抗体、抗Tubulin抗体稀释液孵育过夜;用TBST洗涤3次,每次15 min,使用二抗孵育45 min;TBST洗涤3次,每次15 min,扫描拍照成像。
1.8 统计分析
本试验所有数据除全基因转录谱外,均通过GraphPad Prism 8T-test检验方法对数据结果进行统计分析。**表示差异显著(P<0.01);***表示差异极显著(P<0.001)。
2 结 果
2.1 ASFV不能感染2D培养3D4/21和PK15细胞系
使用不含血清的培养基,以 1 MOI 的ASFV接种3D4/21、PK15和PAMs细胞,48 h收集细胞,反复冻融3次,提取样本DNA,并进行荧光定量PCR检测ASFVB646L基因的拷贝数。结果显示,ASFV接种PAMs后的病毒拷贝数与对照组差异显著,但是ASFV在接种3D4/21和PK15细胞后与对照组的病毒拷贝数无显著差异(图1)。结果表明ASFV不具有感染3D4/21和PK15细胞系的能力。
2.2 ASFV全基因组转录谱分析
基于上述结果,作者进一步分析了ASFV接种PAMs、3D4/21、PK15细胞后基因组转录谱的表达差异。从ASFV接种的PAMs、PK15和3D4/21中提取总RNA,通过聚类热图分析转录组学结果(图2A,图中横坐标代表样本名称,纵坐标表示差异基因,颜色越深表示表达量越高),结果显示不同组间基因表达量出现明显分散,表明组间差异较大。作者通过火山图可视化两组之间差异基因整体分布情况,结果显示,与PAMs相比,3D4/21细胞有4 023个差异基因上调,3 393个基因下调(图2C),PK15细胞有3 279个差异基因上调,4 674个差异基因下调(图2D)。KEGG通路富集分析表明,3D4/21、PK15细胞系与PAMs细胞的共同上调差异基因显著富集在以下途径:1)细胞黏附途径中,如Src、Caveolin、RhoGEF、Vinculin等基因;2)细胞周期途径中,如DP-1、DP-2、SCF、DNA-PK等基因;3)细胞代谢途径中,如UGT1A6、GUSB、UGDH等基因(图2B)。
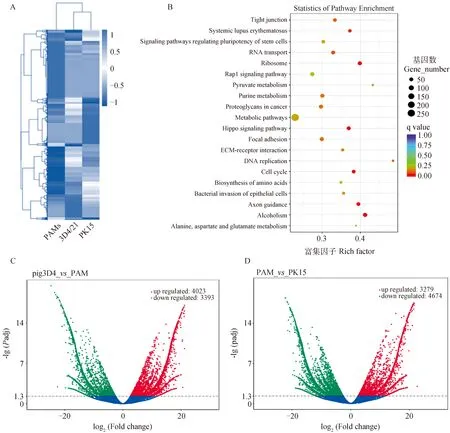
A.全基因组转录谱热图;B.KEGG信号通路富集分析;C.PAMs与3D4/21细胞差异基因统计;D.PAMs与PK15细胞差异基因统计
2.3 悬浮培养显著提高ASFV感染3D4/21和PK15细胞系能力
针对全基因组转录谱的分析结果,为了进一步探究细胞黏附对ASFV体外感染的影响,作者采用了悬浮培养以调节细胞的物理黏附环境。结果显示,ASFV在悬浮培养的3D4/21和PK15细胞中病毒拷贝数、病毒滴度和p30蛋白表达水平显著高于2D培养的3D4/21和PK15细胞(图3A、B、C),但是随着传代次数的增加,ASFV在悬浮培养的细胞中的复制能力下降(图3D)。以上结果表明,改变细胞物理黏附环境可以显著提高ASFV感染3D4/21和PK15细胞系的能力,但随着传代次数的增加其复制能力逐渐下降。
A.2D培养和悬浮培养病毒拷贝数;B.2D培养和悬浮培养病毒滴度;C.2D培养和悬浮培养病毒蛋白水平;D.连续悬浮培养病毒拷贝数
2.4 细胞周期对ASFV感染体外细胞系的影响
为了进一步探究细胞周期对ASFV感染体外细胞系的影响,首先使用Cell Counting Kit-8(CCK8)试剂盒分别测定了3种细胞周期药物对3D4/21(图4A~C)和PK15(图4D~F)细胞的毒性。接下来使用G1/S期抑制剂诺考哒唑(nocodazole,0.002 5 ng·mL-1)、G2/M期抑制剂帕比司他(panobinostat,0.002 5 ng·mL-1)和硫酸长春新碱(vincristine sulfate,0.05 ng·mL-1)调控3D4/21,使用诺考哒唑(0.1 ng·mL-1)、帕比司他(0.05 ng·mL-1)和硫酸长春新碱(0.006 25 ng·mL-1)调控PK15细胞的细胞周期并同时接种MOI=1的ASFV。使用qPCR检测ASFVB646L基因,结果显示,应用G1/S、G2/M期细胞周期抑制剂后,ASFV在3D4/21和PK15细胞中的病毒拷贝数与对照组无显著差异(图4G、H)。以上结果表明,细胞周期对ASFV在体外感染无显著影响。
2.5 细胞代谢对ASFV感染体外细胞系的影响
最后探究了细胞代谢对ASFV感染体外细胞系的影响,使用CCK8细胞活性检测试剂盒分别测定4种代谢药物对3D4/21(图5A~D)和PK15(图5E~H)的细胞毒性。分别使用谷氨酰胺抑制剂BPTES(100 μg·mL-1)、乙酰辅酶A羧化酶-α的变构抑制剂TOFA(40 μg·mL-1)、脂肪酸合成酶抑制剂C75(40 μg·mL-1)、糖酵解抑制剂2-deoxy-D-glucose(100 μg·mL-1)调控3D4/21细胞代谢途径,使用谷氨酰胺抑制剂BPTES(80 μg·mL-1)、乙酰辅酶A羧化酶-α的变构抑制剂TOFA(100 μg·mL-1)、脂肪酸合成酶抑制剂C75(20 μg·mL-1)、糖酵解抑制剂2-deoxy-D-glucose(100 μg·mL-1)调控PK15细胞代谢途径,并同时接种1 MOI的ASFV。通过qPCR检测ASFVB646L基因,结果显示,调控细胞代谢途径后,ASFV在3D4/21和PK15细胞中的病毒拷贝数与对照组无显著差异(图5I、J)。以上结果表明,细胞代谢途径对ASFV在体外感染无显著影响。
3 讨 论
PAMs为研究ASFV的生物学特性提供了良好的体外模型,但是原代细胞的制作成本昂贵且耗时,同时,由于供体动物健康状况的差异可能导致不同批次细胞存在高度差异性,这种差异性可能会阻碍ASFV与宿主相互作用的研究。虽然有报道称,ASFV能够在已建立的一些非宿主细胞系中复制,但是病毒的复制效率较低并且碱基容易发生变异,严重限制了ASFV与宿主互作的研究[13]。已有报道表明,Ⅰ型ASFV的BA71V毒株可以在非洲绿猴肾细胞(Vero)中增殖,但是随着传代次数的增加,病毒基因存在不同程度的点突变或缺失,并且丧失其在巨噬细胞中复制的能力,BA71V毒株适应在Vero中生长后,其毒力完全丧失[14-17]。同样作为免疫抑制性疾病,猪繁殖与呼吸综合征病毒对非洲猴肾上皮细胞(Marc-145)系具有良好的感染能力,但是最近有研究发现Marc-145无法持续维持ASFV的复制[18]。此外,商业化猪传代细胞系,如永生化猪肾巨噬细胞(IPKM)、Zuckerman巨噬细胞-4(ZMAC-4)、普拉姆岛猪上皮细胞(PIPEC)经研究发现对ASFV具有良好的复制能力,可应用于ASFV的生物学特性研究,但以上细胞系对ASFV体外连续传代和感染能力的决定性因素尚未研究[19-21]。
本试验通过对ASFV的易感细胞系PAMs和非易感细胞系3D4/21、PK15进行全基因转录谱的分析,发现差异基因主要富集在细胞黏附等功能上。使用悬浮培养的3D4/21、PK15细胞系对ASFV的体外感染条件进行探究,发现可以显著提高ASFV对3D4/21、PK15细胞的感染能力,但是随着传代次数的增加,悬浮培养不能保持病毒的复制能力,这可能是由于毒株在传代过程发生的基因突变所致。据报道,细胞培养的器材基质的固有化学或物理特性会影响细胞的黏附,从而会进一步影响细胞的生物学功能[22]。因此与传统的细胞贴壁培养方式相比,悬浮培养能够最大程度地发挥细胞的生物学潜能,目前此方式已广泛应用于病毒培养中。
4 结 论
通过悬浮培养调控细胞黏附后,可显著提高ASFV感染3D4/21和PK15细胞系的能力,但复制能力随传代次数的增加而下降,但是通过调控细胞周期和细胞代谢对ASFV感染3D4/21和PK15细胞系的能力无显著影响。本研究为ASFV体外细胞系的建立奠定了一定的研究基础。

