亮氨酸对黄牛皮下脂肪细胞棕色化的影响
郭逸芯,王之盛*,胡 瑞,王俊梅,王 森,施丽媛,张晓红,邹华围,左家学,彭全辉,薛 白,王立志
(1.四川农业大学动物营养研究所,肉用牛低碳养殖创新团队,四川省牛低碳养殖与安全生产高校重点实验室,成都 611130;2.临沧市畜牧技术推广站,临沧 677099)
脂肪是动物体内最大的能量贮存库,在维持体温恒定和机体能量代谢过程中起重要作用。棕色脂肪组织(brown adipose tissue,BAT)可通过非颤抖性产热的方式维持动物体温,帮助幼畜抵御寒冷,提高其存活率[1]。动物的生长和组织的发育需要大量能量,该过程伴随着脂肪组织的沉积。然而,皮下脂肪的食用价值较低,其过度沉积不仅影响胴体品质,还增加饲料消耗和生产成本,进而制约生产效益[2]。BAT使得脂肪酸和葡萄糖分解产生的化学能转化为热能,进而促进脂肪消耗,定向调节动物脂肪沉积,改善肉品质[3]。此外,相较于白色脂肪组织(white adipose tissue,WAT),BAT含有更多不饱和脂肪酸,更有利于消费者健康[4-5]。然而随着哺乳动物的生长发育,BAT逐渐减少,仅占成年后机体脂肪组织的10%。因此,探究家畜BAT的调控手段,对探究脂肪的营养代谢调控和肉牛的机体养分沉积有重要的意义。
WAT和BAT中的脂肪细胞在形态和功能上存在一定差异。白色脂肪细胞(white adipocyte,WA)含有唯一的大单房脂滴,线粒体数量少,其功能主要是以甘油三酯的形式储存能量,多分布于皮下和内脏周围。棕色脂肪细胞(brown adipocyte,BA)含有多房小脂滴,富含线粒体与解偶联蛋白(UCP1)。此外,WAT内还存在着 “米色脂肪细胞(beige adipocyte)”,其脂滴大小和线粒体数量介于WA与BA之间,高表达UCP1,功能与BA相似。在一定条件下,米色脂肪细胞能由WA受到诱导和激活而产生,该过程被称为“白色脂肪细胞棕色化”。米色脂肪细胞虽也表达UCP1,但它还独特表达Cited1、CD137和TMEM26等基因[6-7]。目前,白色脂肪棕色化的研究多集中于人类与小鼠,该现象为人类开辟了通过靶向脂肪组织调控肥胖以及一系列疾病的可能性[8]。
作为功能性氨基酸,亮氨酸在调节代谢和生理过程中发挥多种作用。它具有调节蛋白质合成、传导胰岛素信号、促进葡萄糖摄取和改善动物免疫力的功能[9]。研究表明,亮氨酸能促进脂肪细胞向肌肉细胞的能量分配,减少脂肪细胞中脂质储存,促进肌肉细胞对脂质的利用[10]。此外,亮氨酸也被证实能够影响线粒体含量,促进线粒体生物合成,从而增强细胞呼吸和能量分配[11]。动物营养领域中,亮氨酸在促进畜禽肌肉蛋白质合成方面研究较为广泛,对脂肪沉积方面的研究较少。研究证明,肥胖小鼠饲料中额外添加亮氨酸能促进其白色脂肪棕色化[12,9],但亮氨酸对反刍动物白色脂肪棕色化的影响机制尚不清楚。
本研究以黄牛皮下脂肪细胞为试验材料,重点研究亮氨酸调控白色脂肪细胞棕色化以及对脂肪细胞脂质代谢的影响。旨在从细胞水平探究亮氨酸对黄牛皮下脂肪细胞棕色化和脂质积累的调控机制。
1 材料与方法
1.1 试验材料
MEMα培养基、DMEM高糖培养基、无菌 PBS、胎牛血清(FBS)购自赛默飞世尔科技(中国)有限公司;L-亮氨酸、3-异丁基-1-甲基黄嘌呤(IBMX)、罗格列酮(RSG)购自美国Sigma公司;青霉素-链霉素-两性霉素B(三抗)、地塞米松(DEX)、牛胰岛素(INS)、I型胶原酶、BCA蛋白分析试剂盒购自北京索莱宝科技有限公司;油红O粉末购自北京博奥森生物技术有限公司;总RNA提取试剂盒购自湖南艾科瑞生物工程有限公司;RNA反转录试剂盒、RT-PCR扩增预混合溶液购自翌圣生物科技(上海)股份有限公司;一抗稀释液、RIPA裂解液、蛋白酶磷酸酶抑制剂混合物、超极敏ECL发光试剂盒、Mito-Tracker Green(线粒体绿色荧光探针)购自上海碧云天生物技术有限公司;β-actin、UCP1、CD137、SIRT1、AMPKα、p-AMPKα、PGC1α一抗和鼠抗兔IgG购自江苏亲科生物研究中心有限公司;细胞基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;ATP含量检测试剂盒购自上海酶联生物科技有限公司。
1.2 试剂配置
生长培养基组成为MEMα培养基、10% FBS、1%三抗。诱导培养基为DMEM高糖培养基、10% FBS、1%三抗,添加10 μg·mL-1INS、0.25 μmol·L-1Dex、0.5 mmol·L-1IBMX和1 μmol·L-1RSG。维持培养基为DMEM高糖培养基、10% FBS、1%三抗,添加10 μg·mL-1INS和1 μmol·L-1RSG。
1.3 试验方法
1.3.1 黄牛前体脂肪细胞的分离培养 于屠宰场采取4头3岁育肥的健康雄性黄牛((351.7±42.5) kg)皮下脂肪组织,参照郭红芳等[13]和王森等[14]前体脂肪细胞分离培养方法分离黄牛前体脂肪细胞。分离出的细胞用生长培养基重悬后接种于培养瓶中,差速贴壁1 h纯化细胞,随后在37 ℃、CO2浓度为5%的培养箱中培养,每2 d更换1次培养基,直至传代和冻存备用。
1.3.2 黄牛前体脂肪细胞的诱导分化和试验处理 黄牛前体脂肪细胞诱导分化及试验处理方案如图1所示。将不同来源的前体脂肪细胞混合并接种于6孔板中,细胞生长至90%后,接触抑制2 d再进行诱导分化。使用分化诱导培养基培养细胞3 d后,再更换为额外添加不同浓度亮氨酸(0、0.5、1、2、4、8 mmol·L-1)的分化维持培养基处理3 d。筛选诱导脂肪细胞棕色化的亮氨酸浓度,后续试验分为对照组(CON)和亮氨酸添加组(Leu)。每个处理组6个重复。
图1 黄牛前体脂肪细胞诱导分化及试验处理方案[15]
1.3.3 油红O染色和异丙醇萃取 适量PBS洗涤细胞3次,10%福尔马林溶液固定细胞35 min。PBS洗涤3次后加入油红O工作液染色50 min。之后吸去油红O工作液,PBS洗涤细胞3次,再用60%异丙醇洗掉浮色。干燥后用倒置显微镜观察并拍照。然后用异丙醇萃取油红O染料,加入96孔板,在490 nm波长下读取OD值。
1.3.4 细胞活力检测 将黄牛前体脂肪细胞接种于96孔板中,细胞密度为1×105个·mL-1,分化后期更换添加不同浓度亮氨酸(0、0.5、1、2、4、8 mmol·L-1)的分化维持培养基。孵育24 h后,每100 μL培养液中加入10 μL CCK-8试剂,37 ℃孵育2 h,在450 nm波长下读取OD值。
1.3.5 细胞总RNA的提取与RT-PCR 提取细胞总RNA并检测浓度后,按照反转录试剂盒说明书反转录成cDNA。以cDNA为模板进行RT-PCR,反应体系为:SYBR Green Master Mix 5 μL、上游引物0.2 μL、下游引物0.2 μL、cDNA 1 μL、RNase Free H2O 3.6 μL。反应程序为:95 ℃预变性2 min;95 ℃变性10 s,60 ℃延伸30 s,40个循环;65 ℃延伸5 s,95 ℃再延伸5 min。GAPDH作为内参,用2-ΔΔCT法计算基因的相对表达量。RT-PCR引物由生工生物工程(上海)有限公司设计合成,序列见表1。

表1 RT-PCR引物序列表
1.3.6 免疫印迹杂交 PBS洗涤细胞后,用RIPA蛋白裂解液(1 mmol·L-1PMSF)提取细胞总蛋白,然后对裂解细胞进行超声波破碎(该步骤在冰水混合物上进行),并在4 ℃以13 000 r·min-1离心15 min。离心后,采用BCA蛋白分析试剂盒测定上清液蛋白浓度,加入5×上样缓冲液后99 ℃金属浴变性10 min。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,80 V电压电泳30 min,然后120 V电泳至溴酚蓝指示剂到达分离胶底部,100 V恒压80 min转移蛋白印迹至PVDF膜上。转印完的PVDF膜用5%脱脂牛奶溶液室温封闭2 h,加入一抗(抗体的稀释比见表2),4 ℃孵育过夜。TBST洗涤后,与二抗(鼠抗兔IgG 1∶5 000稀释)室温摇床孵育1 h,ECL试剂显色。以β-actin为内参。

表2 Western Blot中使用的抗体
1.3.7 Mito-Tracker Green染色 去除6孔板中细胞培养液,加入配制好37 ℃预温育的Mito-Tracker Green染色工作液,与细胞37 ℃共孵育30 min。孵育结束后,去除Mito-Tracker Green染色工作液,加入37 ℃预温育的新鲜细胞培养液,用倒置荧光显微镜进行观察。Mito-Tracker Green荧光强度定量分析使用Image J图像分析软件。
1.3.8 线粒体DNA拷贝数测定 将6孔板中培养的细胞处理为细胞悬液,使用基因组DNA提取试剂盒按照说明书方法提取细胞总DNA。通过RT-PCR检测脂肪细胞线粒体基因ND1与核糖体蛋白RPLP0的含量。mtDNA相对拷贝数由线粒体DNA与核DNA之比确定,按2-ΔCT法计算[16,5]。
1.3.9 细胞中ATP含量测定 收集细胞到离心管内,弃上清,按照ATP含量试剂盒说明书详细操作步骤进行测定。蛋白浓度用BCA蛋白分析试剂盒测定。最后以每毫克蛋白浓度校正ATP含量。
1.4 统计分析
采用Excel 2019对数据进行初步整理,所有结果以“平均值(mean)±标准误(SEM)”表示。数据使用SPSS 23.0软件先进行正态分布检验,符合正态分布后,使用One-way ANOVA分析不同亮氨酸浓度对细胞的影响,Duncan检验进行多重比较,独立样本T检验分析是否添加亮氨酸对细胞的影响。若不符合正态分布,使用非参数检验。P<0.05被认为具有显著性差异。使用GraphPad Prism软件8.0版进行图像绘制。
2 结 果
2.1 前体脂肪细胞的形态学观察及分化鉴定
如图2A所示,分离所得的黄牛前体脂肪细胞呈长梭型。分化过程中,细胞收缩,形态由梭形向圆形转变,部分细胞边缘出现明亮脂滴。如图2B所示,随着分化时间的推进,细胞内脂滴数量增加,小脂滴逐渐融合成大脂滴,并与亲脂染料油红O结合。

A.黄牛前体脂肪细胞形态学观察(100×);B.黄牛成熟脂肪细胞油红O染色(200×)
2.2 亮氨酸对脂肪细胞活力的影响
不同浓度亮氨酸对黄牛皮下脂肪细胞活力的影响如图3所示,与对照组相比,2和4 mmol·L-1亮氨酸添加显著增加了脂肪细胞的活力(P<0.05),其他浓度亮氨酸添加对脂肪细胞的活力无显著影响(P>0.05)。
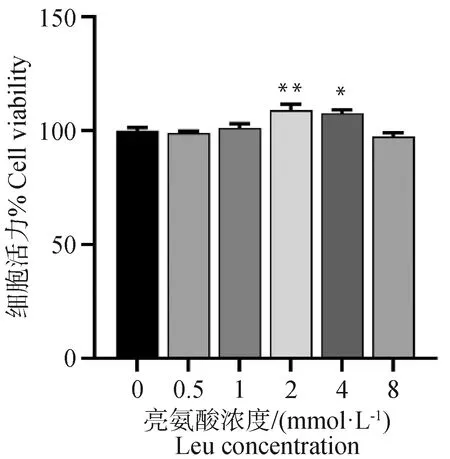
与对照组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01),下图同
2.3 亮氨酸对白色脂肪细胞棕色化标志因子的影响
脂肪细胞中棕色化标志基因的表达水平如图4所示,与对照组相比,2、4 mmol·L-1亮氨酸添加显著提高了脂肪细胞中UCP1的mRNA相对表达量(P<0.05),2、4、8 mmol·L-1亮氨酸添加极显著提高了脂肪细胞中PRDM16和TMEM26的mRNA相对表达量(P<0.01),4、8 mmol·L-1亮氨酸添加显著提高了脂肪细胞中Cited1和Cidea的mRNA相对表达量(P<0.05)。其中,4 mmol·L-1亮氨酸添加对UCP1的mRNA相对表达量影响最为显著,使其升高了5倍。因此选择用4 mmol·L-1亮氨酸进行后续试验。图5中,Western Blot结果也证明4 mmol·L-1亮氨酸添加极显著增加棕色化标志蛋白UCP1、CD137和SIRT1的蛋白表达量(P<0.01)。

图5 亮氨酸对白色脂肪细胞棕色化标志蛋白表达量的影响
2.4 亮氨酸对脂肪细胞线粒体含量的影响
亮氨酸添加处理3 d后,通过Mito-tracker Green对线粒体染色,荧光显微镜观察。如图6A所示,亮氨酸添加后细胞内的绿色荧光强度相比于CON组明显增强。荧光强度定量分析结果如图6B所示,Leu组的绿色荧光强度增强至CON组的1.57倍(P<0.01)。说明亮氨酸添加显著提高了细胞内线粒体数量。
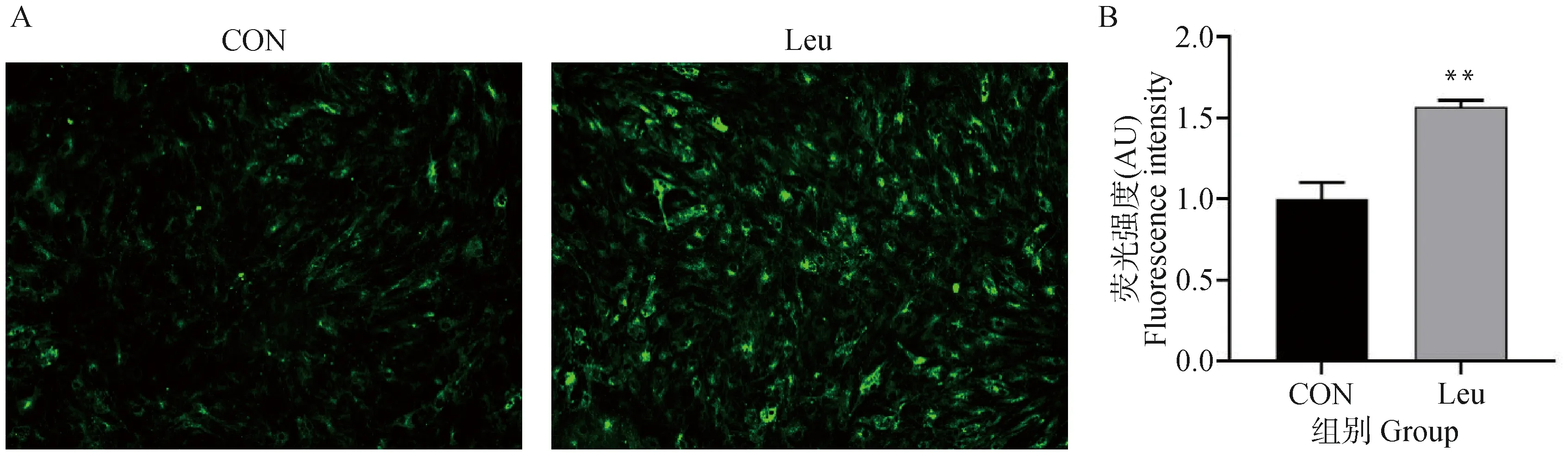
A.脂肪细胞内线粒体绿色荧光探针染色(100×);B.Image J软件分析荧光强度
2.5 亮氨酸对脂肪细胞线粒体生物合成和功能的影响
如图7所示,相比于CON组,亮氨酸添加极显著增加线粒体生物合成的关键基因SIRT1、TFAM、NRF1/2和Cytc的mRNA相对表达量(P<0.01),COX8b的mRNA相对表达量也呈现上调的趋势(P<0.1)。亮氨酸添加极显著增加了脂肪细胞内的mtDNA拷贝数(P<0.01),升高为CON组的1.24倍。此外,亮氨酸添加显著降低了细胞内ATP的含量(P<0.05)。
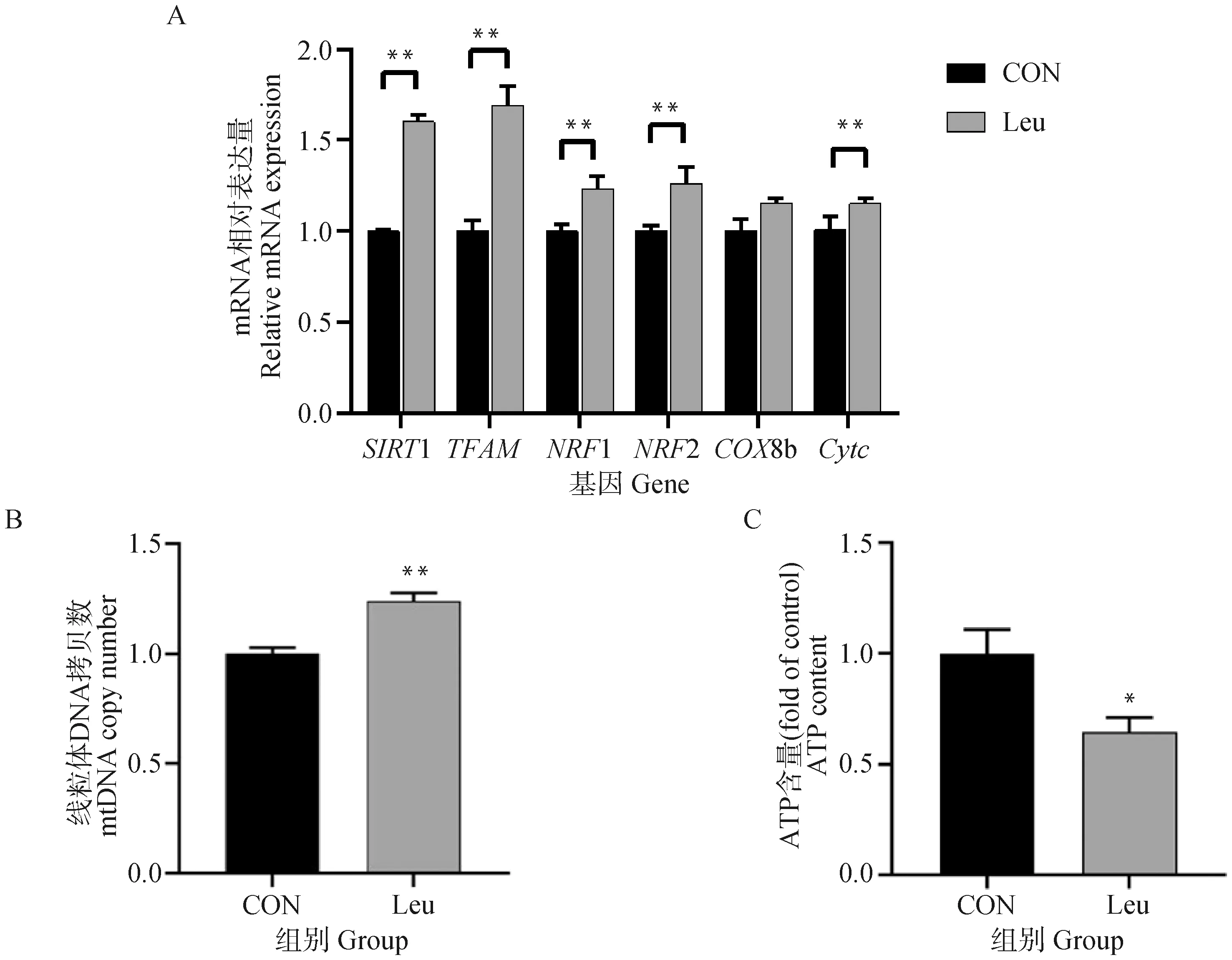
A.脂肪细胞线粒体生物合成基因的mRNA相对表达量;B.脂肪细胞线粒体DNA拷贝数的相对表达水平;C.细胞内ATP含量
2.6 亮氨酸对脂肪细胞脂滴形态和脂质积累的影响
在前体脂肪细胞分化的第9天,同时也是亮氨酸添加的第3天,对细胞进行油红O染色。结果如图8所示,亮氨酸添加后大脂滴数量减少,细胞内脂滴多呈小串珠样,呈环状分布,脂滴形态从大型单房向小型多房转变,符合棕色化脂肪细胞特征。染色后用异丙醇萃取油红O染料,检测脂肪细胞内甘油三酯的含量。亮氨酸添加后,脂肪细胞中甘油三酯含量降低为CON组的0.73倍(P<0.01)。
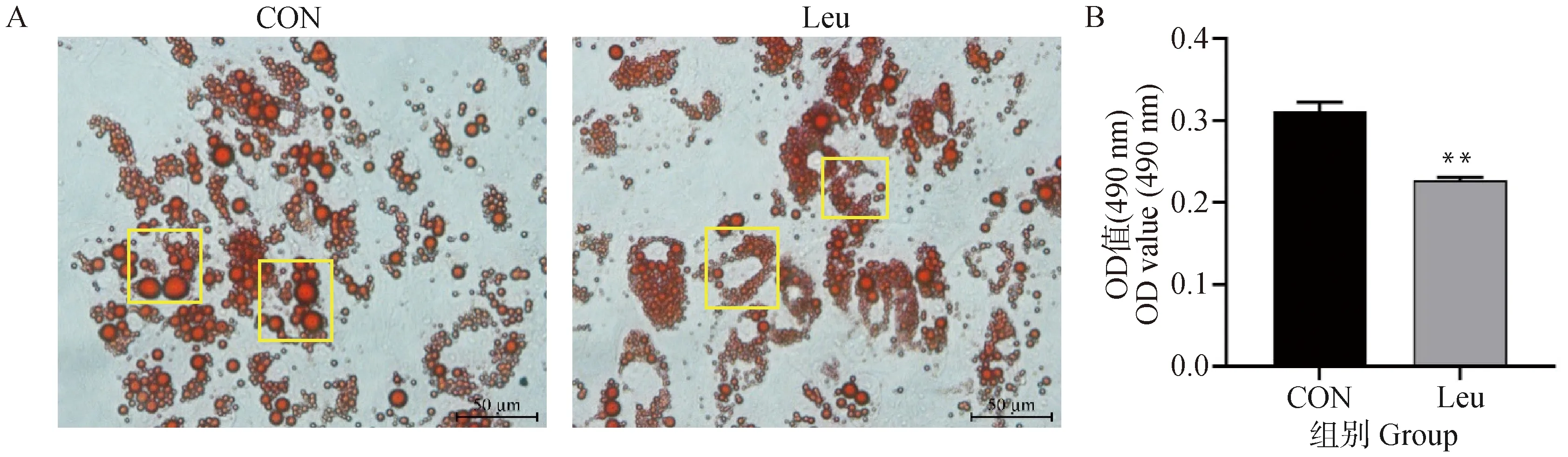
A.脂肪细胞油红O染色(400×);B.异丙醇萃取量化细胞内甘油三酯含量
2.7 亮氨酸对脂肪细胞脂质代谢关键基因的影响
如图9A所示,亮氨酸极显著上调了β氧化过程中关键酶PPARα、ACOX1和CPT1的mRNA相对表达量(P<0.01)。亮氨酸对脂肪细胞脂质代谢关键基因表达的影响如图9B所示。亮氨酸添加后,脂肪合成的关键酶ACC、FAS的mRNA相对表达量极显著降低(P<0.01)。脂肪分解的关键酶HSL、ATGL的mRNA相对表达量极显著增加(P<0.01)。结果表明,亮氨酸抑制脂肪合成,促进脂肪分解。
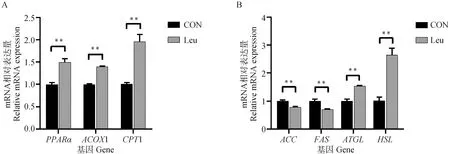
A.脂肪细胞脂肪酸β氧化基因的mRNA相对表达量;B.脂肪细胞脂肪合成和脂肪分解关键基因的mRNA相对表达量
2.8 亮氨酸对脂肪细胞AMPKα-PGC1α通路的影响
为了探究亮氨酸调控脂肪细胞棕色化和脂质代谢的机制,本试验检测了脂肪细胞AMPKα-PGC1α通路的基因和蛋白表达量。结果如图10所示,与CON组相比,亮氨酸极显著上调AMPKα1和PGC1α的mRNA 相对表达量(P<0.01);Western blot结果显示,相比于CON组,亮氨酸添加极显著上调p-AMPKα/AMPKα和PGC1α的蛋白表达量(P<0.01)。
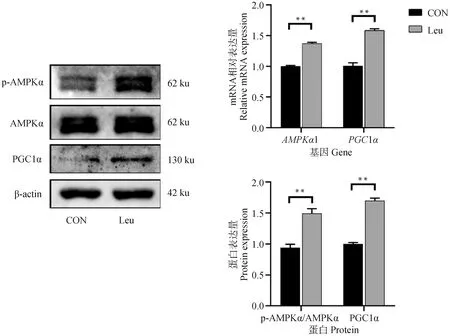
图10 亮氨酸对脂肪细胞脂肪AMPKα-PGC1α通路基因和蛋白表达的影响
3 讨 论
前体脂肪细胞呈“成纤维”样长梭形,本试验分离出的黄牛皮下前体脂肪细胞形态与之相符[17-18]。前体脂肪细胞变为成熟脂肪细胞必须经过分化的过程,未添加亮氨酸处理的分化过程中,前体脂肪细胞内的甘油三酯含量逐渐增加。油红O染料是一种强脂溶剂和染脂剂,能与细胞内甘油三酯结合,呈红色小脂滴状。本试验分离的细胞与前体脂肪细胞形态相符,诱导分化后出现大量与油红O染料结合的脂滴,说明成功分离黄牛皮下前体脂肪细胞且诱导分化成功。
线粒体内的解偶联蛋白UCP1的高表达是棕色脂肪细胞和被活化的米色脂肪细胞最显著的特征。区别于WA由Myf5-祖细胞发育而来,BA和肌细胞都来源于Myf5+祖细胞,在BA中,PRDM16的下调促使其转变为肌细胞[19]。PRDM16能驱动脂肪细胞内棕色化和产热基因程序性表达,被证实是棕色化的分子开关。TMEM26和CD137是米色脂肪细胞的标志性基因[20-21],CD137和TMEM26高表达的米色脂肪细胞伴随着UCP1、PRDM16基因表达水平的增加[6]。Cidea也被证实是具有产热能力的脂肪组织的标志物[22]。4 mmol·L-1亮氨酸显著提高棕色化标志基因和蛋白的表达,证明亮氨酸具有促进白色脂肪细胞棕色化的作用。
线粒体是细胞进行氧化代谢活动、制造并释放能量的细胞器,线粒体数量和活性的增加是白色脂肪细胞棕色化的重要特征,高线粒体含量促进BA的适应性产热能力增强[23-24]。但是细胞不会产生新的线粒体,而是通过线粒体生物合成刺激健康的线粒体增殖[25]。Sun和Zemel[25]证明,0.5 mmol·L-1亮氨酸使C2C12肌肉细胞和3T3-L1脂肪细胞线粒体含量分别增加30%和53%。Schnuck等[26]也证实2 mmol·L-1亮氨酸显著提高细胞内线粒体含量。本研究中,亮氨酸添加后脂肪细胞内的线粒体含量显著增加。线粒体生物合成和增强线粒体功能的核心是激活PGC1ɑ。PGC1ɑ是线粒体基因转录共激活因子,调控下游核呼吸因子1/2(NRF1/2)。线粒体转录因子A(TFAM)是调节线粒体基因组转录的主要转录因子,受NRF1/2的调控[27]。因此PGC1α能诱导线粒体生物合成。试验结果证明,亮氨酸显著促进SIRT1、TFAM和NRF1/2等基因的表达,促进细胞内线粒体生物合成。mtDNA拷贝数是mtDNA在线粒体基因组中的个数,是反映线粒体生物合成的重要标志物之一。mtDNA拷贝数的增加也证实亮氨酸促进细胞内线粒体生物合成。解偶联蛋白能消除细胞线粒体内膜两侧的H+浓度差,使氧化磷酸化与ATP生成过程解偶联,进而产生热能并影响ATP的生成[28]。本研究发现,亮氨酸诱导棕色化发生后,脂肪细胞内的ATP含量降低,与Zhang等[29]的研究结果一致。
棕色化发生后,脂肪细胞内脂滴形态发生相应变化,由单房大脂滴向多房小脂滴转变。Choi等[30,21]证实3T3-L1细胞棕色化后,小脂滴数量增加,并呈环状分布,甘油三酯含量显著降低。本试验发现,亮氨酸添加后脂肪细胞内的大脂滴数量减少,小脂滴数量增加,细胞内的甘油三酯含量也显著减少,说明亮氨酸促进了棕色化现象的发生。
在细胞内,甘油三酯的合成和分解一直处于动态平衡。饲料中额外补充亮氨酸,能够显著降低肥胖小鼠白色脂肪组织的重量和脂肪细胞体积,显著下调脂肪合成关键酶相关基因的表达,上调脂肪分解关键酶的基因表达[12]。杨江涛[31]也证明,亮氨酸显著降低分化中的3T3-L1细胞PLIN蛋白表达,进而激活HSL磷酸化,促进脂肪分解。本研究发现,亮氨酸抑制脂肪合成,促进脂肪分解。脂肪酸β氧化速率的提高也是棕色和活化的米色细胞的特征之一[32]。ACOX1是过氧化体脂肪酸β氧化途径中的第一个酶,CPT1介导脂肪酸进入线粒体的转运,二者都是脂肪酸β氧化的关键限速酶。ACOX1由PPARα激活,介导能量消耗增加[33]。亮氨酸显著促进脂肪酸β氧化关键酶的基因表达,促进细胞内脂肪酸β氧化。
AMPK是生物体内的重要能量代谢调节分子,Yang等[34]发现AMPKα1基因敲除小鼠显著抑制了UCP1和PRDM16等棕色化标志基因和蛋白的表达,严重影响棕色脂肪的大小和产热功能。Wu等[35]发现,AMPKα基因敲除小鼠棕色化基因表达量显著降低,线粒体数量降低66%。AMPKα激动剂剂量依赖性地提高脂肪细胞中产热基因的表达,并显著上调细胞UCP1和线粒体生物合成的主要共调节因子PGC1α的蛋白表达水平。脂肪组织中主要表达的AMPKα1亚型被证明参与白藜芦醇促进棕色脂肪细胞的形成和功能[36]。AMPKα作为PGC1ɑ的上游,也被确定为线粒体生物合成的主要调节因子[37]。因此,AMPK信号通路可刺激白色脂肪棕色化的发生,通过激活PGC1α促进白色脂肪细胞棕色化和线粒体生物合成。本研究发现,亮氨酸添加后p-AMPKα/AMPKα和PGC1α的蛋白表达量明显提高,提示亮氨酸可能通过AMPKα/PGC1α信号途径促进白色脂肪细胞棕色化。
4 结 论
亮氨酸能促使脂肪细胞大型单房形态脂滴向小型多房脂滴转变,诱导黄牛脂肪细胞棕色化,促进细胞线粒体生物合成,促进脂肪分解并抑制脂肪合成,减少细胞内脂质沉积,并上调p-AMPKα/AMPKα和PGC1α的蛋白表达量。

