姜黄素微胶囊的制备及其对小鼠腹泻干预效果的研究
冯慧渝,许瀛引,张志远,何晓兰,郭秀兰,彭卫红,
(1.成都大学食品与生物工程学院,四川成都 610106;2.四川省食用菌研究所,四川成都 610066)
姜黄素(Curcumin)是从姜黄根茎中提取出来的一种脂溶性多酚类化合物,呈橙黄色结晶粉末状,味稍苦[1]。研究发现,姜黄素在抗肿瘤、抗炎、抗氧化、清除自由基以及保护心血管系统等多方面有广泛的药理作用[2-5]。近年来研究还发现姜黄素对肠道黏膜有保护作用[6],能缓解伊立替康化疗导致的迟发性腹泻及其带来的肠道损伤[7]。虽然姜黄素具有多种生物活性,但其耐光性、耐热性、耐铁离子性较差,易被氧化,稳定性低,且姜黄素属于脂溶性成分,在水中的溶解度仅有0.6 μg/mL,极大地限制了姜黄素的应用[8]。姜黄素进入人体后,在体内代谢过程极快,很快被排出体外,难以发挥生理功效,导致生物利用度极低[9]。因此寻求一种方法来保护姜黄素,使其免受环境破坏,安全到达指定部位并增加其保留时间,达到缓释的目的很重要。
微胶囊技术是利用天然或合成的高分子材料对固体、液体或气体等核心物质进行包埋的技术[10],由于能起到保护芯材、控制芯材释放、增强芯材稳定性、提高芯材利用率等作用[11],已被广泛应用于医药、农药、食品、化妆品等多个行业领域。采用微胶囊包埋技术可以将姜黄素制备成微胶囊颗粒,不仅可以提高姜黄素在水中的溶解性和产品的稳定性,而且便于储运、应用范围也更加广阔。目前制备微胶囊的方法繁多,其中锐孔法因其设备简单、操作简便、投资少,所制得的微胶囊形态和粒径都较为均一等优势而备受关注[12]。但使用锐孔法制备姜黄素的研究较少,并且包埋率偏低。刘欣等[13]采用锐孔法以海藻酸钠和壳聚糖为壁材制备的姜黄素微囊,包埋率仅为60%,需要改进制备工艺。另外鲜少有 关于姜黄素微胶囊应用于腹泻的研究,因此探索包埋效果好且能用于腹泻治疗的姜黄素微胶囊配方和制备方法具有应用推广的研究价值。
本试验选用姜黄素、海藻酸钠、海绵胶煤炱菌多糖、吐温80 和CaCl2为原料,通过锐孔法制备姜黄素微胶囊,以成型效果和包埋率为主要考察指标,通过单因素和正交试验得到最佳制备工艺,并对制得的微胶囊进行形貌分析。首次采用动物模型探究了姜黄素微胶囊对小鼠腹泻的干预作用及其机制,为优化姜黄素微胶囊制备工艺及其干预腹泻的临床应用奠定了理论基础。
1 材料与方法
1.1 材料与仪器
姜黄素 纯度98%,西安圣青生物科技有限公司;吐温80 广东润华化工有限公司;无水氯化钙、无水乙醇 分析纯,成都市科隆化学品有限公司;羧甲基纤维素钠 食品级,同发食化商行有限公司;番泻叶 毫州市谯城区康美中药城;海绵胶煤炱菌由四川省宜宾市竹海镇提供;ELISA 试剂盒(IL-6、TNF-α、IL-1β、IL-10) 江苏酶免实业有限公司;试剂盒(DAO、D-乳酸、SOD、MDA) 南京建成生物工程研究所;蛋白抽提试剂盒 上海碧云天生物技术有限公司;SPF 级C57BL/6J 雄性小鼠 体重18~22 g,6~7 周龄,成都达硕实验动物有限公司,实验动物合格证号:SCXK(川)2020-030,动物实验经成都大学伦理委员会批准(批准号20180412)。
B-395 Pro 型微胶囊造粒仪、L-200 Pro 型冷冻干燥机 BUCHI 公司;AH-NANO 型均质机 安拓思纳米技术(苏州)有限公司;WB-2000 型水浴锅郑州长城科工贸有限公司;SB-5200DT 型超声波清洗机 宁波新芝生物科技股份有限公司;SPECORD 210 PLUS 型分光光度计 Analytikjena 公司;SD-90 型离子溅射仪 北京博远微纳科技有限公司;FlexSEM 1000 型扫描电镜 HITACHI 公司;JXFST PRP-CL 型冷冻研磨仪 上海净信实业发展有限公司;ST16R 型高速冷冻离心机、Micro21R 型高速冷冻离心机、Multiskan GO 型全波长酶标仪 赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 海绵胶煤炱菌多糖的制备 将海绵胶煤炱菌鲜样粉碎,以1:11 的料液比加入纯水,然后在100 ℃热水浴浸提20 min,8000 r/min 离心20 min 收集上清液,添加3 倍上清液体积的98%乙醇,搅拌均匀后静置过夜,8000 r/min 离心20 min 后收集沉淀物,烘箱40 ℃烘干后得到海绵胶煤炱菌多糖,经硫酸苯酚法检测多糖含量为92.16%。
1.2.2 微胶囊的制备步骤 a.壁材溶液的配制:称取一定质量的海藻酸钠和海绵胶煤炱菌多糖于烧杯中,加入蒸馏水充分搅拌至溶解,在50 ℃恒温条件下保温4 h,使海藻酸钠完全吸水溶胀后备用;b.芯材和壁材混合液的配制:将乳化剂吐温80 加入壁材溶液中混匀,再称量一定量的姜黄素固体粉末加入壁材溶液中充分搅拌,在25 ℃条件下超声2 min 混匀;c.乳液的制备:在4 ℃条件下,将混合液倒入高压均质机中均质,压力为330 bar,每100 mL 单次均质5 min;d.凝固液的配制:配制不同质量分数的CaCl2溶液,冷却到室温,备用;e.造粒:利用微胶囊造粒仪将乳液缓慢滴入凝固液(CaCl2溶液)中,形成微胶囊。其中凝固液的体积为混合乳液体积的三倍,参数设置分别为喷嘴孔径200 μm,流速7 mL/min,频率1200 Hz,电压700 mV,搅拌速度30%;f.包埋、干燥:将微胶囊在室温条件下搅拌包埋一定时间,分离出微胶囊,用清水洗去微胶囊表面残留的CaCl2,置于-50 ℃,0.5 mbar 条件下冷冻干燥72 h,即得姜黄素微胶囊产品。
1.2.3 单因素实验 单因素实验在姜黄素质量分数0.3%、海绵胶煤炱菌多糖的质量分数0.15%、海藻酸钠质量分数1.5%、CaCl2质量分数2.0%、吐温80 体积分数0.5%、包埋时间1 h 的基础上,依次变换相应的因素水平来开展实验。选择海藻酸钠质量分数分别为0.5%、1.0%、1.5%、2.0%、2.5%;CaCl2质量分数分别为0.5%、1.0%、1.5%、2.0%、2.5%;包埋时间分别为0、0.5、1.0、1.5、2.0 h;海绵胶煤炱菌多糖质量分数分别为0.05%、0.1%、0.15%、0.2%、0.25%;姜黄素质量分数分别为0.2%、0.3%、0.4%、0.5%、0.6%;吐温80 体积分数分别为0.1%、0.3%、0.5%、0.7%、0.9%,进行单因素实验。按上述条件制备姜黄素微胶囊,考察各因素对微胶囊包埋率的影响。
1.2.4 正交优化试验 在单因素实验的基础上,采用正交试验对姜黄素微胶囊工艺进一步优化,考察A(海藻酸钠质量分数)、B(姜黄素质量分数)对微胶囊制备的影响,选择L9(34)正交试验,因素水平如表1所示。
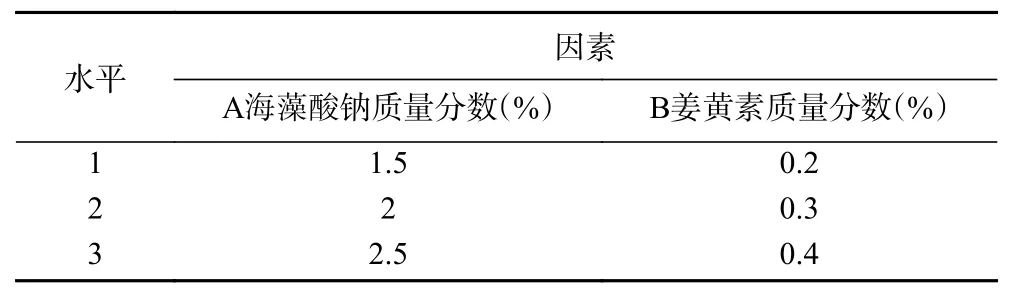
表1 L9(34)正交试验因素水平表Table 1 Factors and levels of L9(34) orthogonal experiment
1.2.5 姜黄素的测定
1.2.5.1 姜黄素标准曲线的绘制 参考高凤苑等[14]方法,称取10.0 mg 姜黄素置于烧杯中,用无水乙醇溶解后转移到100 mL 容量瓶中,再用无水乙醇进行定容,得到100 μg/mL 的储备液。分别移取2、3、4、5、6 mL 储备液到100 mL 的容量瓶中,用无水乙醇进行定容,制成2~6 μg/mL 系列标准溶液。用无水乙醇做空白对照,分别在425 nm 处测定其吸光度。以浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。姜黄素溶液在425 nm 处的回归方程为y=0.163x-0.0006,R2=0.9999>0.99,姜黄素在2~6 μg/mL 范围内具有可行度和良好的线性关系。
1.2.5.2 样品中姜黄素的测定 微胶囊产品中总姜黄素含量测定:参考吴玲玲等[15]方法,准确称取0.01 g姜黄素微胶囊,加入1.5 mL 无水乙醇,放入冷冻研磨机,-20 ℃条件下研磨5 min,使姜黄素微胶囊完全破碎,再加入少量蒸馏水,搅拌,超声10 min,使姜黄素完全溶解,离心后取上清液。用适量蒸馏水反复洗涤残渣,过滤收集洗涤液,定容稀释至合适浓度,用无水乙醇做空白对照,在425 nm 处测定其吸光度,然后根据标准曲线计算姜黄素的含量。
微胶囊产品表面姜黄素含量测定:准确称取0.01 g 姜黄素微胶囊,加入少量无水乙醇,充分搅拌,使微胶囊表面的姜黄素完全溶解在无水乙醇中,离心后取上清液。用适量无水乙醇反复洗涤残渣,过滤收集洗涤液,定容稀释至合适浓度,用无水乙醇做空白对照,在425 nm 处测定其吸光度,然后根据标准曲线计算姜黄素的含量。
1.2.6 微胶囊包埋率的计算 微胶囊包埋率的计算公式为[13]:
式中:ER 为包埋率,W1-为微胶囊产品总姜黄素的质量,W2-为微胶囊产品表面姜黄素的质量。
1.2.7 微胶囊载药量的测定 微胶囊载药量计算公式为[16]:
式中:m1-微囊中姜黄素的质量,m2-所称微囊样品的质量。
1.2.8 微胶囊的微观形态观察 使用扫描电子显微镜观察未包埋姜黄素的空白微胶囊和姜黄素微胶囊的微观形态。在观察之前,用金溅射涂覆姜黄素微胶囊30 s,再放入电镜中观察,观察条件设置为20 kV,放大倍数为300 倍。
1.2.9 腹泻试验
1.2.9.1 造模试剂制备 番泻叶煎剂的制备:参考玄静等[17]的方法稍作调整:取番泻叶40 g,加水400 mL煎煮2 次,每次20 min,纱布过滤,滤液水浴浓缩至100 mL,即0.4 g·mL-1番泻叶煎剂,4 ℃保存,用前水浴加热至25 ℃。
造模剂量设置说明:预实验中小鼠体重约为22 g,每只灌胃番泻叶煎剂0.4 mL,该浓度下小鼠腹泻率为100%,腹泻指数稳定且无死亡,与未灌胃的正常小鼠腹泻指数形成显著差异,以预实验为依据确定番泻叶煎剂的小鼠灌胃量为18.18 mL/kg。
姜黄素乳液的制备:取一定量的姜黄素,使用1%羧甲基纤维素钠溶液配制(除了未进行包埋以外,成分和配制方法与微胶囊一致)为1.028 mg/mL的姜黄素溶液。
姜黄素微胶囊混悬液的制备:取一定量的姜黄素微胶囊,使用1%羧甲基纤维素钠溶液配制为5、10 mg/mL 的姜黄素微胶囊混悬液。
1.2.9.2 动物分组 40 只小鼠在SPF 环境下适应性饲养7 d,温度为25 ℃,湿度为60%,光照与黑暗时间各12 h,期间小鼠自由饮食与饮水。随机分为正常组(Normal)、腹泻组(Control)、非微胶囊组(Non-Microcap)、低浓度微胶囊组(L-Microcap)、高浓度微胶囊组(H-Microcap),每组8 只。分组说明:根据前期预实验确定姜黄素微胶囊的灌胃量,以微胶囊载药量为20.56%计算姜黄素的含量,非微胶囊组和低浓度姜黄素微胶囊组姜黄素含量一致;高浓度姜黄素微胶囊组的姜黄素含量为低浓度姜黄素微胶囊组的姜黄素含量的两倍,以探究微胶囊的最适使用量。由于使用1%羧甲基纤维素钠溶液来制备姜黄素微胶囊混悬液,正常组后续灌胃1%羧甲基纤维素钠溶液作为对照。
1.2.9.3 造模及处理方法 实验前12 h 禁食不禁水,第1~3 d 除正常组按体重灌胃18.18 mL/kg 的蒸馏水外,其余组每天每只小鼠按体重灌胃18.18 mL/kg 番泻叶煎剂,期间正常自由饮食。第4~6 d 正常组灌胃18.18 mL/kg 的蒸馏水、其余组小鼠灌胃18.18 mL/kg的番泻叶煎剂1 h 后,正常组和腹泻组按体质量灌胃18.18 mL/kg 的羧甲基纤维素钠,非微胶组按体质量灌胃18.18 mL/kg 姜黄素乳液,微胶囊组小鼠按体重灌胃18.18 mL/kg 微胶囊混悬液。灌胃结束后,把小鼠置于有垫纸的小鼠笼内,每笼1 只,每隔1 h 换一次垫纸,连续观察6 h。6 h 内观察粪便,不成形或稀便且滤纸上有污迹者,视为造模成功。以稀便率(LSIR)、稀便级(ALSG)、腹泻指数(DI)、腹泻率为腹泻指标,观察并记录连续6 h 内各小鼠的总排便次数、稀便数、稀便级、小鼠腹泻数,统计相关腹泻指标。
1.2.9.4 指标测定 观察指标:参考文献[18]。a.腹泻率:一组动物中排稀便的动物数与该组动物总数之百分比。b.稀便率(LSIR):每只动物所排的稀便数与总便数之比。c.稀便级(ALSG):表示稀便的程度,以稀便污染滤纸形成污迹面积的大小定级,分为4 级,标准表2。统计时先逐个统计每一堆稀便的级数,然后将该鼠所有稀便级数相加除以稀便次数得稀便的平均级数,简称稀便级。d.腹泻指数(DI):稀便率与稀便级的乘积。
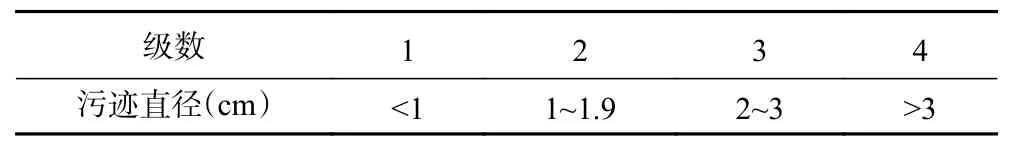
表2 稀便等级表Table 2 Loose stool scale
检测指标:第6 d 最后一次观察结束后,立即将小鼠麻醉处死后腹腔动脉取血,将全血4 ℃静置30 min 后,3000 r/min,4 ℃离心10 min,上清即为血清,4 ℃保存,用于炎症指标IL-6、TNF-α、IL-1β、IL-10、DAO、D-乳酸检测,具体检测方法参照试剂盒说明书。将小鼠空肠取出后按重量1:9 加缓冲液进行匀浆,用于检测SOD 和MDA,具体检测方法参照试剂盒说明书。采用碧云天蛋白抽提试剂盒对空肠蛋白抽提,通过BCA 浓度测定后用于Western blot 测定。取蛋白上样进行SDS-PAGE 电泳,电泳结束后随即转膜(湿转),洗涤,染色脱色、洗涤、孵育一抗、二抗、洗涤、曝光显影等步骤,得到蛋白p-Nrf2、HO-1、NQO1、Keap1、Occludin、Claudin-1、ZO-2、TRL4、IRAK1、Myd88、TRAF6、NF-κB 相对表达量。
1.3 数据处理
使用 SPSS 22.0、Origin 2018 和 Excel 2016 等对试验数据进行分析,每组实验三次平行,实验数据表示为均值±标准差。
2 结果与分析
2.1 单因素实验
2.1.1 海藻酸钠质量分数对微胶囊化效果的影响由图1A 可知,随着海藻酸钠浓度的增加,溶液的粘稠度增加,形成的微囊硬度变大,包埋率呈上升趋势,当海藻酸钠浓度达到1.5%以后缓慢增加。在实际操作中,海藻酸钠浓度低于1.5%时,形成的微囊质地软、流动性大、容易破裂,冻干后呈块状粘连严重,无法形成单独的微胶囊颗粒。海藻酸钠浓度大于2.0%,仪器造粒较困难,浓度大于2.5%,无法通过锐孔,不能造粒。所以后续正交试验海藻酸钠浓度选择1.5%、2.0%、2.5%作为试验水平。
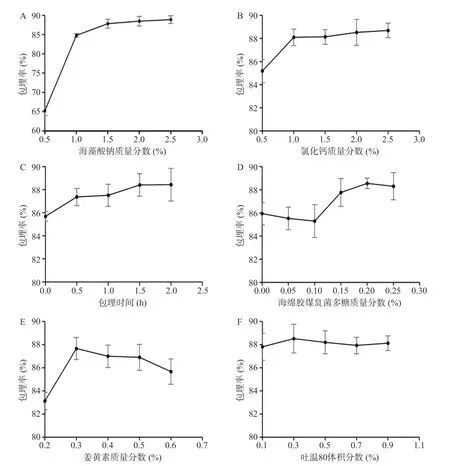
图1 各因素对包埋率的影响Fig.1 Effects of various factors on microencapsulation efficiency
2.1.2 CaCl2质量分数对微胶囊化效果的影响 由图1B 可知,当CaCl2浓度小于1%时,钙离子与海藻酸钠交联反应不完全、影响了微胶囊的形成,导致包埋率偏低。随着氯化钙浓度的增加,包埋率呈上升趋势,浓度达到1.0%以后缓慢增加,到达2.0%以后基本保持稳定。当CaCl2浓度大于2%时,微囊膜增厚且颗粒增大,并且成品有涩味。最终确定CaCl2质量分数为2.0%,在正交试验中不再将其列为试验因素。
2.1.3 包埋时间对微胶囊化效果的影响 由图1C可知,当包埋时间小于0.5 h 时,钙离子与海藻酸钠还未充分发生交联反应,导致包埋率偏低。随着包埋时间的增加,包埋率呈上升趋势,到达1.5 h 以后基本保持稳定。由于对包埋率影响不明显,且为保证制备效率,最终确定包埋时间为1.5 h,在正交试验中不再将其列为试验因素。
2.1.4 海绵胶煤炱菌多糖质量分数对微胶囊化效果的影响 由图1D 可知,随着多糖浓度的增加,包埋率呈现先下降后上升的趋势,当多糖浓度为0.15%时,包埋率大于未添加多糖的包埋率。并且随着多糖浓度的增加,溶液黏度增大,浓度大于0.15%时,仪器造粒困难,因此在实际操作中选择0.15%为最终浓度,在正交试验中不再将其列为试验因素。
2.1.5 姜黄素质量分数对微胶囊化效果的影响 由图1E 可知,随着芯材含量的增加,包埋率也随之增加。当姜黄素含量在0.3%左右时,微胶囊的成型效果和包埋率都较好。此后,由于芯材增加,通过湿微胶囊状态在体视显微镜下观察到芯材逐渐充满微胶囊内部,壁材不能将姜黄素完全包埋,部分姜黄素暴露在壁材表面,且壁材在溶液中所占百分比的减少使得形成的微胶囊膜较薄,质地硬度有所下降,不能包埋内部的姜黄素,导致包埋率明显下降。综上所述,姜黄素浓度在0.2%~0.4%范围内较适宜。
2.1.6 吐温80 体积分数对微胶囊化效果的影响 姜黄素为脂溶性物质,加入乳化剂吐温80 以后,能使姜黄素溶于壁材溶液中形成混合乳液,并且能使微胶囊造粒相对容易。由图1F 可知,吐温80 的添加量为0.3%时,包埋率达到最高,0.5%以后基本持平,由于对包埋率影响不明显,在正交试验中不再将其列为试验因素。
2.2 正交优化试验
根据单因素实验结果,确定包埋时间为1.5 h、CaCl2质量分数2.0%、海绵胶煤炱菌多糖质量分数0.15%、吐温80 体积分数0.3%,采用正交试验对姜黄素微胶囊工艺进一步优化,考察 A(海藻酸钠质量分数)、B(姜黄素质量分数)对微胶囊包埋率的影响,设计L9(34)正交试验。正交试验结果及极差分析见表3。
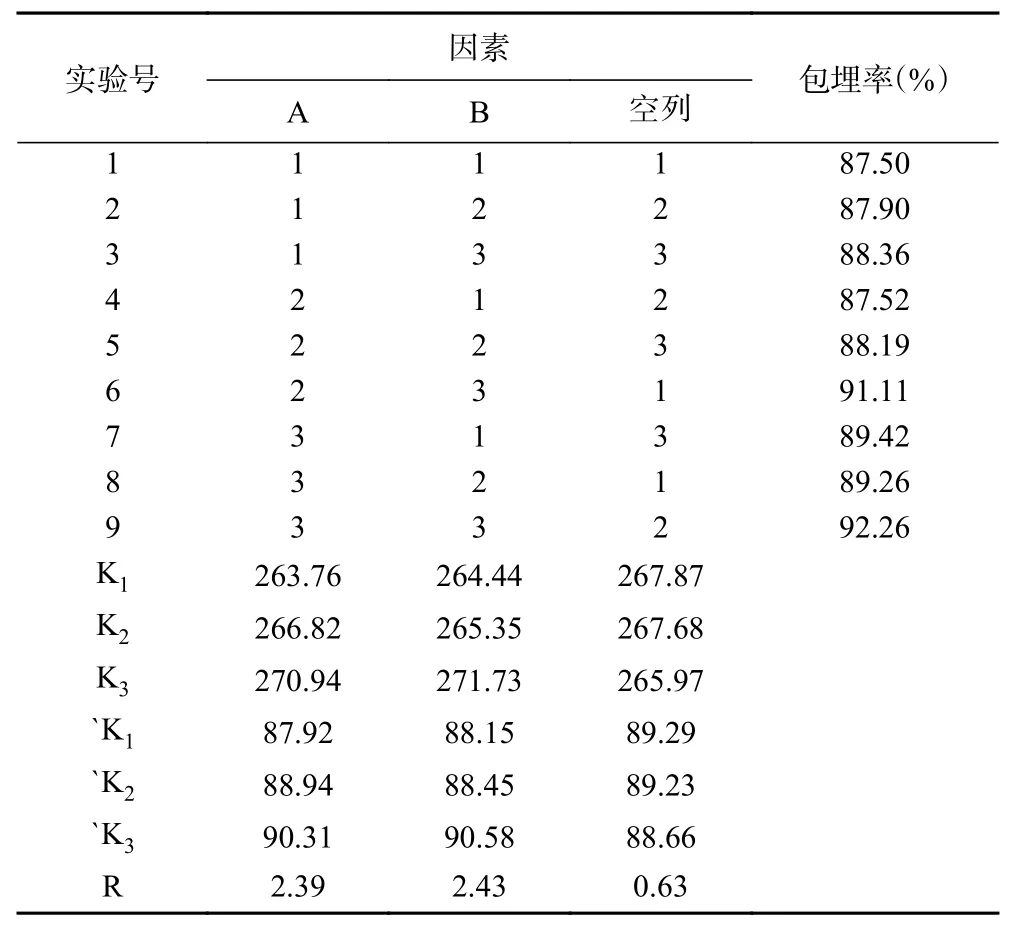
表3 正交试验结果及极差分析Table 3 Orthogonal experiment results and analysis of range
由表3 可知,A3B3组的包埋率最高,为92.26%。RB(2.43)>RA(2.39),各因素对制备姜黄素微胶囊包埋率影响的主次顺序为:B>A,即姜黄素质量分数>海藻酸钠质量分数。且各因素R 值均大于空列R 值,表示各因素水平效应存在差异,该模型可信。由K 值大小判断锐孔法制备姜黄素微胶囊的最佳工艺条件组合为:A3B3。
所以制备姜黄素微胶囊的最佳条件是:海藻酸钠浓度2.5%,姜黄素质量分数0.4%,包埋时间为1.5 h、CaCl2质量分数2.0%、海绵胶煤炱菌多糖质量分数0.15%、吐温80 体积分数0.3%,此时产品包埋率可达92.26%,载药量为20.56%,且该条件下微胶囊易成型,质地较硬,制备效果好。
2.3 微胶囊的形态表征
由图2 可知,制备出的姜黄素微胶囊产品结构完整,表面凹凸不平,颗粒饱满,多数呈球形,表面的褶皱是锐孔法微胶囊的特征,主要是因为干燥后失去水分造成聚缩[19]。而未包埋姜黄素的空白微胶囊表面结构致密,无凸起,较扁平,与包埋姜黄素的微胶囊形态形成鲜明对比,表明该法能够有效将姜黄素进行包埋。
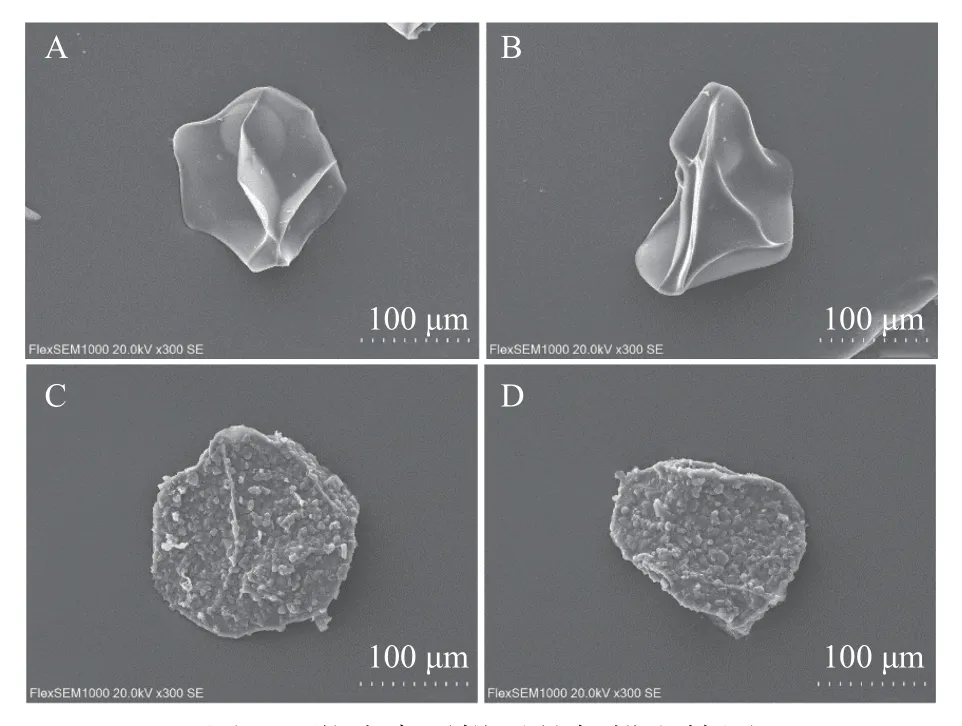
图2 微胶囊干燥后的扫描电镜图Fig.2 SEM of posterior drying microcapsules
2.4 姜黄素微胶囊降低小鼠腹泻指数
经番泻叶灌胃后,腹泻组、非微胶囊组、低浓度微胶囊组、高浓度微胶囊组小鼠均出现稳定的腹泻现象,腹泻率与正常组形成明显差异,说明造模成功。由表4 可知,随着时间推移小鼠的腹泻指数逐步下降可能是因为小鼠机体渐渐适应了番泻叶的刺激。非胶囊组小鼠虽然腹泻指数逐步下降,从75.03±7.79 下降至50.09±7.91,但与腹泻组相比不构成显著差异(P>0.05),说明非胶囊组处理无法有效干预腹泻。灌胃微胶囊后,小鼠腹泻均呈现显著下降趋势(P<0.05),至第6 d 时,低浓度微胶囊组腹泻指数降至51.62±6.89,高浓度微胶囊组小鼠腹泻指数下降至41.71±6.09,其中高浓度微胶囊组小鼠腹泻指数下降更明显,说明微胶囊工艺使得各组分联合作用能够达到干预小鼠腹泻的目的,且高剂量组效果更好。
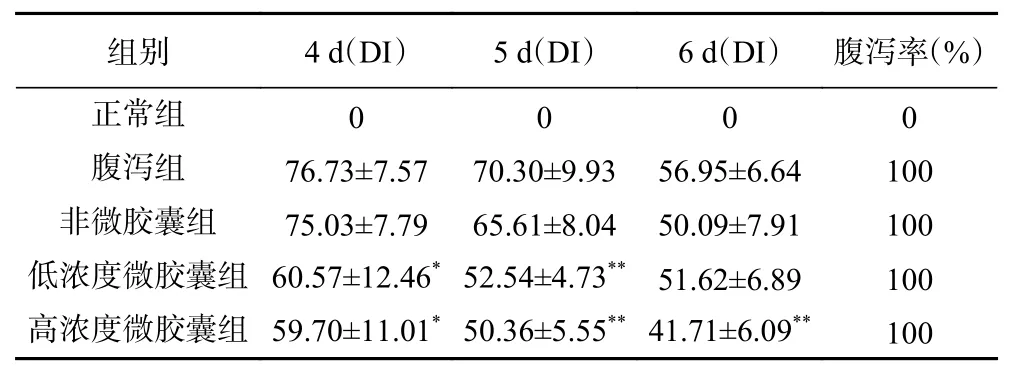
表4 药物干预后五组小鼠腹泻指数(DI)及腹泻率变化Table 4 Changes of diarrhea index (DI) and diarrhea rate in five groups of mice after drug intervention
2.5 姜黄素微胶囊提高腹泻小鼠抗氧化能力
检测小鼠肠组织匀浆中SOD 活力和MDA 含量,SOD 活力的高低间接反映机体清除氧自由基的能力,而MDA 的高低间接反映机体细胞受自由基攻击的严重程度[20]。由表5 可知,小鼠腹泻后,SOD 活力显著下降(P<0.05),机体脂质过氧化程度加深,MDA 含量升高,说明机体清除自由基能力下降。经非微胶囊组和微胶囊组分别处理后,机体清除自由基能力有不同程度提升,其中,高浓度微胶囊提升程度最高,SOD 含量提升至9.24±0.97 U/mgprot,MDA降至5.41±0.65 nmol/mgprot,其次是低浓度微胶囊和非微胶囊组。相比非微胶囊组,经过微胶囊包埋工艺后,姜黄素乳液的抗氧化能力明显上升。虽然进行干预治疗后非微胶囊组、低浓度微胶囊组、高浓度微胶囊组小鼠抗氧化能力未能恢复至正常组小鼠水平,但相比于腹泻组小鼠机体清除自由基能力已产生大幅度回升。

表5 小鼠肠组织SOD 和MDA 值Table 5 Value of SOD and MDA in intestinal tissue of mice
2.6 姜黄素微胶囊提高腹泻小鼠抗炎症能力
细胞因子是肠道免疫调控中的关键信号,包括促炎因子和抗炎因子。关键的促炎因子是白介素6(IL-6)、肿瘤坏死因子(TNF-α)和白介素1β(IL-1β)。抗炎因子白介素10(IL-10)参与炎症和免疫抑制[21-22]。小鼠腹泻后,由图3 可知,血清中促炎因子IL-6、IL-1β和TNF-α分别显著升高至114.07±6.55、75.71±2.44、900.58±45.33 pg/mL(P<0.05),抗炎因子IL-10 显著下降至919.46±124.40 pg/mL(P<0.05),说明腹泻引起了机体炎症反应(图3D)。非微胶囊组血清中促炎因子IL-6 和IL-1β下降可能与样品成分中含有抗炎作用的姜黄素和海绵胶煤炱菌多糖有关。高剂量组微胶囊灌胃后小鼠血清中IL-6、IL-1β和TNF-α分别显著降低至79.71±6.10、56.27±5.83、596.98±43.17pg/mL(P<0.05),IL-10 显著升高至1147.75±124.68 pg/mL(P<0.05),表明高剂量微胶囊能够有效降低机体炎症指标。
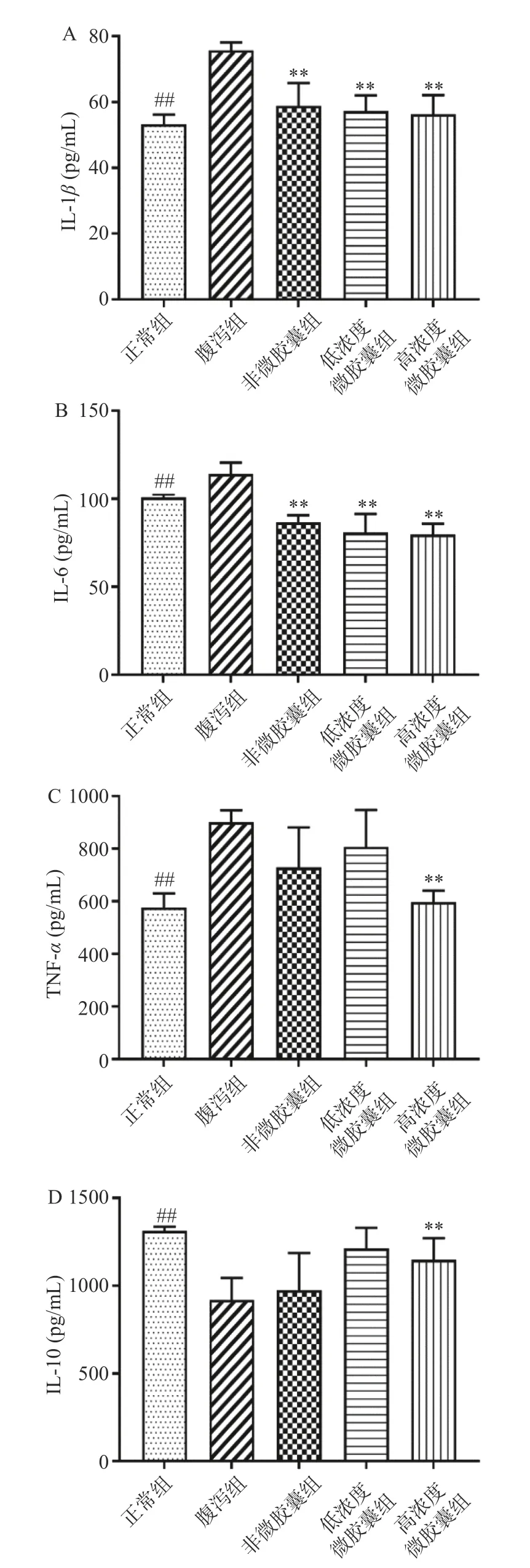
图3 小鼠血清中炎症指标Fig.3 Inflammatory indicators in mice serum
2.7 姜黄素微胶囊对腹泻小鼠肠道屏障的保护作用
一定程度腹泻会影响肠粘膜屏障功能,血清中二胺氧化酶(DAO)、D-乳酸(D-Lactate)水平能够有效评价肠道功能损伤情况,反映肠机械屏障功能,DAO 和D-乳酸血清中含量越高,肠道功能损伤情况越严重[23]。经腹泻造模后,腹泻组小鼠与正常组小鼠相比,血清DAO 含量显著上升至72.25±4.15 U/L(P<0.05),说明腹泻已经一定程度损伤了小鼠肠道屏障(图4A),高剂量的微胶囊有效抑制了DAO 在血清中释放,DAO 显著降至48.82±5.69 U/L(P<0.05),缓解小鼠肠道屏障损伤。由于血清中D-乳酸是由肠道菌群无氧代谢葡萄糖形成的,除了肠道屏障受损影响血清中D-乳酸含量之外,肠道菌群的微生态平衡也影响D-乳酸含量[24]。血清中D-乳酸含量在各个实验组间并没有产生显著差异(P>0.05)(图4B),这可能跟小鼠肠道菌群状态有关,因此无法直接说明肠道屏障是否受损。
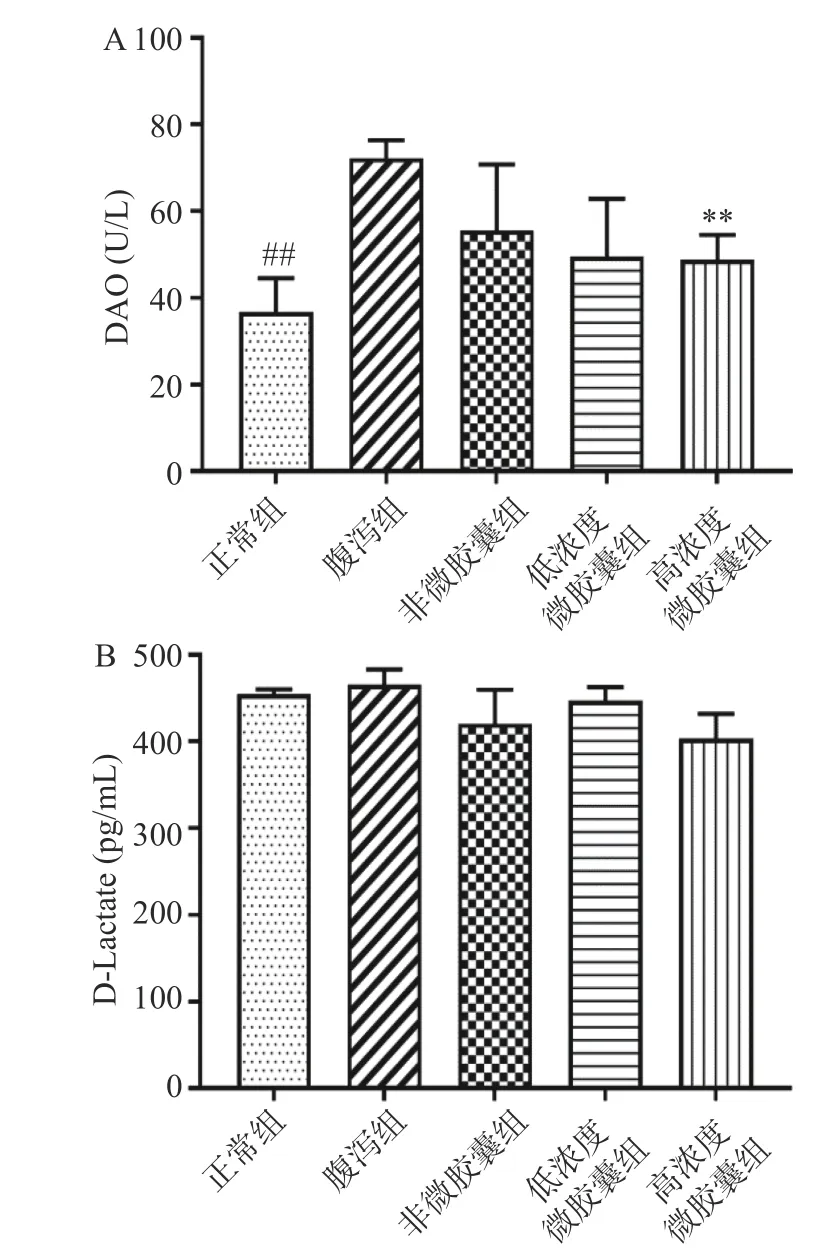
图4 小鼠肠道屏障功能指标Fig.4 Index of intestinal barrier function in mice
2.8 姜黄素微胶囊对腹泻小鼠的干预机制
机体为了控制活性氧诱导自由基链反应,形成了一套复杂的抗氧化防御体系,其中包括核因子NFE2 相关因子(Nuclear factor-erythroid 2-related factor2,Nrf2)[25]。小鼠腹泻后,p-Nrf2 表达下调,经过高剂量微胶囊灌胃后能够显著恢复小鼠p-Nrf2 表达活性(P<0.05)(图5B),结合SOD 和MDA 结果,高剂量微胶囊提升机体抗氧化能力的效果最好,证明了高剂量微胶囊通过上调Nrf2 蛋白表达提升机体氧化应激能力的作用。醌氧化还原酶1(NAD(P)HN:quinone oxidoreductase 1,NQO1)通过维持泛醌和α-生育酚醌的还原形式保护内源性抗氧化剂,而Nrf2 是NQO1表达的中心控制因子[26]。血红素氧合酶1(Heme Oxygenase-1,HO-1)主要催化血红素分解,位于Nrf2下游,是一种重要的抗氧化酶[27]。各实验组对蛋白NQO1 和HO-1 没有显著影响(P>0.05)可能是由于此类腹泻模型与灌胃样品不通过醌类和催化血红素影响抗氧化作用(图5C、图5E)。Kelch 样环氧氯丙烷相关蛋白-1(Keap)可与Nrf2 结合从而负调控Nrf2 转录活性[28]。各实验组对蛋白Keap-1 没有显著影响(P>0.05),可能是因为Keap1 只是Nrf2 的结合位点之一,微胶囊样品可能通过其他结合方式激活Nrf2 调节机体氧化应激功能,还需进一步实验探究(图5D)。
图5 小鼠肠道Nrf2 信号通路相关蛋白表达丰度Fig.5 Abundances of the intestinal Nrf2 signaling pathway-related proteins in mice
肠道氧化应激会通过多种途径破坏肠上皮细胞间的紧密连接状态,导致肠上皮屏障功能受损和肠道通透性增加,提升氧化应激能力也是维持机体肠道屏障的重要途径[29]。紧密连接蛋白是肠道机械屏障的基础结构,包括跨膜蛋白Occludin 和Claudin,以及细胞质蛋白ZO-2 等,用于维持肠道细胞旁通透性,防止大分子有毒物质通过细胞旁连接入侵机体[30-31]。小鼠腹泻后,ZO-2 表达显著下降(P<0.05),经非微胶囊和微胶囊样品灌胃后,ZO-2 表达量有效回复,说明非微胶囊和微胶囊样品成分对紧密连接蛋白均能起一定作用(图6C)。实验组对跨膜蛋白occludin 和claudin没有显著作用(P>0.05)(图6A、图6B),可能是因为番泻叶诱导的腹泻模型主要细胞内紧密连接蛋白ZO-2 起作用,姜黄素微胶囊也是通过细胞内ZO-2 起到恢复肠道屏障的作用[32]。结合高剂量微胶囊对DAO的抑制作用,表明高剂量微胶囊能一定程度改善小鼠肠道细胞质紧密连接蛋白,干预DAO 释放至血清。
图6 小鼠肠组织紧密连接蛋白表达丰度Fig.6 Abundances of the intestinal tight junction proteins in mice
Toll 样受体4(TLR4)在肠道中可特异性识别病原体相关分子模式和损伤相关分子模式[33]。MyD88、IRAK1、TRAF6、p-NF-κB 是TLR4 信号通路下游分子,其中NF-κB 是调控促炎因子产生的重要核转录因子[34]。小鼠腹泻后TLR4 和p-NF-κB 表达显著上调(P<0.05),高浓度微胶囊有效降低TLR4、MyD88、p-NF-κB 表达活性(图7),这与炎症指标检测结果一致,而实验组对IRAK1 和TRAF6 没有显著作用(P>0.05),表明微胶囊样品是通过TLR4/NF-κB 通路抑制炎症因子释放,调控腹泻小鼠炎症反应。
图7 小鼠肠组织Toll 样受体4(TRL4)信号通路相关蛋白表达丰度Fig.7 Abundances of the intestinal Toll-like receptor 4 (TLR4) signaling pathway-related proteins in mice
3 结论
本研究采用单因素变量法结合正交试验确定了锐孔法制备姜黄素微胶囊的最佳工艺条件,海藻酸钠、海绵胶煤炱菌多糖、姜黄素、吐温80、CaCl2浓度分别为2.5%、0.15%、0.4%、0.3%、2.0%,包埋时间1.5 h,此条件下制备的姜黄素微胶囊包埋率高达92.26%。制备出的姜黄素微胶囊产品结构完整,颗粒饱满。
采用灌胃番泻叶诱导的腹泻小鼠模型来检测姜黄素微胶囊的作用效果。试验结果表明工艺优化后的姜黄素微胶囊能通过TRL4/NF-κB 通路提升机体氧化应激能力,降低促炎因子IL-1β、TNF-α、IL-6 并促进抗炎因子IL-10 释放;通过Nrf2 信号通路提升小鼠肠道抗氧化性,促进超氧化物歧化酶SOD 生成,抑制丙二醛MDA 生成;最终在抗氧化和抗炎的共同作用下维持小鼠肠道屏障,降低小鼠腹泻指数,缓解小鼠腹泻程度,证实了姜黄素微胶囊干预小鼠腹泻的效果,并研究了微胶囊的作用机理,为姜黄素微胶囊干预腹泻制剂的推广应用奠定了理论基础。

