发酵陈皮水提物体外抗氧化活性及对秀丽隐杆线虫抗衰老作用
吕晨豪,李俊健,陈昶安,何致霖,杜 冰,2,黎 攀,2,
(1.华南农业大学食品学院,广东广州 510642;2.岭南现代农业科学与技术广东省实验室,广东广州 510642)
衰老(Aging)是生物学中机理最复杂的现象之一[1]。随着机体的衰老,细胞对外部和内部损伤的调节能力逐渐减弱,多种生物活动也出现生理性的减少[2-3],是一种随着年龄增长而必然发生的、不可逆转的一种机体退化的过程[4]。有研究指出[5],过量的自由基可使细胞内多种物质发生氧化损伤,影响机体的正常生理功能,从而导致机体加速衰老。因此,提高机体的抗氧化活性对延缓衰老具有重要作用,而植物源的天然抗氧化剂是当今研究的热点,利用植物提取物研发具有抗氧化功效的食品和保健品具有深远的现实意义。
陈皮为芸香科植物橘(Citrus reticulata Blanco)及其栽培变种的干燥成熟果皮,是一种药食同源的中药,药材分为“陈皮”和“广陈皮”[6]。广陈皮也被称为新会陈皮,传统认为新会陈皮为道地药材,品质最为优良[7]。广陈皮提取物中的多甲氧基黄酮含量最高,相比其他陈皮有着更好的抗氧化和抗炎活性[8]。黄酮类化合物具有多种抗氧化活性,柑橘果皮因富含黄酮等物质具有比果肉更强的抗氧化活性[9],且柑橘果皮的自由基清除能力与黄酮之间具有很强的相关性[10]。据报道,补充黄酮类物质可以有效降低脂质过氧化物的水平,提高动物体内的超氧化物歧化酶、谷胱甘肽等抗氧化酶的活力[11]。以上研究结果表明陈皮具有一定的抗氧化活性,其体外抗氧化活性已被1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl, DPPH)自由基清除能力、亚铁离子螯合能力、氧化自由基吸收能力等实验所证明[12-14]。
研究表明经过微生物发酵后可以有效提高植物源提取物中多种功效物质的释放,如黄酮、多酚等,可提高机体抗氧化活性。乳酸芽孢杆菌DU-106 具有良好的产左旋乳酸性能[15],本课题组成功将乳酸芽孢杆菌DU-106 应用于巴戟天等中药材发酵上,显著提高了巴戟天的抗氧化活性,延长了秀丽隐杆线虫的寿命并改善了氧化损伤[16]。秀丽隐杆线虫(Caenorhabditis elegans, C. elegans)是首个被完整测序的多细胞真核生物,形体结构简单,生命周期适中,繁殖能力强,有60%~80%的基因与人类同源,在衰老过程中体现出的运动能力下降、摄食减少、自由基积累等与人类衰老表现十分相似,因此线虫已经在衰老与寿命研究领域被广泛使用[17-18]。杨雪妍[19]建立线虫衰老模型,使用不同浓度的柑橘黄酮提取物对线虫进行干预,结果显示川陈皮素在没有影响线虫生殖能力的基础上,可显著延长线虫正常和不良环境下的寿命,同时提升了抗氧化酶活性和降低了活性氧、丙二醛的水平,为柑橘黄酮提取物的抗衰老研究提出思路。鉴于此,本研究利用乳酸芽孢杆菌DU-106 对陈皮进行发酵,比较陈皮发酵前后水提物中功效物质总多酚、总黄酮和总糖及其清除自由基的能力的变化,此外,以秀丽隐杆线虫为模式动物,研究陈皮水提物的体内抗氧化活性的变化,为陈皮的开发研究提供理论依据和数据支持。
1 材料与方法
1.1 材料与仪器
新鲜陈皮 取样于广东省江门市新会区,鉴定为茶枝柑Citrus reticulata cv. 'Chachiensis'品种;乳酸芽孢杆菌DU-106 由华南农业大学新资源与功能性原料研究及评价中心保藏;N2 秀丽隐杆线虫和OP50大肠杆菌 美国秀丽隐杆线虫遗传中心;DPPH、芦丁标准品、没食子酸标准品 美国Sigma 公司;丙二醛(Malondialdehyde, MDA)含量测定试剂盒、超氧化物歧化酶(Superoxide Dismutase, SOD)活力测定试剂盒、过氧化氢酶(Catalase, CAT)活力测定试剂盒、谷胱甘肽(Glutathione, GSH)含量测定试剂盒南京建成生物工程研究所;胡桃醌(分析纯)、链霉素硫酸盐 上海源叶生物科技有限公司;BCA 蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;白砂糖 安琪酵母(赤峰)有限公司;氯化钠、硫酸亚铁、过氧化氢、氯化亚铁、菲啰嗪、水杨酸、氯化钙、硫酸镁、磷酸三钾、福林酚 广州化学试剂厂;琼脂粉、胰蛋白胨 广东环凯微生物科技有限公司;其他试剂 均为国产分析纯。
JXFSTPR-32 全自动样品研磨仪 上海净信实业发展有限公司;MK-3 酶标仪 美国Thermo Labsystems 公司;BPH-9042 生化培养箱 上海一恒科学仪器有限公司;紫外分光光度计 上海美谱达仪器有限公司;ALPHA 2-4 LD plus 冻干机 德国CHRIST公司;SZ760BLED 型体式显微镜 重庆奥特光学仪器有限公司;LDZX-50KBS 立式高压灭菌器 上海申安医疗器械厂。
1.2 实验方法
1.2.1 陈皮及发酵陈皮水提物的制备及主要成分测定
1.2.1.1 发酵陈皮水提物的制备 将陈皮切分、洗净,121 ℃高压蒸汽灭菌15 min,冷却后按陈皮质量的两倍加入无菌水,装入泡菜坛中,再添加总质量的2%食盐和4%白砂糖搅拌均匀;按陈皮质量的0.1%添加乳酸芽孢杆菌DU-106(菌粉浓度1012CFU/g),混匀,于25 ℃下密封发酵10 d,取陈皮固体样品后在50 ℃恒温下烘干至恒重,4 ℃保存备用。
陈皮水提物的制备参考文献[20]的方法略作修改,将烘干后的陈皮磨粉过40 目筛,准确称取一定质量,按料液比1:10(g/mL)于100 ℃恒温水浴锅热水浸提1 h,4000 r/min 离心10 min 后收集上清液,滤渣重复加水抽提两次,合并上清液,经浓缩冷冻干燥后得陈皮水提物。其中未发酵陈皮水提物命名为WE (Water Extract),发酵陈皮水提物命名为FWE(Fermented Water Extract)。
1.2.1.2 总黄酮含量测定 参考文献[21]采用亚硝酸钠-硝酸铝比色法,得标准曲线方程为Y=19.56X-0.0023 (R2=0.9998)。取1 mL 陈皮水提物上清液,按标准曲线制作方式依次加入试剂,根据标准曲线计算水提物的总黄酮含量。
1.2.1.3 总多酚含量测定 参考文献[22]采用福林酚分光光度计法,得标准曲线方程为Y=183.68X+0.0022 (R2=0.996)。取1 mL 陈皮水提物上清液,按标准曲线制作方式依次加入试剂,根据标准曲线计算水提物的总多酚含量。
1.2.1.4 总糖含量测定 参考文献[20]采用苯酚硫酸法,得葡萄糖标准曲线Y=8.5148X+0.0204(R2=0.996)。取1 mL 陈皮水提物上清液,按标准曲线制作方式依次加入试剂,根据标准曲线计算水提物的总糖含量。
1.2.2 陈皮水提物体外抗氧化活性的测定
1.2.2.1 DPPH 自由基清除能力测定 参考文献[23]方法略作改动,分别取1、2、3、4、5 mg/mL 浓度的样品溶液1 mL 于试管中,加入1 mL 的DPPH 溶液,充分摇匀后,室温避光静置30 min,在517 nm 处测定吸光度。DPPH 自由基的清除率公式为:
式中:A2为样品实验组吸光度;A1为用蒸馏水替代DPPH 溶液的对照组吸光度;A0为用蒸馏水与DPPH 溶液混合的空白组吸光度。
1.2.2.2 羟基自由基清除能力测定 参考文献[24]方法略作改动,分别取1、2、3、4、5 mg/mL 浓度的样品溶液1 mL 于试管中,依次加入6 mmol/L 的FeSO4溶液和H2O2溶液各1 mL,摇匀后静置10 min,再加入6 mmol/L 的水杨酸1 mL,摇匀后室温避光静置30 min,在510 nm 处测定吸光度。羟基自由基的清除率公式为:
式中:A2为样品实验组吸光度;A1为用蒸馏水替代水杨酸的对照组吸光度;A0为用蒸馏水替代样品溶液的空白组吸光度。
1.2.2.3 亚铁离子螯合能力测定 参考文献[25]方法略作改动,分别取1、2、3、4、5 mg/mL 浓度的样品溶液1 mL 于试管中,依次加入蒸馏水3.7 mL、2 mmol/L 的FeCl2溶液0.1 mL 和5 mmol/L 的菲啰嗪溶液 0.2 mL,振荡摇匀,室温避光静置10 min 后,5000 r/min 离心10 min,取上清液在562 nm 处测定吸光度。亚铁离子螯合率公式为:
式中:A2为样品实验组吸光度;A1用蒸馏水替代FeCl2的溶液对照组吸光度;A0为用蒸馏水替代样品溶液的空白组吸光度。
1.2.2.4 总还原能力测定 参考文献[25]方法略作改动,分别取1、2、3、4、5 mg/mL 浓度的样品溶液1 mL 于试管中,依次加入磷酸盐缓冲液(pH6.6)和5%铁氰化钾溶液各1 mL,摇匀后50 ℃水浴20 min,加入10%三氯乙酸溶液1 mL;充分摇匀后3000 r/min离心10 min,取上清液1 mL,加入1 mL 的蒸馏水和1 mL 0.1% FeCl3溶液,摇匀后室温静置10 min,在700 nm 测其吸光度。总还原能力公式为:
式中:A2为样品实验组吸光度;A1为用蒸馏水替代样品溶液的空白组吸光度。
1.2.3 陈皮水提物对秀丽隐杆线虫体内抗氧化活性的测定
1.2.3.1 线虫培养、同期化和给药途径 线虫的培养参考文献[26]方法略作修改。线虫培养在线虫生长固体培养基(Nematode Growth Medium, NGM)上进行,称取1.2 g 氯化钠、8 g 琼脂粉、1 g 胰蛋白胨、0.08 g 链霉素硫酸盐于锥形瓶中,加入390 mL蒸馏水混匀密封后于灭菌锅内121 ℃灭菌30 min,待培养液温度降至65 ℃时,依次加入400 μL 1 mol/L CaCl2溶液、400 μL 1 mol/L MgSO4溶液、400 μL 5 mg/mL 的胆固醇以及10 mL 1 mol/L K3PO4缓冲液。混匀后,在无菌条件下,趁热分装至培养皿中。每个平板加入100 μL 大肠杆菌OP50菌液作为线虫食物,置于20 ℃生化培养箱中培养。
线虫同期化参考文献[27]方法略作修改,采用高氯酸钠漂白法,用1 mL M9 缓冲溶液将培养72 h左右的成虫洗至无菌EP 管中,加1 mL 裂解液,反复振荡3 min,3000 r/min 离心1 min,弃上清。再用1 mL M9 缓冲液冲洗线虫,重复2 次。离心弃上清后用移液枪吸取EP 管底部虫卵滴于平板的无菌区,约48 h 后虫卵基本发育成L4 期幼虫,完成同期化。
给药途径参考文献[28]方法略作修改。配制1 mg/mL(低剂量组)、3 mg/mL(中剂量组)、5 mg/mL(高剂量组)的陈皮水提物(WE)和发酵陈皮水提物(FWE)溶液,分别命名为WE-1、WE-3、WE-5、FWE-1、FWE-3、FWE-5。过滤除菌后,与大肠杆菌OP50菌液(OD 值=1.0)等体积混匀,吸取100 μL涂布于NGM 平板上喂养线虫。此条件下,药物主要是通过线虫摄食进入线虫体内。
1.2.3.2 线虫寿命测定 试验分为空白组(CD)和实验组,空白组以不含样品提取物的OP50菌液涂布培养基,以此判定样品效果。将虫卵均匀加入至各组平板上,20 ℃培养箱中培养48 h,得同期化后生长至L4 期线虫。每组平均挑取150 条同期化至L4 期的线虫进行实验,将线虫转移至新的给药NGM 平板上。从转移当天开始记为0 d,每24 h 转移线虫至对应的实验组新平板中,记录每天线虫的存活与死亡数,直至所有线虫死亡。
1.2.3.3 线虫热应激实验 培养方法同寿命实验,挑选同期化后的L4 期的线虫药物干预4 d 后,将培养箱温度调高至35 ℃,此时设为0 h,每隔1 h 观察记录一次线虫的存活情况,直至所有线虫死亡。每组3 个平板,每个平板30 条线虫。
1.2.3.4 线虫氧化应激实验 培养方法同寿命实验,挑选同期化后的L4 期的线虫药物干预4 d 后,每组平均挑取90 条线虫,转移至500 μmol/L 胡桃醌平板上。转移后每30 min 记录线虫存活率(存活率(%)=存活条数/总条数×100),及时移走死亡线虫,直至线虫全部死亡。
1.2.3.5 线虫运动能力测定 参考文献[27]方法略有改动。在线虫寿命第5、10、15 d 时,观察线虫运动能力,运动能力可分为三个等级:线虫自发运动,不需要触碰刺激,记为状态A;线虫必须受到触碰刺激才运动,记为状态B;线虫受到触碰刺激后只摆动头部和尾部,记为状态C。此外,在线虫寿命第5、10、15 d,每组随机观察10 条线虫在30 s 内的头部摆动频率,重复三次。
1.2.3.6 线虫产卵量测定 每实验组5 个平板,每个平板单独饲养2 条L4 期线虫,此时记为第一天,每24 h 将线虫转移至新平板上,直至线虫停止产卵。所有平板在20 ℃下继续孵化,48 h 后计算每个平板上子代数目。
1.2.3.7 抗氧化酶活性测定 挑选L4 期线虫至各组平板,干预4 d 后使用M9 缓冲液冲洗收集各组线虫至离心管中,于1000 r/min 离心3 min,收集上清液。根据试剂盒中的操作方法对线虫体内MDA 含量、SOD 活力、CAT 活力和GSH 含量进行测定,结果通过蛋白质浓度标准化。蛋白质浓度测定采用BCA 法,得到回归方程为A=1.0555x+0.1031(R2=0.9986)。
1.2.3.8 线虫体内活性氧(ROS)含量测定 参照文献[29]方法稍作修改。线虫培养96 h 后用M9 缓冲液清洗三遍,加入研磨珠后冷冻研磨,4000 r/min离心1 min,取上清液50 μL 于96 孔板中,加入50 μL 100 μmol/L 的H2DCF-DA,避光混匀,在激发波长485 nm、发射波长530 nm 的酶标仪下每20 min 进行一次荧光强度测定,连续测定2 h,并以上清液蛋白质浓度进行相对荧光强度标准化。
1.3 数据处理
采用Excel 软件、Prism 9 软件对实验结果进行统计和作图,结果用平均值±标准差表示。利用SPSS 26.0 统计分析软件对线虫寿命的实验数据以及对线虫抗氧化相关生理指标的数据进行单因素方差分析,P<0.05 表示显著差异,P<0.01 表示极显著差异。
2 结果与分析
2.1 陈皮水提物的成分分析
陈皮发酵前后水提物主要成分含量如表1 所示,FWE 总黄酮和总多酚含量显著高于WE(P<0.05),但总糖含量显著低于WE,说明乳酸发酵能够提升陈皮水提物中总黄酮和总多酚的含量,而这些物质的增加可能与陈皮水提物抗氧化活性的提升有关[30]。另外,总糖含量的下降与乳酸菌发酵过程中大量消耗糖类物质有关。
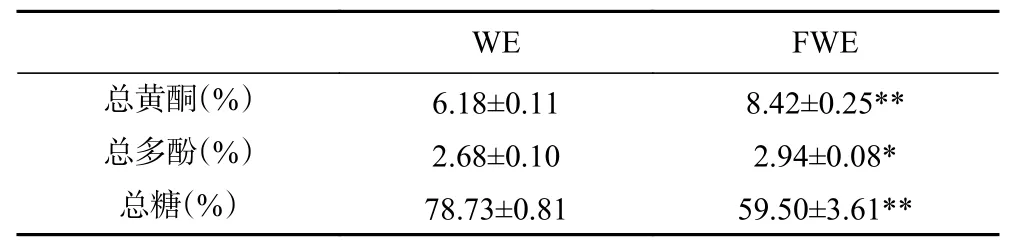
表1 陈皮发酵前后水提物主要成分含量Table 1 Content of the main components of PCR water extracts before and after fermentation
2.2 陈皮水提物体外抗氧化活性
DPPH 自由基清除率由图1A 所示,发酵前后水提物对DPPH 自由基的清除能力在1~5 mg/mL 的浓度范围内均具有上升趋势,且呈现出剂效关系。FWE 在5 mg/mL 的浓度时清除能力达到最高,达到阳性对照VC的94.65%,且FWE 的DPPH 自由基清除能力优于WE,毛传亮等[31]通过研究青钱柳叶提取物抗氧化活性与黄酮含量之间的关系,发现黄酮含量与DPPH 自由基清除率呈极显著正相关,与羟基自由基清除率呈显著正相关,说明黄酮类化合物可能是其中主要的抗氧化成分之一。乳酸芽孢杆菌发酵能够提升陈皮水提物中的黄酮含量,这可能是FWE 组具有更强的DPPH 自由基清除能力的原因,表明乳酸发酵有助于提高陈皮的抗氧化性。
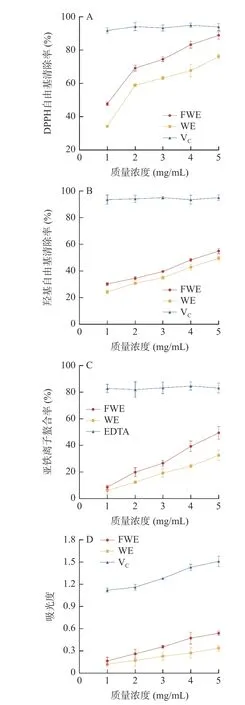
图1 陈皮水提物的体外抗氧化活性Fig.1 In vitro antioxidant activity of PCR water extracts
羟基自由基是一种具有强氧化能力的活性氧,能穿透细胞膜刺激蛋白质、碳水化合物等生物大分子,从而产生不同反应造成机体产生损伤[32]。由图1B可得,随着浓度的增大,FWE 和WE 对羟基自由基的清除率呈上升趋势,并表现出一定的浓度依赖性。FWE 在5 mg/mL 时效果达到VC的59.11%;WE 在5 mg/mL 时效果达到VC的53.38%,表明通过乳酸芽孢杆菌发酵能进一步提升陈皮水提物的抗氧化活性。
亚铁离子的螯合率由图1C 所示,以EDTA 为阳性对照,EDTA 螯合率维持在83%左右,螯合能力显著高于两种陈皮水提物;两种水提物均具有一定的亚铁离子螯合能力,且体现出了明显的浓度依赖性;随着浓度的增大,FWE 的螯合率由8.65%升至49.49%,WE 的螯合率由6.14%升至32.58%;在同一浓度下FWE 的螯合能力均比WE 高。因此,通过乳酸芽孢杆菌发酵能够提升陈皮水提物的螯合能力,增强其抗氧化的能力。
总还原能力是抗氧化活性评价的一个重要指标。不同浓度的水提物总还原能力如图1D 所示。随着反应浓度的增加,FWE 和WE 的还原能力都在逐渐增强,并表现出了剂效关系;在同一浓度下,FWE 的还原能力高于WE。以VC作为阳性对照,在5 mg/mL 的浓度下,FWE 的吸光值为0.54,达到VC的35.76%;WE 的吸光值为0.34,达到VC的22.52%。这表明发酵后的陈皮水提物放出的电子更多,具备更强的还原能力,具有被开发成天然抗氧化剂的潜力。
2.3 陈皮水提物对秀丽隐杆线虫寿命及衰老生理指标的影响
2.3.1 陈皮水提物对线虫寿命的影响 线虫的寿命分析是线虫抗氧化研究中最为直观的一项指标,标准条件下陈皮水提物对线虫寿命影响的生存率曲线如图2,相关的存活时间统计学分析如表2。与空白组相比,使用1、3、5 mg/mL 三个剂量的水提物处理线虫,可以使线虫的生存率曲线明显右移;线虫饲喂低剂量和中剂量的水提物后,平均寿命上升至16.41 d左右,最大寿命上升至23 d 以上,与空白组产生显著差异(P<0.05)。当线虫饲喂5 mg/mL 的高剂量水提物后,FWE 组平均寿命为(20.67±1.20) d,WE 组平均寿命为(19.02±0.56) d,与空白组相比分别显著延长了28.34%和39.47%,但FWE 组最大寿命显著高于WE 组,比WE 组延长了13.85%(P<0.05)。分析结果表明,饲喂水提物可以显著延长线虫的寿命,寿命与样品浓度之间有明显的剂效关系,并且发酵陈皮水提物效果较陈皮水提物效果更为显著。
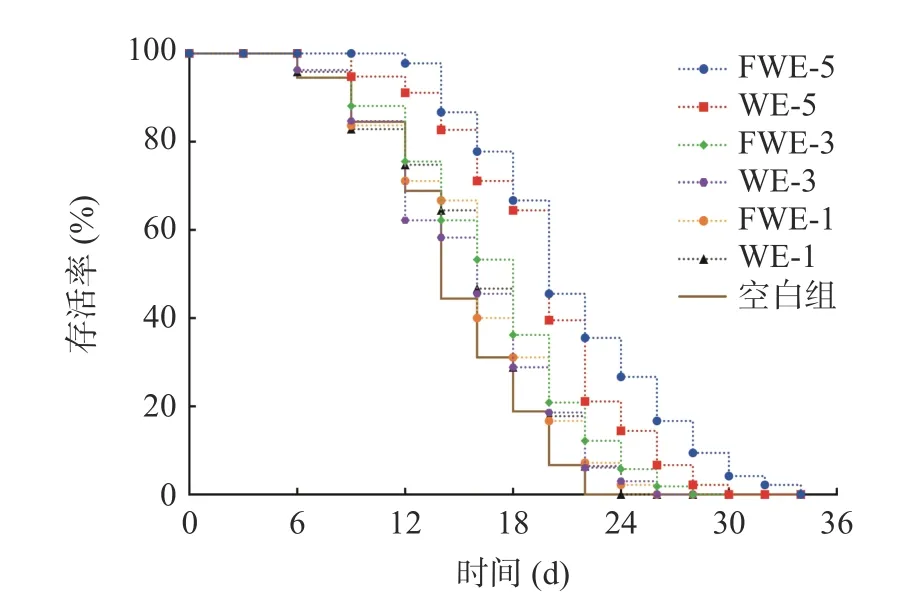
图2 标准条件下陈皮水提物对线虫寿命的影响Fig.2 Effects of PCR water extracts on the lifespan of C. elegans under standard conditions
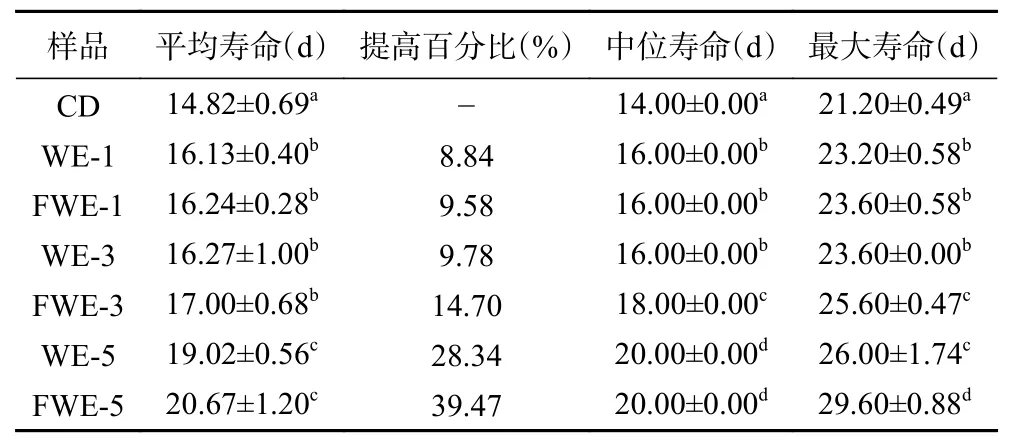
表2 标准条件下线虫存活时间统计学分析Table 2 Statistical analysis of C. elegans survival time under standard conditions
2.3.2 陈皮水提物对线虫抗逆性的影响
2.3.2.1 热应激下陈皮水提物对线虫寿命的影响大量研究表明,线虫寿命的提高通常与线虫抗逆能力提高有关,35 ℃的高温会引起线虫体内代谢紊乱,产生大量的活性氧,从而引起氧化应激降低寿命,因此抗热应激能力的高低成为了线虫抗氧化活性强弱的重要指标。热应激下陈皮水提物对线虫寿命影响的生存率曲线如图3,相关的存活时间统计学分析如表3。由图3 可以看出,在35 ℃热应激环境下,经过水提物饲喂的线虫存活率曲线都有明显右移,说明两种陈皮水提物均具有提高线虫抗热应激能力的作用,且FWE 组的生存曲线较WE 组右移更明显。另外,刘佳[33]发现蒲公英总黄酮对热应激线虫的寿命也存在延长作用,并呈现一定的剂量依赖效应,与本实验结果相似。饲喂低中剂量的FWE 和WE 后,线虫平均寿命和最大寿命都出现了不同程度的提高;而饲喂FWE-5 的线虫平均寿命和最大寿命可达7.08±0.17 d 和9.34±0.00 d,比空白组线虫提高了19.39%和22.89%,两者均显著高于空白组线虫(P<0.05),且FWE-5 组的抗热应激能力最强,整体趋势与寿命实验一致。结果表明乳酸发酵陈皮水提物的抗氧化活性的提升能够起到间接提高线虫抵抗热应激能力的作用,这可能也是有效延长线虫存活时间的原因。
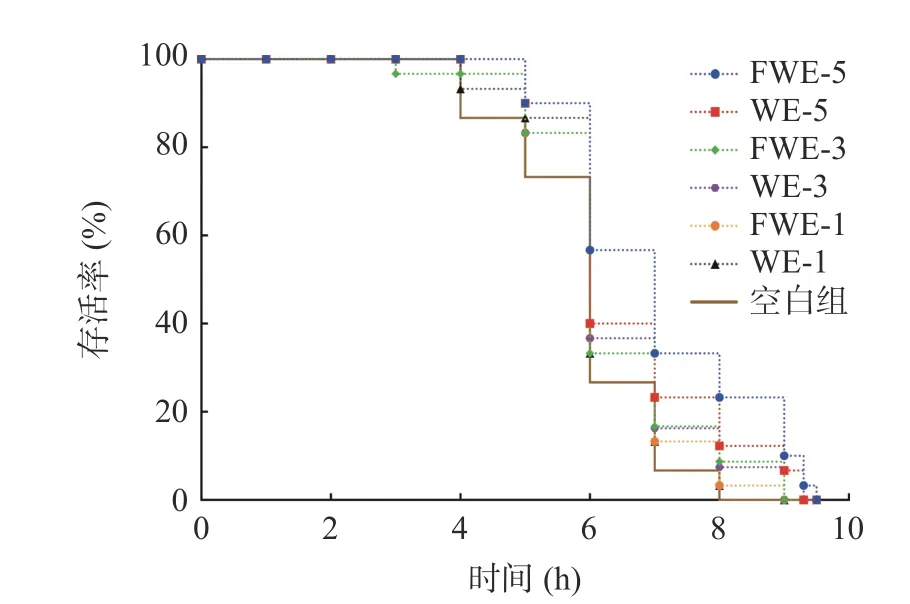
图3 热应激下陈皮水提物对线虫寿命的影响Fig.3 Effects of PCR water extracts on the lifespan of C. elegans under heat stress
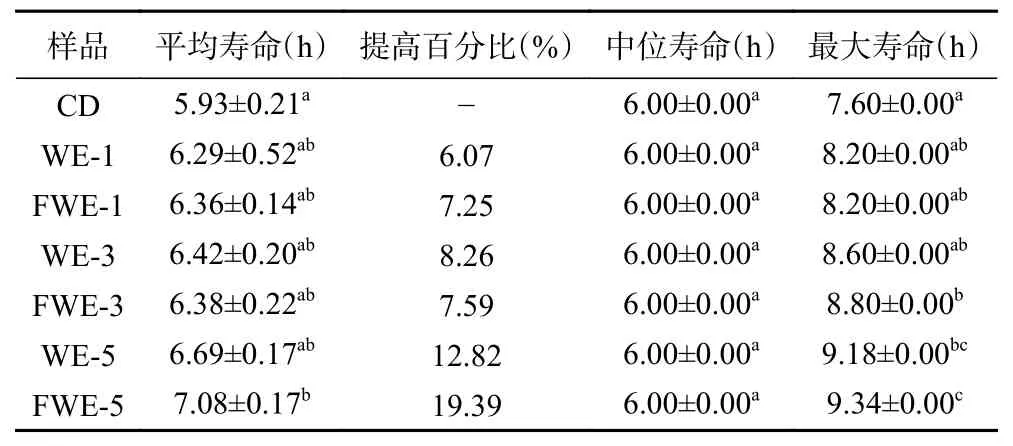
表3 热应激下线虫存活时间统计学分析Table 3 Statistical analysis of C. elegans survival time under heat stress
2.3.2.2 氧化应激下陈皮水提物对线虫寿命的影响
氧化应激下陈皮水提物对线虫寿命影响的生存率曲线如图4,相关的存活时间统计学分析如表4。从图4 的曲线中可以看出,饲喂样品后的线虫生存率曲线明显右移,说明水提物溶液具有明显的抵抗胡桃醌的氧化应激能力。空白组线虫的平均寿命和最大寿命分别为1.23±0.06 h 和1.70±0.00 h,饲喂低、中、高三个剂量样品的线虫平均寿命和最大寿命均和空白组有显著差异(P<0.05),寿命的延长与样品的浓度有着一定的正向相关性;其中饲喂FWE-5 的线虫相比于空白组平均寿命可提高117.89%,最大寿命可提高152.94%,同时也显著高于饲喂WE-5 的线虫寿命(P<0.05)。结果表明,发酵和未发酵陈皮水提物均能提高线虫抵抗胡桃醌诱导急性氧化应激的能力,并且发酵水提物的效果更为显著,且对线虫抗氧化应激能力的影响要强于对线虫抗热应激能力的影响。
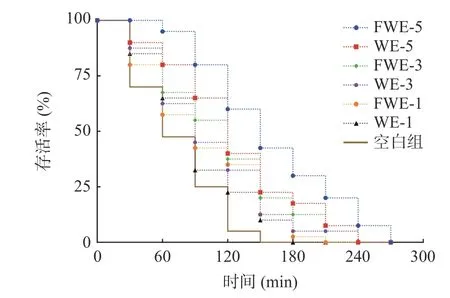
图4 氧化应激下陈皮水提物对线虫寿命的影响Fig.4 Effects of PCR water extracts on the lifespan of C. elegans under oxidative stress
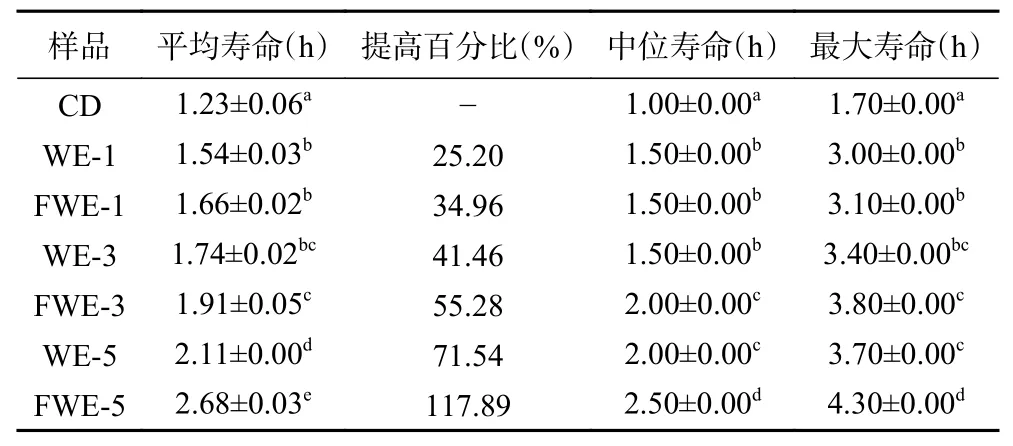
表4 氧化应激下线虫存活时间统计学分析Table 4 Statistical analysis of C. elegans survival time under oxidative stress
2.3.3 陈皮水提物对线虫运动能力的影响 线虫运动能力的下降一般代表着机体的衰老和肌肉的退化,运动行为也被用作反映神经系统的基本功能[34]。如图5 和图6,实验观察了线虫生命早、中、晚期(分别为第5、10、15 d)的自发运动情况和头摆频率。第5 d时,所有组别线虫都保持在运动A 的状态,饲喂水提物的线虫头摆频率均显著高于空白组,说明水提物能在一定程度上提高线虫的运动能力。第10 d 时,空白、WE-1、WE-3 和FWE-1 等四个组别开始出现运动B 状态,所有组别暂未出现运动C 状态;头摆频率较第5 d 均有不同程度的下降,但是饲喂样品的所有组别均显著高于空白组。第15 d 时,空白组中有25%线虫处于运动C 状态,而FWE-5 组还有90%线虫处于运动A 或B 状态,显著高于空白组,同时也优于WE-5 组;头摆频率FWE-5 组可达40 次/30 s,较空白组高135.29%,较WE-5 组高17.65%。结果表明,水提物在提高线虫寿命的前提下,还能显著改善线虫的运动能力,在同一剂量下,饲喂FWE 对线虫运动状态的影响优于WE。
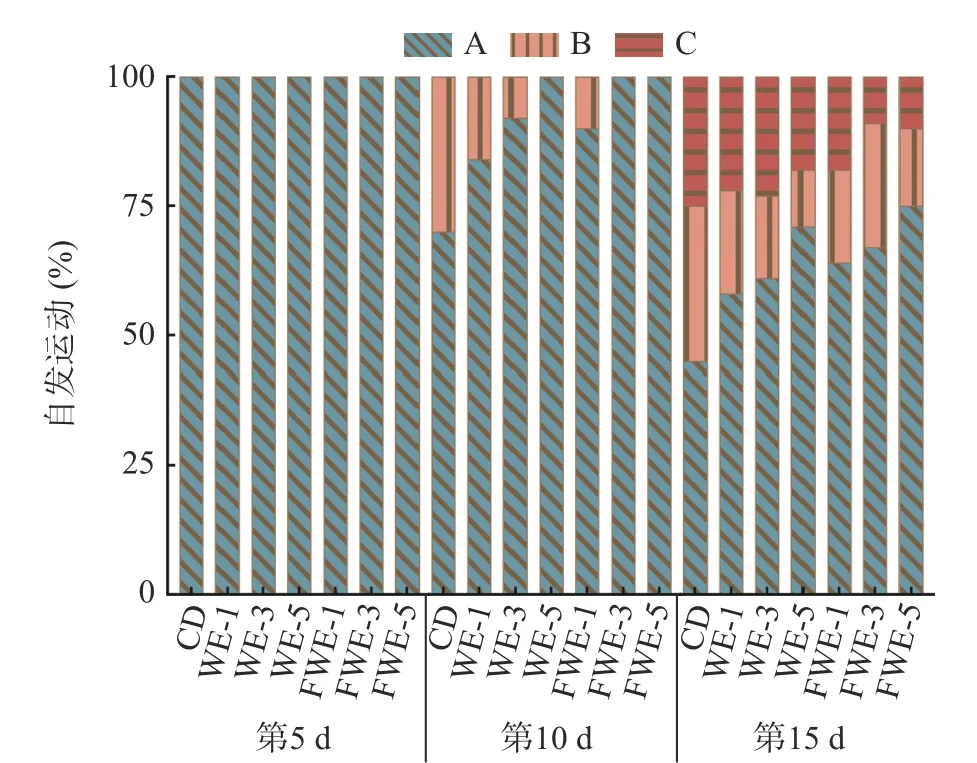
图5 陈皮水提物对线虫自发运动能力的影响Fig.5 Effects of PCR water extracts on spontaneous motility of C. elegans
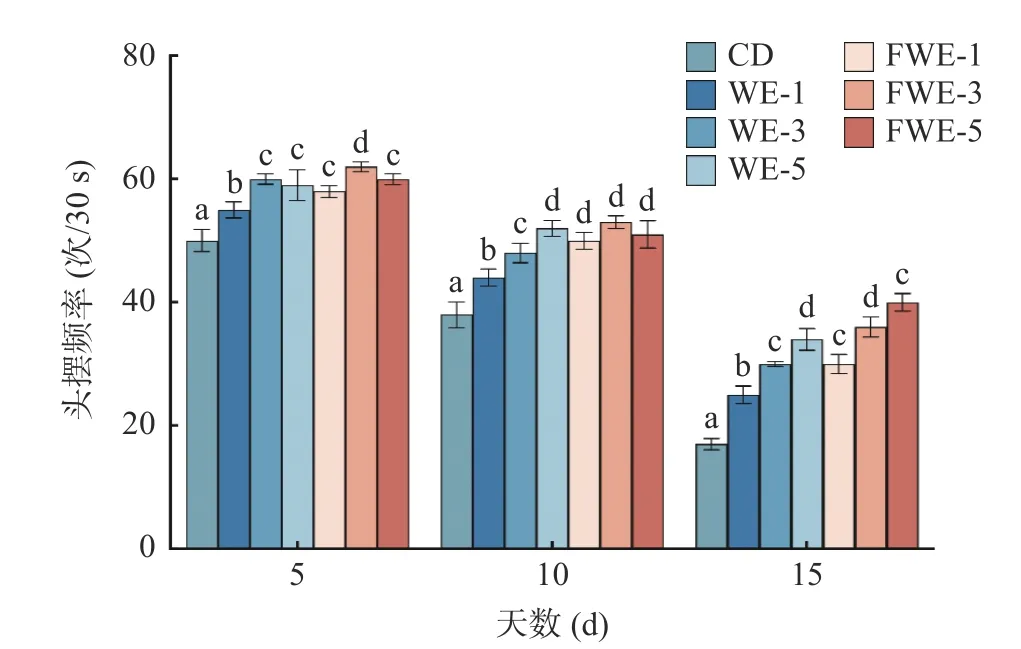
图6 陈皮水提物对线虫头摆频率的影响Fig.6 Effects of PCR water extracts on the frequency of C.elegans head pendulum
2.3.4 陈皮水提物对线虫产卵量的影响 有报道指出秀丽线虫的寿命与生殖能力之间存在“利弊权衡”,即寿命的延长将以降低或丧失生殖能力为代价[35];同时也有报道指出多酚类物质可以延长线虫寿命而不影响生殖能力[36]。因此,研究陈皮水提物在延长线虫寿命的前提下,是否会降低其生殖能力显得尤为重要。为了研究水提物对线虫生殖能力的影响,通过对总产卵量的计数,如图7 所示,空白组和实验组总产卵量都在200 条左右,饲喂不同浓度的水提物没有使线虫产卵量有显著变化,说明水提物在提高线虫寿命的基础上不会对其生殖能力有影响。
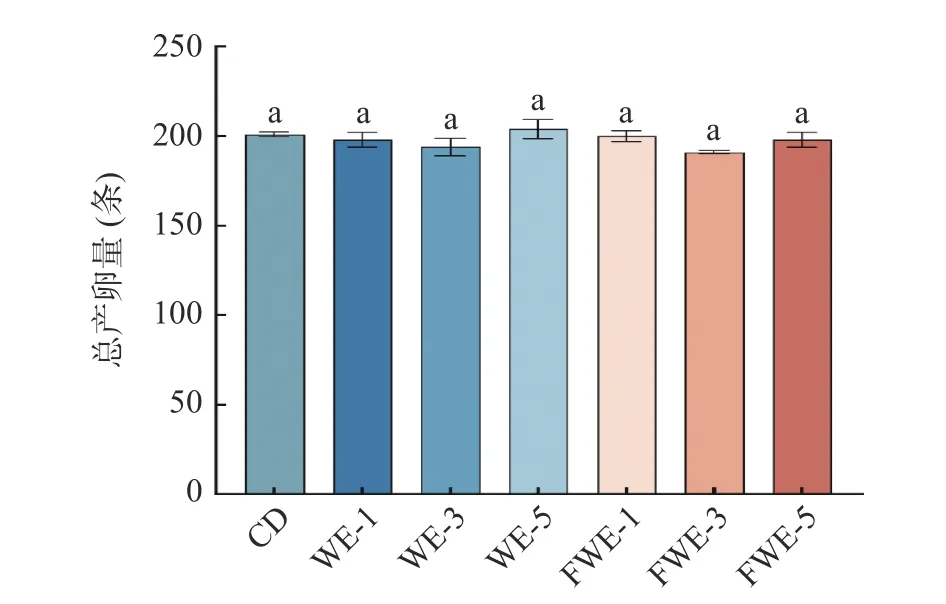
图7 陈皮水提物对线虫产卵量的影响Fig.7 Effects of PCR water extracts on C. elegans egg production
2.3.5 陈皮水提物对线虫体内抗氧化酶系及丙二醛含量的影响 MDA 是生物体内脂质过氧化的最终产物,被广泛应用为生物体氧化损伤的指标[37];如图8A 所示,饲喂水提物后的线虫具有更低的MDA含量,与空白组相比有显著差异(P<0.05);其中饲喂低、中剂量组的FWE 和WE 线虫之间MDA 含量差异不显著(P>0.05),高剂量组之间有显著差异(P<0.05),FWE-5 组的MDA 含量最低,较空白组和WE-5 组分别下降了66.64%和20%,说明陈皮的水提物能在一定程度上抑制脂质过氧化反应,且乳酸发酵能够提升水提物抑制脂质过氧化反应的能力,抑制程度与水提物浓度成正相关。
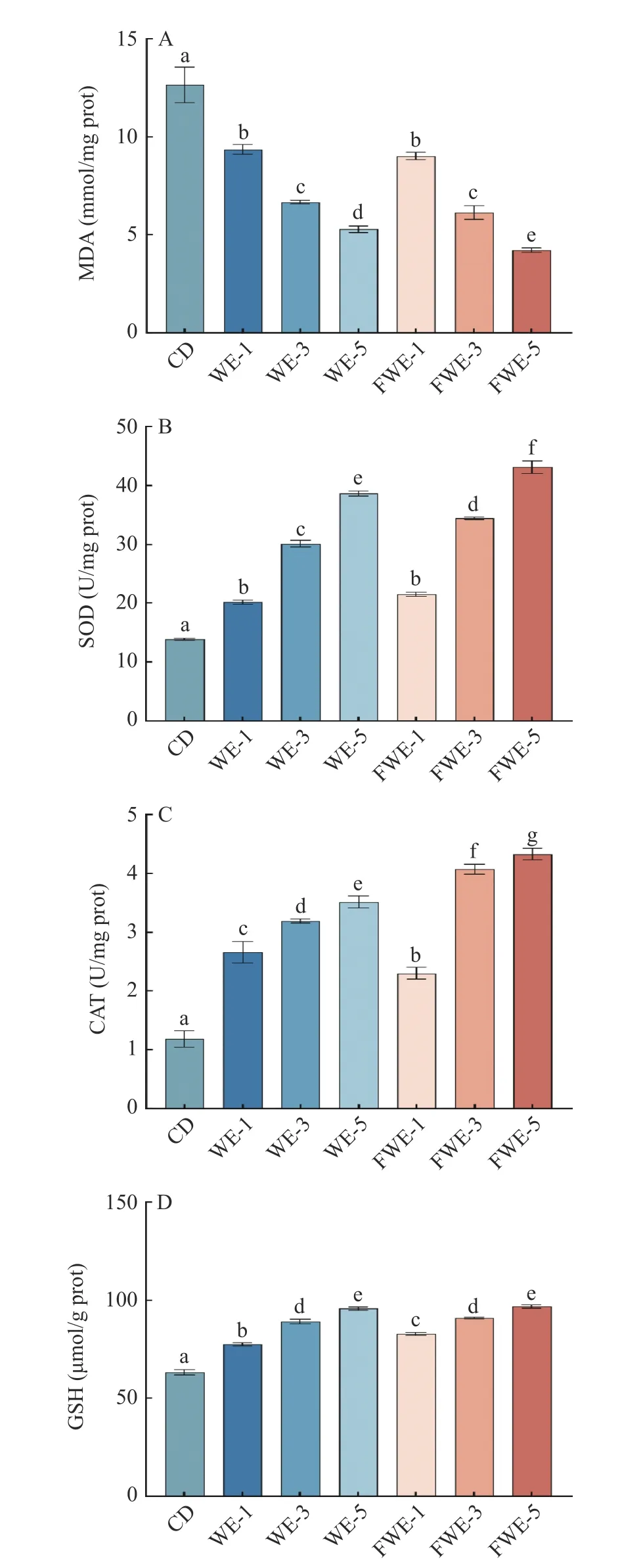
图8 陈皮水提物对线虫抗氧化防御体系的影响Fig.8 Effects of PCR water extracts on the antioxidant defence system of C. elegans
SOD 和CAT 是线虫体内主要的抗氧化酶,提高SOD 活力有助于催化超氧阴离子发生歧化反应生成H2O2,提高CAT 活力则能够催化H2O2生成水,在此反应过程可以清除线虫体内多余的自由基,减少氧化损伤[38]。如图8B 和图8C 所示,饲喂不同剂量的水提物均能显著提高SOD 和CAT 酶活力,其中FWE-5 和FWE-3 组的SOD 活力与WE-5 和WE-3 组有显著差异(P<0.05),而FWE 组所有剂量的CAT 酶活力均与WE 组有显著差异(P<0.05)。其中FWE-5 组的SOD 和CAT 酶活力最高,相比WE-5 组分别提升了11.50%和23.11%。
GSH 是一种低分子清除剂,GSH 的量是衡量线虫抗氧化活性大小的重要因素[39]。如图8D 所示,饲喂水提物能显著提高GSH 的含量,最高的FWE-5 组比空白组高出53.52%,但中、高剂量下FWE 和WE 组没有显著差异(P>0.05)。以上数据表明线虫摄入水提物均能在一定程度上提高其抗氧化活性,在激活线虫抗氧化防御体系方面FWE 比WE 显示出了更大的潜力。
2.3.6 陈皮水提物对线虫体内活性氧自由基积累量的影响 机体由于正常衰老或受不良环境胁迫时,会产生过量的ROS,导致ROS 与抗氧化酶失衡,引起氧化应激反应,破坏蛋白质和DNA 等物质结构,加速机体衰老和凋亡[38]。由图9 可知,在反应的120 min内,线虫体内的ROS 水平随着反应时间的延长而增加,在第100 min 后趋于稳定;经饲喂不同浓度的水提物后,线虫可显著改善ROS 异常积累。与空白组相比,FWE 组的低、中、高剂量分别降低了32.43%、48.65%、62.16%的ROS 相对含量;WE 组的低、中、高剂量则分别降低25.41%、45.94%、54.05%。以上结果表明,水提物可以有效清除线虫体内的ROS,清除效率与水提物浓度具有依赖性,在同一浓度下,FWE 的ROS 清除效果优于WE,该结果与抗氧化防御体系分析一致。路璐璐[40]的研究表明毛蕊异黄酮可通过增强机体清除活性氧自由基的能力,提高机体的抗氧化活性,从而延长线虫的寿命,由此推测发酵后陈皮水提物清除活性氧自由基能力的提升可能与其中黄酮含量的提升有关。
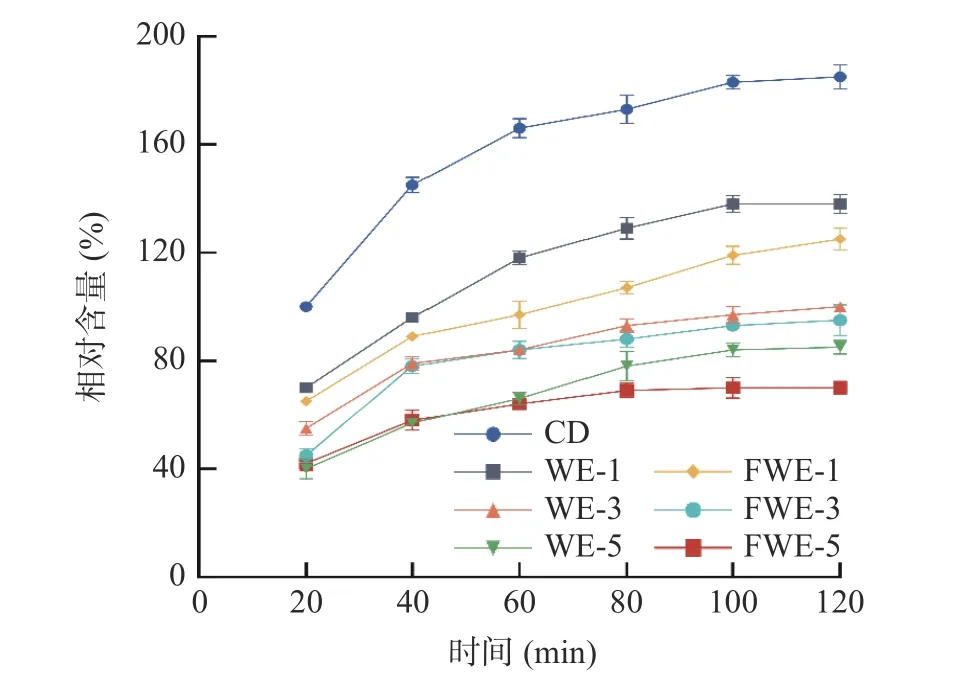
图9 陈皮水提物对线虫体内ROS 积累量的影响Fig.9 Effects of PCR water extracts on the accumulation of ROS in C. elegans
3 结论
本实验采用了DPPH 自由基清除率、羟自由基清除率、亚铁离子螯合能力和总还原能力4 个指标来评价陈皮水提物的体外抗氧化活力,结果表明,在最高剂量下,发酵后的陈皮水提物较未发酵的陈皮水提物在DPPH 自由基清除率、羟自由基清除率、亚铁离子螯合能力和总还原能力4 个指标上分别提升了16.65%、10.73%、51.88%和59.23%。因此,陈皮水提物具有良好的体外抗氧化活性,且经乳酸芽孢杆菌发酵后的陈皮水提物(FWE)的抗氧化活性优于发酵前陈皮水提物(WE)。乳酸芽孢杆菌发酵还提高了陈皮水提物的体内抗氧化活性和对秀丽隐杆线虫的抗衰老功效。与空白对照组相比,两种水提物均能提高秀丽隐杆线虫寿命和改善抗逆性,提高运动能力的同时不影响生殖能力,提升线虫体内抗氧化防御体系和减少活性氧自由基的积累,并且发酵后的陈皮水提物具有更加显著的效果,说明乳酸芽孢杆菌发酵提高了陈皮的体内抗氧化活性以及对秀丽隐杆线虫的抗衰老功效。
本研究初步表明陈皮可作为天然的食品抗氧化剂加以开发利用,为以后陈皮在功能食品方面的进一步研究提供可靠的理论依据和实验参考,但是其产生抗氧化作用的具体作用机制较为复杂,还需要后续更进一步的研究。

