超声辅助双水相提取刺梨黄酮的工艺优化及其对黄嘌呤氧化酶活性的抑制作用
庄乾飞,刘丹丹,陈泽雨,尚祖飞,刘晓燕,2,3,马立志,2,3,
(1.贵阳学院食品与制药工程学院,贵州贵阳 550005;2.贵州省果品加工工程技术研究中心,贵州贵阳 550005;3.贵州省果品加工、贮藏与安全控制协同创新中心,贵州贵阳 550005)
刺梨(Rose roxburghiiTratt)是蔷薇属植物缫丝花的果实,主要分布在我国的贵州、四川和云南等地,其中以贵州的刺梨资源最为丰富[1]。刺梨黄酮类化合物中包括木犀草素、儿茶素、异槲皮素、槲皮素、杨梅素、芦丁、山奈素等多种有效成分,具有抗氧化[2]、辐射防护[3]、防治糖尿病[4-5]、预防动脉粥样硬化[6]、抗癌[7]与抗凋亡[8-10]等生物活性。近年来,以无机盐和短链醇为基础的新型双水相体系(Aqueous two-phase system,ATPS)[11-14]具有成本低、界面张力低、分辨率好、产率高、放大简单等优点,被认为是一种很有前景的提取技术,它具有提取和部分纯化目标物的功能,还可以在获得高得率的同时保持分子的生物活性。ATPS 应用于生物活性成分的提取技术已十分成熟,如酶[15]、蛋白质[16]、多糖[17-19]和黄酮等,但还未应用于刺梨黄酮的提取。
黄嘌呤氧化酶(Xanthine oxidase,XOD)是一种由两个完全对称亚单位组成的蛋白酶,是调控尿酸生成的关键酶。血液中尿酸含量增加会导致高尿酸血症(Hyperurcicemia,HUA)[20]。多项研究表明黄酮类化合物诸如山奈素、落新妇苷及其异构体[21]、木犀草素、芹菜素、儿茶素等可以与黄嘌呤氧化酶的活性中心结合从而抑制其活性,这一发现提示黄酮类化合物或许可以作为HUA 的有效发生抑制剂。目前,HUA的治疗主要集中在抑制尿酸生成和促进尿酸排泄上,代表药物分别为别嘌醇和苯溴马隆[22]。然而,这些药物在临床应用中有着严重的副作用,如肝肾毒性和Stevens-Johnson 综合征等[23],因此寻找更加安全的植物提取物治疗HUA 迫在眉睫。
当前有关刺梨黄酮双水相萃取的工艺优化和其抑制XOD 活性方面的研究资料较少。植物提取物治疗HUA 的研究主要集中在XOD 抑制剂的筛选[24-25]和影响尿酸转运蛋白的表达上[26-27]。因此,本试验以刺梨为原料,旨在构建超声波辅助乙醇(C2H5OH)-硫酸铵((NH4)2SO4)双水相萃取刺梨黄酮的技术体系以及确定最佳提取工艺,为深入开发植物资源和工业生产中高效提取刺梨黄酮提供科学依据,并通过对刺梨黄酮提取物抑制黄嘌呤氧化酶效果的研究,为发现一种天然黄嘌呤氧化酶抑制剂及刺梨功能活性的研究奠定理论基础。
1 材料与方法
1.1 材料与仪器
刺梨鲜果 购自贵州恒力源生物科技有限公司;XOD(50 U/mg)、黄嘌呤(98%)、芦丁(95%)、别嘌醇(98%) BR,均购自上海源叶生物科技有限公司;磷酸二氢钾、磷酸氢二钾、EDTA-2Na、硫酸铵、乙醇 均为分析纯;水为纯水。
SCIENTZ-18N 冷冻干燥机 宁波新芝生物科技股份有限公司;CS-2000Y 超帅多功能粉碎机 永康市天祺盛世工贸有限公司;FA2004N 电子天平 上海菁海仪器有限公司;KQ-400KDE 型高功率数控超声波清洗器 昆山市超声仪器有限公司;SHB-III 循环水式多用真空泵 郑州长城科工贸有限公司;THERMO 酶标仪 百樂科技有限公司。
1.2 实验方法
1.2.1 原料预处理 将刺梨鲜果切片后冷冻干燥,粉碎过100 目筛后放入保鲜袋,于2 ℃冰箱中保存。
1.2.2 C2H5OH-(NH4)2SO4双水相相图绘制 采用浊度滴定法[28]绘制C2H5OH-(NH4)2SO4双水相相图中双节线。向40% (NH4)2SO4溶液中滴加无水乙醇至溶液浑浊,记录加入C2H5OH 溶液的质量,后加入蒸馏水至溶液澄清,记录加入蒸馏水的质量。反复操作并记录,操作完成之后计算出记录的C2H5OH-(NH4)2SO4质量浓度,绘制相图。
1.2.3 刺梨黄酮标准曲线的绘制 采用亚硝酸钠(NaNO2)-硝酸铝(Al(NO3)3)比色法[29]。配制1 mg/mL 的芦丁标准溶液,分别取0.1、0.2、0.3、0.4、0.5 mL 标准液,用70%乙醇定容至1 mL,取50 μL 至96 孔板后加入30 μL 5%NaNO2,静置6 min,再加入30 μL 10%Al(NO3)3,静置6 min,加入100 μL 4%NaOH,反应30 min 后于510 nm 处测吸光值,绘制标准曲线得到回归方程A=1.3994x-0.0002,R2=0.9991。
1.2.4 构建双水相体系 固定体系质量为50 g,根据乙醇-硫酸铵双水相相图,选取14%、16%、18%、20%、22%的硫酸铵质量分数和28%、30%、32%、34%、36%的乙醇质量分数,考察硫酸铵质量分数对黄酮得率的影响时,固定乙醇质量分数为28%;考察乙醇质量分数对黄酮得率的影响时选取最佳硫酸铵质量分数,测定硫酸铵质量分数和乙醇质量分数对刺梨黄酮得率的影响。在100 mL 离心管中构建49.00 g 双水相体系(例:49.00 g 32%C2H5OH-20%(NH4)2SO4双水相体系,称取9.80 g 硫酸铵和15.68 g无水乙醇,剩余质量由蒸馏水补充,混合均匀)后加入1.00 g 的刺梨粉末,将离心管置于超声清洗器中超声,固定功率400 W,温度50 ℃,超声30 min。用布氏漏斗抽滤,滤液置于分液漏斗中静置20 min 使其分相完全,分离后分别测量上下相体积,计算相比(R);取上下相溶液测定其黄酮得率(Y),计算刺梨黄酮的分配系数(K)和萃取率(X)[30]。
式中:Vt、Vb 为上、下相体积,mL;Ct、Cb 为上、下相溶液黄酮浓度,mg/mL;n 为稀释倍数;m 为刺梨粉的质量,g。
1.2.5 单因素实验 分别考察超声功率(A)、超声时间(B)、超声温度(C)及料液比(D)对刺梨黄酮得率的影响。
1.2.5.1 超声功率对刺梨黄酮得率的影响 固定体系质量为50 g,考察不同的功率对黄酮得率的影响,在离心管中加入32% C2H5OH,加入20% (NH4)2SO4,加入1.00 g 刺梨粉,剩余质量由蒸馏水补充,按照1.2.4 方法进行实验,超声功率分别设置为240、280、320、360、400 W,其它条件不变。
1.2.5.2 超声时间对刺梨黄酮得率的影响 考察不同的超声时间对黄酮得率的影响,固定超声功率为上述条件最优值,对其进行超声处理,时间分别为 10、20、30、40、50 min,其他条件不变。
1.2.5.3 超声温度对刺梨黄酮得率的影响 固定超声功率和时间为上述实验的最优值,其他条件不变,温度分别设置为30、40、50、60、70 ℃,考察不同的温度对黄酮得率的影响。
1.2.5.4 料液比对刺梨黄酮得率的影响 考察不同的料液比对黄酮得率的影响,固定超声功率、时间和温度为上述实验的最优值,其它条件不变,料液比分别设置为1:29、1:39、1:49、1:59、1:69(g/g)。
1.2.5.5 响应面试验 通过单因素实验结果确定4 个因素的较优水平范围,以黄酮得率为响应值,设计4 因素3 水平的响应面试验,如表1 所示。
1.2.6 刺梨黄酮提取物抑制黄嘌呤氧化酶活性研究 将优化工艺条件下的刺梨黄酮提取液用旋转蒸发仪浓缩后冷冻干燥,保存至-20 ℃备用。
在酶促反应过程中,XOD 是通过调节两个基本氧化反应控制尿酸产生的关键酶,包括催化次黄嘌呤转化为黄嘌呤和黄嘌呤转化为尿酸[31]。取刺梨黄酮提取物冻干粉末,用蒸馏水配制8、10、12、14、16、18、20 mg/mL 浓度的提取液,按照表2 中各物质添加量进行试验,向96 孔板依次加入磷酸盐缓冲液(PBS,pH7.5、50 mmol/L、含200 μmol/L EDTA-2Na)、刺梨黄酮提取液、黄嘌呤氧化酶(0.1 U/mL)溶液,在37 ℃下孵育5 min 后,加入底物黄嘌呤溶液(0.15 mmol/L),在37 ℃下反应20 min 后,于295 nm 处测定吸光值[32]。
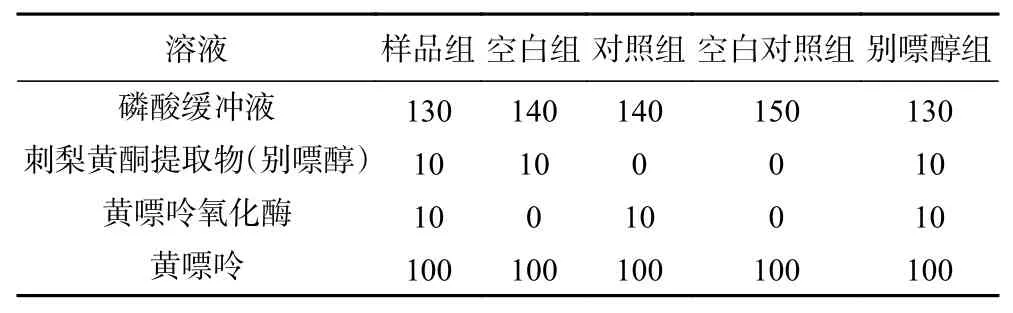
表2 酶活测定体系的组成(μL)Table 2 Composition of the enzyme activity assay system (μL)
式中,AE=A对照组-A空白对照组;AI=A样品组-A空白组。
1.3 数据处理
所有数据均为3 次重复实验的平均值,所有实验数据运用SPSS 25 进行显著性分析及Origin 2017软件绘制趋势曲线图;响应面实验采用Design-Expert 11 软件进行方差分析,半抑制浓度(IC50)通过SPSS 25 软件计算。
2 结果与分析
2.1 乙醇-硫酸铵双水相相图和双水相体系确定
2.1.1 乙醇-硫酸铵双水相相图 由图1 可知,C2H5OH-(NH4)2SO4在较大浓度范围内均具有良好的成相能力,与报道一致[33];双节线上的点为临界点,双节线以下的区域,两种溶剂均溶于水而不分相,称为均相区;而体系总组成配比取在双节线上方的区域,体系就会分为两相,称为双相区。其中上相为富乙醇相,下相为富盐相,黄酮类物质极性较小而富集于上相。因此,在实验时,乙醇和硫酸铵的配比应取在双节线上方,并取上相溶液作为待测液进行研究。
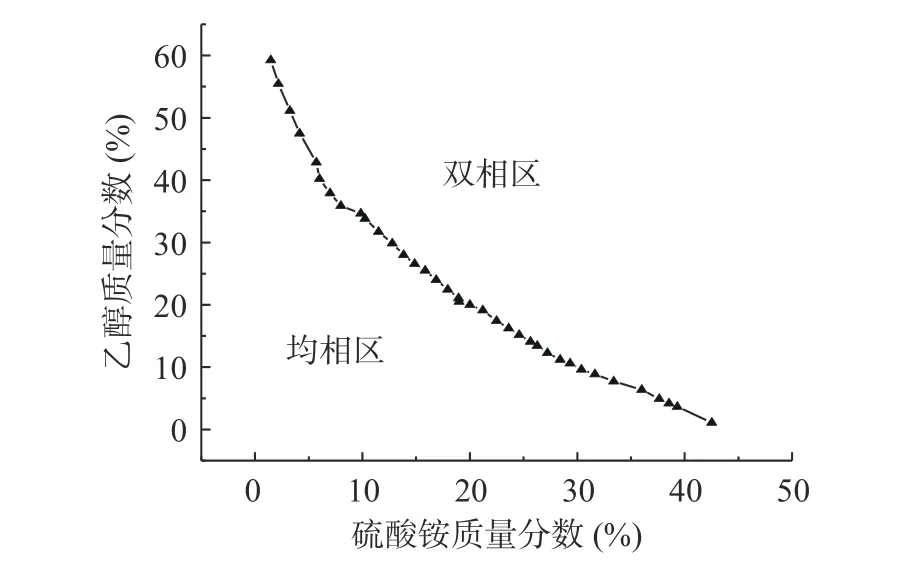
图1 乙醇-硫酸铵双水相相图Fig.1 Phase diagram of ethanol-ammonium sulfate aqueous two-phase system
2.1.2 双水相体系确定
2.1.2.1 硫酸铵质量分数对刺梨黄酮分相萃取的影响 图2 表明,(NH4)2SO4质量分数小于20%时,黄酮得率、萃取率和分配系数均随着质量分数的增加而增加(P<0.05),当(NH4)2SO4质量分数为20%时,刺梨黄酮得率(116.57 mg/g)、萃取率(63.47%)及分配系数(1.57)均达到最高;当(NH4)2SO4质量分数超过20%后,(NH4)2SO4在双水相体系会在中析出,会造成硫酸铵和乙醇对水分子的竞争,极性增大[34],使上相乙醇的体积减小,从而导致刺梨黄酮的溶出受到抑制,使萃取率和分配系数下降。因此C2H5OH-(NH4)2SO4ATPS 中(NH4)2SO4的最佳添加质量分数为20%。
2.1.2.2 乙醇质量分数对刺梨黄酮分相萃取的影响
如图3 所示,随着C2H5OH 质量分数增加,刺梨黄酮得率、萃取率和分配系数呈先增大后减小的趋势(P<0.05)。乙醇质量分数为32%时,3 个指标均达到最大值,分别为122.79 mg/g、95.98%和11.141,而后随着C2H5OH 质量分数的增加,3 个指标均出现下降。这可能是黄酮在乙醇中的溶解度更大,随着C2H5OH 质量分数增加,ATPS 的分相能力增加[35],而在C2H5OH 质量分数过高时,会导致下相盐的析出,同时其他物质在上相中的溶出量也大大增加,这会导致黄酮的析出减少[36]。因此确定C2H5OH-(NH4)2SO4ATPS 最佳的乙醇质量分数为32%。
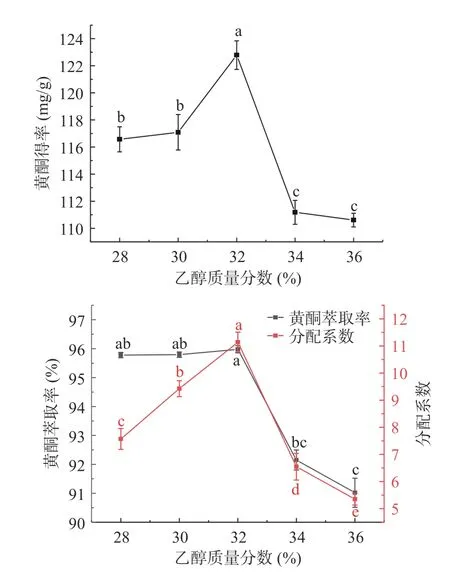
图3 C2H5OH 质量分数对黄酮得率、萃取率及分配系数的影响Fig.3 Effect of ethanol mass fraction on the yield of flavonoids, extraction rate and partition coefficient
2.2 单因素实验
2.2.1 超声功率对黄酮得率的影响 如图4 所示,刺梨黄酮的得率随着超声功率的增加而呈先增加后降低的趋势,当超声功率达到320 W 时,得率达到最大值125.48 mg/g,而当超声功率超过320 W 后,黄酮得率略有减小,无显著性差异(P>0.05)。这可能是由于超声波加速了刺梨粉在提取液中运动,从而增加黄酮的溶出,继续增大超声功率时,功率过大导致刺梨细胞过度破碎,刺梨黄酮类成分发生聚合或分解等反应[37],造成刺梨黄酮得率下降。因此,当超声功率为320 W 时,刺梨黄酮得率较好。
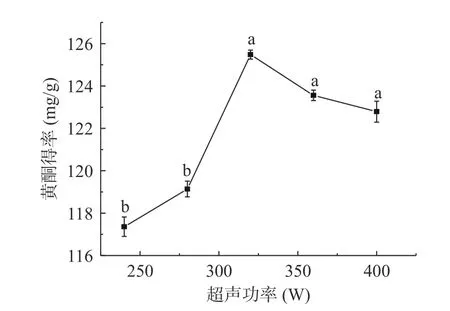
图4 超声功率对刺梨黄酮得率的影响Fig.4 Effect of ultrasonic power on the yield of Rose roxburghii Tratt flavonoids
2.2.2 超声时间对黄酮得率的影响 由图5 知,刺梨黄酮得率随着时间的增加,出现先上升(P<0.05)后下降的趋势,当超声时间增加到30 min 时,黄酮得率达到峰值125.34 mg/g,随后降低。随着超声时间延长,细胞裂解完全,黄酮得率增加;超过一定时间,可能会使刺梨中的皂苷类等物质溶出,使黄酮类物质在上相的溶出量减少[37]。因此,确定黄酮超声提取的最适时间为30 min。
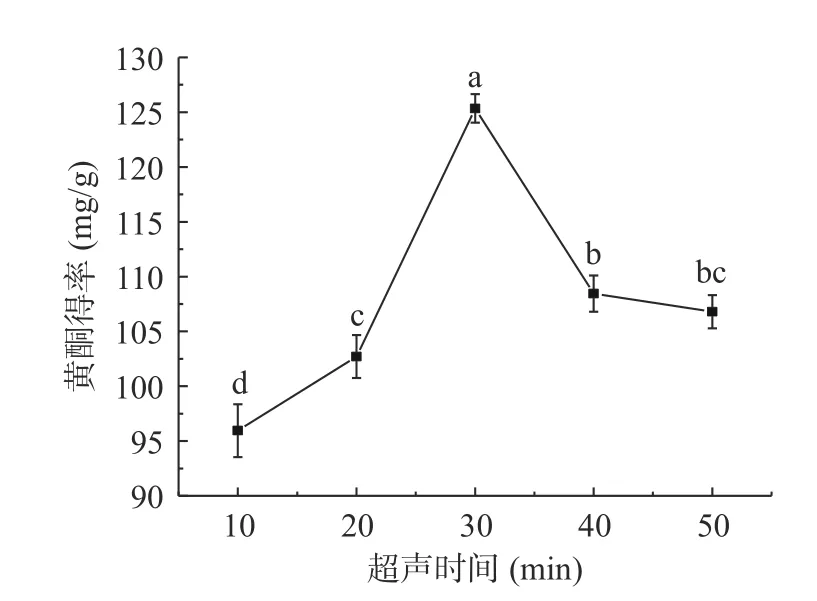
图5 超声时间对刺梨黄酮得率的影响Fig.5 Effect of ultrasonic time on the yield of Rose roxburghii Tratt flavonoids
2.2.3 超声温度对黄酮得率的影响 如图6 所示,刺梨黄酮得率随着温度的增加,出现先上升后下降的趋势(P<0.05),当超声温度达到50 ℃刺梨黄酮得率达到峰值,为125.29 mg/g,继续增大超声温度,黄酮得率下降。可能是当ATPS 温度过高时,黄酮类成分发生结构变化甚至氧化分解等反应[38]。因此,当超声提取温度为50 ℃时,黄酮得率较高。
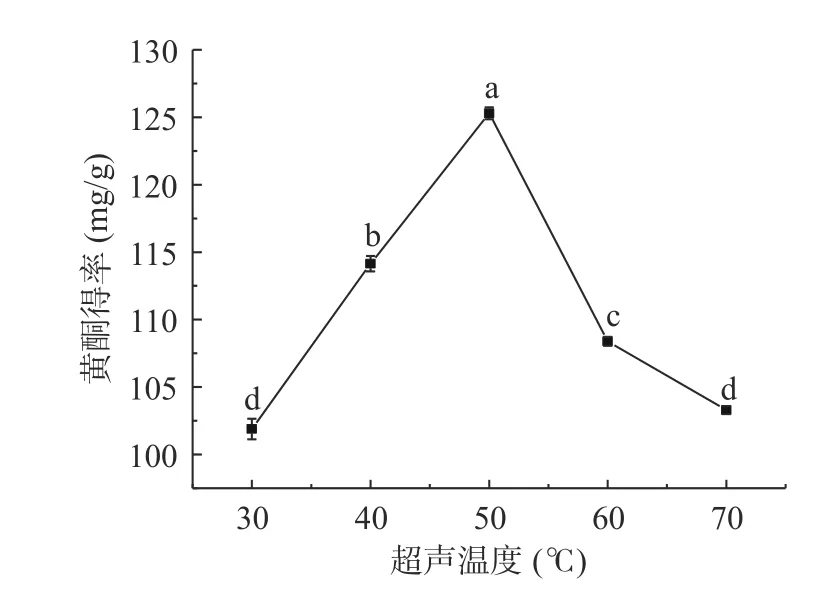
图6 超声温度对刺梨黄酮得率的影响Fig.6 Effect of ultrasonic temperature on the yield of Rose roxburghii Tratt flavonoid
2.2.4 料液比对黄酮得率的影响 由图7 显示,随着料液比的增大,刺梨黄酮得率出现先上升后下降的趋势(P<0.05)。当料液比为1:59(g/g)时,刺梨黄酮得率最大,达到137.19 mg/g,可能是溶剂增多导致提取液与刺梨粉末接触面积增大,促进黄酮类成分自刺梨粉中溶出。但当液料比继续增加到1:69(g/g)时,黄酮得率显著下降(P<0.05)。可能是由于上相体积增大导致黄酮浓度下降,同时还会造成其他物质的溶出加剧,也会抑制黄酮的提取[36]。除此之外,料液比过大会造成C2H5OH 和(NH4)2SO4使用量增加,增加生产成本。综上所述最适料液比为1:59(g/g)。
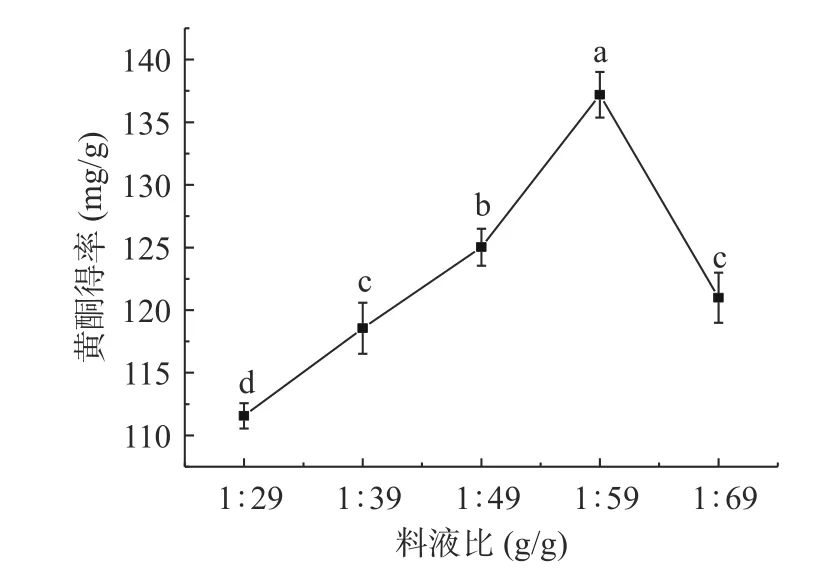
图7 料液比对刺梨黄酮得率的影响Fig.7 Effect of solid-to-liquid ratio on the yield of Rose roxburghii Tratt flavonoid
2.3 响应面试验结果
2.3.1 响应面试验结果分析 采用Box-Behnken 响应面法优化双水相萃取刺梨黄酮的结果如表3 所示。
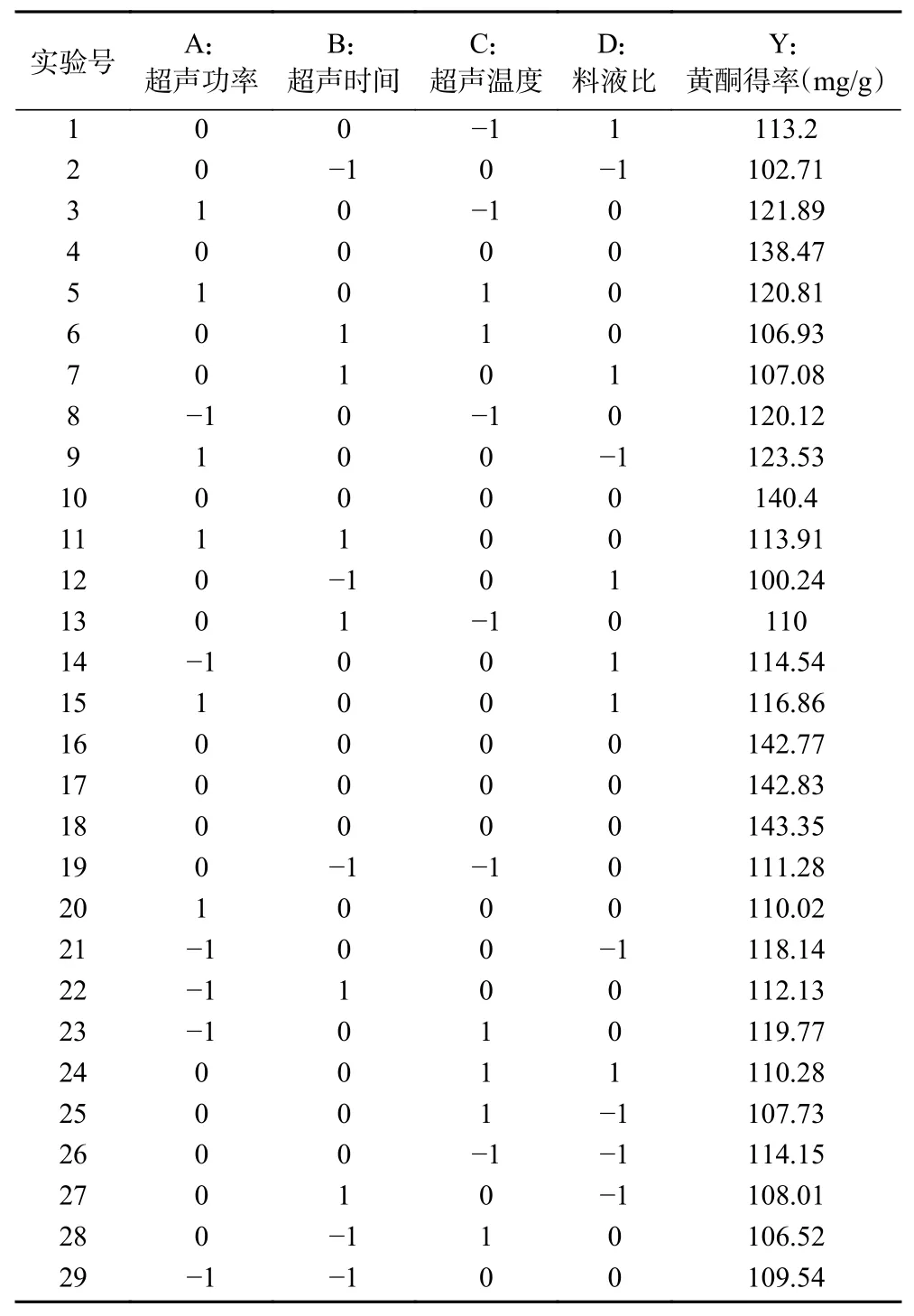
表3 试验设计及对应的响应值Table 3 Experimental design and corresponding response values
采用Design-Expert11 对刺梨黄酮得率结果进行拟合,得到回归方程如下:
方差分析结果如表4 所示,回归模型达到极显著水平(P<0.01),实测值与预测值相近,试验决定系数R2=0.9801、校正决定系数R2adj=0.9601 和变异系数C.V.%=2.13%,表明模型拟合程度较好;超声功率、超声时间、超声温度及料液比之间相互作用的响应面曲线图如图8 所示。通过响应面图可直观地看出各因素之间相互影响的显著性,模型中的AD、BD 对刺梨黄酮得率的影响差异极显著(P<0.01),AB、AC、BC、CD 对刺梨黄酮得率的影响差异不显著(P>0.05),此模型可以对双水相提取刺梨黄酮的结果进行分析和预测。4 个因素对刺梨黄酮得率的影响次序为B>D>A>C,即超声时间>料液比>超声功率>超声温度。
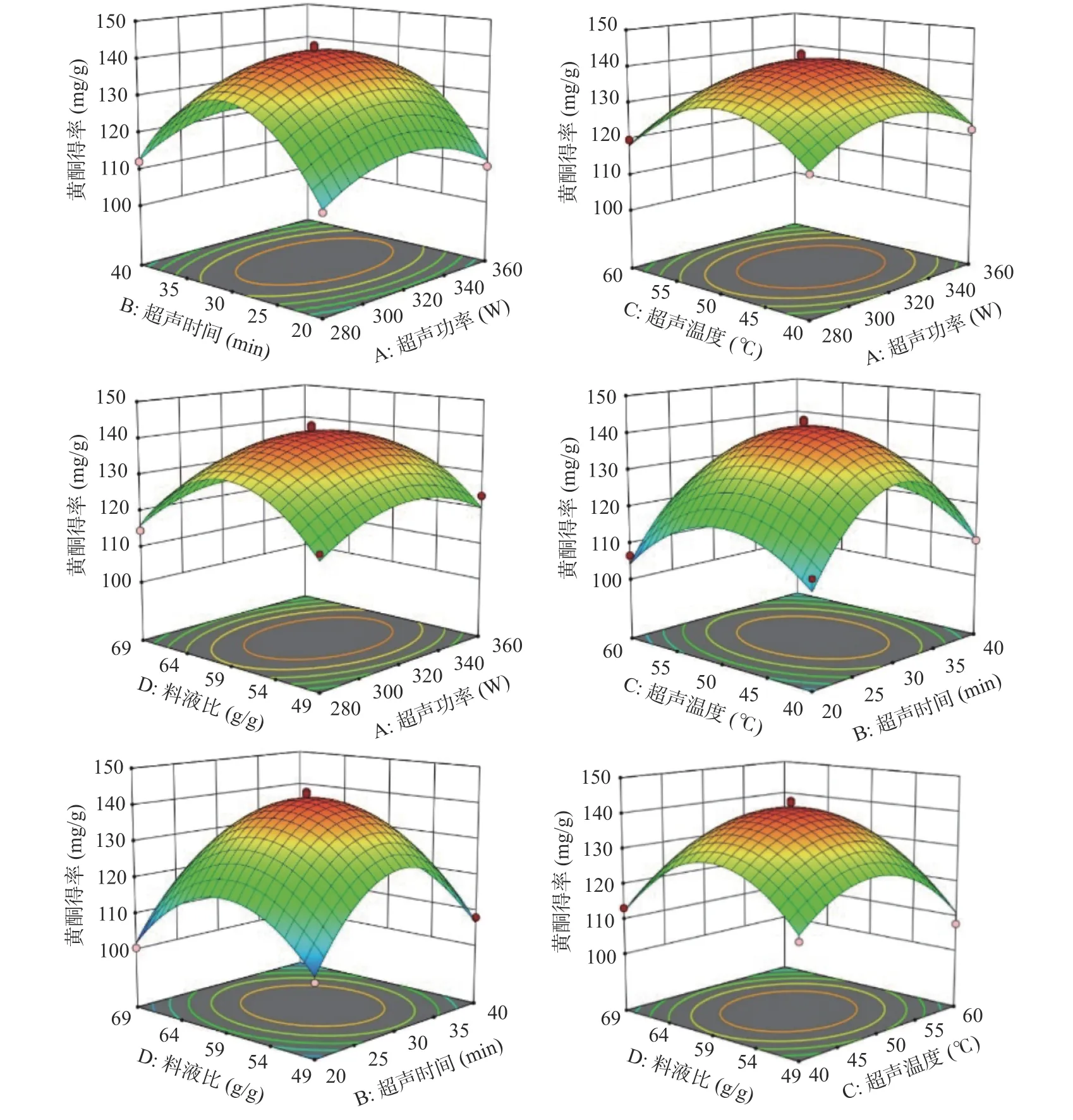
图8 各因素对响应值影响的曲面图Fig.8 Surface plot of the influence of various factors on the response value
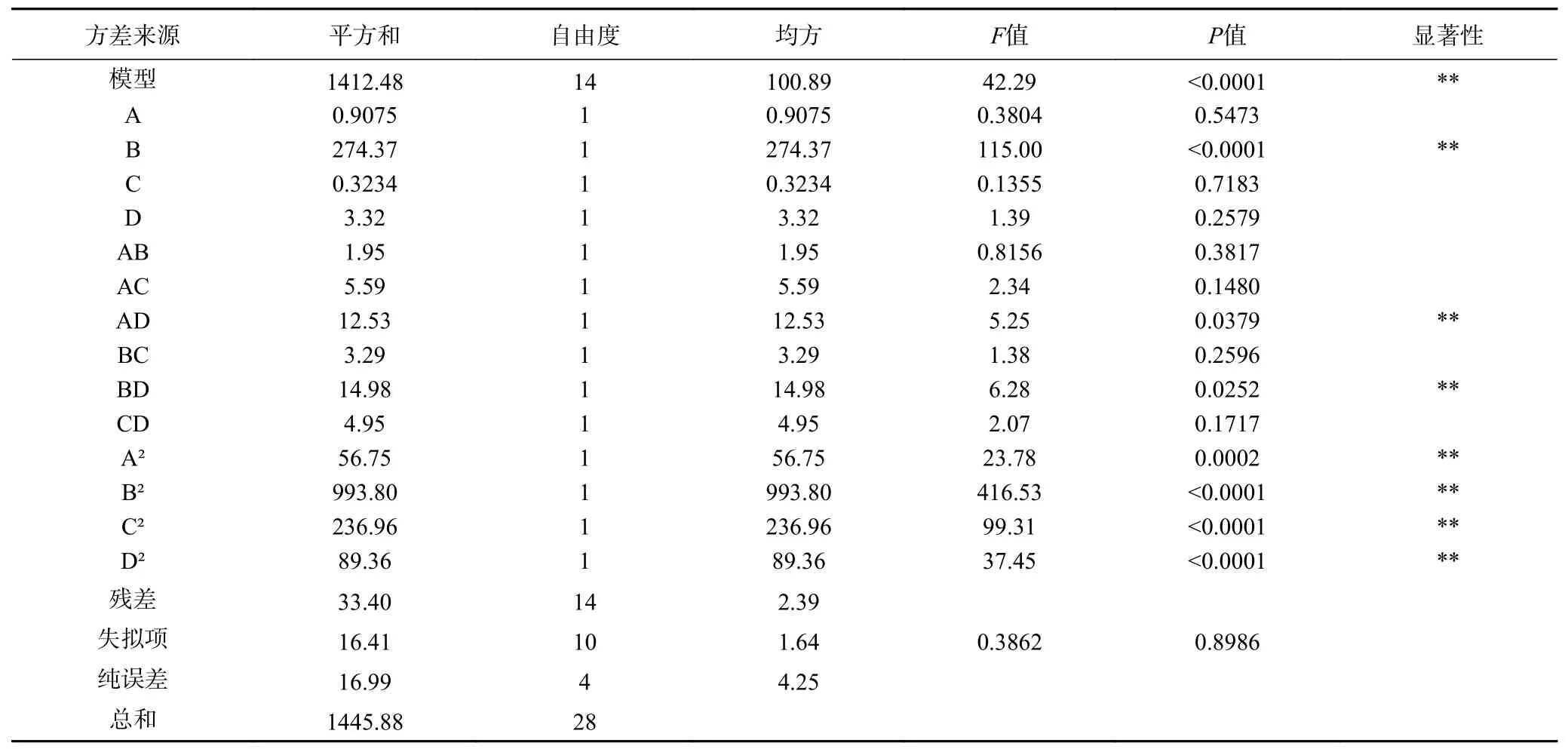
表4 二次模型方差统计分析Table 4 Anaiysis of the variance (ANOVA) for the second-order polynomial model
2.3.2 最佳工艺条件的预测及验证实验 根据Box-Behnken 响应面模型,以最大得率为指标,预测的双水相提取刺梨黄酮的最佳工艺条件为:超声功率322.78 W,时间为30.35 min,温度49.39 ℃,料液比1:58.66 g/g,理论黄酮得率为141.69 mg/g,为了验证预测值的准确性,兼顾实际应用,将最佳工艺条件调整为:超声功率320 W,时间为30 min,温度50 ℃,料液比1:59 g/g,在此工艺条件下进行验证,平行试验3 次,测得刺梨黄酮平均得率为(140.57±1.78) mg/g,与预测值较近,表明该模型适用于刺梨黄酮的提取,所得刺梨黄酮纯度可达18.72%。
2.4 刺梨黄酮提取物对XOD 的抑制效果分析
研究发现,活性物如:木犀草素、芹菜素[39]、表没食子儿茶素[40]、槲皮素[41]等黄酮类物质可以通过与XOD 活性中心结合从而抑制黄嘌呤氧化酶的活性,减少尿酸生成。如图9 所示,刺梨黄酮提取物对XOD 表现出较好的抑制作用,且随着刺梨黄酮提取物浓度的增加,抑制率也逐渐升高,表现出较好剂量-效应关系;通过SPSS 分析计算,得到刺梨黄酮提取物对XOD 的IC50为12.72 mg/mL,与0.24 mmol/L(0.0324 mg/mL)别嘌醇抑制率相当,与葛根水提物(11.24 mg/mL)和老鹳草水提物(11.61 mg/mL)[42]、辣木叶的醇提物(10.55 mg/mL)[43]、银杏叶醇提物(13.67 mg/mL)[44]抑制活性接近。证明刺梨黄酮提取物对于XOD 有较好的抑制效果,可以做为一种天然的XOD 活性抑制剂。
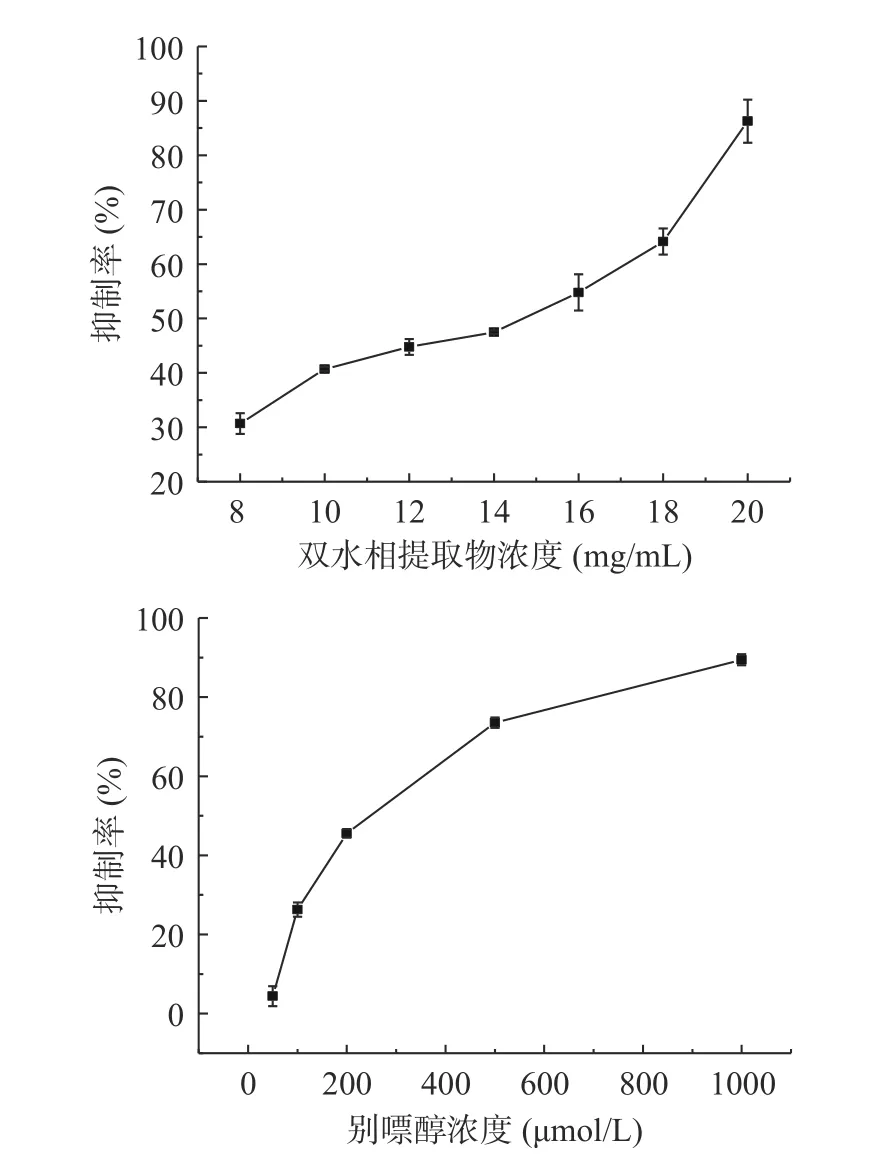
图9 不同浓度的刺梨黄酮提取物和别嘌醇对黄嘌呤氧化酶活力的影响Fig.9 Effects of different concentrations of Rose roxburghii Tratt extract and allopurinol on the activity of xanthine oxidase
3 结论
本研究采用超声辅助双水相技术提取刺梨黄酮,确定最佳提取工艺为:32% C2H5OH~20%(NH4)2SO4ATPS,超声功率320 W,时间30 min,温度50 ℃,料液比1:59 (g/g)。此工艺下刺梨黄酮的得率为140.57 mg/g,其对XOD 的抑制IC50值为12.72 mg/mL。本试验表明刺梨黄酮提取物能够较好的抑制黄嘌呤氧化酶的活性,可以作为一种较好的天然XOD 抑制剂开发利用。

