电针对糖尿病神经源性膀胱大鼠肌球蛋白系统的影响
韩栩珂 ,周冬祺 ,王佳艺 ,朱婵 ,邱现良 ,陈一丁 ,陈秋
1.陕西中医药大学针灸推拿学院,陕西 咸阳 712046; 2.成都中医药大学附属医院,四川 成都 610072;3.泰康西南医学中心,四川 成都 610213; 4.四川大学华西第二医院,四川 成都 610021
糖尿病神经源性膀胱(diabetic neurogenic bladder,DNB)是糖尿病常见的慢性神经病变之一,主要表现为膀胱储排尿功能异常,通常被描述为膀胱感觉下降、顺应性和容量增加、逼尿肌收缩力受损的三联征[1-2]。糖尿病患者DNB发病率为40%~80%,血糖控制理想的情况下仍为25%,在糖尿病进展10年后出现DNB症状的概率高达50%[3-5]。垂体腺苷酸环化酶激活肽(PACAP)在膀胱平滑肌收缩舒张过程中发挥重要作用[6],可能是治疗DNB的关键靶点[7]。PACAP对膀胱平滑肌的调控依赖于环磷酸腺苷(cAMP),此外,作为cAMP关键底物的蛋白激酶A(PKA)也是影响平滑肌功能的重要分子[8]。膀胱平滑肌收缩活动受肌球蛋白系统细胞内Ca2+水平变化引起的磷酸化、去磷酸化影响[9]。肌球蛋白系统相关收缩元件,如肌球蛋白轻链激酶(MLCK)和肌球蛋白轻链(MLC)在调控膀胱储尿排尿过程中起关键作用[10-13]。
针刺被广泛用于治疗膀胱功能障碍和改善神经功能[14-15]。研究报道,电针能有效抑制大鼠膀胱过度活动,改善膀胱顺应性,减少膀胱组织病理损伤,从而改善膀胱功能[16-17]。但其治疗DNB的效应机制尚不明确。因此,本研究通过建立DNB大鼠模型,观察电针对膀胱肌球蛋白系统PACAP/cAMP/PKA信号转导通路的影响,探讨针刺治疗DNB的效应机制。
1 实验材料
1.1 动物
50只SPF级健康SD大鼠,雌性,体质量(200±20)g,购于成都达硕实验动物公司,动物许可证号SYXK(川)2019-189。饲养于标准实验室,温度(22±2)℃,相对湿度50%~60%,12 h明暗交替,自由摄食饮水,适应性饲养7 d后实验。本研究经成都中医药大学附属医院医学伦理委员会审批(2020SL012)。
1.2 主要试剂及仪器
链脲佐菌素(STZ,货号S0130,Sigma公司),柠檬酸缓冲液(货号C2488,Sigma公司),戊巴比妥钠(货号11715,Sigma公司),PACAP38、cAMP、PKA ELISA 试剂盒(货号分别为ZC-54700、ZC-36711、ZC-36517,上海茁彩生物科技有限公司),BCA蛋白定量试剂盒(货号P0009,上海碧云天生物),蛋白提取试剂盒(货号P0033,上海碧云天生物),β-actin(货号AC026,Abclonal公司),p-MLCK抗体(货号ab200809,Abcam),p-MLC 抗体(货号ab2480,Abcam)。一次性无菌不锈钢针灸针(规格0.25 mm×25 mm,可孚医疗科技有限公司)。
SDZ-V电针仪(华佗医疗科技有限公司),Ⅰ型710血糖仪及血糖试纸(江苏鱼跃医疗设备股份有限公司),PHD22/2000微量灌注泵(Harvard仪器),TGL-16G台式离心机(上海安亭仪器厂),GBS002尿动力学分析仪(Laborie公司),MyLabTMSix智能型超声诊断仪(Esaote公司),PowerPacTM-1645070转印电泳仪(Bio-Rad公司),ChemiDocTMTouch ECL发光成像系统(Bio-Rad公司),JEM-1400PLUS透射电子显微镜(JEOL有限公司)。
2 实验方法
2.1 分组、造模及干预
50只大鼠随机分为正常组(10只)和造模组(40只),正常组常规饲料喂养,造模组在前期造模方法[18]基础上进行优化,采用高脂高糖饲料喂养4周后,单次腹腔注射1%STZ溶液35 mg/kg,3 d后尾静脉采血检测空腹血糖,≥16.7 mmol/L为糖尿病大鼠,继续高脂高糖饲料喂养8 周,以饲养笼内垫料呈常态性潮湿为DNB模型造模成功。
将30只DNB大鼠随机分为模型组、电针组和假电针组,每组10只,电针组参照《实验针灸学》[19]取穴,双侧“肾俞”“膀胱俞”“中髎”斜刺约5 mm,双侧“三阴交”直刺约3 mm。得气后,单侧“肾俞”(正极)、“膀胱俞”(负极)为一组,“中髎”(正极)、“三阴交”(负极)为一组,2 组腧穴同时电刺激(疏波10 Hz、密波50 Hz),以大鼠肢体轻微抖动、不嘶叫为度,次日换为对侧组穴。每次30 min,每日1次,每周连续5次,连续8周。假电针组仅将针身固定于相同体表位置,但不刺入穴位,其余操作与电针组相同,但电针仪电源关闭。干预期间继续高脂高糖饲料喂养。正常组和模型组仅固定,不干预。
2.2 一般状况观察
观察造模前后大鼠精神状态、皮毛光泽度及活动度,分别于造模第0、4、8周记录大鼠体质量和空腹血糖。第8周将大鼠移入代谢笼,检测24 h尿量。
2.3 糖耐量检测
电针干预结束后,大鼠禁食12 h,尾静脉采血检测空腹血糖后,腹腔注射50%葡萄糖2 g/kg,于注射后15、30、60、120 min尾静脉采血检测大鼠血糖。
2.4 尿流动力学检测
腹腔注射戊巴比妥钠40 mg/kg麻醉大鼠,仰卧位固定,将导尿管经尿道缓慢插入膀胱,并通过三通管连接至尿动力仪和微量灌注泵,待压力曲线稳定后记录膀胱压力。以生理盐水灌注膀胱(0.3 mL/min),检测大鼠尿流动力学参数(膀胱最大容量、膀胱基础压、漏尿点压和膀胱顺应性),每只大鼠重复检测3次,取平均值。
2.5 取材
尿流动力学检测结束后,迅速切取完整膀胱,用预冷生理盐水洗净,滤纸吸干水分,称量膀胱质量。将部分膀胱组织投入液氮,置于-80 ℃冰箱保存备用。
2.6 透射电镜观察
切取1 mm×3 mm膀胱组织样品,用4%戊二醛和1%四氧化锇固定2 h,丙酮(30%、50%、70%、80%、90%、95%、100%)梯度脱水,包埋,将样品切成50 nm超薄切片,醋酸铀室温染色15 min,柠檬酸铅染色2 min,透射电镜下观察并拍摄图像。
2.7 ELISA检测
取适量膀胱组织,加9倍量生理盐水制成10%组织匀浆,平衡至室温后,根据ELISA试剂盒说明书检测膀胱组织PACAP38、cAMP和PKA含量。
2.8 Western blot检测
使用蛋白提取试剂盒提取膀胱组织总蛋白,BCA法测定蛋白浓度。按照30 μg/孔上样,电泳,湿转法转膜,用5%BSA室温封闭1 h,滴加p-MLCK、p-MLC一抗(1∶1 000)和β-actin一抗(1∶100 000),4 ℃孵育过夜,TBST洗膜3次,每次10 min,滴加二抗,室温孵育3 h,采用ECL法进行显影分析。以β-actin为内参,计算目的蛋白相对表达量。
3 统计学方法
4 结果
4.1 造模前后一般状况
造模过程中,正常组大鼠体质量逐渐增加,血糖平稳,精神状态、活动正常,反应灵敏,皮毛光泽,饲养笼内垫料干燥;造模组大鼠尿量增多,反应迟缓,皮毛晦黯无光,饲养笼内处于持续性潮湿状态。与正常组比较,造模组大鼠第4 周体质量明显增加(P<0.05),空腹血糖明显升高(P<0.05);第8周体质量明显降低(P<0.05),空腹血糖明显升高(P<0.05),24 h尿量增多(P<0.05)。见表1。
表1 大鼠造模前后一般状况比较(±s)

表1 大鼠造模前后一般状况比较(±s)
注:与正常组比较,*P<0.05
?
4.2 电针对模型大鼠糖耐量的影响
与正常组比较,模型组大鼠空腹血糖明显升高(P<0.05),注射葡萄糖后15、30、60、120 min血糖明显升高;与模型组比较,电针组和假电针组大鼠注射葡萄糖后血糖差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠糖耐量比较(±s,mmol/L)

表2 各组大鼠糖耐量比较(±s,mmol/L)
注:与正常组比较,*P<0.05
?
4.3 电针对模型大鼠尿流动力学的影响
与正常组比较,模型组大鼠膀胱最大容量、膀胱顺应性明显升高(P<0.05),漏尿点压明显降低(P<0.05);与模型组比较,电针组大鼠膀胱最大容量和膀胱顺应性明显降低(P<0.05),漏尿点压明显升高(P<0.05),假电针组各指标差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠尿流动力学指标比较(±s)

表3 各组大鼠尿流动力学指标比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
?
4.4 电针对模型大鼠膀胱质量的影响
与正常组比较,模型组大鼠膀胱质量明显增加,差异有统计学意义(P<0.05);与模型组比较,电针组大鼠膀胱质量明显减少,差异有统计学意义(P<0.05)。见表4。
表4 各组大鼠膀胱质量比较(±s,mg)

表4 各组大鼠膀胱质量比较(±s,mg)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
?
4.5 电针对模型大鼠膀胱组织超微结构的影响
正常组大鼠膀胱组织结构无异常;模型组大鼠逼尿肌细胞可见多数线粒体肿胀,线粒体嵴断裂,甚至溶解消失,出现少量自噬体;电针组大鼠逼尿肌细胞可见部分线粒体轻度肿胀;假电针组大鼠逼尿肌细胞部分线粒体肿胀,线粒体嵴断裂、溶解甚至消失,少量粗面内质网轻度扩张。见图1。

图1 各组大鼠膀胱组织超微结构(×12 000)
4.6 电针对模型大鼠膀胱组织垂体腺苷酸环化酶激活肽38、环磷酸腺苷和蛋白激酶A含量的影响
与正常组比较,模型组大鼠膀胱组织PACAP38、cAMP 和PKA 含量明显减少(P<0.01);与模型组比较,电针组大鼠膀胱组织PACAP38、cAMP和PKA含量明显增加(P<0.01),假电针组膀胱组织PACAP38、cAMP 和PKA 含量差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠膀胱组织PACAP38、cAMP和PKA含量比较(±s,pg/mL)

表5 各组大鼠膀胱组织PACAP38、cAMP和PKA含量比较(±s,pg/mL)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.01
?
4.7 电针对模型大鼠膀胱组织磷酸化肌球蛋白轻链激酶和磷酸化肌球蛋白轻链蛋白表达的影响
与正常组比较,模型组大鼠膀胱组织p-MLCK蛋白表达明显降低,p-MLC蛋白表达明显升高,差异有统计学意义(P<0.01);与模型组比较,电针组大鼠膀胱组织p-MLCK 蛋白表达明显升高,p-MLC 蛋白表达明显降低,差异有统计学意义(P<0.05)。假电针组p-MLCK和p-MLC差异无统计学意义(P>0.05)。见图2、表6。

图2 各组大鼠膀胱组织p-MLCK和p-MLC蛋白免疫印迹
表6 各组大鼠膀胱组织p-MLCK和p-MLC蛋白表达比较(±s)
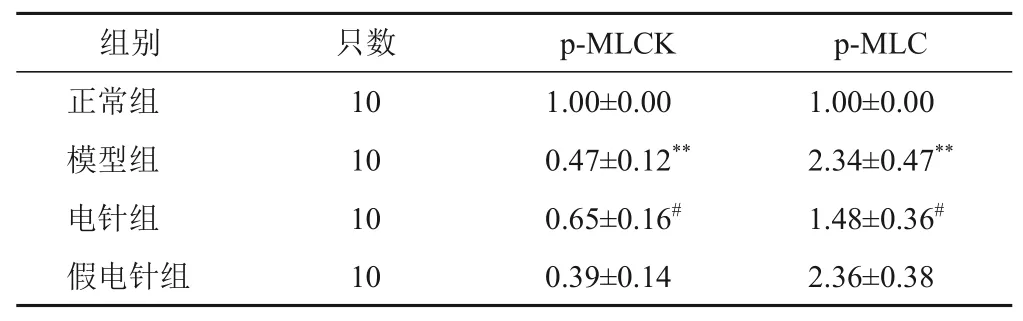
表6 各组大鼠膀胱组织p-MLCK和p-MLC蛋白表达比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,*P<0.05
?
5 讨论
中医学认为,DNB病位在膀胱,涉及多个脏腑。脾气受损,肾阳亏虚是其内因。肾阳不足,脾气虚弱,命门火衰,气化失司,膀胱失约是其主要病机。《针灸大成》有“中髎、下髎主大小便不利”,《证治准绳》有“小便不通,先艾灸三阴交”。中髎、三阴交是治疗膀胱功能障碍相关疾病常用腧穴[20-21]。“经脉所过,主治所及”,中髎深处有S3 神经根前支,三阴交下有L4~S3神经根的胫神经,深层有L5及S1神经节段,针刺可激活神经冲动传导至腰骶部排尿中枢,协调逼尿肌和膀胱括约肌节律性收缩,以调控膀胱功能[22-23]。肾与膀胱相表里,肾俞与膀胱俞配伍可激发足太阳膀胱经气血,达增强气化、通调气机之效。
已有研究使用低剂量STZ联合高脂饮食建立2型糖尿病模型研究DNB 的病理机制,并取得了一些成果[24]。研究发现,STZ联合高脂饮食诱导的DNB大鼠典型特征是血糖和膀胱质量增加[25]。本实验中,模型大鼠膀胱质量、24 h尿量和血糖升高,体质量降低,提示模型大鼠出现膀胱功能障碍及代偿性肥大,符合DNB临床生理特征和发病机制。电针干预后,模型大鼠膀胱质量减少,提示电针能缓解模型大鼠膀胱代偿性肥大。DNB典型尿流动力学特征包括膀胱最大容量和膀胱顺应性增加,漏尿点压降低[26-28],与本实验模型组结果一致。随着DNB进展,Na+-K+-ATP酶代谢紊乱,细胞凋亡,膀胱感觉降低,最大膀胱容量增加。在代偿期膀胱过度活动后,逼尿肌收缩力下降,向失代偿期进展,顺应性增加[29-30]。经电针干预后,模型大鼠膀胱最大容量和膀胱顺应性降低,漏尿点压升高,说明电针能改善模型大鼠膀胱高顺应性状态,双向调节膀胱张力。
作为细胞能量的供应枢纽,逼尿肌细胞线粒体状态决定了膀胱的收缩功能。研究发现,糖尿病模型大鼠膀胱逼尿肌细胞线粒体内膜受损,部分呈空泡状[31]。此外,DNB模型大鼠逼尿肌细胞线粒体出现自噬,推测高血糖引起线粒体氧化磷酸化功能失衡,ATP合成减少,肌肉收缩和神经传导供能不足,出现膀胱功能障碍[32]。本实验发现,DNB模型大鼠膀胱逼尿肌细胞部分线粒体肿胀、自噬,电针组大鼠仅出现轻度线粒体肿胀。提示电针可通过修复逼尿肌细胞受损的线粒体,改善氧化磷酸化,恢复能量代谢,提高膀胱功能的稳定性。
膀胱逼尿肌收缩是Ca2+-ATP交互影响的过程,当细胞内Ca2+水平升高与钙调蛋白结合后,会引起MLCK构象改变,从而影响MLC磷酸化水平以分解ATP,使化学能转化为机械能,触发肌球蛋白和肌动蛋白之间的横桥摆动,以调控逼尿肌活动[33-34]。本研究发现,模型组大鼠膀胱组织p-MLCK蛋白表达降低,p-MLC蛋白表达升高,与相关研究结果[35-37]一致,提示糖尿病进展改变了MLCK活性,促使MLC磷酸化、能量代谢失常及膀胱功能紊乱。电针干预能上调模型大鼠膀胱组织p-MLCK蛋白表达,下调p-MLC蛋白表达,调控能量代谢,改善膀胱功能。PACAP38可催化ATP水解形成cAMP,以活化PKA,使其相关靶蛋白系统磷酸化[38],PKA能对下游肌球蛋白系统收缩元件产生级联反应,通过调控MLCK和MLC磷酸化改变肌球蛋白ATP酶活性,介导平滑肌收缩舒张[39-42]。本实验结果显示,模型组大鼠膀胱组织PACAP38、cAMP和PKA含量明显减少,电针干预后,模型大鼠膀胱组织PACAP38、cAMP和PKA含量明显增加。提示上调PACAP38、cAMP和PKA水平可能是电针治疗DNB的始动环节,进而使MLCK磷酸化、MLC去磷酸化,影响能量代谢,改善模型大鼠膀胱功能障碍。
综上所述,电针通过激活膀胱组织PACAP/cAMP/PKA信号转导通路,调控肌球蛋白系统磷酸化水平,修复逼尿肌细胞受损的线粒体,改善能量代谢以治疗DNB。

