贝莱斯芽孢杆菌角蛋白酶的克隆表达、纯化及酶学性质
殷方荣, 翟李欣, 田乔鹏, 管政兵, 蔡宇杰, 廖祥儒*
(1. 江南大学 生物工程学院, 江苏 无锡 214122;2. 江南大学 教育部工业生物技术重点实验室, 江苏 无锡 214122)
随着人口的增长,人们对食品和饲料行业中蛋白质的需求也在同步增长。 据估计,到2050 年,全球仅对动物源性蛋白质的需求就可能翻一番[1]。 而在2019 年,仅鸡毛就产生了470 多万t[2]。羽毛被归为第三类动物副产品,是低风险的动物材料,所以能作为新的可循环的蛋白质或氨基酸的来源[3-4]。 然而, 羽毛中蛋白质资源的90%左右都为角蛋白,角蛋白由多个氢键和疏水残基的相互作用[5-6]以及二硫键交联的肽链结构组成[7],使其难以被降解,所以即便羽毛有着丰富的蛋白质资源,每年仍有数百万公斤的羽毛会被丢弃到环境中。
丢弃的羽毛一般会被填埋或焚烧处理,但是填埋会侵占宝贵的土地资源,焚化羽毛也会产生有毒气体,从而导致环境的污染[7-8]。 目前一般采用高温高压或化学处理羽毛,直接将羽毛转化为羽毛粉作为动物饲料,但是这种做法会破坏氨基酸,造成资源浪费,消化率和利用率很低,并且容易造成环境污染,成本也较为高昂[9-11]。因此,如何经济环保地提高羽毛粉的利用率,是一个非常有价值的研究方向。
使用酶和微生物从可再生资源中获得有价值的产品已成为一个快速发展的领域[12-14]。 角蛋白很难被降解, 但是角蛋白酶(Keratinase,EC3.4.99.11)可以破坏角蛋白中的二硫键,降解角蛋白,这也是它区别于其他蛋白酶的特质[15-16]。 利用角蛋白酶处理羽毛粉,提高羽毛粉利用率也是羽毛资源利用的主要途径之一。 相比于其他蛋白酶,角蛋白酶具有更广的利用范围,所以其应用价值较高[17-18]。
从自然界中直接分离筛选菌种是开发新酶的途径,然而用野生菌表达角蛋白酶,其纯化分离困难,不利于角蛋白酶的应用。 现在微生物基因组信息资源则提供了一种更快捷的方式——基因挖掘[20]。 利用基因工程克隆表达角蛋白酶有利于酶的分离纯化,也便于后续对酶的酶活性质及应用的探究。 目前用分子生物学手段挖掘潜在的角蛋白酶基因进行表达的研究还不多,因此,筛选降解羽毛粉水平高的菌种,对其角蛋白酶基因进行挖掘并进行酶学性质的探究,可以为表达优良的角蛋白酶提供尽可能多的基因材料,也能为羽毛粉降解提供新的有价值的角蛋白酶。
芽孢杆菌是角蛋白酶的主要来源[19],在芽孢杆菌中发掘新型角蛋白酶对食品饲料行业有潜在的应用价值。 近年来,国内外已经报道了多种微生物来源的角蛋白酶,在这些微生物中,芽孢杆菌仍然是主要的产酶微生物,说明在芽孢杆菌中挖掘潜在的角蛋白酶基因是可行的[21-26]。
先前已有研究人员通过基因挖掘从Bacillus velezensis SYBC H47 中克隆表达了优良的磷酸酯酶、转氨酶、羧酸酯酶等基因,显示出菌株B.velezensis SYBC H47 有着极大的基因挖掘价值和工业应用价值[27-30]。 根据角蛋白酶氨基酸序列同源性分析,其编码基因与枯草杆菌蛋白酶的编码基因有着较高的序列同源性[31]。 作者通过对B. velezensis SYBC H47的全基因组筛选,获得新的角蛋白酶基因(baker1),对其进行了生物信息学分析、克隆表达、纯化和酶学性质研究, 探究了其在羽毛粉降解中的应用,并通过高效液相色谱仪进行验证。
1 材料与方法
1.1 细菌菌株、质粒和培养条件
E. coli DH5a 及BL21(DE3)、质粒pColdⅡ:均购自大连Takara。 在重组菌株的活化和构建过程中,菌株均在Luria-Bertani 肉汤培养基(10 g/L 胰蛋白胨,5 g/L 酵母提取物,10 g/L NaCl)中培养,必要时将氨苄青霉素(100 mg/mL)加入该培养基中。
1.2 生化材料和分子生物学工具
氨苄青霉素、偶氮酪蛋白和酪蛋白:购自上海Sigma-Aldrich;分子生物学工具(DNA 提取试剂盒、质粒提取试剂盒、纯化试剂盒、Bradford 蛋白质测定试剂盒、DNA 及标准蛋白质Marker、DNA 聚合酶、限制性内切核酸酶、T4 DNA 连接酶和IPTG 等):购自Takara;其他化学药品:均为国产分析纯。
1.3 角蛋白酶活性的检测
参考Yang 等人的方法检测角蛋白酶的活性[38]。
1.4 生物信息学分析
根据B. velezensis SYBC H47 的全基因组信息注释(GenBank No:CP017747),共有23 条基因被推定为蛋白酶基因。 对其开放阅读框、信号肽预测、保守结构域等分析参照Huang 等的方法[34]。
1.5 PCR 扩增和重组菌株的构建
B. velezensis SYBC H47 的基因组DNA 通过DNA 提取试剂盒获得。根据之前筛选获得的基因序列,使用Primer Premier 5.0 设计引物,并按照预设方法进行PCR 扩增。 核酸凝胶检测并纯化PCR 产物,之后用设定的限制性核酸内切酶消化,并与相同的内切酶消化后的质粒pColdⅡ进行连接。 将连接的产物转化到E. coli DH5a 中,并通过质粒DNA测序(无锡天霖)来验证。 测序成功后,将正确的重组质粒提取出来,再转化到E. coli BL21(DE3)中进行蛋白质的诱导表达[32]。
1.6 重组角蛋白酶的富集和纯化
低温诱导表达后,离心收获重组菌株,经过超声波破碎并离心, 使得角蛋白酶释放到上清液中。由于重组角蛋白酶还有组氨酸标签,可用镍柱亲和层析来纯化重组角蛋白酶[33]。将得到的粗酶液用0.22 μm 纤维素滤膜过滤,采用AKTA avant 蛋白纯化系统进行纯化。 最后通过5 mL HitrKeTM 脱盐柱(上海GE Healthcare)将纯化的酶脱盐,并使用超滤管(10 000 截留值)浓缩。
通过SDS-PAGE 凝胶电泳分析纯化后的蛋白质相对分子质量[34]。 Bradford 蛋白质测定试剂盒测定蛋白质质量浓度, 标准蛋白质为牛血清白蛋白(BSA)。
1.7 纯化角蛋白酶的生化特性
1.7.1 最佳pH 和pH 稳定性的确定 使用偶氮酪蛋白作为底物, 将等量酶液加入5.0~13.0 的不同pH 缓冲液中测定最佳pH,55 ℃下反应20 min。 另外,在55 ℃下将酶在不同pH 的缓冲液中温育1 h,之后测酶的残余活性,用来研究pH 的稳定性。缓冲液的浓度为50 mmol/L, 分别为pH 5.0~7.0 的Na2HPO4-NaH2PO4、pH 7.0~9.0 的Tris-HCl、pH 9.0~12.0 的甘氨酸-NaOH 以及pH 12.0~13.0 的KCl-NaOH。
1.7.2 最佳温度和热稳定性的确定 在保证最佳pH 时,以偶氮酪蛋白作为底物,在10~85 ℃的设定梯度测定最佳温度。 另外,为了研究热稳定性,在最佳pH 条件下,将酶在10~80 ℃设定梯度,分别温育1 h 后测酶的残余活性。
1.7.3 金属离子对酶活性的影响 用氯化物盐测定金属离子对酶活性的影响,包括NaCl、KCl、CaCl2、MgCl2、FeCl2、ZnCl2、NiCl2、MnCl2、CoCl2和CuCl2, 金 属离子浓度设为2 种,分别为1 mmol/L 和5 mmol/L。将含有酶的缓冲液(最适pH)与不同浓度的不同金属离子混合,在最适温度下反应1 h 后,以偶氮酪蛋白为底物测酶残余活性,不含金属离子的酶活性为100%。
1.7.4 抑制剂、表面活性剂和有机溶剂对酶活性的影响 将含有酶的缓冲液(最适pH)与5 mmol/L 的PMSF、EDTA、DTT 和尿素混合, 体积分数0.5%的DMSO 和吐温80,甲醇、乙醇、异丙醇、丙酮、乙腈、二氯甲烷、正己烷和乙酸乙酯等有机溶剂配成体积分数5%的溶液再与反应体系混合。 以偶氮酪蛋白为底物测酶残余活性,不含添加剂的酶活性为100%。
1.7.5 底物特异性和动力学性质 用偶氮酪蛋白和天然蛋白质为底物测定底物特异性,天然蛋白质包括酪蛋白、羽毛粉、红虫粉、血红蛋白、丝肽和明胶。 采用1.4 中所述方法测定酶活性。 用偶氮酪蛋白、 酪蛋白和羽毛粉在最佳条件下研究动力学参数。 通过使用Origin Pro 9.0 来计算动力学常数Km和Vmax值,并且通过计算公式Kcat=Vmax/[E]获得kcat(t为60 s)。
1.8 蛋白酶水解羽毛粉分析
为了检测羽毛粉的降解效果, 将5 mL 酶液分别与0.2 g 羽毛粉混合,在最佳条件下反应6 h。 取2 mL 反应产物, 加入相同体积的TCA (体积分数10%) 终止反应。 室温下静置30 min,8 000 g 离心10 min 得上清液,过0.22 μm 的滤膜。 通过高效液相色谱仪测定水解产物中的各种氨基酸含量。 同时为了对比角蛋白酶降解效果, 对羽毛粉进行酸水解。 具体方法为:配置体积分数35%的硫酸在100 ℃水解羽毛粉6 h,用BaCO3中和除酸,静置,取适量上清液加入等量TCA 终止反应, 过0.22 μm 的滤膜,用高效液相色谱仪测定产物中的各种氨基酸含量。 羽毛粉的降解效果用酪氨酸的释放量来表示。
2 结果与分析
2.1 生物信息学分析
根据B. velezensis SYBC H47 的全基因组信息注释,共有23 条基因被推定为蛋白酶基因。
为了筛选潜在的角蛋白酶基因, 作者选择了3种典型的角蛋白酶氨基酸序列作为模板,分别来自地衣芽孢杆菌、枯草芽孢杆菌和短小芽孢杆菌。 根据它们的保守结构域, 分析出它们都属于肽酶S8A超家族并且均属于丝氨酸蛋白酶家族中的枯草杆菌蛋白酶类蛋白酶,这与大多数属于丝氨酸蛋白酶类的角蛋白酶是一致的。 因此,将属于肽酶S8A 超家族的基因1、2、3、4 推测为编码角蛋白酶的基因,分别命名为baker1、baker2、baker3、baker4。 对它们的功能注释以及理化性质分析见表1。 同时,预测了4 种角蛋白酶的氨基酸数目和信号肽,baker1和baker2 具有信号肽, 但baker3 和baker4 没有信号肽。

表1 4 种推测的角蛋白酶的功能注释和理化性质Table 1 Function annotations and physicochemical properties of the four-putative keratinase
将BaKer1 氨基酸序列在NCBI 网站中进行BLAST 分 析, 显 示BaKer1 (GenBank accession number:MZ147000)与属于S8 家族肽酶的蛋白酶的同源性最高,是一种丝氨酸蛋白酶。 发现其与来源于Bacillus subtilis S1-4 基因组中编码角蛋白酶BsKER71 的 氨 基 酸 序 列 (GenBank 登 录 号:MN256128)有85.6%的相似性,说明该基因编码的氨基酸序列与已知的角蛋白酶序列有着较高的同源性,是一种值得探究的角蛋白酶基因,对此基因的挖掘将会丰富角蛋白酶基因库。 对BaKer1 与部分相似性高于60%的来源于芽孢杆菌的角蛋白酶进行聚类分析, 可发现BaKer1 与来源于枯草芽孢杆菌的角蛋白酶遗传距离最近,见图1。

图1 BaKer1 与部分来源于芽孢杆菌的角蛋白酶进行聚类分析Fig. 1 Cluster analysis of BaKer1 with some reported keratinases from Bacillus
2.2 角蛋白酶的表达与纯化
将正确的重组质粒转化至E. coli BL21(DE3)感受态细胞中, 得到重组表达菌株。 只有含有baker1 基因的重组菌株显示出角蛋白酶活性,能有效降解羽毛粉。 因此,后续研究集中在这个酶上,命名为BaKer1。 值得注意的是,在诱导目的蛋白质表达时加入分子伴侣pGro7 后,目的蛋白质才成功进行了表达,推测分子伴侣能够帮助重组酶进行成功的折叠与组装,使其能够发挥活性。 在大肠杆菌诱导角蛋白酶中尝试加入分子伴侣是先前没有报道过的,此前研究以大肠杆菌为表达宿主时,有的酶可以成功表达,多数酶易形成包涵体,需复杂的变性才能进行活性研究。 推测形成包涵体的重组酶在表达时不能成功折叠与组装, 若加入分子伴侣,很可能提供帮助。 重组的细胞内蛋白酶活性在15 ℃和200 r/min 下培养24 h 可以达到最高。
BaKer1 的纯化过程见表2。 通过镍柱亲和层析纯化Baker1,纯化倍数为5.91 倍,回收率为12.80%。基因工程菌发酵液粗酶活为(34.59±0.23)U/mL,对于角蛋白酶工程菌而言并不是很高。 与以大肠杆菌作为表达宿主的其他角蛋白酶重组菌的粗酶液相比差别不大,如来源于Bacillus licheniformis BBE11-1的角蛋白酶在E. coli BL21(DE3)中克隆表达后,其发酵液粗酶活为47.8 U/mL[39]。但是以大肠杆菌为宿主进行角蛋白酶的表达,其发酵液粗酶活普遍低于以枯草芽孢杆菌或毕赤酵母为宿主进行表达的重组菌的粗酶活, 推测这与角蛋白酶作用底物广泛有关。重组菌产生的角蛋白酶可能会对重组菌产生一定的毒害作用,角蛋白酶表达量的增加伴随着重组菌的生长减缓。 因此,不同的角蛋白酶对于表达载体及宿主菌的选择也不同,可根据前人研究进行选择并尝试不同表达宿主及载体。
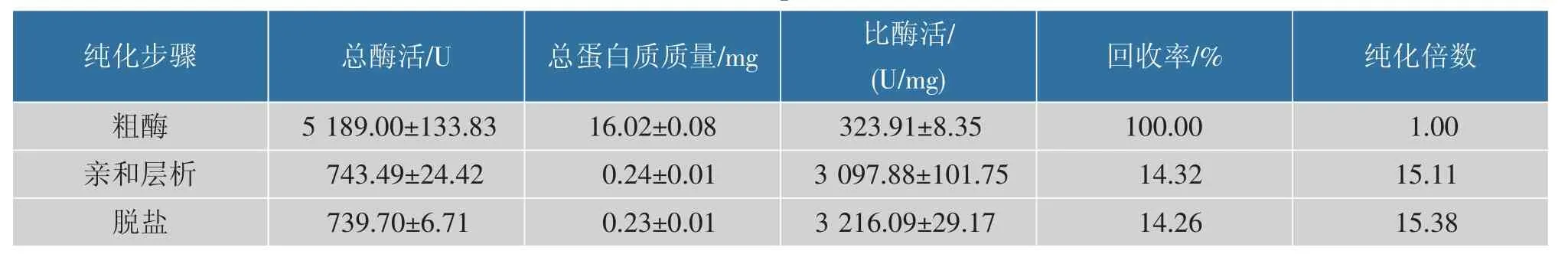
表2 BaKer1 的分离纯化Table 2 Isolation and purifications of BaKer1
SDS-PAGE 显示均匀的蛋白质条带,相对分子质量约为28 000, 与推测相对分子质量大小不一致, 见图2。 这是由于基因序列中含有信号肽和前肽,并且在前肽会自动加工和降解,之后才形成成熟的角蛋白酶。
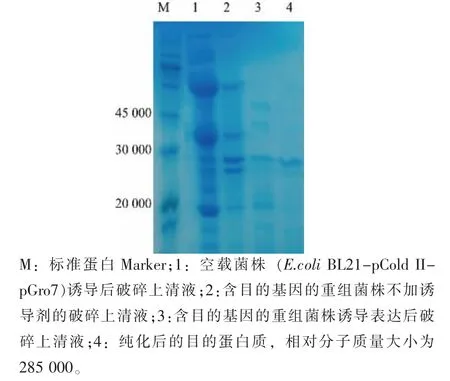
图2 表达产物的SDS-PAGE 分析Fig. 2 SDS-PAGE analysis of expressed products
2.3 序列比对
选取部分芽孢杆菌角蛋白酶序列与BaKer1 序列比对发现,属于丝氨酸蛋白酶的角蛋白酶在多个区域高度保守,保守区域中分布着三联催化体Asp-His-Ser,这对于角蛋白酶发挥活性十分重要。 通过比对发现BaKer1 保守序列与S8A 亚家族一致,见图3。
2.4 pH 和温度对角蛋白酶活性和稳定性的影响
Baker1 的最适pH 和稳定性见图4。 BaKer1 反应最适pH 为9.5,且该酶在pH 6.5~10.5 依然能够保留60%以上的酶活,这与之前有过的大部分文献报道的角蛋白酶的最适pH 是碱性保持一致。然而,当pH>10.5 或者pH<6.5 时,酶活都会大幅度降低。
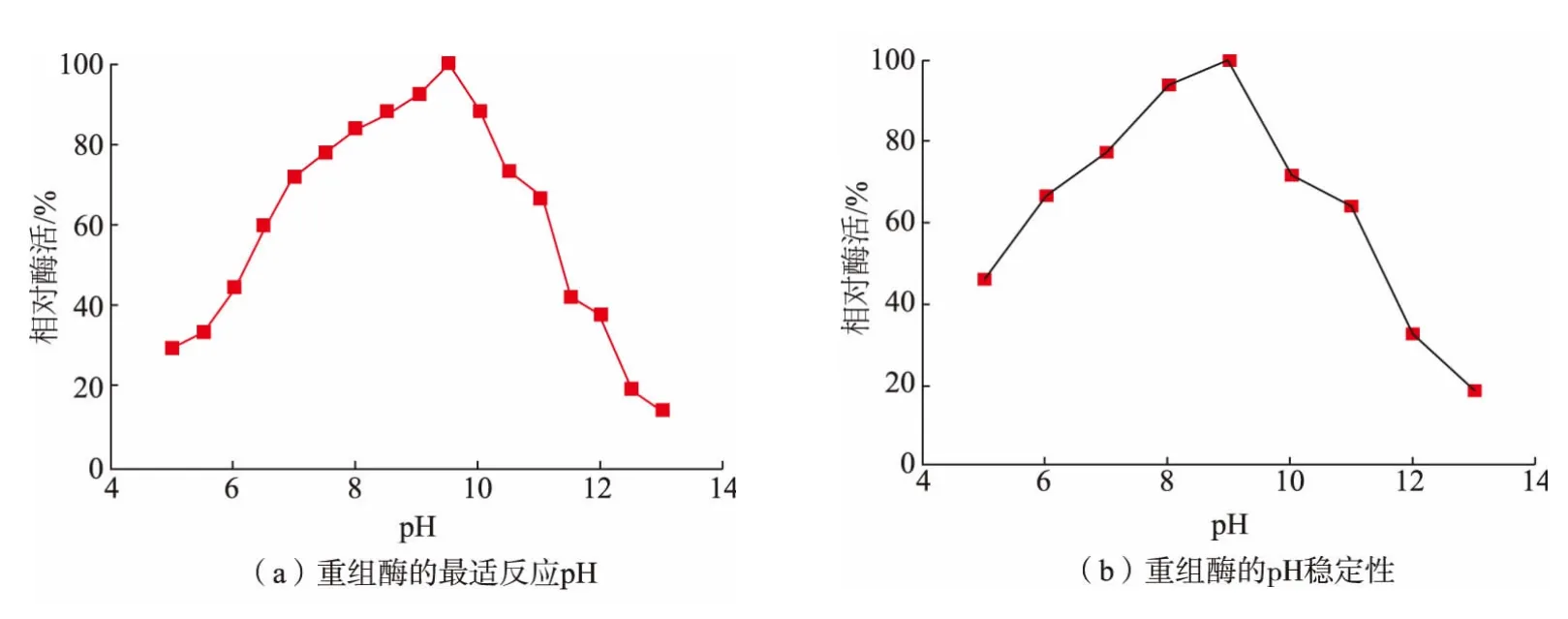
图4 BaKer1 最适反应pH 及pH 稳定性Fig. 4 Optimal pH and pH stability of BaKer1
BaKer1 的pH 稳定性较好, 能在一定的pH 范围内保留着较高的活性。 实际上,对于在碱性环境中的各种应用, 角蛋白酶都表现出极好的应用潜力,目前,许多研究人员也都在开发在碱性条件下稳定性较好的角蛋白酶。
BaKer1 的最适温度和热稳定性见图5。BaKer1最适反应温度为55 ℃;温度在10~50 ℃时,BaKer1可以保留80%以上的酶活; 在高于65 ℃的高温环境下时,酶活极低甚至直接失活。 推测是由于高温致使角蛋白酶变性,从而不能发挥作用。 以上结果表明,BaKer1 为中温蛋白酶。
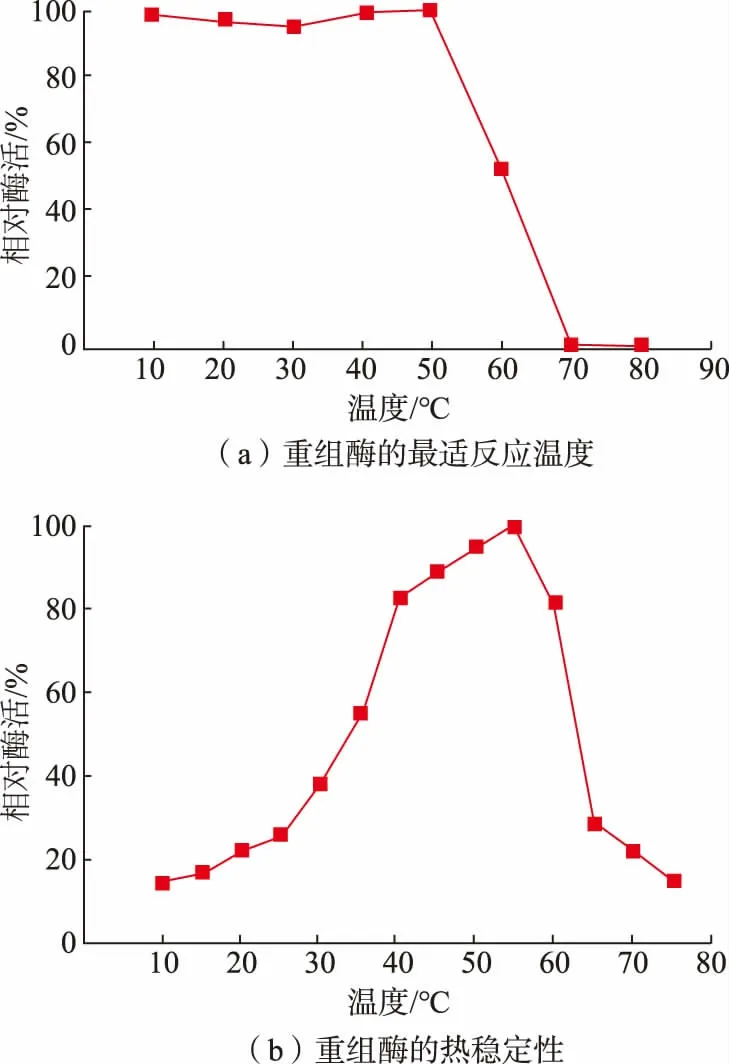
图5 BaKer1 的最适温度和热稳定性Fig. 5 Optimal temperatures and thermal stability of BaKer1
2.5 不同添加剂对角蛋白酶活性的影响
以标准反应组的酶活作为对照组,金属离子对BaKer1 活性的影响见表3。Ca2+对BaKer1 的酶活有显著促进作用, 能将酶活增加到原来的1.45 倍,然而之后随着Ca2+浓度的增高,Ca2+对BaKer1 的促进作用反而减弱。 由于BaKer1 属于丝氨酸蛋白酶,这一类蛋白酶能够被Ca2+显著激活[31],这与实验结果一致。 原因可能是由于Ca2+的存在使酶分子有稳定的活性构象,酶活性受到影响[35]。而Mg2+也表现出一定的激活效果,并且随着浓度的升高,激活作用变强。推测Mg2+和Ca2+的核外电子排列有相似性,从而Mg2+与弱的Ca2+位点可以结合。 有关Mg2+的激活作用原理还需要对角蛋白酶的结构做进一步研究。
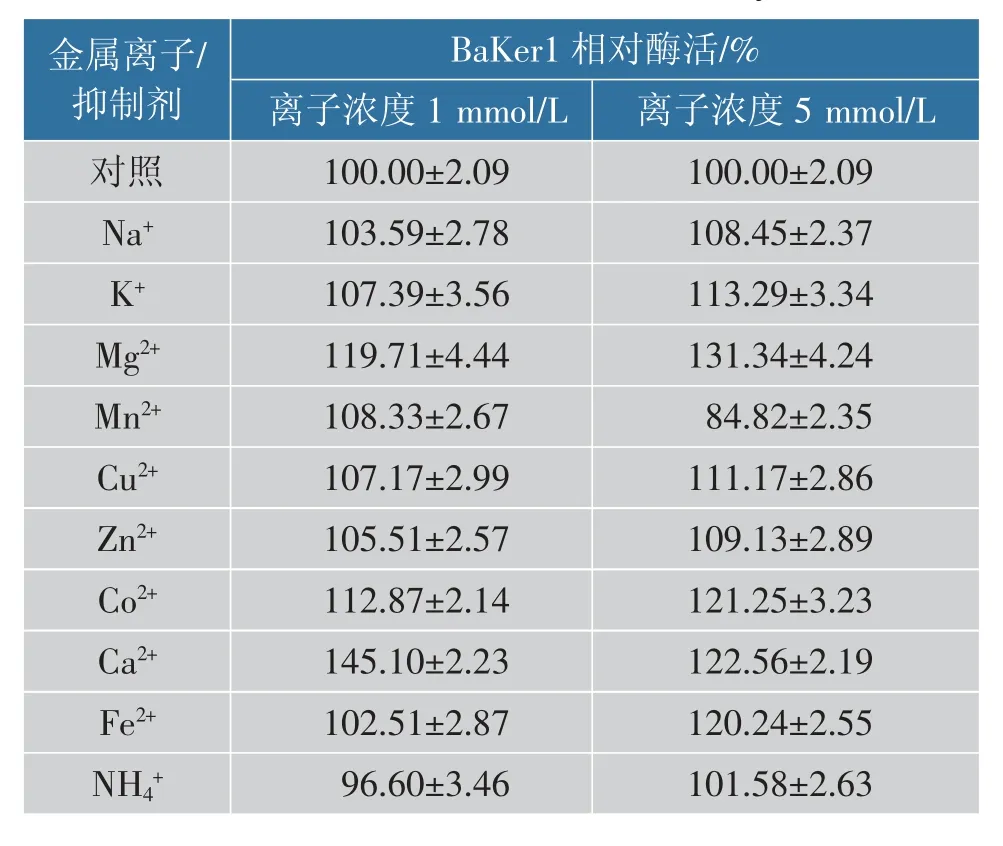
表3 金属离子对BaKer1 活性的影响Table 3 Effect of metal ions on the activity of BaKer1
另外,1 mmol/L 的Zn2+、Fe2+、Mn2+都对BaKer1有轻微促进作用,除了Mn2+在5 mmol/L 时有较明显抑制作用以外,其他离子随着浓度的升高其促进作用更明显;Na+、K+、NH4+对BaKer1 影响不大。
另外,EDTA 显著抑制BaKer1 的酶活性, 表明金属离子对酶活性的重要性, 也解释了Ca2+对BaKer1 酶活的影响。 PMSF 也有非常强烈的抑制作用, 而PMSF 与丝氨酸蛋白酶活性位点的丝氨酸残基能够共价结合[36],说明BaKer1 是典型的丝氨酸蛋白酶。 DTT 对BaKer1 抑制作用不强,表明结构中不存在二硫键。 除了正己烷以外, 其他有机溶剂对BaKer1 均有抑制作用。表面活性剂对其略有促进效果,说明BaKer1 在洗涤剂行业有一定的应用价值,见表4。
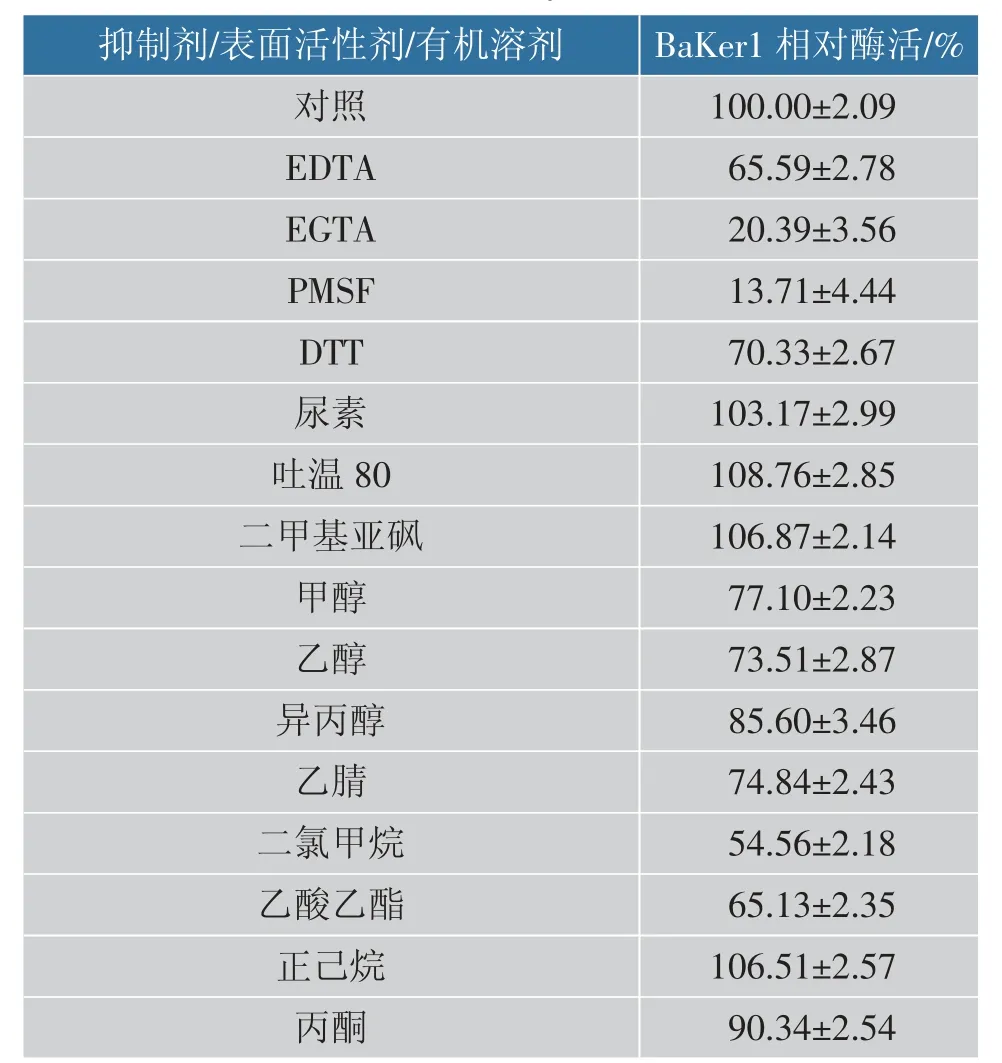
表4 抑制剂、表面活性剂和有机溶剂对重组酶BaKer1 活性的影响Table 4 Effect of inhibitors, surfactants and organic solvents on the activity of recombinant BaKer1
2.6 Baker1 的底物特异性和动力学性质
BaKer1 的底物特异性见表5。BaKer1 对羽毛粉的水解活力很高,说明该酶在羽毛粉再加工利用方面有着极大的潜力。 对于大多数天然蛋白质底物,BaKer1 对它们的水解活性相似, 没有特别的差异,这也符合角蛋白酶底物广泛的特性, 说明BaKer1在许多天然蛋白质的水解中也能发挥一定的作用。另外,BaKer1 不能水解明胶, 而明胶的主要来源是胶原蛋白, 说明在动物的脱毛处理中BaKer1 对皮革中的胶原蛋白不会造成损失,有着潜在的应用价值。
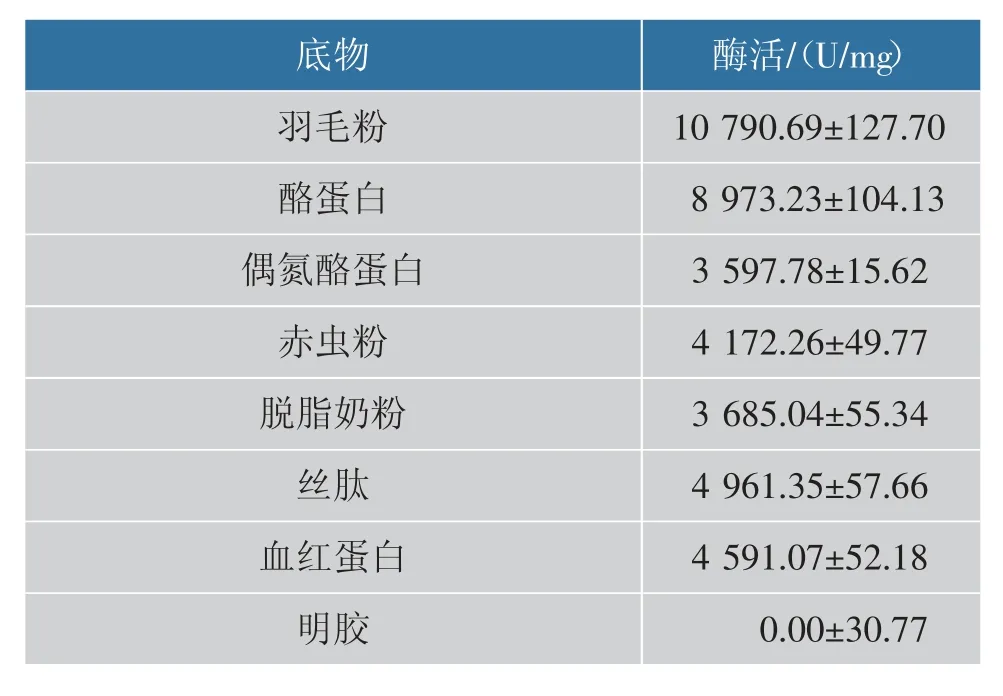
表5 BaKer1 的底物特异性Table 5 Substrate specificity of BaKer1
进一步研究了BaKer1 的催化能力, 根据所测的底物浓度以及反应速率的数据,计算得到了Km和Vmax值,由此也计算出kcat和kcat/Km。其中,Km值表示了BaKer1 与底物的亲和力关系,而kcat/Km可以说明BaKer1 对底物的整体催化能力。 如表6 所示,BaKer1 分别以羽毛粉、偶氮酪蛋白、酪蛋白为底物时,其动力学参数如下:Km值分别是5.06、1.09、1.39 mmol/L;kcat/Km值分别为1 058.24、2 536.54、3 733.79 s·mmol/L。

表6 BaKer1 的动力学参数Table 6 Kinetic parameters of BaKer1
2.7 羽毛粉降解产物分析
羽毛粉的降解部分产物见表7。 羽毛粉中游离氨基酸质量浓度较低,大部分氨基酸质量浓度低于40 μg/mL。 经BaKer1 处理后释放大量氨基酸,其中半胱氨酸释放量最大,其余几种氨基酸的释放量也较高, 说明BaKer1 对提高羽毛粉的营养利用价值有着良好的应用前景。 在相同条件下,BaKer1 处理羽毛粉可达到酸水解效果的33.51%。虽然效果不如酸水解,但是,酶更加绿色环保,并且反应条件温和,成本廉价,对后期产物的再利用也更加安全,说明酶处理法对于羽毛粉的二次绿色加工有着比较高的应用价值[37]。
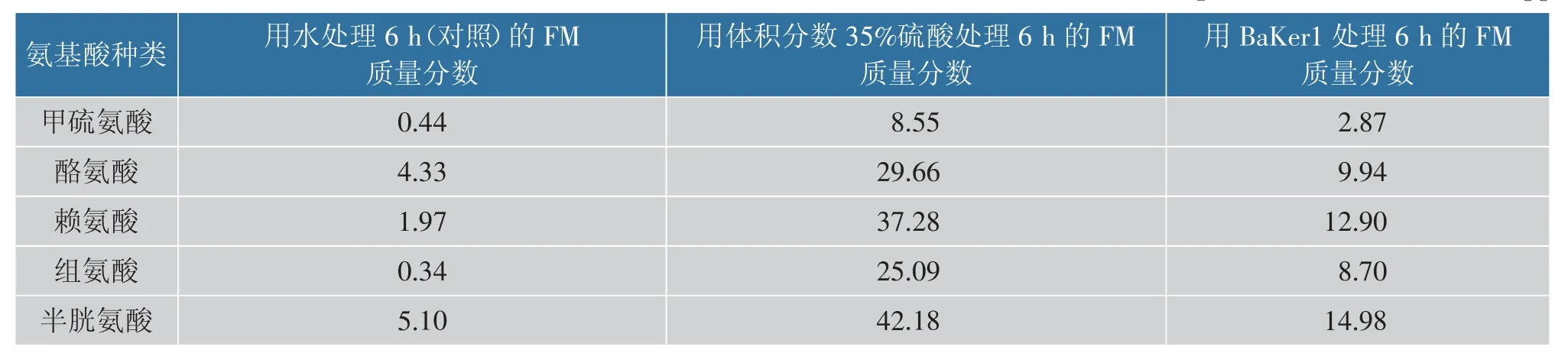
表7 经过发酵和未经过发酵的羽毛粉(FM)中几种氨基酸的质量分数Table 7 Mass fraction of several amino acids in fermented and unfermented feather powder(FM) 单位:mg/g
3 结 语
对B.velezensis SYBC H47 基因组中的所有蛋白酶基因进行生物信息学分析和分类,为进一步研究蛋白酶的功能提供了理论依据。 筛选得到1 个角蛋白酶基因,该基因编码的氨基酸序列含有丝氨酸催化三联体Ser-Asp-His, 通过分析其属于丝氨酸蛋白酶S8A 家族。 将该基因与pCold II 质粒连接,并加入分子伴侣pGro7, 成功构建重组表达载体并导入宿主细胞得到表达。 该酶的最适反应pH 为9.5,最适反应温度为55 ℃,在中温及碱性条件下稳定性和耐受性较好。 Ca2+对BaKer1 有显著促进作用。 EDTA 显著抑制BaKer1 的酶活性,表明酶活性需要金属离子。 PMSF 显著抑制BaKer1 的酶活性,表明它是典型的丝氨酸蛋白酶。 DTT 对BaKer1 抑制作用不强, 这表明它们的结构中不存在二硫键。除正己烷以外, 其他有机溶剂对BaKer1 有明显抑制作用。 分别以羽毛粉、偶氮酪蛋白、酪蛋白为底物研究动力学参数,BaKer1 的Km值分别是5.06、1.09、1.39 mmol/L,kcat/Km值分别为1 058.24、2 536.54、3 733.79 s·mmol/L。 BaKer1 处理羽毛粉,可释放大量氨基酸,其中半胱氨酸释放量最大。 BaKer1 处理羽毛粉效果达到酸水解的33.51%。虽然效果不如酸水解,但更加绿色环保,并且反应条件温和,成本廉价, 后期产物安全, 有利于产物的再利用, 说明BaKer1 对于羽毛粉的二次绿色加工提高营养价值有良好的应用前景。

