miRNA 影响苯并[a]芘诱发毒性的机制研究进展
袁 莉, 贾颖宇, 骆 莹
(1. 陕西师范大学 西部果品资源高值利用教育部工程中心, 陕西 西安 710119;2. 陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
苯并[a]芘(B[a]P)是由芘和苯稠合而成的一类多环芳香烃类化合物(PHAs),主要包括1,2-B[a]P、3,4-B[a]P。 它广泛存在于水、空气、土壤以及煤、石油等能源物质燃烧所产生的各种烟气中[1]。 此外,食物在熏制、烘烤和煎炸等高温加工过程中,脂肪、胆固醇、蛋白质和碳水化合物等经过一系列反应产生包括B[a]P 在内的PHAs 类物质。 B[a]P 不仅会污染食品、气体、水体,且具有极强的生物毒性,如致癌性、致突变性及间接致畸性。 它是世界上公认的致癌物之一,也是研究较深入的致癌PHAs 之一。
微小RNA(miRNA)是单链(17~25 个核苷酸)非编码RNA, 通过mRNA 降解或翻译抑制负调控特定的靶基因[2]。 miRNA 是由RNA 聚合酶II 在细胞核中转录的一种转录产物pri-miRNA[3],然后在核酸酶Drosha 和辅因子DGCR8/Pasha 组成的微处理器复合体中被剪切成具有60~70 个核苷酸5′磷酸基团和3′末端二核苷酸茎环结构的miRNA 前体(per-miRNA)[4]。 miRNA 参与调控细胞增殖、分化、凋亡、稳态和应激反应等多种生命活动[5]。 其作用机制主要为以下两种情况: 第一种是miRNA 与靶mRNA 完全互补结合, 降解mRNA 并抑制其翻译;第二种是成熟的miRNA 不与靶mRNA 非翻译区完全互补结合,在mRNA 结构不被破坏的前提下抑制其翻译。 根据转录机制可将miRNA 分为独立转录miRNA、寄生转录miRNA 及共转录miRNA[6]。
近年来,miRNA 被广泛研究, 发现和鉴定的miRNA 也越来越多。 截至2021 年,已报道人类有2 693 个成熟的miRNA(miRBase v22.1)[7-8]。 诸多研究表明,一些miRNA 表达的改变与B[a]P 的毒性作用密切相关。 因此,作者以miRNA 在B[a]P 诱发毒性过程中的表达和功能展开综述。
1 miRNA 在B[a]P 诱发癌变过程中的作用
miRNA 是一种新的肿瘤发生发展调控因子,既可下调原癌基因表达, 也可下调抑癌基因的表达。miRNA 在多种组织中表达稳定,具有较高的敏感性和特异性,且具有检测简单、快捷及价格低等多种优势,使miRNA 成为肿瘤的特异性检测标志物,有助于肿瘤的诊断和治疗[9]。 miRNA 在B[a]P 诱发毒性过程中的作用见表1。
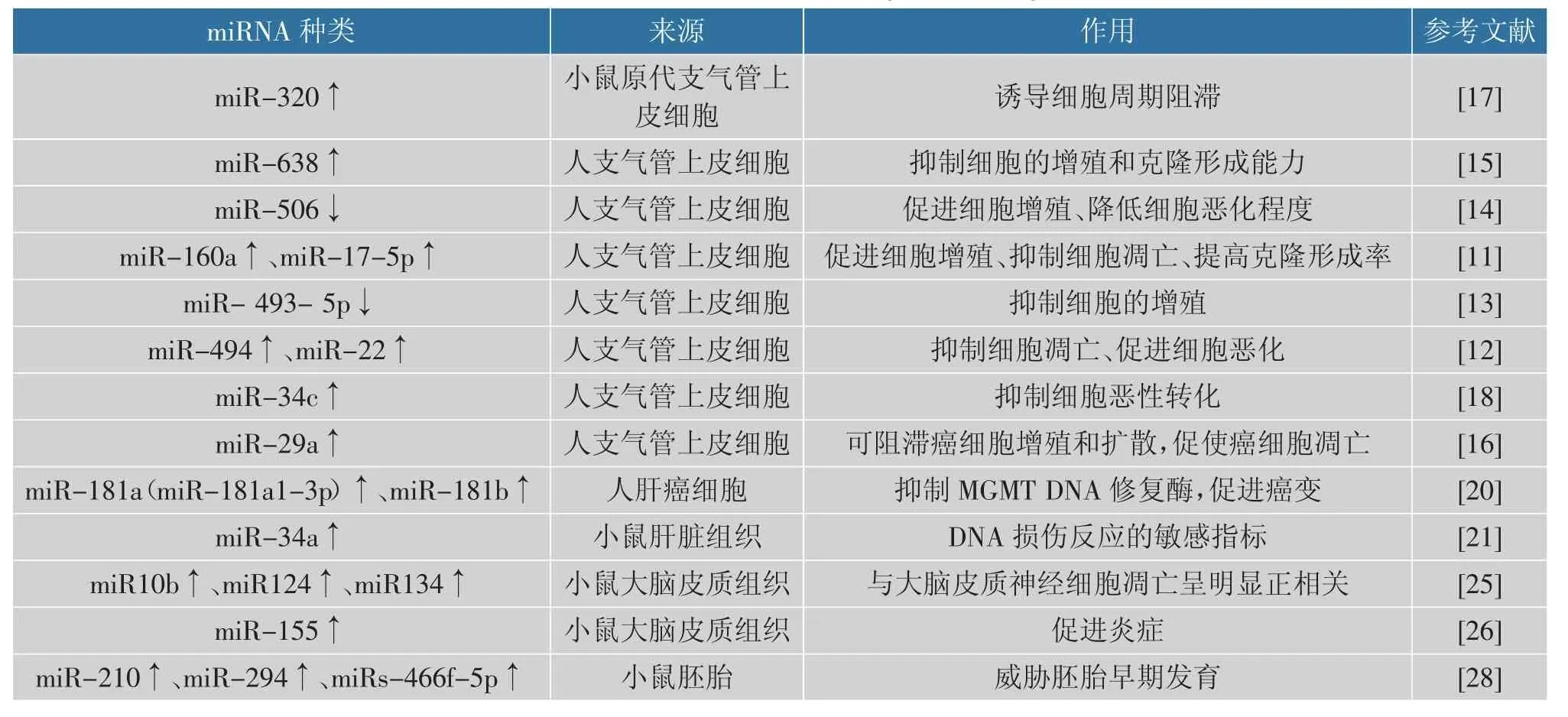
表1 miRNA 在B[a]P 诱发毒性过程中的作用Table 1 Effect of miRNA on toxicity induced by B[a]P
1.1 肺癌
miRNA 与肺癌的相关性备受关注。Halappanavar 等人[10]对口服B[a]P 的小鼠肺部DNA加合物、基因和miRNA 表达进行定量测定,发现高剂量组(300 mg/kg)和低剂量组(150 mg/kg)中分别有13 个和9 个miRNA 表达异常, 其中,miR-34c、miR-34b-5p、miR-29b、miR-141、miR199a-5p、miR-125a-5p 和miR-200c 均上调,miR-122、miR-142-3p、miR-144 和miR-142-5p、miR-150 和miR-451 均下调。 这表明miRNA 与B[a]P 导致的肺毒性密切相关。
肺癌多发于上皮细胞。 最近的研究发现,B[a]P在诱导人支气管上皮细胞恶性转化过程中,miR-17 -5p、miR -22、miR -106a、miR -320、miR -494、miR-638、miR-506 和miR-34c 等多个miRNA 表达异常。 吴延等人发现,在anti-BPDE 恶性转化细胞中miR-160a 和miR-17-5p 的高表达能够影响16HBE- T 人气道上皮细胞的增殖能力、 细胞周期和细胞凋亡率[11],表明miR-106a 和miR-17-5p 在anti-BPDE 致癌过程中发挥类癌基因的作用。此外,anti-BPDE 恶性转化细胞中miR-494 和miR-22 可在转录后水平反向调控靶基因PTEN 表达, 发挥类癌基因作用[12]。 mir-493-5p 表达水平的改变会影响anti-BPDE 恶性转化细胞的增殖能力, 低表达的mir-493-5p 可能也发挥了类抑癌基因的作用[13]。Yao 等人[14]认为miR-506 对癌基因N-Ras 具有靶向作用,且作为潜在的肿瘤抑制因子发挥作用。 这些研究表明,miRNA 在B[a]P 致癌过程中可调控癌基因或抑癌基因的表达。Li 等人发现miR-638 通过靶向BRCA1 参与B[a]P 诱导的癌变过程[15];miR-29a可能主要在G1/S 和S/G2 期修复DNA 损伤,促进细胞从G1 期向S 期转变, 即miR-29a 可阻滞癌细胞增殖和扩散,促使癌细胞凋亡,降低5-脂氧合酶介导B[a]P 活化致癌作用[16];抑制miR-320 表达可削弱B[a]P 导致的小鼠原代支气管上皮细胞G1 期阻滞,并通过调控CDK6 的表达影响细胞周期[17]。 同时,miR-494、miR-34c 也可影响B [a]P 暴露后的细胞周期[18],从而促进细胞的转化。
1.2 肝癌
肝细胞癌(hepatocellular carcinoma,HCC)是发病率和致死率较高的一种肿瘤疾病,多由慢性肝硬化、病毒感染(HBV、HCV)等慢性肝脏疾病导致。miRNA 的异常表达在HCC 的发生、 发展过程中发挥重要作用。
miR-181 家族的成员 (miR-181a-1-5p、miR-181a-2-5p、miR-181b-1-5p 和3p 以及miR-181b-1)已经被证明参与了肝癌发生[19]。 Florian 等人[20]对暴露B[a]P 后的小鼠肝脏基因表达谱进行分析发现,miR-181 家族的两个成员miR-181a 和miR-181b表达上调,且mir-181a-1-3p 持续高表达,可能通过抑制MGMT DNA 修复酶从而引发癌变。 B[a]P 暴露会导致肝脏DNA 加合物的形成和突变分子中lacZ转基因的突变。 但是,B[a]P 暴露28 d 后,小鼠肝脏miRNA 的变化很小, 仅有miR-34a 发生了显著改变,即使在最低剂量(25 mg/kg)的B[a]P 中,miR-34a 的表达也显著升高, 因此认为miR-34a 可能是肝脏DNA 损伤反应的敏感指标[21]。
长期暴露于高诱变剂量的B[a]P 会引起肝毒性和肺毒性,并干扰miRNA 的表达。 相比之下,B[a]P对肺部miRNA 的影响更强烈。 诸多研究表明,miRNA 在B[a]P 诱发肺癌过程中起着重要的调节作用,其有望作为B[a]P 诱导肺癌的生物标志物,可用于肿瘤的早期筛查。 可能由于miRNA 在肝脏中稳定性较高,所以对于miRNA 在B[a]P 诱导肝癌的研究相对较少。 也有研究表明B[a]P 可诱导小鼠肝癌和结肠癌[22-23],但有关miRNA 在B[a]P 诱导其他癌症中的研究很少,因此未来的研究可以更多集中在暴露B[a]P 后其他癌症组织中早期miRNA 的反应。
2 miRNA 在B[a]P 诱发神经毒性中的作用
B[a]P 具有高度亲脂性,可透过血脑屏障进而威胁神经系统。 有研究发现,腹腔注射B[a]P 可使小鼠表现出学习和记忆功能障碍、自发活动减少和抑郁样行为增加[24],说明B[a]P 能诱发小鼠神经毒性效应。 在B[a]P 致小鼠抑郁样行为中,小鼠皮质组织中miR-10b、miR-124、miR-134 及miR-155 的高表达可能是B [a]P 致神经细胞损伤的原因。 其中,miR-124 和miR-134 的表达上调最显著,可能是主要机制[25]。 miR-10 有miR-10a 和miR-10b 共2 种成熟序列,与结肠癌、肺癌及胰腺癌等癌症的发生、发展有紧密联系。 研究表明,B[a]P 染毒组小鼠大脑皮质miR-10b 表达上调,且与大脑皮质神经细胞凋亡呈明显正相关;miR-124 是神经系统中表达最丰富的miRNA,miR-134 是神经系统中高度特异表达的miRNA,在神经系统发育的过程中,这2 种miRNA在促进神经干细胞向神经元分化方面发挥作用。B[a]P 染毒后,miR-124 和miR-134 表达上调最显著,且与大脑皮质神经细胞凋亡呈正相关,这表明它们与神经细胞凋亡密切相关, 该实验还验证了BDNF 为miR-134 的靶 基 因,BDNF/TrkB/CREB 信号通路被抑制是B[a]P 导致神经细胞损伤的主要原因。炎症模型小鼠神经细胞中miR-155 水平显著升高,miR-155 被敲除后可减轻炎症反应。 同时,B[a]P高剂量组(10 mg/kg)的小鼠大脑皮质组织miR-155表达上调,且小鼠有明显炎症反应,表现为肛门和眼部黏膜红肿,这表明高表达miR-155 在B[a]P 诱发神经毒性过程中可能发挥了促炎作用[26]。
3 miRNA 在B[a]P 诱发生殖毒性中的作用
据报道,长期接触亚致命剂量(10 μg/kg)的B[a]P 会影响类固醇生成和精子生成,导致成年雄性大鼠的生育能力下降[27]。 Brevik 等研究了雄鼠暴露于B[a]P 对发育中的小鼠胚胎miRNA 表达的影响[28],结果发现小鼠胚胎中的几种miRNA 表达异常, 一些失调的miRNA 的靶基因在许多不同的途径中富集, 这些途径可能与发育中的小鼠胚胎有关,在某种程度上可能对胚胎的发育有害,基于公开可用的数据库鉴定了一些可能作为B[a]P 介导的遗传毒性应激的全局标记的miRNA 靶基因, 发现miR-210、miR-294 和miRs-466f-5p 在组织中高度表达,但相关作用机制尚不明确,需要进一步研究来解释早期胚胎miRNA 的表达失调。
4 miRNA 与多环芳烃受体
4.1 多环芳烃受体简介
多环芳烃受体 (AhR) 是碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH) 转录因子超家族中PAS (periodicity /aryl hydrocarbon receptor nuclear translocator /single-minded,PAS) 的亚家族成员之一,是一种配体激活转录因子[29]。 AhR 具有多种配体,除了PAHs、PCBs、卤代芳烃等外源性配体还有大量内源性植物化学物质[30]。当无配体结合时,大多数AhR 位于细胞质中, 与热激蛋白90 (heat shock protein 90,HSP90) 二聚体及乙型肝炎病毒X 蛋白结 合 蛋 白 2 (hepatitis B virus X protein -associatedprotein 2,XAP2)结合,形成复合物。 除了HSP90 和XAP2,AhR 复合物中还包括其他的蛋白因子如p23,可促进AhR 与DNA 的结合能力,也能促进基因的转录。 ARNT 是AhR 核转位蛋白,存在于许多动物、植物以及原核生物中,它位于细胞核内,并在体内大量表达。
AhR 与配体结合并被其激活后,AhR 与ARNT形成二聚体,之后进入细胞核发挥作用。 AhR 直接或间接调控大量基因, 这些基因参与多种生化途径,包括能量代谢、脂质和胆固醇合成、异生素代谢等[31]。 AhR 还参与了对细胞正常稳态至关重要的各种信号通路,这些信号通路涵盖了生理学的多个方面,如细胞增殖和分化、细胞运动和迁移、炎症等,而这些生理过程的失调会引起机体相应疾病的发生[32]。
4.2 多环芳烃受体的作用机制
在缺乏配体的情况下,AhR 与HSP90、XAP2 以复合物的形式存在于细胞质中,而当配体与AhR 结合后,复合物中的其他成分解离出来,游离的AhR进入细胞核中与ARNT 结合[33]。 AhR 与ARNT 形成的二聚体转位至核内,与外源性化学物质调节元件(xenobiotic regulative element,XRE)结合,介导一系列外源性代谢酶的表达,包括I 相代谢酶(主要是细胞色素P450 超家族成员,如CYP1A1、CYP1B1 等)和II 相代谢酶(谷胱甘肽转移酶、葡萄糖醛酸转移酶等)的表达,从而使机体对外源性化合物产生毒性反应[34]。
4.3 miRNA 对B[a]P 诱发AhR 激活的影响
有研究表明,AhR 与miRNA 之间存在一定联系,AhR 的表达对于细胞miRNA 水平的生理调节是必不可少的, 阐明AhR 和miRNA 之间的功能关系可能会发现AhR 的其他新的非配体依赖性作用。
AhR 配体B[a]P 可以改变miRNA 表达,但是对于AhR 是否能独立影响miRNA 表达尚不清楚。Hecht 等人对AhR 的存在是否影响miRNA 表达水平进行了研究[35],分析了AhR-/-和AhR+/+小鼠的肺成纤维细胞(即没有外源性配体)中miRNA 表达。 结果发现,与AhR+/+细胞相比,许多miRNA 在AhR-/-中的表达差异超过3 倍, 其中,miR-196a 和miR-146a 表达下调,miR-134 表达上调。 进一步通过RT-qPCR 验证miR-134、miR-146a 和miR-196a 的表达水平后发现,AhR 可促进暴露于1 μmol/L B[a]P的AHR+/+细胞中miR-196a 的表达; 将AhR-/-和AhR+/+成纤维细胞与未处理细胞相比, 发现B[a]P 作用24 h 后miR196a 表达显著降低。 AhR 配体B[a]P使得miR-196a 表达减少的同时,AhR 蛋白质水平也减少, 表明AhR 表达对提高肺纤维细胞中miR-196a 的基础水平至关重要。 研究发现由TCDD(2,3,7,8-四氯二苯-p-二口惡英)和DIM(3,3’二吲哚甲烷) 激活的AhR 参与了乳腺癌细胞中miR-212/132 的上调,且AhR 通过与miR212/132 启动子结合进而调节miR-212/132 的转录[36]。 此外,如图1所示,miR-125b 作为AhRR 的抑制剂可控制AhR活性和细胞存活, 用miR-125b 模拟物转染NRK52E 细胞可以降低AhRR 水平,转染miR-125b(miR-125b-ASO)的反义寡核苷酸(ASO)可延缓顺铂降低细胞活力,促进了AhRR 的表达,表明miR-125b 可抑制AhRR mRNA 翻译,降低顺铂引起的肾脏毒性[37]。 由此可推测,miR-125b 通过抑制AhRR激活AhR 对mdm2 的诱导作用, 并通过AHR 抑制TGF-β1(转化生长因子β1 蛋白,它可降低AhR 的转录能力以及miR-196a 的表达), 这表明促进miR-196a 的表达可能是miRNA 影响B [a]P 激活AhR 的重要作用方式。
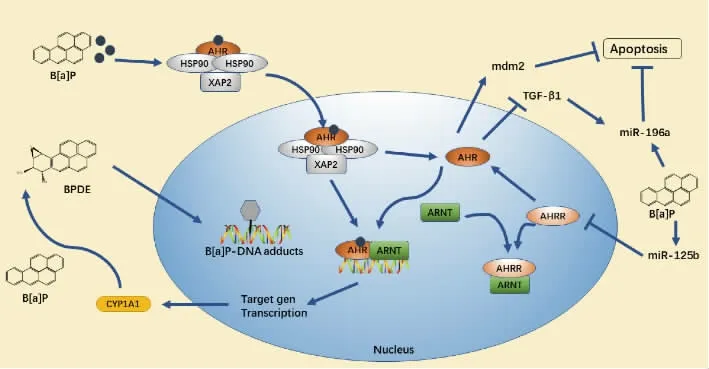
图1 B[a]P 介导的AhR-miRNA 信号通路Fig. 1 Signaling pathway of AhR-miRNA mediated by B[a]P
5 展 望
非编码RNA 是重要的表观遗传学机制, 近年来对非编码RNA 的研究越来越深入,从miRNA 到lncRNA 再到circRNA 的研究逐渐扩大了表观遗传学的领域。 非编码RNA 的功能也越来越完善,其可以在转录调控、RNA 修饰、甚至mRNA 翻译等方面发挥重要作用。 众多对miRNA 的研究揭示了它们的多种生物学功能,包括控制细胞增殖、细胞周期、细胞凋亡、关键转录后调节因子等。 它们的失调可能导致基因表达异常,从而威胁人体健康。 miRNA表达异常在B[a]P 诱导的毒性效应中起着重要作用,miRNA 与B[a]P 的致癌性有着密切的关系,miRNA将有望成为肿瘤新的诊断标志物及基因治疗的有效靶点。 近年来,与AhR 有关的治疗肿瘤的药物也受到了广泛关注,随着对AhR 相关信号通路的进一步研究,有助于深入了解B[a]P 的致癌机制,更重要的是可从AhR 信号通路入手, 结合miRNA 的作用为B[a]P 毒性的防治提供新的途径。 但是, 有关miRNA 参与调节B[a]P 毒性过程的作用机制尚不完全明了, 充分发掘和揭示miRNA 的异常表达和功能作用可为B[a]P 危害诊断和制定控制策略提供方向。

