具有吸附铅能力戊糖片球菌的体内安全性评价
张 亮, 于 哲, 贺银凤
(内蒙古农业大学 食品科学与工程学院, 内蒙古 呼和浩特 010018)
重金属铅污染与人类活动有密切的关系[1]。 环境中的铅降解缓慢,且易形成化合物附着在土壤表面和水体中[2-3],铅通过生物放大作用影响食品安全进而影响人体健康[4]。 进入人体的铅易蓄积且不易排出,会对人体生殖系统、神经系统等产生损伤[5]。考虑到铅对环境和人体的危害,需要采取措施将环境和人体中的铅移除[6]。 过去常采用物理化学法去除铅,因其效率低下、价格高昂、操作烦琐,逐渐被微生物修复法所替代[7]。 近些年的研究发现,乳酸菌应用于吸附重金属也有良好的效果,其细胞壁成分在吸附重金属方面起关键作用[8]。
乳酸菌多分布于人与动物肠道中,它们可以调节人与动物肠道的菌群结构和生理功能。 同时,一部分乳酸菌还有治疗腹泻、增强免疫力、降血压、治疗抑郁、抗肿瘤等保健和医疗作用[9-11]。 乳酸菌有悠久的使用历史, 一向被认为是安全的(generally recognized as safe,GRAS)。但是,也有研究报道从感染性病变和临床样本中分离出了乳杆菌属、片球菌属和双歧杆菌属[12-13],这就使得新菌种资源应用于人体或者动物体前进行安全性评价是必要的。
目前对具有吸附重金属铅能力的乳酸菌安全性的研究报道十分少见。 为了解该菌株在使用中是否会对人体及动物体产生不良影响,作者测定了戊糖片球菌10-a-1 对小鼠的急性毒性、 遗传毒性和28 d 毒性,并通过小鼠采样后分析小鼠血液生化学指标、脏器指数、生产性能、血生化指标和肠组织的厚度变化,评价其对动物的安全性,以期为新资源的开发提供科学依据。
1 材料与方法
1.1 试验动物
健康昆明小鼠:内蒙古大学实验动物研究中心提供,清洁级,体质量(20±2) g,用于急性毒性试验与28 d 毒性试验;体质量(30±2) g,用于遗传毒性试验。
1.2 试验菌株
戊糖片球菌10-a-1 分离自内蒙古自治区包头市包钢矿区的羊粪中,经鉴定是戊糖片球菌,由内蒙古农业大学食品微生物技术团队测定, 菌株10-a-1 在其最适生长温度37 ℃和最适pH 6.5 时对铅的吸附率达到(91.77±1.97)%。 随着菌体浓度升高,吸附率随之上升;随着吸附时间的增加,单位菌体吸附量和吸附率也逐渐增加[14]。
1.3 仪器与材料
1.3.1 试验仪器 5810R 型高速低温离心机: 德国Eppendorf;BioTek Epoch 全波长酶标仪: 美国BioTek;SX-500 型高压灭菌锅: 日本Tomy Digital Biology;OLYMPOS BX50 光 学 显 微 镜: 日 本OLYMPOS;SMART-N 超纯水机: 力康生物医疗科技控股有限公司;HWS-26 型电热恒温水浴锅:上海一恒科学仪器有限公司。
1.3.2 试验材料 姬姆萨稀释液:北京酷来博科技有限公司;1 mL 一次性使用无菌注射器: 河南曙光汇知康生物科技股份有限公司;2 mL 一次性真空采血管:石家庄康卫仕医疗器械有限公司;谷草转氨酶测定试剂盒、 谷丙转氨酶测定试剂盒、γ-谷氨酰转肽酶测定试剂盒:南京建成生物工程研究所。
1.4 戊糖片球菌10-a-1 供试菌液制备
作者按照GB 15193.3—2014[15]的规定中的上-下法执行,灌胃剂量采用默认计量梯度系数为3.2,高、中、低剂量组分别为2.000、0.555、0.175 mg/g(以体质量计)。 取戊糖片球菌10-a-1 在37 ℃培养箱培养至第二代,将培养至稳定期的菌液于4 ℃、8 000 r/min 离心5 min,弃去上清液,菌泥再用0.85 g/dL 的生理盐水洗涤2 遍, 菌泥水分质量分数70%左右。 所得湿菌泥的高、中、低剂量为6.667、1.850、0.583 mg/g(以体质量计)。 灌胃溶剂采用0.02 mL/g(以体质量计)的0.85 g/dL 生理盐水,将湿菌泥溶于0.85 g/dL 生理盐水中。
1.5 急性毒性试验
按照GB 15193.3—2014[15]的规定执行。 将适应环境2 d 的健康昆明小鼠分为2 组, 每组10 只,雌雄各半,分别是对照组和戊糖片球菌10-a-1 组。 对照组用0.85 g/dL 的生理盐水灌胃,戊糖片球菌10-a-1 试验组用6.667 mg/g (以体质量计) 的菌液灌胃。灌胃前1 d 小鼠采取断食不断水饲养方式,灌胃后第1、3、5、7 d 分别记录小鼠的行为表现及中毒情况。 主要指标包括中枢神经系统及躯体运动、自主神经系统、呼吸系统、胃肠系统现象的观察记录。 细菌移位试验是在喂养结束后将小鼠处死, 摘取心、肝、脾、肾并在无菌环境下切开,用无菌棉签擦拭脏器剖面, 涂布于固体MRS 培养基上,37 ℃培养48 h,观测是否有细菌生长。 如果有菌落生长时,则根据菌落外观、细胞形态、液体培养基生长特性、流动性、革兰氏反应等筛选出具有与本研究菌株相似属性的微生物, 提取DNA 进行PCR 技术扩增进一步判断是否试验菌株发生细菌移位。
1.6 遗传毒性试验
1.6.1 哺乳动物红细胞微核试验 按照GB 15193.5—2014[16]的规定执行。 选7 周龄小鼠,体质量(30±2) g,雌雄性小鼠各25 只,分为高、中、低共3 个戊糖片球菌10-a-1 剂量组和阳性、阴性对照组共10 组,每组5 只。 阳性采用40 mg/kg(以体质量计)环磷酰胺经口灌胃,高、中、低剂量组采用1.2.1方法制备菌液灌胃;阴性对照组用0.85 g/dL 生理盐水灌胃。 采用30 h 受试物给予法,第一次给予受试物后的第24 小时,再次给予受试物6 h 后采集骨髓样本。 骨髓样本用生理盐水冲洗后滴于载玻片上,与小牛血清混匀推片,晾干后用甲醇固定,再使用Giesam 染色冲片晾干后观察。镜检记录并统计嗜多染红细胞中微核与正染红细胞数量,计算得到微核率。 目的菌各剂量组微核率、PCE/NCE 与阴性对照组相比,无统计学意义,则结果应是阴性;有统计学意义,并有明显的剂量反应关系,则结果应是阳性。
1.6.2 小鼠精子畸形试验 按照GB 15193.7—2003[17]的规定执行。 选7 周龄雄性小鼠25 只,体质量(30±2) g,分为阳性、高剂量、中剂量、低剂量、生理盐水对照组共5 组, 每组5 只。 阳性对照采用40 mg/kg(以体质量计)环磷酰胺经口灌胃,高、中、低剂量组用制备的菌液灌胃,对照组用0.85 g/dL 生理盐水灌胃。 在处死前3 h 按40 mg/kg (以体质量计)经口灌胃环磷酰胺,将小鼠脱颈处死,小鼠腹部最下端喷少许体积分数75%乙醇并将其剪开。 剥离腹部脂肪可见黄豆粒大小睾丸,将睾丸侧下方附睾取下, 漂洗后放入含有2 mL 的离心管中, 将其剪碎,并用移液枪吹打,使精子与生理盐水混匀,再将4 层擦镜纸过滤的滤液滴于载玻片上, 晾干后用甲醇固定,再用体积分数2%伊红染液染色1 h。 镜检记录并统计目的菌剂量组畸变率与阴性对照组精子畸形的形态以及数量情况,计算得到精子畸形率(%)并将其相比,无统计学意义则结果是阴性;有统计学意义并有明显的剂量反应关系,则结果是阳性。
1.7 28 d 喂养试验
按照GB 15193.22—2014 的规定执行[18]。 选择健康的KM 小鼠,雌雄小鼠各20 只,体质量为(26±2) g,随机分为4 组,每组10 只。 采用经口灌胃法,将0.85 g/dL 生理盐水按0.02 mL/g(以体质量计)作为灌胃溶剂,对照组只使用溶剂灌胃,高、中、低剂量组采用制备的菌液灌胃。 喂养试验开始后,每天09:00 进行灌胃,28 d 连续灌胃并且观察记录小鼠的体质量、采食量。在试验结束后,进行16 h 断粮不断水的操作,为下一步试验做准备。
1.7.1 小鼠血液生化指标 将28 d 喂养试验小鼠乙醚麻醉后摘眼球取全血于EDTA 抗凝管中,3 500 r/min 离心10 min,取抗凝管上层血清,使用血清生化测定试剂盒测定谷草转氨酶(AST)、谷丙转氨酶(ALT)、γ-谷氨酰转肽酶(γ-GT)。
1.7.2 肠黏膜组织学检查 参照文献[19]的方法完成。 将28 d 喂养的对照组与试验组的小鼠回肠、盲肠、结肠各取2 cm,用生理盐水将肠道内容物清理后,放入体积分数4%多聚甲醛固定液中,送往爱博试剂公司进行苏木精-伊红染色和切片, 使用光学显微镜上的目镜测微计测量形态学参数。 记录上皮细胞高度、绒毛高度、黏膜厚度,每个样本的每个参数随机进行10 次测量, 并将这些测量值的平均值用于统计分析。
1.8 数据分析
试验组内组间重复3 次, 采用SPSS23.0 和One-Way(ANOVA)进行统计和显著性分析。
2 结果与分析
2.1 急性毒性试验
2.1.1 小鼠一般情况 将戊糖片球菌10-a-1 以6.667 mg/g(以体质量计)溶解于0.02 mL/g(以体质量计)的生理盐水中,采用灌胃的方式给予1 只小鼠受试物,48 h 内小鼠无不良反应和死亡。 再取5只小鼠以相同的剂量标准进行灌胃,在饲养一周后小鼠全部存活, 并且中枢神经系统及躯体运动、自主神经系统、呼吸系统、胃肠系统等指标试验组与对照组相同且全部正常(见表1),表明该菌株对小鼠半致死量LD50>6.667 mg/g(以体质量计)。
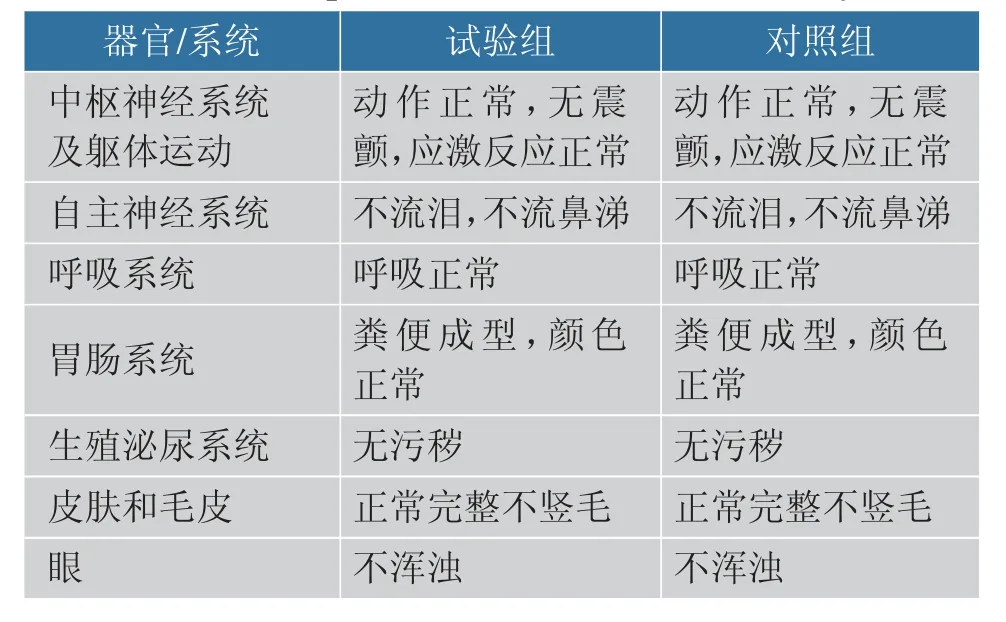
表1 急性毒性试验小鼠表现Table 1 Mice performance in the acute toxicity test
2.1.2 细菌移位试验 作为进入动物体或人体的微生物, 首先要考虑其对宿主是否有不利的影响,大量摄入活菌制剂的毒性及其易位性等日益成为人们关注的问题[20]。 细菌易位是一种活细菌穿过肠道屏障定植在周围组织和器官的现象,可引起全身炎症反应、组织损伤、器官衰竭以及机体死亡。 在肠外组织中转移、存活和增殖的能力是肠道致病菌引起系统性感染可能性的关键决定因素,通常小鼠感染后7 d,致病菌向脾脏的移位达到峰值水平,此后开始下降。 因此,在喂食益生菌的第7 天进行细菌向脾脏移位试验的研究[21]。将心、肝、脾、肾表面切开后, 内部用无菌棉拭子擦拭后的组织液在MRS 固体培养基上涂布培养48 h。 图1 所示试验菌株10-a-1 的MRS 培养基上未见菌落生长,与阴性对照试验结果相同, 证明戊糖片球菌10-a-1 未发生细菌移位现象。

图1 细菌移位结果Fig. 1 Bacterial translocation results
2.2 遗传毒性试验
遗传毒性是指外部的理化因素直接或间接作用于人体或者动物体, 使其遗传物质在染色体、分子和碱基水平受到损伤,这种损伤被认为是可遗传效应的基础,是致癌性的前体[22]。
2.2.1 小鼠精子畸形试验 通过小鼠精子畸形试验可观察到: 在精子接触某种物质一定时间后,其头部及尾部形态改变,就可使供试物生殖细胞畸形[23]。 由表2 可以看出,在观察每个剂量组5×1 000个精子后, 阳性对照组总的精子畸形个数为537个,阳性对照组个体畸形率为11.46%;戊糖片球菌10-a-1 各剂量组和生理盐水对照组总精子畸形数126~141 个,个体畸形率2.52%~2.82%,各剂量组与阴性对照组无显著性差异(P>0.05)。 说明在试验剂量范围内,小鼠精子畸形试验结果为阴性,戊糖片球菌10-a-1 对小鼠精子不产生畸变作用。

表2 小鼠精子畸形试验数据分析表(n=5)Table 2 Data analysis of mouse sperm deformity test(n=5)
2.2.2 小鼠红细胞微核试验 微核试验常作为检测染色体或有丝分裂器损伤的一种重要手段,作为致癌作用的重要信号,是遗传毒性评价重要构成部分[24]。 由表3 可以看出,在观察每个剂量组5×1 000个PCE 后, 戊糖片球菌10-a-1 各剂量组中PCE 含微核的总数12~16 个,实验组和阴性对照组微核率为0.24%~0.32%,试验菌在雌雄各剂量组与生理盐水对照组比较无显著性差异(P>0.05),且微核率都在正常范围内。 在PCE/NCE 中和阴性对照组为0.92~0.93, 目的菌株各剂量组与生理盐水对照组PCE/NCE 比较无显著性差异(P>0.05)。 经口灌胃环磷酰胺的阳性对照组微核率极显著高于阴性对照组以及试验组(P<0.01)。 说明在试验组的剂量范围内戊糖片球菌10-a-1 未引起小鼠骨髓嗜多染红细胞微核发生率升高, 戊糖片球菌10-a-1 对小鼠骨髓细胞未见损伤作用。
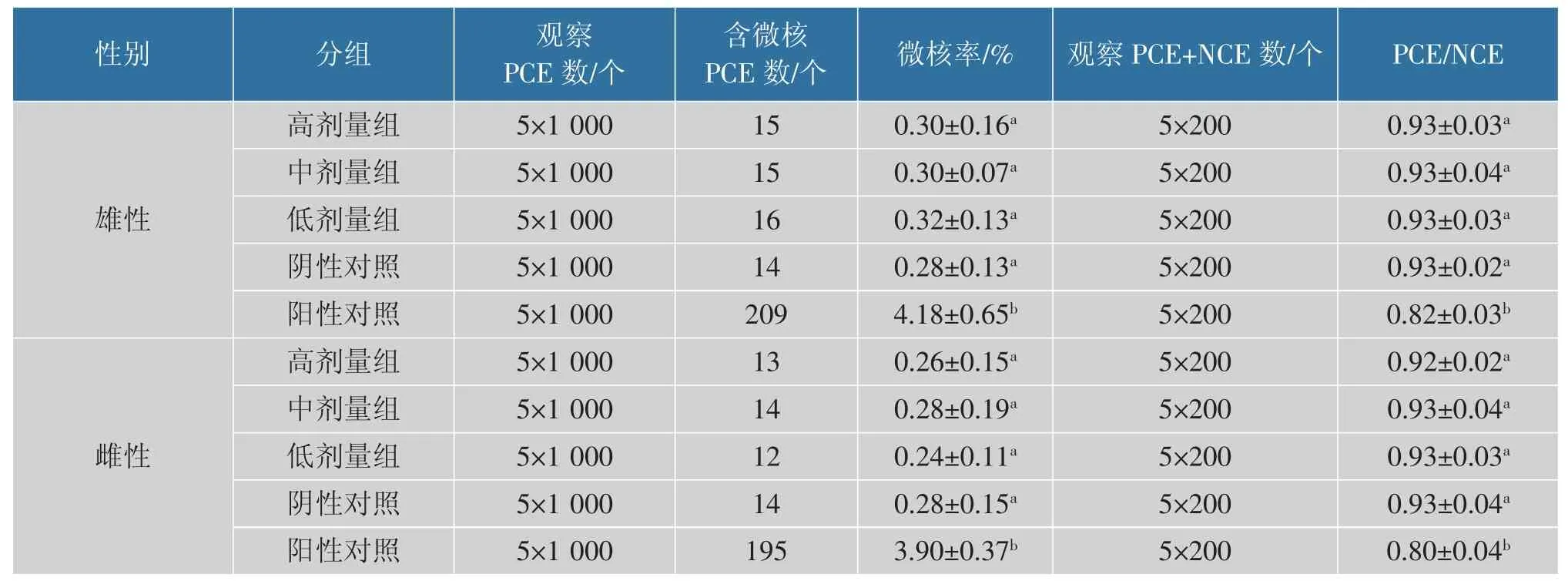
表3 小鼠红细胞微核试验数据分析表(n=5)Table 3 Data analysis of mouse red blood cell micronucleus test (n=5)
2.3 28 d 毒性试验
2.3.1 小鼠生产性能分析 连续28 d 的活菌经口灌胃,对小鼠进食状况分析,观察小鼠能否适应大量活菌入侵从而引发炎症反应的发生,进而影响小鼠的体质量增长、摄食量、料体质量比。 由表4 可以看出,戊糖片球菌10-a-1 在小鼠生产性能试验中,雄性小鼠戊糖片球菌10-a-1 各剂量组与对照组初始体质量在(30±2) g,雌性小鼠戊糖片球菌10-a-1各剂量组与对照组初始体质量在(26±2) g,当连续灌胃喂养28 d 后,终体质量无显著性差异(P>0.05),小鼠总摄食量试验组与对照组无显著性差异 (P>0.05),并且各剂量组未见计量依赖关系。 雌性中剂量组的体质量增长与摄食量略低于其余试验组,这可能是鼠笼摆放位置处于笼架下方,导致小鼠每日的光照时间不足,活动量小于其余试验组,而非雌性小鼠的抵抗力弱于雄性小鼠所致[25]。 雌性小鼠低剂量组的料体质量比大, 可能与小鼠称质量时,雌性低剂量组在最后,因为操作导致小鼠受惊吓不进食,处于饥饿状态有关。 但在雌性中剂量试验组增质量、低剂量组料体质量比与对照组的小鼠进食状况中未见统计学差异,并且雄性试验组与对照组正常,表明戊糖片球菌10-a-1 菌株具较高安全性。
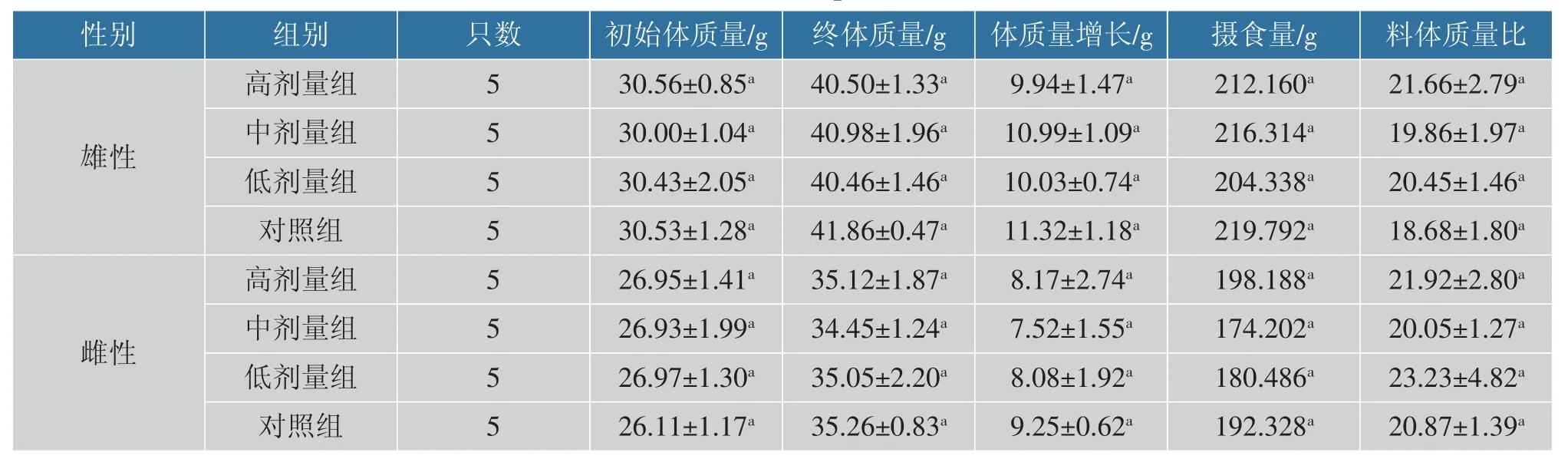
表4 小鼠生产性能试验(n=5)Table 4 Production of mouse performance test(n=5)
2.3.2 小鼠脏器指数 心脏指数通常是反应身体健康状况的指标,肾与肝是排毒解毒器官,脾有产生免疫反应的重要功能,血液中抗原在脾中可引起有力的细胞免疫和体液免疫反应[26-27]。 当致病菌入侵时可能会导致器官萎缩或者肿大,通过脏器指数能进行有效观察[28]。 由表5 可知,戊糖片球菌10-a-1灌胃的雄性和雌性小鼠的高、中、低剂量组,心、肾、肝、脾占体质量比例与对照组比较,均无显著性差异(P>0.05)。 在雌性与雄性肾体比中,有显著性差异,是因为雄性肾脏所占比例大,不是戊糖片球菌10-a-1 导致。 这些表明戊糖片球菌10-a-1 对小鼠脏体比无明显影响。
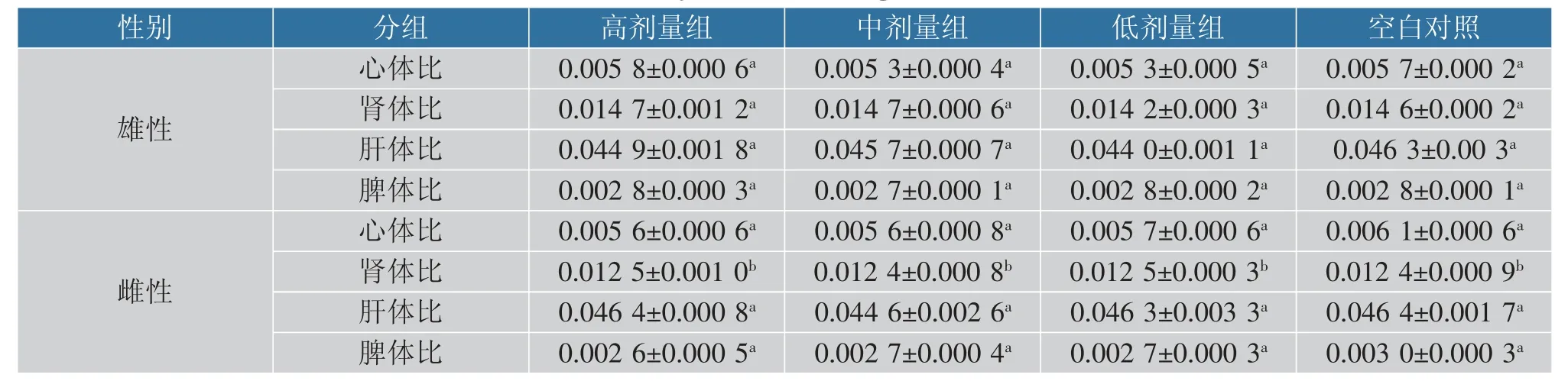
表5 小鼠脏器指数分析表(n=5)Table 5 Analysis of mouse organ index(n=5)
2.3.3 血清生化指标检测 在毒性试验中常以γ-GT、ALT 和AST 来反应受试物是否对肝肾功能损害。 ALT 和AST 是参与氨基酸代谢的酶,在肝细胞轻度受损时这2 种酶活性有明显变化。 γ-GT 是一种转移酶,主要催化谷氨酰基转换反应。 γ-GT 主要存在于肝细胞质微粒体、肝细胞膜的胆汁分泌侧和细小的胆管上皮中,能够催化谷胱甘肽或其他含谷氨酰基多肽上的谷氨酰基转移到其他合适的受体上去,也是反映肝功能较为敏感的指标[29-32]。 表6 血液生化指标结果显示,经不同剂量戊糖片球菌10-a-1活菌灌胃28 d 后,血清生化指标ALT、γ-GT 与对照组无显著性差异(P>0.05),证明戊糖片球菌10-a-1对小鼠的肝脏细胞无损伤。 各剂量组AST 对照组无显著性差异(P>0.05),证明对小鼠心肌细胞无损伤。

表6 小鼠血清生化指标分析表(n=5)Table 6 Analysis of serum biochemical indexes of mouse(n=5)
2.3.4 肠黏膜组织学检查 大多数乳酸菌被认为是安全的,它们存在于人体皮肤表面、口腔和肠道中, 而且它们在食品中有着长期的安全使用历史,用于预防或治疗肠道疾病。 乳酸菌作为益生菌食品添加剂来增强免疫功能和预防胃肠道感染有着重要的作用。 但Patricia 等发现,一些双歧杆菌具有胃肠道黏蛋白降解活性,同时有afcA 和engBF 基因存在时分解黏蛋白能力会增强[33]。 Salvatore 等人研究发现SLAB51 益生菌能使猪肠道黏蛋白发生特异性变化,从而改善了动物的健康状态[34]。表7 肠黏膜组织学检查结果显示, 在灌胃戊糖片球菌10-a-1 的各剂量组中,试验组回肠绒毛高度与生理盐水对照组回肠绒毛高度无显著性差异(P>0.05),试验组与生理盐水对照组回肠、盲肠、结肠的黏膜厚度与上皮细胞高度无显著性差异(P>0.05),并且黏膜厚度在30~40 μm,说明戊糖片球菌10-a-1 不会对小鼠的肠道组织产生损伤。
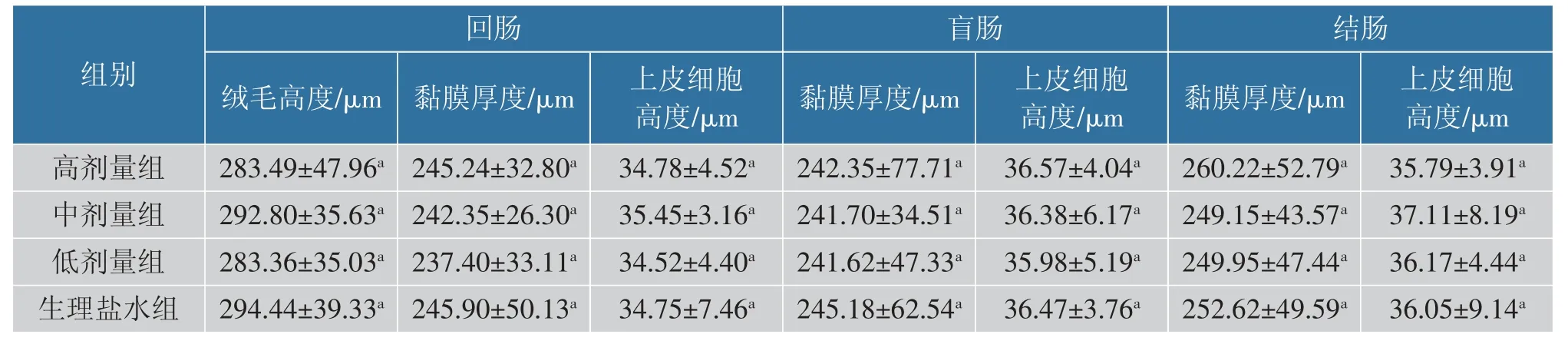
表7 乳酸菌对肠道形态的影响(n=5)Table 7 Effect of Lactobacillus on intestinal morphology (n=5)
3 结 语
作者对分离自内蒙古自治区包头市包钢矿区羊粪中具有铅吸附能力的戊糖片球菌10-a-1 进行了包括急性毒性试验、遗传毒性试验和亚慢性毒性试验的小鼠体内试验, 通过小鼠一般情况观察、细菌移位、摄食量、小鼠骨髓微核率、小鼠精子畸形率、小鼠脏器指数、血清生化指标检测、肠黏膜组织学检查等较为全面的安全性评价,证明戊糖片球菌10-a-1 对动物机体不产生毒害作用,具有较高的安全性,有开发成吸附铅的微生态制剂的潜能,为实际生产应用提供了良好的理论基础。

