小叶苦丁枝条提取物的植物乳杆菌发酵代谢组分析
吴雨烔, 周礼红*, 方月月, 解文利, 白 雪
(1. 贵州大学 生命科学学院,贵州 贵阳 550025;2. 贵州大学 农业生物工程研究院,贵州 贵阳 550025;3. 贵州大学 山地植物资源保护与保护种质创新教育部重点实验室, 贵州 贵阳 550025;4. 贵州泰和现代生态农业科技有限公司,贵州 遵义 564400)
我国拥有悠久的别样茶饮用历史,其中小叶苦丁最早载于《贵州民间方药集》[1],由于其含咖啡因较少,口感层次丰富,饮后不影响睡眠,能清热解毒,在夏季颇受人们喜爱。 小叶苦丁为木樨科植物,包括粗壮女贞、丽叶女贞、日本毛女贞等属,本研究中贵州小叶苦丁属粗壮女贞,在中国、孟加拉国、柬埔寨、越南均有分布。 其在我国分布颇广,主要生长在海拔400~2 000 m,分布地区主要有贵州、云南、四川、安徽南部等[2],其中贵州余庆县及四川筠连县产业规模较大。
小叶苦丁茶中黄酮、多酚、苯乙醇苷类等生物活性成分在各项研究中表现出优异的药理作用。 氧化应激是衰老和许多疾病的诱因,会给细胞造成难以修复的损伤,而小叶苦丁茶在体外抗氧化模型和动物模型中效果显著[3]。 在Caco-2 细胞肠道模型中能有效保护细胞免受H2O2诱导的氧化应激损伤[4],调节肠道微生态,增强肠道屏障抵御能力,减轻肠道炎症[5-6],而肠道微生态又通过脑肠轴与肥胖症、糖尿病、心血管疾病等代谢失调类疾病相关联。 研究还发现,小叶苦丁茶能降低血糖浓度和预防高血压[7]、降低血脂[8]和改善肥胖人群心血管疾病的相关指标[9]、抑菌抗炎和抗肿瘤活性[10],可作为功能性食品开发的原料、天然的食品添加剂和药用成分的提取原料。
贵州省余庆县小叶苦丁茶量大质优,深受市场青睐,远销日、法、东南亚,被称为“中国小叶苦丁之乡”。 2020 年,贵州省余庆县小叶苦丁茶销售产值超过5 亿元,市场需求量超过6 500 t,在全国37个中大城市开设了300 余个销售网点[11]。 采茶后剩余的大量枝条一般作为废料焚烧,环境不友好的同时还忽略了其可能存在的食用或者药用价值。
作者前期研究发现,小叶苦丁枝条在体外抗氧化模型中表现优异,而抗氧化性与多种生理活性相关联, 表明小叶苦丁枝条中存在多种生理活性成分, 且小叶苦丁枝条活性成分水提率较为理想,同时提取后残渣可用于有机肥生产。 乳酸发酵可以提高基质的生理活性和功能特性,作者所在实验室已经建立了植物乳杆菌发酵提取物的工艺,故采用植物乳杆菌对小叶苦丁枝条提取物进行发酵, 通过LC-MS、NRM 非靶向代谢组研究其发酵前后物质构成和分布。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂 菌种:Lactobacillus plantarum LP-15,专利号ZL 2016 1 027815.9;小叶苦丁Ligustrum robustum(Rxob.) Blume 枝条:取自贵州省遵义市余庆县,北纬27°16′29″,东经107°48′19″;甲醇、乙腈:纯度≥99.9%,Thermo 公司;2-氯苯丙氨酸: 纯度98.5%,Aladdin 公司;甲酸:LC-MS 级,TCI 公司;甲酸铵:纯度≥99.9%,Sigma 公司;H2O:Milli-Q 公司。
1.1.2 仪器与设备 离心机H1850-R:湖南湘仪实验室仪器开发有限公司;混匀仪QL-866:上海巴玖实业有限公司;真空浓缩仪5305:艾本德股份有限公司;滤膜0.22 μm PTFE:天津市津腾实验设备有限公司;液相色谱仪UltiMate 3000、质谱仪Q Exactive Focus:赛默飞世尔科技公司。
1.2 方法
1.2.1 发酵样品制备 枝条前处理:余庆县的小叶苦丁枝条洗净, 切成约2 cm 长小段后烘干至恒质量待用。
枝条水提物制备: 称取200 g 枝条置于1 000 mL 蒸馏水中煮沸20 min,过滤,补齐蒸发水分至1 000 mL, 即得小叶苦丁枝条提取物。 提取物用100 mL 锥形瓶分装,装样量为70 mL,在110 ℃下灭菌10 min, 取发酵前样品, 编号LS1、LS2、LS3、LS4、LS5、LS6,记为GPLS1 组。
枝条水提物发酵方法:取作者所在实验室保藏菌种植物乳杆菌LP-15, 在斜面上活化2 次后用无菌水冲洗, 调整菌悬液OD600值为0.700±0.002,以10%的接种体积分数接种于MRS 液体培养基中,37℃培养24 h。 该种子液以5%的接种体积分数接入上述灭菌提取液中,37 ℃下培养24 h, 取发酵后样品,编号FLS1、FLS2、FLS3、FLS4、FLS5、FLS6,记为GPLS2 组。
1.2.2 代谢组检测样本制备 上述样品分别取100 μL 加入400 μL 甲醇中, 振荡混匀60 s,4 ℃下于12 000 r/min 离心10 min,取上清液进行真空浓缩。所得样品加入4 μg/g 的2-氯苯氨酸和体积分数80%甲醇溶液120 μL 复溶, 经0.22 μm 膜过滤后进行代谢组检测。
每个待测样本各取20 μL 混合成质量控制(quality control,QC)样本,用于跟踪校正信号漂移的情况,分别在数据采集过程中的开始、过程中和结束时插入QC 样本。
色谱条件: 采用ACQUITY HUPLC®HSS T3 1.8 μm(2.1 mm×150 mm)色谱柱,自动进样温度为8℃,流量0.25 mL/min,柱温40 ℃,进样量2 μL,流动相正离子为0.1 g/dL 甲酸水和0.1 g/dL 甲酸乙腈,负离子为5 mmol/L 甲酸铵水和乙腈,见表1。
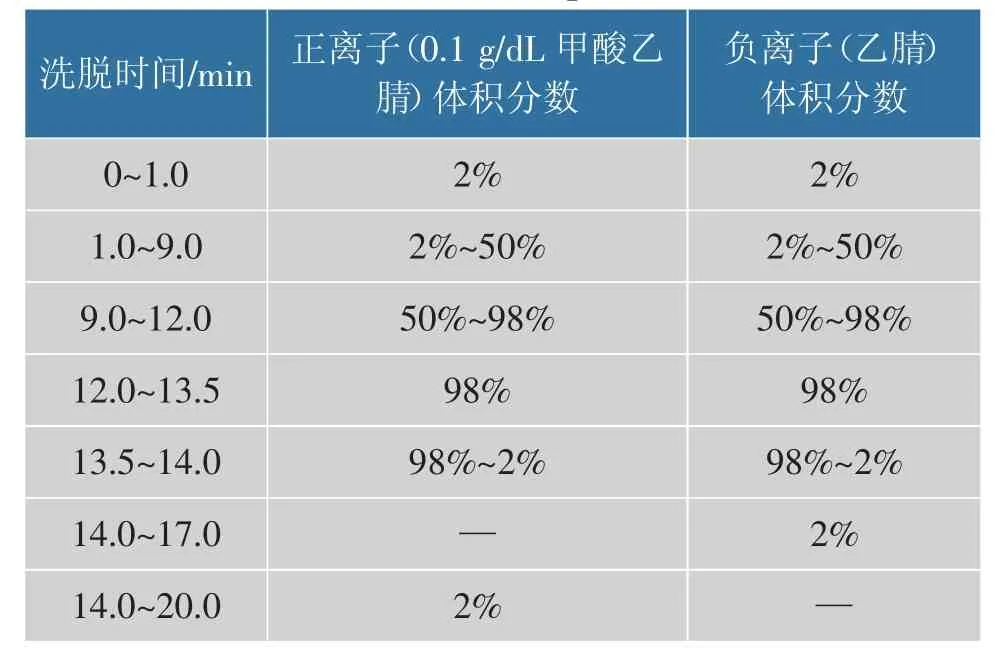
表1 洗脱程序Table 1 Elution procedure
质谱条件:电喷雾离子源电压分别为正离子喷雾电压3.5 kV,负离子喷雾电压2.5 kV,鞘气5.25 MPa,辅助气1.75 MPa。 毛细管温度325 ℃,以分辨率70 000 进行全扫描,扫描范围81~1 000,并采用HCD 进行二级裂解,碰撞电压为30 eV,同时采用动态排除去除无必要的MS/MS 信息。
1.2.3 数据处理 使用Proteowizard 软件将检测到的原始数据转换成mzXML 格式后, 通过R 语言的XCMS 程序包进行峰识别、峰过滤、峰对齐,得到包括质核比和保留时间及峰面积等信息的数据矩阵;进而得到正负离子模式下的前体分子,导出数据至excel, 使用R 语言MetaboanalystR 程序包3.0 版进行主成分分析、偏最小二乘法判别分析等多元统计分析。
2 结果与分析
2.1 质量控制
QC 样本用于跟踪和校正数据采集过程中产生的信号漂移,如图1~2 所示,在正负离子模式下QC样本均包含于95%置信区间内,聚集良好,说明检测方法稳定,数据可靠。

图1 正离子模式QC 样本PCA 得分Fig. 1 PCA score of QC sample in positive ion mode
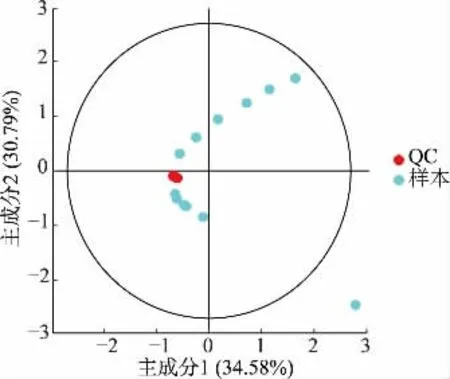
图2 负离子模式QC 样本PCA 得分Fig. 2 PCA score of QC sample in negative ion mode
2.2 主成分分析
通过主成分分析(principal component analysis,PCA),样本自然聚集成明显分离的2 组,即发酵前样本组与发酵后样本组, 与研究者的人为分组吻合。 样本均被包含在95%的置信区间内,不存在离群值, 在66.7%的概率上解释了小叶苦丁枝条提取物在植物乳杆菌发酵前后物质变化上存在的差异。
2.3 偏最小二乘法判别分析
PCA 适用于组间差异大的情况,当组间差异较小时, 用偏最小二乘法判别分析 (Partial Least Squares Discriminant Analysis,PLS-DA)补充分析,可以更好地确定样本关系。GPLS1 和GPLS2 样品均包含于95%置信区间内,无离群值,两组点云明显分离,说明发酵前后代谢物有显著差异,Compnent1 能在54.7%的概率上解释GPLS1 和GPLS2 的组间差异,Compnent1 和Compnent2 累计贡献率为61.3%,见图3。 用置换检验n=100 来判断PLS-DA 模型的区分效果,结果见图4。观测检验统计量在随机分布右侧, 说明对GPLS1 和GPLS2 的判别结果并不完全由随机导致。 P>0.05,说明模型判别效果不显著,有必要进行正交偏最小二乘法判别分析减少噪音干扰,见图5。
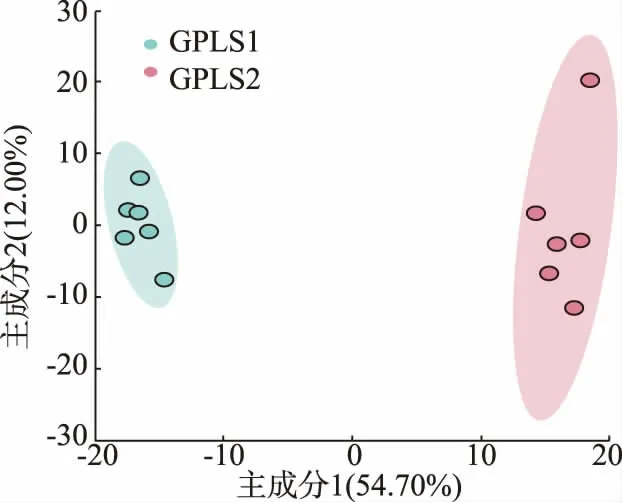
图3 PCA 得分图Fig. 3 Score plot of PCA
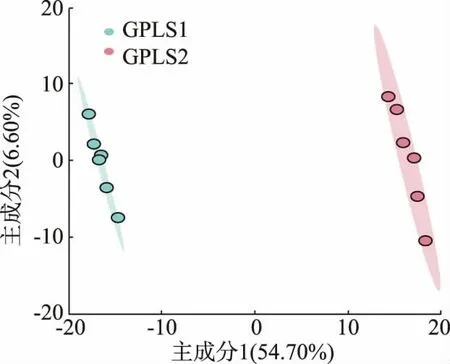
图4 PLS-DA 得分图Fig. 4 Score plot of PLS-DA

图5 PLS-DA 置换检验统计量分布及P 值Fig. 5 PLS-DA permutation test statistics distribution and P value
2.4 正交偏最小二乘法判别分析
与PLS-DA 结果一致,GPLS1 和GPLS2 所有样本点均被包含于95%的置信区间内,无离群点,2 组点云明显分离, 在61.3%的概率上可以解释2 组代谢物变化上的差异。交叉检验R2Y=0.995,Q2=0.983,均接近于1,说明模型稳定可靠。对正交偏最小二乘判 别 分 析 (orthogonal partial least squares discrimination analysis,OPLS-DA) 模型 进 行频 次100 次的置换检验,结果见图6~7。 观测检验统计量位于随机分布右尾后,且P<0.05,说明OPLS-DA 模型能够有效判别不同分组,小叶苦丁枝条发酵前后存在差异显著的代谢物。
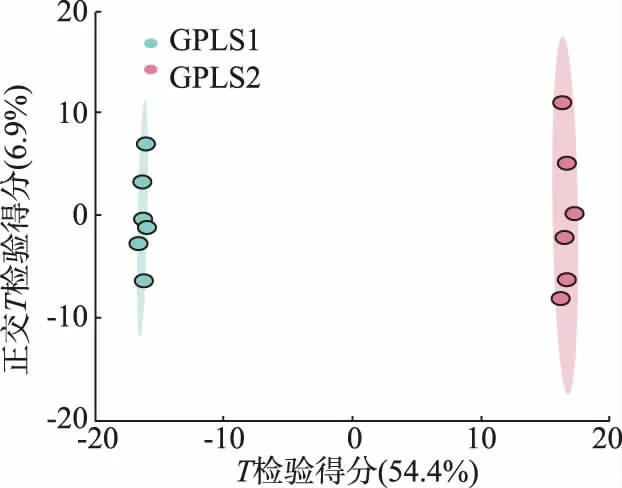
图6 OPLS-DA 得分图Fig. 6 Score plot of OPLS-DA
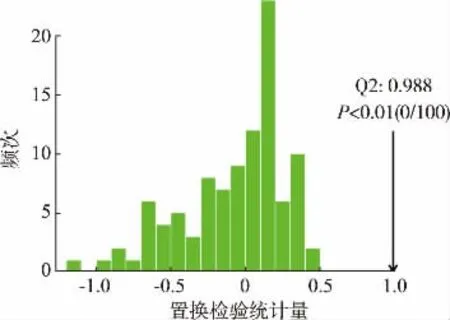
图7 OPLS-DA 置换检验统计量分布及P 值Fig. 7 OPLS-DA permutation test statistics distribution and P value
2.5 单变量分析
多元分析结果显示,GPLS1 和GPLS2 间存在显著差异,单变量分析通过代谢物变化倍数来衡量差异的大小。 如图8 所示, 粉色点代表了变化倍数(fold change,FC)绝对值大于2 且P<0.05 的代谢物,这些代谢物在发酵前后变化较大,发酵后显著上调的代谢物106 种,显著下调的代谢物92 种。 为了筛选出重要代谢物并直观显示其发酵前后的变化,以FC≥2 或FC≤0.5 且P<0.05 为标准,筛选出单维统计排名前25 的代谢物作箱式图,见图9。 发酵后相对含量大幅度上调的16 种,下调的9 种,这些代谢物在GPLS1 组和GPLS2 组的组间差异极显著。
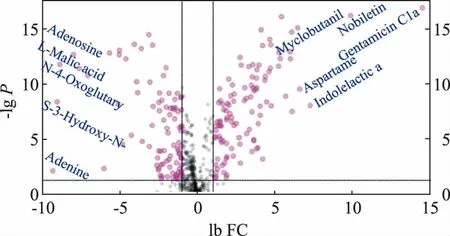
图8 变化倍数火山图Fig. 8 A volcano map of multiple variations
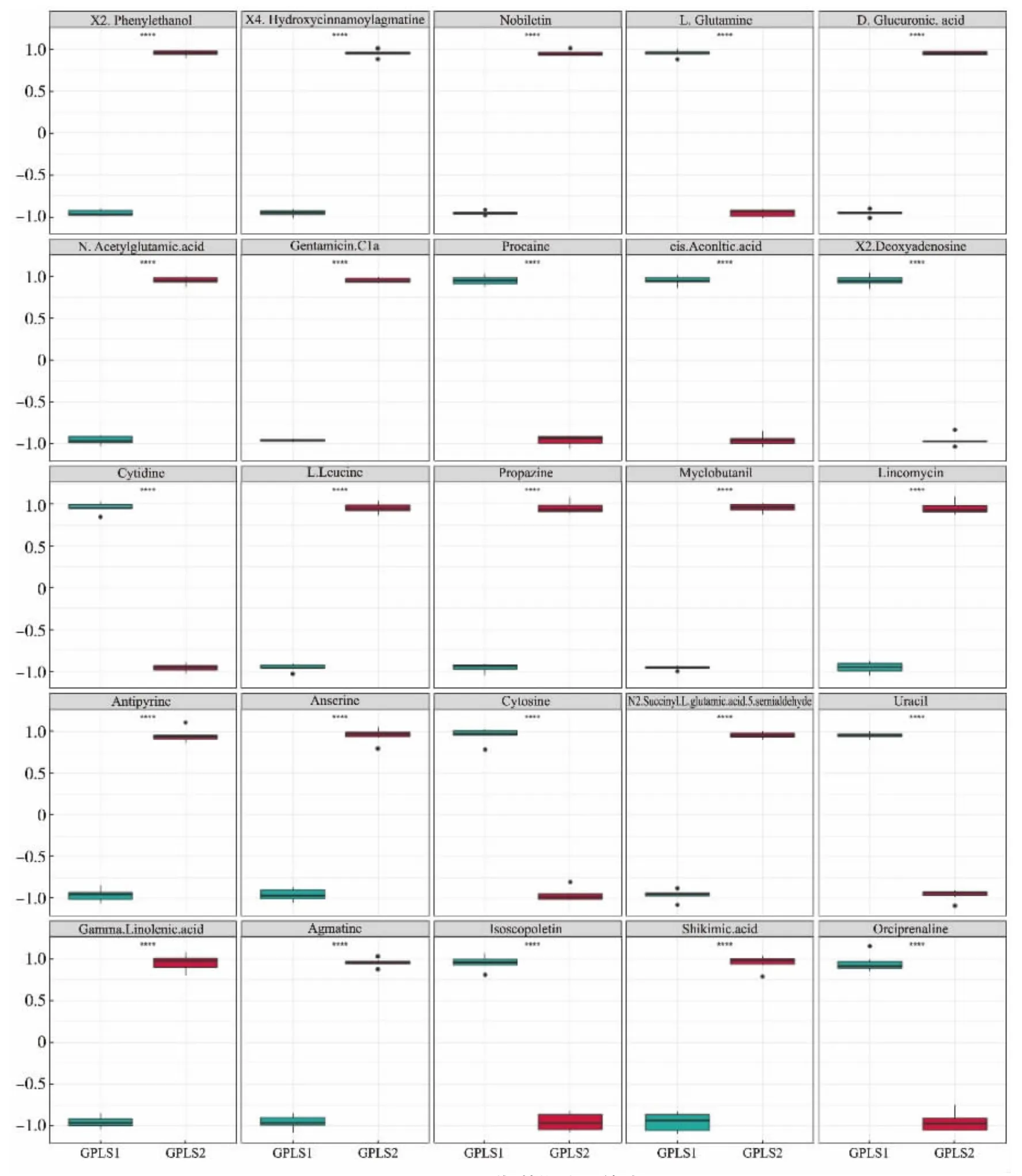
图9 TOP 25 代谢物差异箱式图Fig. 9 Box plot of top 25 differential metabolites
2.6 差异代谢物筛选
根据OPLS-DA 的分析结果,变量重要性(value importance in projection)VIP>1 且P<0.05 的代谢物共286 种, 这286 种代谢物对OPLS-DA 判别结果有重要作用。 为了进一步筛选差异显著的代谢物,结合OPLS-DA 和单变量分析结果, 以FC≥2 或FC≤0.5 且P<0.05、VIP>1 为指标,共筛选出175 种代谢物, 其中显著上调的100 种, 显著下调的75种, 筛选出单维统计排名前25 的代谢物作为差异较大的代谢物,见表1。 其中肽类3 种,碳水化合物1 种,核酸类4 种,脂类1 种,有机酸1 种,黄酮类1种,其他14 种。庆大霉素C1a、川皮苷、鹅肌肽、莽草酸分别上调22 672 倍、915 倍、11 倍、20 倍;普鲁卡因、尿嘧啶、奥西那林分别下调33 倍、16 倍、15 倍。
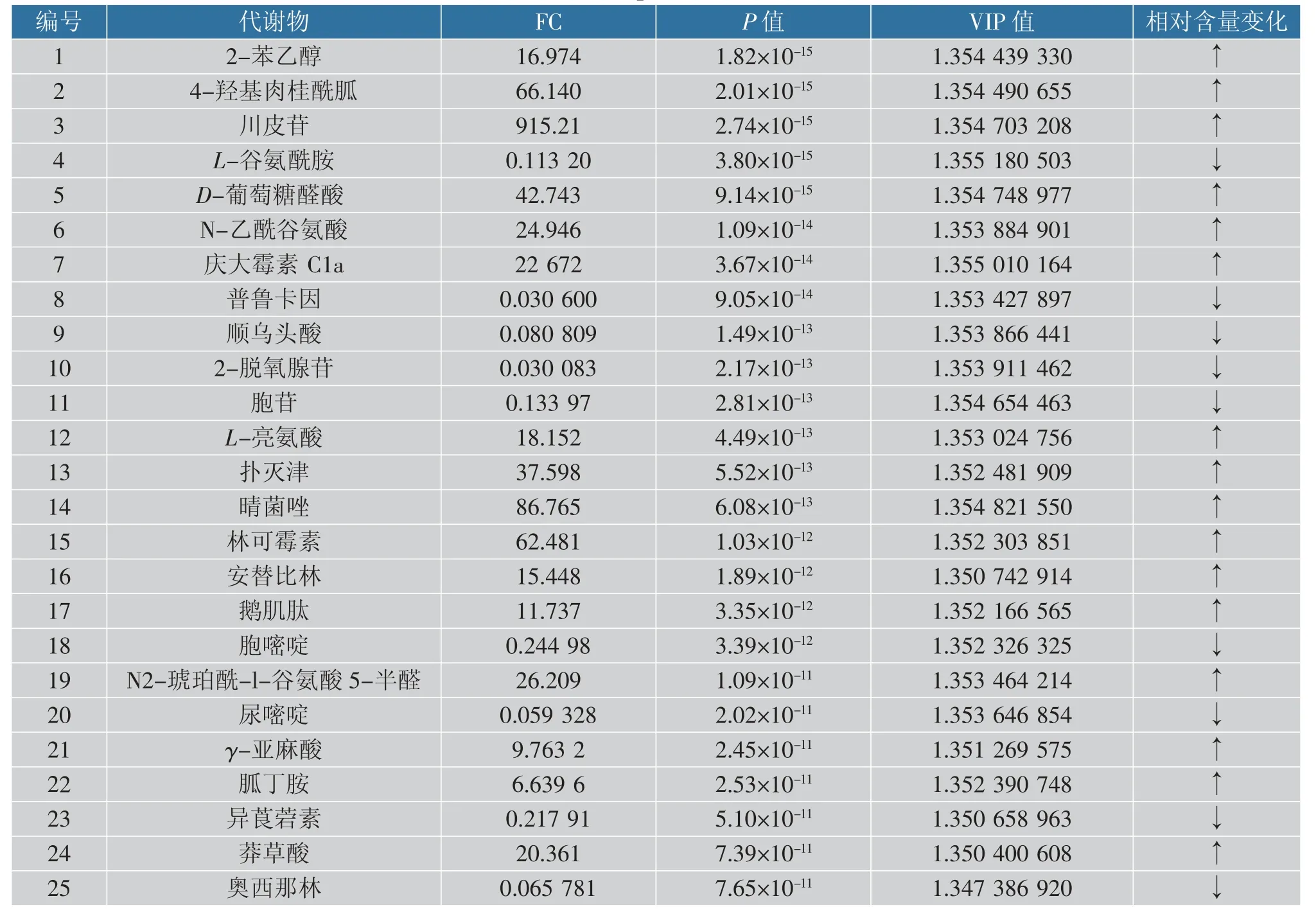
表1 TOP 25 代谢物Table 1 Top 25 metabolites
2.7 代谢通路分析
上述筛选出的差异代谢物作为关键代谢物通过富集分析和拓扑分析得到11 条差异显著的代谢通路,其中氨基酸代谢通路6 条,说明发酵过程中氨基酸代谢相关物质前后变化较为丰富。 如图10蓝色区域所示,在显著富集的前11 条通路中:丙氨酸、天冬氨酸和谷氨酸代谢的气泡最大,通路中关键代谢物包括L-谷氨酰胺,琥珀酸半醛等;其次是β-丙氨酸代谢通路,关键代谢物包括差异代谢物鹅肌肽、尿嘧啶等。 苯丙氨酸代谢包括苯乙醇、富马酸等;络氨酸代谢包括富马酸、4-羟基苯乙醇、琥珀酸盐等; 泛酸盐和辅酶A 的生物合成包括尿嘧啶、L-缬氨酸、维生素B5等。苯丙氨酸、酪氨酸和色氨酸的生物合成包括莽草酸、L-苯丙氨酸、L-色氨酸等。TCA 循环是好氧生物体内各大代谢的重要枢纽部分,包括差异代谢物富马酸、顺乌头酸等;氮素代谢的关键代谢物包括L-谷氨酰胺、 一磷酸腺苷等;精氨酸和脯氨酸代谢通路中包括了显著差异的代谢物L-谷氨酰胺、2-琥珀酰-L-谷氨酸-5-半醛、胍丁胺等; 亚油酸代谢包括γ-亚麻酸、12,13-DHOME等;丁酸盐代谢途径包括关键代谢物富马酸、琥珀酸等。
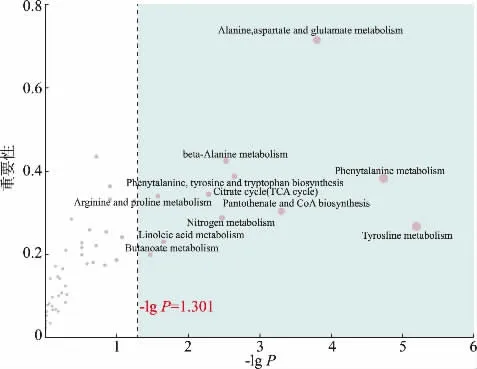
图10 代谢通路富集分析和拓扑分析Fig. 10 Enrichment analysis and topology analysis of metabolic pathway
3 讨 论
通过LC-MS 非靶向代谢组检测手段, 共检测出代谢物543 种,其中多肽类相对含量在发酵后由32.5%增加至70.8%; 碳水化合物由39.2%减少至7.8%;有机酸发酵前为9.4%,发酵后为9.1%;核酸由7.9%下调至1.9%; 维生素和辅酶类发酵前为5.6%,发酵后为3.6%;脂类在发酵前为4.2%,发酵后为2.6%; 类固醇发酵前为0.63%, 发酵后升高到4.3%;激素由0.046%降至0.023%。
发酵后小肽相对含量大幅增加,通过微生物发酵产生的小肽可能表现出一系列亲代蛋白质不具有或效果一般的生理活性:如抗氧化活性、降低血液胆固醇、血管紧张素Ⅰ抑制活性[12]、α-葡萄糖苷酶和α-淀粉酶抑制作用[13],有在体内拮抗炎症、多种心脑血管疾病、糖尿病的潜能。 肽类中鹅肌肽、L-亮氨酸、L-谷氨酰胺被鉴定为差异代谢物。 鹅肌肽是一种组氨酸二肽,能有效降低高尿酸血症小鼠的尿酸水平[14],具有抗氧化活性,人体补充鹅肌肽对促进健康有着积极作用[15]。L-亮氨酸是人体必需的21 种氨基酸之一,参与调节氨基酸和蛋白质代谢、改善糖代谢和脂代谢紊乱[16-17]。 L-谷氨酰胺虽然是非必需氨基酸,但其参与蛋白质代谢,能够有效减轻肠道炎症和氧化应激[18]。 植物乳杆菌的生理代谢活动消耗碳源,碳水化合物的相对含量大幅下降,产生有机酸。 有机酸是发酵后枝条酸味的来源,代谢物中检测到L-苹果酸、富马酸、顺乌头酸、没食子酸、奎尼酸等,研究表明有机酸具有多种生物活性[19]。鉴定到的有机酸中,顺乌头酸为三羧酸循环的中间产物, 莽草酸是芳香族类物质生物合成途径的中间体,连接糖代谢和多酚代谢[20],具有抗炎、镇痛、抗血栓作用[21]。核酸相对含量明显下调,差异代谢物中几种核酸类物质降低倍数超过2 倍,核苷酸参与体内许多代谢,嘌呤最终代谢物尿酸升高是疾病的生化基础。 25 种差异代谢物中,川皮苷变化倍数为915倍,川皮苷是一种黄酮类脂分子,苦味化合物,具有抗氧化、抗炎、抗癌[22]及神经保护作用[23]。 γ-亚麻酸变化倍数为9 倍,同样具有抗炎、抗氧化、降低血糖[24-25]等一系列生理活性。 2-苯乙醇是一种芳香化合物,有苦味、花卉味、蜂蜜味,与糖结合形成苯乙醇苷类,苯乙醇苷类具有很强的生物活性如抗氧化性[26]。
4 结 语
通过对植物杆乳杆菌发酵小叶苦丁枝条前后的代谢物进行统计学分析,发现发酵前后代谢物差异显著,说明发酵改变了小叶苦丁枝条提取物的物质构成, 提高了某些生理活性代谢物的相对含量。而抗生素庆大霉素C1a 与林可霉素及其他药用成分的大幅增加,也为植物乳杆菌发酵小叶苦丁枝条提取物的安全问题带来了不确定性。 作者初步分析了小叶苦丁枝条提取物发酵前后的差异组成,证明了乳酸菌发酵对小叶苦丁枝条的资源化利用是可行的,而庆大霉素C1a 等成分带来的安全风险和川皮苷等几种生物活性成分精确定量还需要进一步的评估和研究。

