体外消化模型评估食物过敏原致敏性研究进展
黄智本,唐婷,顾萱,闵星,施一凡,邢广良
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
近年来,食物过敏及其相关疾病的发生率在世界范围内迅速增加,食物过敏问题已受到了广泛的关注,在一些西方国家,食物过敏成人患病率约为2%,在儿童中高达8%[1]。食物过敏是机体免疫系统对食品中蛋白质的变态反应。一般认为,一种天然或变性的蛋白质想要维持其致敏性,该蛋白的免疫球蛋白E(immunoglobulin E,IgE)结合位点所处的氨基酸片段必须耐受体内消化[2]。因为人体在摄入食物过敏原后,胃肠消化系统会对过敏蛋白进行水解处理,过敏蛋白需具有一定的消化稳定性才能到达胃肠黏膜,并与敏感个体免疫系统中的免疫细胞(抗原呈递细胞、效应细胞等)相互作用,从而导致免疫系统反应异常和形成特异性抗体。当同类过敏原以同样的方式再次到达胃肠黏膜后会引发组胺等活性介质的产生,从而导致严重的食物过敏反应[3],最常见的食物过敏原蛋白致敏过程如图1 所示。
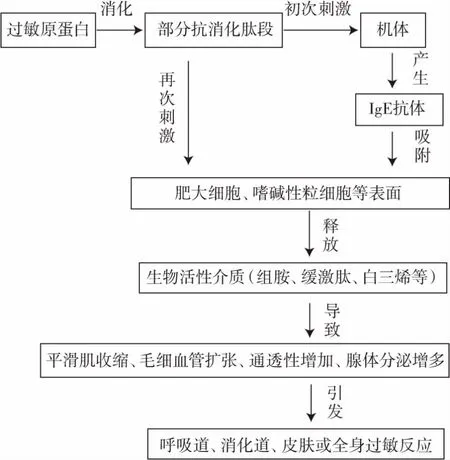
图1 食物过敏原蛋白致敏过程Fig.1 The allergic reaction process of food allergen proteins
食物过敏发生时可涉及身体多个器官系统,严重时可能会危及生命,影响过敏患者的生活质量,因此广大科研工作者致力于食物过敏原的潜在致敏性研究,检测和评价食物过敏原的潜在致敏性越来越受到重视。体外胃肠道消化实验是食物过敏原潜在致敏性评价体系的重要环节之一,可帮助人们更好地了解食物过敏原自身特性及其对人体免疫系统的影响,已广泛应用于食物过敏原致敏性评价中。体外胃肠道消化模型主要可分为静态消化模型和动态消化模型。静态消化模型提供一种廉价且易操作的方法评估食物过敏原,动态消化模型最接近体内条件,相比于静态消化模型更适合于研究食物过敏原的消化,然而需要复杂昂贵的设备且维护成本高。Mulet-cabero 等[4]设计了一种中间模型,即半动态消化模型,它在静态模型基础上增加了胃液分泌、胃排空等动态过程,且易于操作,不需要昂贵或复杂的设备。
本文系统介绍体外胃肠道消化模型的种类及其应用,并综述体外消化模型与体内消化模型相比的优缺点,最后对食物过敏原消化稳定性与潜在致敏性的关系进行探讨,以期为食物过敏原潜在致敏性评价研究中体外模拟消化方法的应用及消化结果分析提供参考。
1 体外胃肠道消化模型
体外胃肠道消化模型是根据体内生理功能和条件模拟食物消化的工具,它在食物过敏原的潜在致敏性评估过程中占有重要地位。不同的消化模型,所对应的特征条件也不同。例如,消化过程中所包含的步骤数量和类型不同(根据研究目的不同,可以包括口腔、胃和小肠的部分阶段或所有阶段,在某些情况下,还可以包括大肠发酵阶段),每个阶段消化液的化学组成、酶浓度、缓冲液类型以及表面活性剂等成分也不同[5]。迄今为止,相关研究者已经建立了各种体外消化模型,主要可分为两大类:静态消化模型和动态消化模型。
1.1 静态消化模型
体外静态消化模型是最早使用的模型,根据研究目的,模型可由口腔、胃、小肠等消化阶段组成。大多数静态模型使用一个锥形烧瓶、试管或烧杯,放置在37 ℃恒温振荡水浴槽中进行模拟消化,各个消化阶段在一个反应容器中完成,且每个阶段的pH 值、酶和电解质等生理数据均固定。Hur 等[6]详细介绍了各种静态体外消化在食品方面的应用,并对各个消化模型的消化参数进行了归纳。
研究者们曾设计多种静态消化模型,但是不同模型之间消化参数的差异往往导致消化结果呈现不同程度的差异性。因此Minekus 等[7]将消化参数标准化,提出一种标准化INFOGEST 静态体外消化方法,规定实验条件和程序,使不同实验室间消化结果的可比性和重复性得到增强。Brodkorb 等[8]在前者基础上进行改进,提出INFOGEST 2.0 体外静态消化方法,如图2 所示,它对消化液、操作步骤、设备等进行更详细的说明,并对酶活性的测定、消化过程中样品的采集和处理给出了详细的方案。现阶段体外静态消化模型在食物过敏原潜在致敏性的评价中已得到广泛应用。
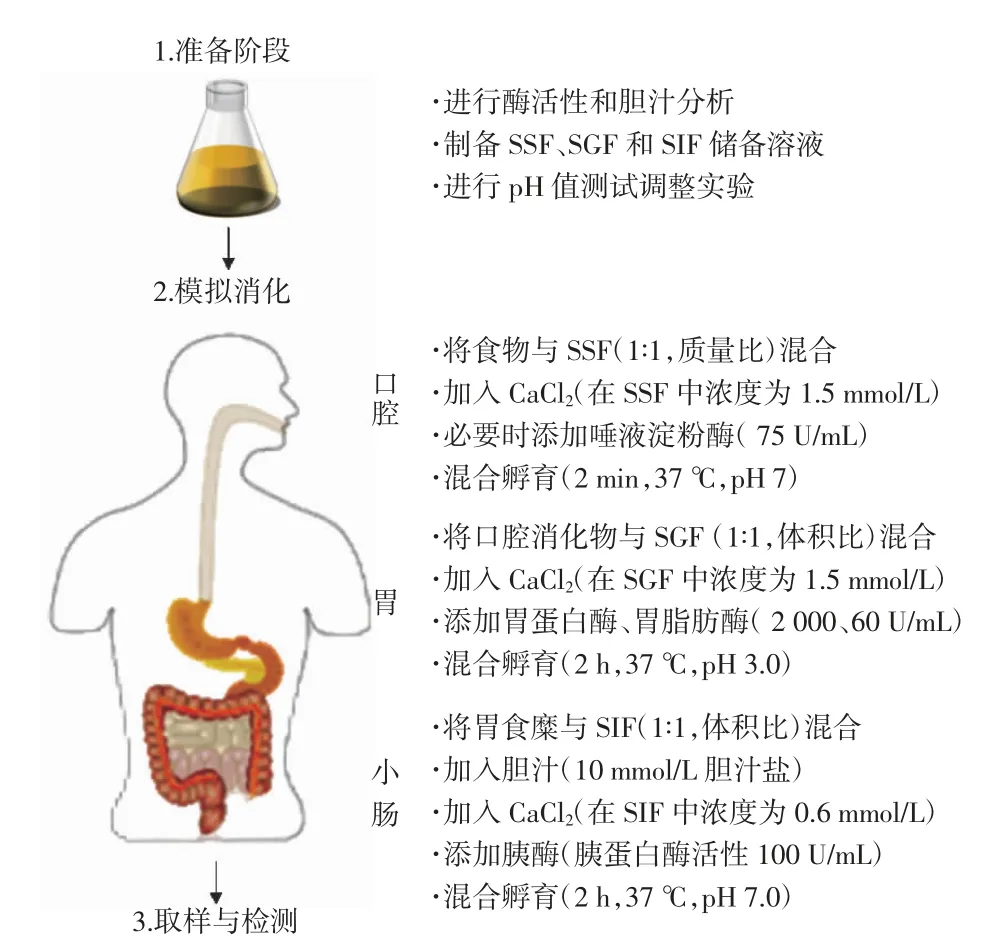
图2 INFOGEST 2.0 体外消化法流程图Fig.2 Flow diagram of the INFOGEST 2.0 digestion method
Di Stasio 等[9]利用标准化静态消化模型对生坚果和烤坚果进行消化,并通过蛋白质组学和生物信息学工具监测过敏原的降解,结果发现烤坚果比生坚果更易消化,也导致更多过敏原的已知表位减少或破坏。也有研究者对静态消化模型与体内消化模型的相关性进行了研究,例如Sanchón 等[10]通过鼻胃管收集口服酪蛋白和乳清蛋白后的人体空肠消化液,并使用标准化静态消化方法将蛋白质降解和小肽释放情况与相同底物消化液中的蛋白质降解和小肽释放情况进行比较,结果表明,在蛋白质降解和肽释放方面,体外消化方案的结果类似于体内肠道消化,证明了标准化静态消化方案与牛奶蛋白质的生理胃肠道消化非常接近。Bohn 等[11]回顾了体外静态消化模型的一系列应用及其与体内消化实验数据之间的相关性,发现大豆蛋白、乳清蛋白等蛋白质在通过静态模型消化后的肽段及消化率等终点值与体内消化实验有着显著的相关性。Ekmay 等[12]研究结果表明,静态体外消化模型是蛋白质和氨基酸消化率等终点值的可靠预测方法。这些研究说明了体外静态消化结果与体内消化结果有良好的相关性。
1.2 动态消化模型
尽管目前静态消化模型在评估食物过敏原方面得到了广泛应用,但它们过于简化消化生理学,未能模拟消化的动力学方面。为了弥补静态模型的不足,近年来研究人员已开发出一系列动态体外模型。动态体外模型一般可通过计算机控制消化过程中的消化液、酶、pH 值、持续时间、蠕动、吸收和排空等参数,更接近体内的生理环境。动态消化模型主要可分为单室消化系统和多室消化系统。
动态单室消化系统主要包括人体胃模拟器(human gastric simulator,HGS)、人工结肠模型(artificial colon,ARCOL)等。HGS 是常用的单室消化系统,它模拟人体胃腔生理相关的物理和化学条件。HGS 模型由一个柔性的外部容器模拟胃部,用一个变速电机控制滚轮的收缩频率以此来模拟胃部的蠕动收缩,胃液通过容器顶部的管子进入,样本通过容器远端的小管排空[13]。然而HGS 仅对胃腔的消化行为进行建模,如要反映食物消化的全过程,需要与其他静态或动态消化模型联合使用。ARCOL 是一种单室发酵模型,可复制人类或动物的结肠环境。这是第一个允许通过微生物群来维持代谢活性的模型。该系统集成了大肠内活体发酵的主要参数,如肠道pH 值、温度、厌氧环境、消化酶、代谢活性微生物群的存在等[14]。它还配备了透析纤维,以模拟微生物代谢物的吸收,因此ARCOL 模型可主要用于评估肠道微生物群对食物消化的影响。
动态多室消化系统主要有DIDGI R 系统、TIM 系统、SHIMER系统等[13]。DIDGIR系统由模拟胃和小肠的两个连续的隔间组成,可用于监测在模拟消化过程中发生的食物分解和水解动力学。为了达到生理学上的真实效果,DIDGIR系统中计算机控制的系统再现了胃和小肠的传输时间、胃和小肠中pH 值的动力学、消化液的添加顺序以及胃和小肠中内容物的搅拌[13]。DIDGIR系统的特点是其隔间是透明的,可实时观察消化过程中食物结构的演变,但只包括基本的搅拌,未能模拟小肠中营养物质的吸收。TIM 系统开发较早,并在近年得到不断完善。它提供了胃肠道的完整模拟,其由4个不同的隔间组成,代表胃肠道系统的胃、十二指肠、空肠和回肠部分。TIM 系统整合了人体消化的关键参数:温度、胃和肠道pH 值的动力学、转运时间、蠕动混合和运输、消化液的添加顺序,以及通过透析系统被动吸收水和小分子[15]。它提供了最接近人类胃肠道的消化环境,这与其他体外消化装置相比具有优势。但TIM 系统也有其局限性,例如没有模拟肠黏膜环境,无法研究肠道微生物对食物消化的影响。SHIMER模型由5 个反应器组成,模拟了胃肠道的不同部分,是一种由计算机控制的设备,可用于模拟健康人、婴儿、老年人在某些特定疾病条件(如肠炎、病原体感染)以及猪、狗和猫的胃肠道微生物生态和生理学[13]。研究表明,肠道微生物在调节机体对致敏原的免疫反应中起着关键作用[16]。而SHIMER模型可以准确模拟黏膜微生物定植,与宿主上皮细胞非常接近,此外,该模型还具有在不同的结肠隔室中长时间培养肠道微生物群的潜力,因此其可用于评估肠道微生物对食物消化的影响。但SHIMER模型也和其他体外模拟器一样,面临着缺乏模拟生理环境的问题,例如,无法模拟对水和代谢物的吸收。以上各动态消化系统的类型及主要特征如表1 所示[13]。

表1 主要动态消化系统及其主要特征Table 1 The dynamic digestion systems investigated and their main characteristics
现阶段体外动态消化模型在食物过敏原致敏性评估中的应用仍较少,其主要应用于蛋白质消化动力学分析。Guo 等[17]比较了南美白对虾粗提取物在静态、动态消化模型中的消化稳定性和潜在致敏性,结果表明,虾蛋白在动态消化过程中表现出不同的消化动力学行为,尤其是原肌球蛋白表现出更强的消化稳定性。这说明静态消化模型方法可能存在低估过敏原潜在致敏性的风险,动态消化模型更适合用于食物过敏原的潜在致敏性评估。Egger 等[18]用DIDGIR动态模拟消化系统及活体猪仔体内模拟消化实验对脱脂奶粉进行消化,分析其蛋白质稳定性及游离氨基酸的释放等特点,发现动态模拟消化试验结果与猪体内的结果非常接近,这也说明动态消化模型与体内消化结果具有相关性。因此动态消化系统将会成为研究食物消化的必备工具。
2 体内及体外胃肠道消化模型的优缺点对比
研究食物过敏原潜在致敏性最理想的方法是在人体志愿者体内或实验动物体内进行研究,体内消化实验可以直接反映食物过敏原在体内的真实情况。然而,体内消化实验的费用昂贵,且受到伦理道德上的限制,还往往存在实验结果重复性差、实验个体间存在差异以及难以形成标准化评估技术等问题。因此,作为体内消化实验替代方案的体外消化模型在试验研究中得到广泛应用。
如上所述,体外消化模型主要有静态消化模型和动态消化模型。静态消化模型由一系列生物反应器组成,这些生物反应器模拟食物进入胃肠道(口、胃、小肠)的不同腔室时遇到的物理化学和酶环境,有着易于使用、易于评估、价格低廉等优点。目前,静态体外消化模型已被证明是蛋白质和氨基酸消化率等终点值的可靠预测方法[12]。然而,静态消化模型也有其局限性,例如,不同研究中使用的不同试验条件(酶与底物的比率、pH 值、各阶段消化持续时间等)往往会导致试验结果间存在差异,阻碍了试验间的比对。而标准化INFOGEST 静态体外消化方法的提出使这一问题得到解决,它规定了实验条件和程序,使不同实验室间消化结果的可比性和重复性得到了增强。静态模拟消化的另一个缺点是其仅限于研究终点消化产物,且静态消化模型过于简单,不能反映不同阶段之间的消化转运和各阶段的吸收,不能模拟复杂的动态过程以及与机体生理的相互关系。相比之下,动态消化模型再现了食物消化的动态过程,比如蠕动、酶分泌、胃排空和吸收等生理过程,较好反映了人体胃肠道环境。因此,动态消化方法更适合用来研究过敏性食物在胃肠道中的消化稳定性及其消化动力学。Miralles 等[19]采用动态胃肠模拟器SIMGI 评估乳清蛋白浓缩物的胃消化情况,并将消化得到的样本与静态消化方案INFOGEST 得出的样本进行比较,结果发现虽然两种消化模型消化得到的肽段相似,但在动态条件下,观察到肽的数量随着时间的推移逐步增加,而静态消化方案从消化开始就产生大量肽段,这反映了胃蠕动振荡和胃排空等生理因素对蛋白质消化率的影响。
迄今为止,已建立多种动态消化模型。动态消化模型可提前预设消化条件,实现自动消化,一般可以实时监测模拟胃腔及肠腔中的pH 值变化情况,且样品在消化过程中可进行取样,有设计合理、运行可靠、操作简单等优点。但这些模型往往非常复杂,需要大量的硬件和软件,安装和维护成本较高。相比体内消化,动态消化模型也存在一些不足。目前大多数体外消化系统中,胃肠道的形态(如胃壁表面的皱纹、胃肠道尺寸等)和肠道微生态很少被纳入,为了使动态消化系统更逼真,应该考虑更多的胃肠道细节[15]。Bunyavanich[16]研究表明,肠道微生物在调节机体对致敏原的免疫反应中起着关键作用。Fu 等[20]对益生型干酪乳杆菌调节虾原肌球蛋白致敏能力进行了小鼠实验,发现在干酪乳杆菌的干预下,小鼠过敏症状得到了不同程度的缓解,益生菌可改善肠道屏障状态。另外,目前的动态模拟消化系统一般不涉及食物从口腔到大肠的所有消化步骤,例如,HGS 模型仅模拟了胃部环境,而已有研究证明,蛋白质可以高度抵抗胃消化,但进入小肠后几分钟内就可以被完全水解[21]。TIM、DIDGIR等一些相对成熟的动态消化模型也没有涉及到食物的口腔消化过程,口腔消化过程虽然简短,但在整个消化过程中,尤其是对固体食物的胃消化和胃排空率起着重要作用[22]。此外,动态消化模型在消化时一般需要大量的过敏原原料及消化酶,不适用于一些昂贵的纯化过敏原的致敏性评价。虽然动态消化模型与体内消化还存在差距,其依旧是目前比较先进的食物过敏原评估手段,因此动态消化系统会得到进一步完善。体内及体外胃肠道消化模型的优缺点对比如表2 所示。

表2 体内及体外胃肠道消化模型的优缺点对比Table 2 Comparison of advantages and disadvantages of in vivo and in vitro gastrointestinal digestion models
3 食物过敏原消化稳定性与潜在致敏性的关系
联合国粮农组织和世界卫生组织曾对蛋白的致敏性评估提出一些参考指标,其中包括体外消化稳定性这一指标[23]。体外消化稳定性一词有多种性质,不仅包括蛋白质酶水解稳定性,还包括耐热性、耐酸性和物理稳定性(例如聚集趋势)等[24]。在体外消化系统对过敏原的研究中,Astwood 等[25]通过模拟胃液消化实验对16 种已知食物过敏原(乳球蛋白、卵清蛋白、大豆蛋白等)和9 种非过敏蛋白(大豆种子的脂氧合酶、小麦仁中的蔗糖合成酶、大麦仁中的茁-淀粉酶等)进行评估,发现过敏蛋白有很强耐消化性,而非过敏蛋白在消化过程中被完全降解,可以通过消化稳定性区分过敏蛋白和非过敏蛋白。然而随着研究的深入,已有越来越多的试验研究与此结论相矛盾,研究表明并非所有的食物过敏原都有强耐消化性。例如,Akkerdaas 等[26]对5 种已确定的“完全过敏原”以及它们各自的4 种功能性非/低致敏同系物进行模拟胃液消化,结果表明大多数蛋白质,包括过敏原和非过敏原,都对胃蛋白酶具有高度耐消化性。这说明食物过敏原的消化稳定性虽然可能有助于增加其引发过敏反应,但食物过敏原的消化稳定性与其致敏性没有必然关联。
通常,对消化和加工具有高度稳定性的食物过敏原能够进入到小肠并被吸收,以其IgE 反应形式到达胃肠道免疫系统,并引发严重的过敏反应[27]。Scheurer等[28]提到过敏原至少需要两个IgE 结合表位,才能促进肥大细胞和嗜碱性粒细胞的IgE 交联和活化而导致过敏反应。也有研究指出,具有致敏性肽段的相对分子量下限大约为3.5 kDa[29]。然而,最近的研究表明,一些食物过敏原在消化成小肽片段时,仍可能保留致敏蛋白和IgE 反应的潜力。
王学丽等[30]以南美白对虾中主要过敏原原肌球蛋白为研究对象,研究原肌球蛋白在体外模拟胃液消化中表位的变化情况,结果显示原肌球蛋白在胃液消化过程中大部分抗原表位被破坏,但是原肌球蛋白在胃液中消化2 h 时仍具有免疫活性和过敏原性。这种现象可能是肽段聚集效应导致。Prodic 等[31]研究结果表明,肽段能够结合在一起,并在特定条件下可形成类似于天然过敏原的三维结构。例如,牛奶中酪蛋白经胃蛋白酶消化后可快速降解成小肽片段,大多数小肽片段仅含有IgE 结合表位的一部分,然而在模拟胃肠液消化后其IgE 结合表位可以聚集并重新作为一种完整的过敏原发挥作用,能够结合IgE 并引发过敏反应[32]。此外,消化过程中二硫键形成[33]或脯氨酸残基的羟基化[34]等现象也可能会使过敏蛋白保持其过敏性。Dupont 等[35]指出,过敏蛋白在胃肠道消化中的稳定性很大程度上取决于过敏蛋白是纯化状态还是嵌入到复杂的食物基质中,过敏蛋白与其他食物成分或消化酶的相互作用可能会显著改变胃肠道中过敏蛋白的水解。例如,Jiménez-saiz 等[36]研究在含有果胶、阿拉伯树胶和木聚糖的情况下,鸡蛋中主要过敏原卵清蛋白和卵黏蛋白的IgE 结合和体外胃肠道消化率,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、反向高效液相色谱和排阻色谱法分析胃和十二指肠消化液,并使用鸡蛋致敏患者的血清通过免疫印迹和酶联免疫吸附法评估特异性人类IgE 结合能力,结果发现,与纯化的蛋白质相比,混有多糖卵清蛋白和卵黏蛋白对人类IgE 的反应性显著增加,并且它们对消化的敏感性降低。Luo 等[37]测定添加脂肪乳剂对鱼类过敏蛋白小白蛋白(parvalbumin,PV)的体外消化抵抗力和IgG/IgE结合能力的影响,结果表明,脂肪乳剂显著降低了PV 对胃消化的水解程度,在乳化条件下,消化后90~120 min 仍可检测到胃消化的免疫片段,显示出抵抗力,它还改变了消化产物的IgG/IgE 结合能力,表明含有脂肪乳剂的PV 对消化具有抵抗力,并且具有更高的IgE 结合能力,从而在致敏个体中导致更高的过敏风险。这些试验结果说明,食物基质在消化过程中对过敏蛋白可能有保护作用。另外,食物的pH 值通常在4~7 之间,而胃内的pH 值大约在1 左右,食物的摄入会使胃的pH 值从基线中值pH1 增加到pH4.5,从而限制胃蛋白酶的活性,这将大大减少蛋白质的水解[38]。因此,食物过敏原的消化稳定性与致敏性之间的关系并不简单,对于食物过敏原的致敏性评价,需要将其消化稳定性分析与免疫学分析、氨基酸序列分析等手段相结合,这将有助于了解食品过敏原在进入过敏患者消化系统后对机体免疫系统的影响。
综上所述,食物过敏原的消化稳定性可能有助于增加其引发过敏反应,但食物过敏原消化稳定性与其致敏性没有必然关联。食物过敏原要保持其致敏性除了需耐受胃肠道消化,其消化产物也需有含抗原表位的蛋白片段,此外,其致敏性还与蛋白片段的抗原表位丰度等因素有关。
4 结语
体外胃肠道消化实验是食物过敏原潜在致敏性评价体系的重要环节之一,可帮助人们更好地了解食物过敏原自身特性及其对人体免疫系统的影响,已广泛地应用于食物过敏原致敏性的评价中。本文系统介绍了体外胃肠道消化模型的种类及其应用,发现目前虽有许多的体外消化系统已经被开发出来,可以应用于食物过敏原潜在致敏性的研究,但是不同的体外消化模型对食物过敏原潜在致敏性的评价有不同的结果。这表明建立一个合适、标准的模型非常重要,标准化的消化模型可以增加实验间的可比性和重复性。此外,对于评估食物过敏原时模型的选择,建议从不同食物过敏原的特性出发,选择最合适的消化系统,因为每种类型的消化模型都有其自身的优势和局限性。
食物过敏原的消化稳定性有助于增加其引发过敏反应的可能性,但食物过敏原消化稳定性与其致敏性没有必然关联。对食物过敏原的评估不应仅局限于高分子量肽段的检测,也应该考虑到含有抗原表位的小型短肽,其他的一些因素也会对过敏原的消化产生重要影响。例如,消化过程中小型肽段的聚集和二硫键形成或脯氨酸残基的羟基化等现象也可能会使过敏蛋白保持其过敏性。食物过敏原致敏性受到多种因素影响,过敏原需要耐胃肠道消化,且消化结果含有抗原表位的蛋白片段,其致敏性还与蛋白片段的抗原表位丰度等因素有关。另外,肠道微生物在调节机体对致敏原的免疫反应中起着关键作用,但目前的消化模型中较少有涉及到肠道微生物。因此,对于未来,我们需要更可靠的体外消化模型来预测消化,更好地了解胃肠道中蛋白质片段稳定性,以及它们如何与人体内的相关免疫细胞的相互作用。

