中药作用靶点及分子机制的转录组学研究思路与方法
董 艳 李 军 张振鹏 高嘉良 王 阶
(中国中医科学院广安门医院,北京,100053)
一直以来中医药为人们的健康保驾护航,但随着精准医学的不断发展,中医药客观化、精确化和靶向化问题已逐渐成为阻碍其现代化发展的壁垒。转录组学是在整体水平上研究特定生长周期或生理状态下某个细胞或组织所有基因转录及转录调控规律的一门学科[1],它包括编码蛋白质的信使RNA(Messenger RNA,mRNA)和不编码蛋白质的非编码RNA(Non-coding RNA,ncNRA)。转录组是决定基因表达与否,连接基因与表型的关键环节,它受外源和内源因素的共同调控,能反映内部基因组与外部物理特征的整体动态联系,符合中医整体观理论及中药多靶点整体网络调控的特性。有鉴于此,从转录组学层面研究中药作用靶点,将有助于揭示中药多成分、多靶点、整体调节的分子机制,是中医药向精准医疗迈进的一大步。
1 转录组学理念符合中医药作用特征
随着当前药物研究从“一药一靶一病”的单靶点理念向多层次、多靶点整体调节的方向转变[2],越来越多的研究者开始关注组学技术在中药研究中的应用[3]。各种组学技术,包括基因组学、转录组学、蛋白质组学、代谢组学和脂质组学等已经成为中药药理机制、中药复杂体系、中药活性成分筛选及中药材鉴别等的主要策略。其中,转录组学受内源和外源因素的协同调控,在基因承载和表达之间起着关键的枢纽作用。它的整体性、时空性和复杂网络关系尤其适用于中药靶点及机制的研究,故而其技术应用也极为广泛[4]。借助转录组学技术,中药活性成分、单味中药以及中药复方的多层次、多靶点协同作用机制得以逐步阐释[5-6]。通过研究mRNA的差异表达能反映中药在基因转录水平的潜在作用,而有关微小RNA(Micro RNA,miRNA)、长链非编码RNA(Long Non-coding RNA,lncRNA)、环状RNA(Circular RNA,circRNA)等ncRNAs及其lncRNA-miRNA-mRNA、circRNA-miRNA-mRNA及miRNA-mRNA等复杂关系的研究则能进一步从转录后基因修饰和调控网络层面揭示中药的作用靶点和分子机制。因此,转录组学技术有望成为挖掘中医药宝藏的有力武器,基于转录组学技术研究中药的作用靶点及分子机制已经成为了当前的热点领域。
2 转录组学研究的常用检测技术
随着转录组学发展的逐渐深入,基于mRNA和多种ncRNAs的表达谱日趋完善,多种转录组学技术也应运而生。目前该技术主要包括基因芯片、RNA测序、单分子测序、单细胞测序和空间转录组等,其中RNA测序运用最广泛,单细胞测序和空间转录组则是当前的热点技术,已逐步运用到中医药研究中。
2.1 基因芯片 基因芯片技术是转录组学中发展较早和传统的技术方法。它由数以万计的核酸探针排列构成,其中每条探针都对应特定的基因序列,用以检测基因的表达丰度。基因芯片技术能快速、准确地检测基因表达,其操作简便,价格相对低廉,且相关的数据分析软件及理论也较为成熟[7]。在中药研究领域,该技术主要用于药理、毒理、药物靶点及药效机制的研究[8]。但是,这种基于现有已知基因序列的检测方法,有其自身的局限性:1)不能识别先验基因组序列以外的新RNA;2)杂交技术灵敏度较低,难以精确分辨同源性较高的基因序列和表达丰度较低、瞬间表达的目标序列,亦不能检测异常转录的基因;3)检测范围会因背景信号和荧光信号的饱和而受到限制;4)标准化的基因表达分析方法,使得不同实验和平台之间的定量化基因表达比较研究难以实施[9-11]。有鉴于此,该技术已逐渐被RNA测序技术所替代。
2.2 RNA测序 RNA测序技术,即RNA-seq技术、第二代测序技术、全转录组测序技术,直接对RNA逆转录生成的cDNA序列进行测序。该技术采用边合成边测序方法,能一次性测定几十万到几百万条核苷酸序列,灵敏度高,检测范围广,且无需设计探针,具有整体性、组织差异性和时间独立性等特点,故而可构建不同组织、不同时间段的基因转录谱。目前,RNA测序技术已经成为转录组学研究的主要方法,通过分析不同转录谱之间的差异表达基因,进一步整合生物信息学方法,有助于明确中药治疗疾病的作用机制。但是,测序片段读长相对较短、扩增时易引入偏差以及无法完整解析复杂重复区域,依然是RNA测序技术的主要挑战。同时,当前数据处理模型的发展落后于测序技术,导致海量数据难以得到有效分析和合理利用。因此,尽管运用RNA测序能获得全转录组的基因表达,但是这些结果模糊而庞杂,难以聚焦到关键的作用靶点或明确的调控网络机制。
2.3 单分子测序 单分子测序,即第三代测序技术,具有长读长、单分子及实时测序等特点[12],主要包括单分子实时测序技术和单分子纳米孔测序技术等[13-15]。目前,大部分单分子测序技术还处于发展阶段,其中较为成熟的是单分子实时(Single Molecule Real-time,SMRT)测序技术。它基于单分子水平,边合成边测序,拥有更高的通量、超长读长、运行快速、精确性更高、无需模板扩增和逆转录等优势[13],现主要运用于小型基因组从头测序和组装、转录组测序和甲基化分析等[16]。有学者利用SMRT技术进行地中海贫血相关hba1/2和hbb基因的全长测序,解析了其基因的完整变异信息,而这些基因信息难以用传统的RNA测序技术获得[17]。另有研究运用单分子测序的长读长模式分析一对智力障碍综合征的双胞胎患儿,发现了源于母系的12 kb染色体倒转,而该倒转能直接影响brpf1基因表达,进而导致遗传性智力发育障碍[18]。值得注意的是,单分子测序技术已逐渐应用于中医药领域,有学者联合SMRT测序与高通量测序深入分析中药材丹参成分,发现丹参的主要活性成分之一——丹参酮,其主要产生并积累于植物的根皮部位[19]。另有研究利用SMRT与RNA测序技术研究三七的转录组序列,结果显示三七花是合成其主要活性成分人参皂苷的主要部位,而三七根则是贮藏人参皂苷的部位,且三七开花时间受光周期调节,编码光受体蛋白的基因通过大量扩增,提高其光能利用率[20]。由此而见,单分子测序技术在研究单味中药转录组及其活性成分代谢相关基因方面已经初露头角,在后续针对具体疾病的中医药作用靶点及机制研究方面值得期待。
2.4 单细胞测序 单细胞测序是目前转录组学研究的新兴技术,也是当前生物科学领域的焦点,它能实现单细胞基因组、转录组和表观遗传学的测序。现有针对单细胞的测序主要基于RNA测序技术,RNA测序所需样品较少且无需片段化RNA,因而能完成单细胞全转录组测序[21]。单细胞测序适用于分析不同细胞类型或亚群以及揭示细胞异质性,在探索单个细胞对药物反应的动态变化,以及不同细胞对药物反应的异质性方面表现出巨大优势[22]。一项研究运用单细胞转录组测序(Single-cell RNA-Seq,scRNA-Seq)分析正常及心肌梗死后不同时间节点的内皮细胞簇,发现在心肌梗死过程中内皮细胞存在缺氧、炎症反应及增殖的动态病理演变[23]。而针对动脉粥样硬化的scRNA-Seq和质谱流式细胞研究发现,高脂诱导的动脉粥样硬化主要是炎性单核巨噬细胞群增多,而非固有巨噬细胞及2型树突细胞[24]。另有学者将单细胞测序与单分子测序技术结合,开发了单细胞基因组单分子测序(Single-cell Genome Long-read Sequencing Technology,SMOOTH-seq)新方法,该方法克服了传统单分子测序对样本量的要求,实现了对微量样品和单细胞样品的单分子测序[25]。值得注意的是,单细胞测序的细胞已然失去了自身的组织空间信息,而这种微环境的改变有可能会导致细胞基因表达谱的变化,这在一定程度上限制了单细胞测序的应用[26]。此外,测序成本较高和测序时间较长也是当前影响scRNA-Seq推广应用的关键。
2.5 空间转录组 空间转录组目前已被广泛应用于心血管、肿瘤、肾病及肝病等领域[27-30]。它不仅可以分析基因表达数据,还能获得细胞空间位置信息,在一定程度上可以弥补单细胞测序的不足。空间转录组技术包括基于原位杂交、基于高通量测序、基于原位测序和基于活细胞标记等[31]。其中,高通量测序性价比较高,是目前运用比较广泛的技术[31]。有研究整合了单细胞核转录组和空间转录组等技术,研究正常和心肌梗死后不同阶段的心肌组织,发现心肌梗死后不同病理区域的心肌细胞存在显著的差异空间基因调控,并绘制了心肌梗死后心脏重构的高分辨率整合图谱[32]。另有学者应用空间转录组技术对射血分数保留心力衰竭患者的心肌组织进行分析,发现了5种胎儿标记基因,而这些基因由于表达量微弱,正常情况下很难被检测[33]。此外,为了揭示不同生长阶段、不同解剖部位的心脏特异性基因图谱,该学者进一步结合空间转录组和scRNA-Seq技术,构建了人类心脏的时空基因表达图谱,并形成了公开数据库[34]。由此可见,空间转录组作为当前生物技术领域的热点,必将为推进人类组织原位细胞真实基因表达、微环境互作和生理病理变化研究提供重要手段。尽管如此,目前采用空间转录组学研究中医药仍处于探索阶段,未来该技术将在不断完善自身的基础上为中医药精准医疗提供可靠技术支撑。
3 中药作用靶点及分子机制的转录组学研究方法
利用转录组学的研究思路与方法能实现从宏观到微观,从单一到网络的中药作用靶点与分子机制探索。目前常用研究思路为:初期小样本筛选差异RNA表达谱,经过生物信息学,或联合网络药理学,或结合其他多组学筛选方法,分析关键RNA和调控网络,并采用反转录聚合酶链反应(Reverse Transcription-polymerase Chain Reaction,RT-PCR)技术对关键RNA进行大样本验证,以确定中医药对特定RNA调控的稳定性;然后,利用RNA干扰技术,对验证后的关键RNA进行沉默和(或)过表达,从功能学上证实中医药与该RNA之间的靶向关系及其涉及的上下游调控网络;最后,通过探索RNA与药物分子的结合位点,证实中药干预RNA的直接靶向作用。见图1。
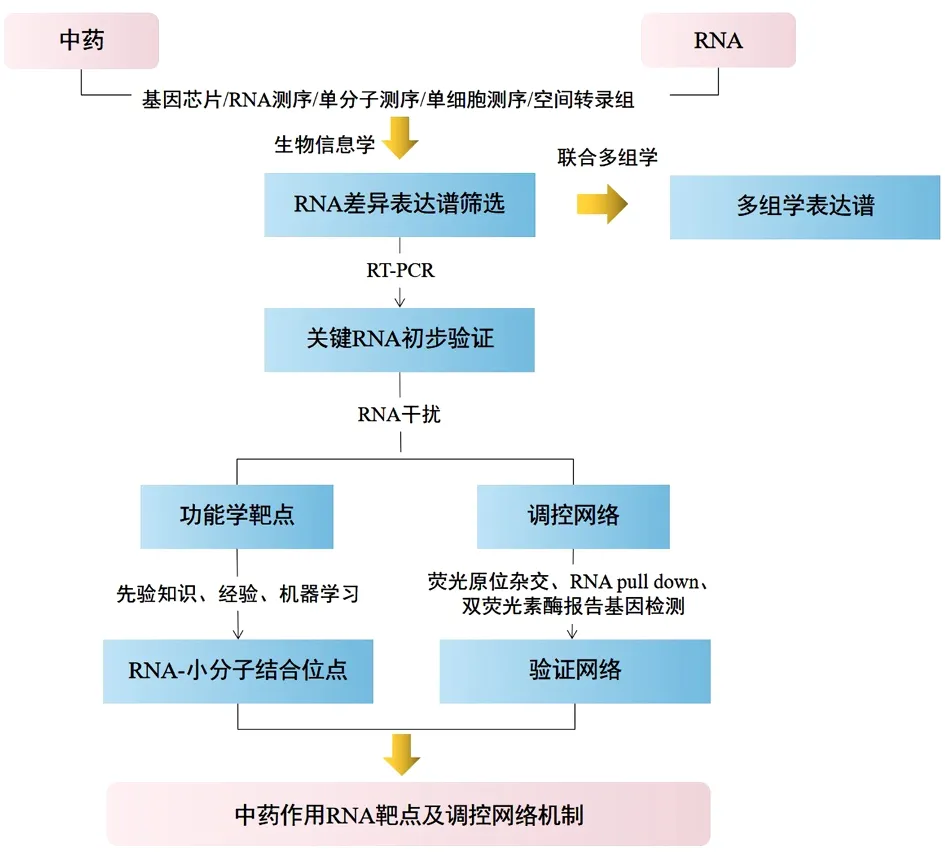
图1 中药作用靶点及分子机制的转录组学研究思路
3.1 转录谱筛选及关键RNA初步验证研究——利用基因芯片/RNA测序/单细胞测序等联合RT-PCR技术 利用基因芯片或RNA测序技术检测中药治疗前后的转录谱变化,结合生物信息学方法分析基因的功能和通路,能较为全面地筛查中药潜在靶基因。但由于测序费用相对昂贵,临床上往往先进行小样本的差异转录谱筛选,然后进一步针对关键基因扩大样本量进行RT-PCR检测,以验证这些基因作为中药靶点的有效性和稳定性。因此,将基因芯片或RNA测序与RT-PCR技术结合才能完成一项完整的初筛和验证工作,目前这种方法也是研究中药治疗疾病的RNA靶点及其机制的主要手段。有学者在筛选冠心病血瘀证差异转录谱基础上,开展了关键基因的RT-PCR验证和中药干预研究,阐释了血塞通软胶囊治疗冠心病血瘀证的潜在靶点和作用机制[35]。利用基因芯片筛选出冠心病血瘀证患者差异表达的1 081个mRNAs和25个miRNAs,结合生物信息学分析,进一步构建了miR-146b-5p/CALR/炎症反应和miR-199a-5p/TP53/凋亡调控网络,并用RT-PCR验证了以上关键基因的表达。经血塞通软胶囊干预后,RT-PCR检测结果显示冠心病血瘀证患者hsa-miR-199a-5p、hsa-miR-146b-5p和TP53的异常表达被逆转[36];且细胞学研究显示,血塞通软胶囊能通过调节hsa-miR-146b-5p表达,抑制细胞凋亡,从而发挥保护血管内皮细胞的作用[37]。
另有研究利用RNA测序技术对冠心病及其冠心病血瘀证、冠心病非血瘀证和正常对照进行转录组分析,发现冠心病血瘀证存在39个lncRNA,229个miRNA和221个mRNA的差异表达;并运用网络拓扑分析和韦恩分析,获得转录谱中的关键节点和lncRNA-miRNA-mRNA调控网络[38-39]。在此基础上,进一步开展血塞通软胶囊干预冠心病血瘀证的临床试验[40],采用RT-PCR方法验证中药对其关键lncR CTB114C7.4-miR3656-BCL2A1调控网络的作用,从而证实了血塞通软胶囊治疗冠心病血瘀证在转录层面的靶点及调控网络。由此可见,基于差异转录谱筛选和RT-PCR验证,可以初步确定中药的潜在RNA靶点,但这种RNA的差异变化仅仅体现了中药与转录组之间存在相关性,更直接的靶向调节证据仍需进一步开展RNA干扰实验。
值得注意的是,随着单细胞测序理念的发展,传统针对组织或多细胞群体的转录组测序已无法满足当前研究的需要,针对单细胞全转录组的测序正逐渐应用于中医药领域。一项运用单细胞RNA转录组测序,结合DESeq2差异表达分析的研究发现,左归丸可以逆转高糖诱导的14个核糖体通路相关基因的下调,上调呼吸链相关基因和氧化磷酸化,进而促进糖代谢,抑制高糖导致的胚胎细胞死亡[41]。此外,利用单细胞测序联合空间转录组能更全面系统地揭示中医药作用的时空信息,但目前相关研究报道较少,值得将来进一步探索和挖掘。
3.2 功能学靶点及上下游调控机制研究——基于RNA干扰技术的基础研究 通过转录谱筛选和关键RNA验证工作后能初步明确中药作用的潜在靶点。但是,要进一步确定这些潜在靶点能否在功能上直接影响药效,仍需通过RNA沉默或过表达才能证实。有鉴于此,越来越多的研究利用慢/腺病毒介导的shRNA转染、化学合成siRNA或其他靶点抑制剂实现基因表达的干扰,从功能学上观察靶点与药效的关系。有研究联合siRNA和shRNA方法对miR-3 656和lncR CTB-114C7.4基因进行表达干扰,发现三七总皂苷能上调lncR CTB-114C7.4和BCL2A1表达,下调miR-3 656表达,抑制细胞凋亡;将lncR CTB-114C7.4过表达或阻滞miR-3 656后,均能获得与三七总皂苷完全一致的调控作用;进一步在三七总皂苷干预基础上分别敲降lncR CTB-114C7.4和过表达miR-3 656发现,前者能完全逆转三七总皂苷的调节作用,而后者未能达到同样的效果,由此揭示lncR CTB-114C7.4的表达水平能影响三七总皂苷的疗效,是三七总皂苷发挥抗H2O2诱导氧化应激损伤的功能学靶点之一[42]。三七总皂苷能通过上调lncR CTB-114C7.4,激活lncR CTB114C7.4↑-miR3656↓-BCL2A1↑网络,从而抑制血管内皮细胞凋亡。另有学者报道,小檗碱能以P53依赖性方式上调肝细胞癌中miR-23a的表达,抑制Nek6,并促进P53相关肿瘤抑制基因p21和GADD45α的转录激活,从而导致肝癌细胞死亡,G2/M细胞周期停滞和肿瘤生长抑制;而当miR-23a抑制时,小檗碱诱导的保护作用被减弱,从而反向证实了miR-23a是小檗碱发挥抗肿瘤作用的重要靶点[43]。此外,另一项研究显示lncRNA UCA1在前列腺癌中高表达,与患者的不良预后正相关。青蒿琥酯能显著降低lncRNA UCA1表达,并调节下游miR-184/Bcl-2轴,从而诱导细胞凋亡并抑制转移能力;相反,当lncRNA UCA1过表达时又可逆转青蒿琥酯诱导的上述保护作用,由此证实了lncRNA UCA1是青蒿琥酯的治疗靶点,并揭示了其下游的miR-184/Bcl-2调控网络[44]。
由此可见,采用RNA干扰的方法对潜在靶基因进行研究,可以从功能学上证实中医药的作用靶点,并明确该靶点的上下游调控网络,但该靶点与中药在结构上的关系及其结合位点仍需进一步深入探索。
3.3 RNA-小分子结合位点研究——基于机器学习的结合位点预测 药物与RNA结合位点的研究是当前实现转录层面精准医疗的热点和难点问题。在明确了特定RNA与中药之间存在功能上的相互作用关系后,进一步深入挖掘RNA与中药或其活性成分的结合位点显得尤为必要,能为揭示中药治疗靶点提供更为直接的证据。由于RNA高度结构化,具有小分子可触及的结合袋或裂口[45],形成潜在的结合位点。因此,小分子物质可能通过与之结合诱导RNA功能的抑制或激活,从而发挥治疗疾病的作用。目前运用较广泛的荧光原位杂交检测能相对定位RNA的表达,结合RNA沉降(RNA Pull Down)和RNA免疫沉淀(RNA Immunoprecipitation,RIP)实验能进一步证实不同RNA之间以及RNA与蛋白质之间的结合和共表达关系;而双荧光素酶报告基因检测则能通过位点突变的方法,实现ncRNA的靶基因验证,预测ncRNA与mRNA的结合位点。但是,关于RNA与药物小分子相互作用结合位点的预测方法则应用有限,主要包括基于先验知识、基于经验及机器学习[46]。其中,基于先验知识的方法是指运用已知的RNA-小分子结合位点数据库,预测可能与药物相关的RNA识别基序[47]。基于经验的方法则主要依赖RNA结构的几何特征,通过寻找这些特征的极值,将其作为结合位点的潜在指标[48]。机器学习方法是指通过计算RNA的结构和序列特征,从而推测其结合位点,该方法体现了多学科交叉的优势,已成为当前应用最主要的手段[46,49]。已有研究发现,许多天然、半合成及合成抗生素可以通过靶向调节RNA发挥抗感染作用[50-51]。另有一些小分子药物正处于临床和临床前开发中,它们通过作用于RNA靶点,发挥治疗遗传病和抗肿瘤的作用[52-54]。然而,遗憾的是目前针对RNA靶向结合位点的中药或其活性成分研究报道较少,未来关于RNA治疗的天然药物研究,中医药仍大有可为。
3.4 中药作用的多组学靶点及机制研究——整合多组学及网络药理学 随着基因组学、转录组学、甲基化组学、蛋白质组学和代谢组学等检测技术逐渐发展,人们越来越关注各组学之间的联合研究,以系统、整体、动态的角度认识疾病的发生发展变化以及中药干预的作用机制。不同于单组学研究可能带来的认识误差,多组学可纵向解释从基因到代谢物产生的整体过程,这种研究思路更符合中医整体恒动的思维,也与中药复方多成分、多靶点的特性一致,因此有关多组学在中医药中的运用也越来越多。见图2。1)转录组学联合基因组学、甲基化组学:将基因组、转录组和甲基化组同时研究能绘制包括DNA、RNA及基因修饰在内的复杂图谱,进而从基因层面揭示可能发生或正在发生的变化,为中药药效及靶点研究提供证据。一项研究采用单分子测序技术研究中药蛹虫草的基因组、甲基化组和转录组图谱,发现其具有安眠作用的N6-(2-羟乙基)腺苷和抗肿瘤作用的麦角甾醇代谢通路[55]。2)转录组学联合蛋白质组学、代谢组学:通过将转录组与蛋白质组、代谢组联合应用,能从已经发生的分子变化层面揭示中药作用靶点和机制。有学者利用转录组学、蛋白质组学及代谢组学研究中药复方治疗慢性阻塞性肺疾病的长期疗效机制[56]。通过分别采用基因芯片、液相色谱-质谱联用仪(Liquid Chromatograph Mass Spectrometer,LC-MS)蛋白质组学和LC-MS代谢组学技术,检测到补肺益肾方干预后的1 106个差异RNA、187个差异蛋白和32个差异代谢物;进一步整合分析多组学数据发现这些差异表达的RNA、蛋白和代谢物,参与调控脂质代谢、炎症反应、氧化应激和黏着斑等过程。3)组学技术联合网络药理学:将组学技术与网络药理学相结合也是当前中药靶点研究常用的方法。网络药理学通过构建化学成分-化学成分、化学成分-靶点以及靶点-疾病之间的相互关系,能帮助研究药物多靶点治疗疾病的作用机制,这种网络预测的方法能节省实验初筛工作所耗费的人力、物力和财力,极大地提高了科研效率,故而在具有多成分、多靶点特性的中药研究中表现出极大的优势[57-58]。目前已有研究将网络药理学与转录组学相结合,研究五味子乙素治疗肝纤维化的靶点和作用机制[59]。采用RNA-seq技术检测五味子乙素上调的2 584个基因和下调的1 659个基因,分析其参与的氧化还原反应、四氯化碳(CCl4)代谢、炎症反应和细胞凋亡等生物过程。运用化学信息学方法建立肝纤维化的靶点数据库,通过高通量、快速“成分-靶点”对接分析,虚拟筛选药物的潜在生物学靶点。针对网络预测的靶点开展实验研究,进一步证实了五味子乙素的潜在靶点为CB2受体以及相关的抗氧化、抗炎和抗凋亡作用。另有学者则基于网络药理学、转录组学和代谢组学3种技术研究葛根芩连汤对2型糖尿病的作用机制,结果显示黄酮类和生物碱类是葛根芩连汤发挥药效的主要成分,能促进过氧化物酶体增殖物激活受体(Peroxisome Proliferators-activated Receptor γ,PPARγ)和PPARα表达,参与糖脂代谢,从而治疗2型糖尿病[60]。
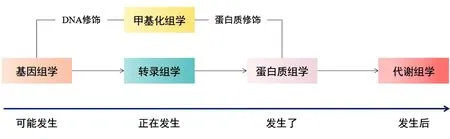
图2 各组学研究认识阶段及特点
多组学方法是当前研究中药靶点及分子机制的重要手段,尤其是将组学思维与网络药理学相结合,有利于从数据量庞大的基因图谱中进一步明确中药药效成分及其作用靶点。同时,针对中药ncRNA层面的靶点研究,充分利用网络药理的基因及蛋白数据库,有助于寻找ncRNA的下游调控基因、蛋白及通路,从而揭示中药的ncRNA-mRNA网络作用机制。但是,随之出现的不同组学的海量数据如何充分利用和合理分析,如何聚焦出具体而完整的“基因-RNA-蛋白-代谢产物”生物调控机制,仍然是目前需要解决的关键与瓶颈问题。
4 讨论
转录组学的发展使得中药在RNA层面的靶点和机制研究成为了可能。基于mRNA在DNA和蛋白质之间的关键枢纽作用,以及不同ncRNA之间、ncRNA与mRNA之间的网络调节特性,采用全转录组学的检测技术和研究方法能系统揭示中药的全部RNA靶点及转录后修饰作用,并聚焦到关键的生物功能和分子机制。但是,作为一个相对年轻的新兴学科,目前转录组学在中药靶点及机制研究领域仍然存在以下几个问题:1)由于全转录组测序费用昂贵,目前多数研究仅仅是检测某种特定的RNA类型,例如mRNA、miRNA、lncRNA或circRNA表达谱。这种单一类型的RNA转录谱并非真正意义上的转录组学,因此它也不能全面揭示中药在转录层面的所有差异表达的RNA。2)目前大部分研究仅进行了RNA表达谱筛选和RT-PCR验证,表明了中药与差异表达RNA的相关性以及潜在的信号通路。但更直接、更确切的治疗靶点和调控网络仍需进一步开展关键RNA的干扰实验和相应结合位点研究才能实现。3)不同类型RNA之间存在相互调控关系,尤其对于lncRNA和circRNA这种内源性竞争性RNA而言,它们能与miRNA和mRNA构成自上而下的调控网络。然而,现有研究大多侧重寻找中药单一层面的RNA靶点,而忽视其网络调控关系。4)转录组学能用于解释目前正在发生的基因变化,但导致其发生的遗传物质基础,及其是否确切发生并带来了什么后果仍不得而知,因此近年来多组学研究逐渐兴起。值得注意的是,在单组学技术仍未充分理解并利用时,过早开展多组学研究不仅耗费大量的研究经费,随之产生的海量组学数据更难以分析。而转录组作为中心法则的中间环节,对于承接遗传物质表达,推进蛋白质及代谢产物的生成至关重要;同时ncRNA的出现更丰富了中心法则以外的基因修饰过程,使得原本线性关联的遗传物质之间变得更加立体和真实。有鉴于此,充分利用最新转录组学技术,找到适合中医药的检测手段和数据分析方法,挖掘中药疗效背后的关键mRNA和ncRNA,形成系统明确的调控网络,仍然是下一步中药作用靶点及分子机制研究的重点。
利益冲突声明:无。

