古草生机汤对H22荷瘤小鼠体内抑瘤及免疫调节作用的初步研究
张伊冰 亓焕伟 李家峰 亓焕明 李瀛伟 包永睿,3,4 孟宪生,3,4
(1 辽宁中医药大学药学院,大连,116600; 2 沈阳百草济世肿瘤医药研究中心,沈阳,110041; 3 辽宁省现代中药研究工程实验室,大连,116600; 4 辽宁省中药多维分析专业技术创新中心,大连,116600)
世界卫生组织最新公布的《世界癌症报告》显示:2018年,肝癌成为全球第6大常见癌症和全球第4大常见癌症致死因素,在亚洲和非洲的年龄标准化发病率高于美国、欧洲和大洋洲[1]。在中国癌症流行病学的最新报告中,肝癌在全国恶性肿瘤发病率排名第4位,约为26.92/10万,年发病患者约37万[2]。
古草生机汤为沈阳百草济世肿瘤医药研究中心研制,由白花蛇舌草、黄药子、莪术等8味中药组成,有散结化痞、清瘀消滞、通利排毒等功效,在临床上用于恶性肿瘤的治疗和其他治疗方式的联合用药,经过多年数百病例观察均有很好的治疗效果。近年来该方剂治疗消化系统恶性肿瘤获得较好疗效,在治疗肝癌的同时,能够对肝脏功能、免疫功能起到一定的保护和调节作用,且具有不良反应小等特点,但其药效评价及具体抗肿瘤机制尚未有详细报道。本研究为2016、2017年度辽宁省创新团队研究项目——中药药效物质组学及作用机制整合研究中的一部分,旨在通过动物体内模型初步探究临床有效抗肝癌方剂——古草生机汤的抗癌作用机制。研究基于古草生机汤在临床应用所取得一定成果的基础上,探究该方剂对肝癌的抑制作用及分子机制,采用H22肝癌荷瘤小鼠模型,通过免疫器官、瘤体组织显微结构、血清指标、基因表达等不同层面,应用苏木精-伊红(Hematoxylin Eosin,HE)染色、酶联免疫吸附试验、实时荧光定量PCR等方法对古草生机汤体内抑瘤和免疫调节作用进行药效学评价,为将来此药的临床应用及抗消化系统恶性肿瘤的进一步研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物与细胞 实验动物:无特定病原体(Specific Pathogen Free,SPF)级昆明种小鼠,8周龄,雄性,体质量为18~22 g(购于辽宁长生生物技术股份有限公司,许可证号SCXK(辽)2015-0001,辽宁中医药大学动物实验伦理号/动物使用许可证号SYXK(辽)2019-0004)。在室温(23±1)℃、相对湿度55%±5%、12 h/12 h昼夜交替日光灯照射动物房内饲养,摄食、饮水自由的环境中适应1周后,用于实验。细胞株:H22小鼠肝癌瘤株,购于江苏齐氏生物科技有限公司。
1.1.2 药物 古草生机汤(由沈阳百草济世肿瘤医药研究中心提供),环磷酰胺(扬子江药业集团公司,批号:19032821)。
1.1.3 试剂与仪器 组织固定液(海门市博创实验器材有限公司,批号:2050354)、肝素钠(北京索莱宝科技有限公司,批号:1024E026)、1640培养基(Gibco公司,美国,货号:2058872)、胎牛血清(Gibico公司,美国,货号:10099-141),肿瘤坏死因子-α(Tumor Necrosis Factor,TNF-α)酶联免疫分析试剂盒(本生健康科技有限公司,货号:BS-0121)、小鼠γ干扰素(Interferon-γ,IFN-γ)酶联免疫分析试剂盒(本生健康科技有限公司,货号:BS-9828),小鼠白细胞介素-2(Interleukin-2,IL-2)酶联免疫分析试剂盒(本生健康科技有限公司,货号:BS-2689)、凋亡相关因子(Factor Related Apoptosis,FAS)酶联免疫分析试剂盒(本生健康科技有限公司,货号:BS-0009)、小鼠凋亡相关因子配体(Factor Related Apoptosis Ligand,FASL)酶联免疫分析试剂盒(本生健康科技有限公司,货号:BS-0723)、天门冬氨酸氨基转移酶(Aspartate Transferase,AST)酶联免疫分析试剂盒(本生健康科技有限公司,货号:BS-1626)、丙氨酸氨基转移酶(Alaninetransaminase,ALT)酶联免疫分析试剂盒(本生健康科技有限公司,货号:BS-5192),RNA提取试剂盒(TransZol Up,北京全式金生物技术有限公司,批号:L30731)、反转录试剂盒(Trans Script One-Step gDNA Removal and cDNA Synthesis Super Mix,北京全式金生物技术有限公司,批号:L10303)、荧光定量PCR试剂盒(Trans Start Top Green qPCR Super Mix,北京全式金生物技术有限公司,批号:L20830)。实验涉及所有引物委托大连万泽贸易有限公司技术人员,按照引物中适宜的(G+C)/(A+T)比例进行设计,使退火温度在60 ℃附近,设计好的引物序列交与生物上海生工生物公司进行合成。CO2培养箱(Millipore公司,美国,型号:W2001R),超纯水处理装置(Millipore公司,美国,型号:Milli-Q)、荧光倒置显微镜(NIKON公司,日本,型号:ECLIPSE-TI),酶标仪(Molecular Devices公司,美国,型号:Spectra Max Plus384),微量离心机(Thermo Fisher公司,美国,型号:Sorvall Lengend Mico21)。
1.2 方法
1.2.1 分组与H22荷瘤小鼠动物模型建立 小鼠肝癌H22细胞株用含有1%青链霉素和10%胎牛血清的1640培养基,放置于37 ℃、5%CO2、95%相对饱和湿度的培养箱内进行常规培养和传代,传代3次后,取对数生长期的细胞进行后续实验。
取上述对数生长期状态良好的H22小鼠肝癌细胞,离心弃上清,用磷酸盐缓冲液(Phosphate-buffered Saline,PBS)吹散调整细胞浓度为1×107个/mL,0.2 mL/只腹腔注射昆明种小鼠体内进行扩增,自由摄食饮水,饲养8 d。在无菌台下,取生长状态良好的小鼠脱颈椎处死,75%乙醇消毒腹部,无菌注射器腹腔穿刺,抽吸腹水,得到乳白色浓稠状腹水,留存备用。将腹水21 000×g离心5 min,弃上清,加PBS吹散离心清洗2次,用PBS调整细胞浓度为1×107个/mL,用于第2代腹水注射。连续传3代,第3代腹水经台盼蓝拒染法检测细胞活性,细胞存活率≥95%,备用。取8周昆明种小鼠,将腹水细胞浓度调整为1×107个/mL,0.2 mL/只,注射于小鼠右前肢腋下,密切观察小鼠变化,2 d后小鼠右前肢腋下可触摸到鼓起结节,表明造模成功。
随机将成模小鼠分为空白组、模型组、阳性药组(环磷酰胺27 mg/kg)、古草生机汤低剂量组(0.75 g/kg)、古草生机汤高剂量组(1.5 g/kg)。
1.2.2 给药方法 模型组和空白组给予生理盐水,每只0.2 mL,1次/d,每隔1 d称量小鼠体质量,共给药7 d。末次给药2 h后,禁食不禁水。次日称量各组小鼠体质量,将小鼠眼眶取血,加入肝素抗凝,静置30 min后,21 000×g离心10 min,取上层血浆。脱颈椎处死小鼠,除空白组外,其余组解剖,依次剥离取出脾、胸腺、瘤体,分别称重。
1.2.3 检测指标与方法 计算各组的抑瘤率、脾脏指数和胸腺指数:抑瘤率%=(1-给药组平均瘤重/模型组平均瘤重)×100%;脾指数=小鼠脾重量(mg)/小鼠体质量(g)×10;胸腺指数=小鼠胸腺重量(mg)/小鼠体质量(g)×10。
HE染色法评价古草生机汤对H22荷瘤小鼠实体瘤生长情况的影响:将模型组、阳性药组、古草生机汤低剂量组和古草生机汤高小鼠的瘤体组织放入10%甲醛溶液中固定,经脱水、透明、浸蜡、包埋、切片和贴片,用HE试剂染色封片,显微镜下观察各组瘤组织结构改变、肿瘤细胞密度、肿瘤细胞凋亡及坏死程度。
酶联免疫吸附试验法检测H22荷瘤小鼠血清中IL-2、TNF-α、IFN-γ、Fas、FasL、AST、ALT的含量:按照试剂盒内说明书上的操作制备各组的血浆样品,对应加入各反应试剂,在酶标仪450 nm下测定吸光度,建立标准曲线,根据标准曲线及各样品的吸光度,计算出各组小鼠血浆中IL-2、TNF-α、IFN-γ、Fas、FasL、AST、ALT的含量。
荧光实时定量PCR法检测古草生机汤对Bcl-2相关X蛋白(Bcl-2-associated X Protein,Bax)和B细胞淋巴瘤(B Cell Lymphoma-2,Bcl-2)mRNA表达的影响:取除空白组外其他组小鼠的瘤体组织,以Transzol法提取总RNA,按照Trans Script One-Step gDNA Removal and cDNA Synthesis Super Mix反转录试剂盒说明书的操作步骤,将提取的总RNA反转录成第一链cDNA,反应条件为:25 ℃孵育10 min,42 ℃孵育15 min,85 ℃加入5 s使反转录酶失活。用Trans Start Top Green qPCR Super Mix试剂盒对目的基因进行扩增,内参基因为β-actin,扩增反应条件:94 ℃加热30 s,94 ℃加热5 s、55 ℃加热15 s、72 ℃加热10 s重复40次。引物序列为如下。Bax-F:5-AGGATGCGTCCACCAAGAA-3。Bax-R:5-CAAAGTAGAAGAGGGCAACCAC-3-3。Bcl-2-F:5-CAACACTCCCTCTTGACCTATGC-3。Bcl-2-R:5-GAAAATGTTCCCAAGTGAGTTAGA-3。VEGF-F:5-CCCGAATTCTCCTGGTGAGAGATCTGGTT-3。VEGF-R:5-GGGGGATCCGCCTCCGAAACCATGAACTT-3。β-actin-F:5-GTCCCTCACCCTCCCAAAAG-3。β-actin-R:5-GCTGCCTCAACACCTCAACCC-3。
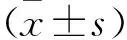
2 结果
2.1 古草生机汤对H22小鼠平均体质量、实体瘤抑瘤率和免疫器官的影响 模型组小鼠给药期间的平均体质量增长率为3.81%,明显低于空白组(18.66%);阳性药组、古草生机汤低剂量组和高剂量组小鼠平均体质量增长率分别为17.31%、14.96%和13.35%,均高于模型组,且差异均有统计学意义(均P<0.01)。见表1,图1。
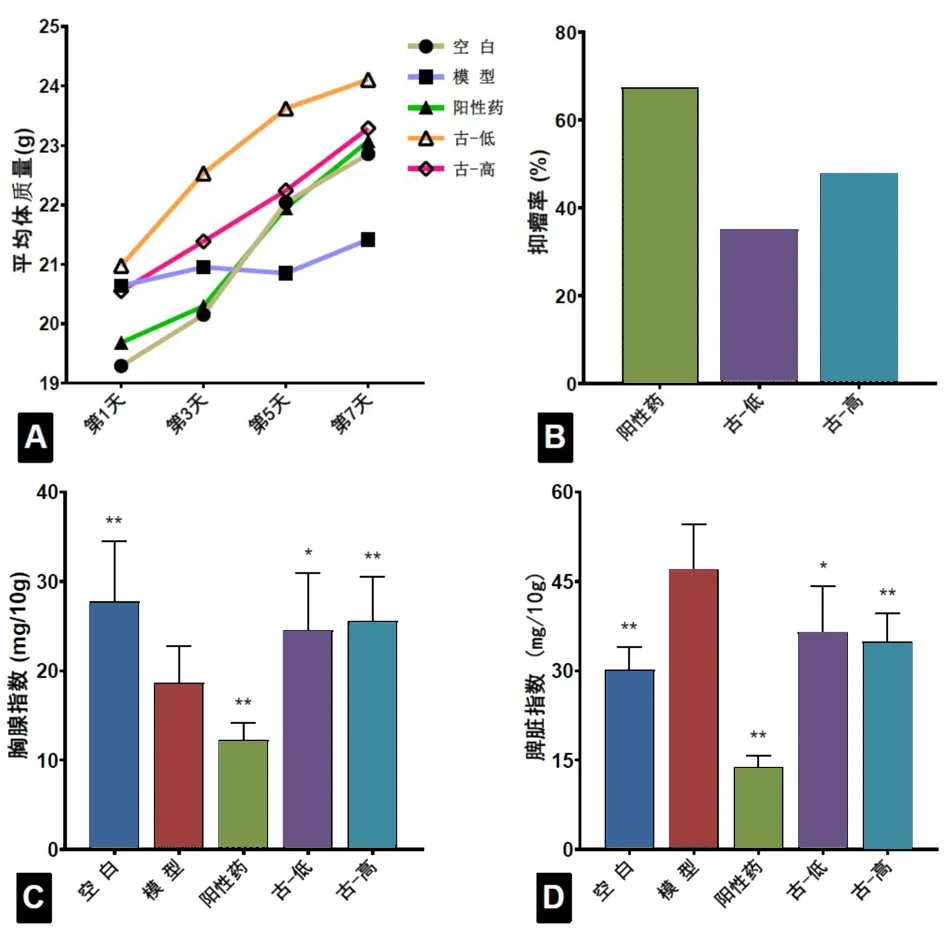
图1 各组小鼠的体质量、抑瘤率、脏器指数注:古-低为古草生机汤低剂量组,古-高为古草生机汤高剂量组;与模型组比较,*P<0.05,**P<0.01
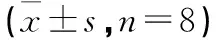
表1 给药期间各组小鼠平均体质量变化
阳性药组、古草生机汤低剂量组、高剂量组H22荷瘤小鼠实体瘤的平均重量明显低于模型组,差异均有统计学意义(均P<0.01)。阳性药组、古草生机汤低、高剂量组的抑瘤率分别为67.45%、35.11%和47.81%,古草生机汤的抑瘤率与给药剂量负相关。见表2,图1。除空白组外各组小鼠瘤体图片见图2。阳性药组和古草生机汤低、高剂量组小鼠瘤体的体积变化规律与计算所得抑瘤率结果相同。
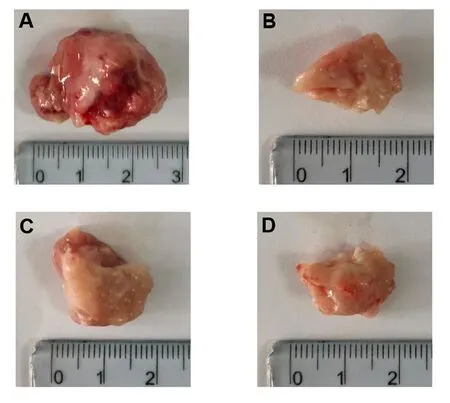
图2 各组H22荷瘤小鼠的实体瘤注:A.模型组;B.阳性药组;C.古草生机汤低剂量组;D.古草生机汤高剂量组
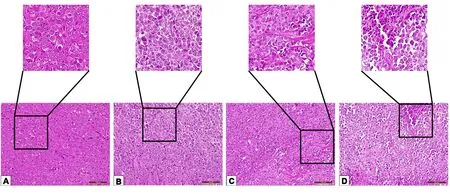
图3 各组H22荷瘤小鼠实体瘤病理切片(HE染色,×200)注:A.模型组;B.阳性药组;C.古草生机汤低剂量组;D.古草生机汤高剂量组
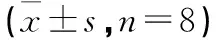
表2 各组小鼠的抑瘤率
模型组小鼠的胸腺指数为18.62±3.83,低于空白组27.71±6.35;模型组的脾脏指数为47.06±7.04,高于空白组30.20±3.48。阳性药组和古草生机汤低、高剂量组的胸腺指数为12.30±1.77、24.47±6.07、25.53±4.61;3组的脾脏指数分别为13.80±1.78、36.42±7.23和34.89±4.38。与模型组比较,古草生机汤低、高剂量组能够明显提高小鼠的胸腺指数并降低脾脏指数,且其药效随药浓度的增加而增强,差异有统计学意义(P<0.01,P<0.05)。阳性药小鼠的胸腺指数明显低于空白组,但脾脏指数明显降低且远低于空白组的正常小鼠。
2.2 古草生机汤对H22荷瘤小鼠实体瘤生长情况的影响 从HE染色的病理切片中可以看出,模型组肿瘤细胞排列较紧密,细胞密度大,坏死细胞少见,细胞核较大胞浆较少,细胞间质较少;阳性药组细胞排列疏松,坏死细胞多见细胞核有中心坏死和破裂,细胞质凝聚固缩;古草生机汤低、高剂量组和模型组比较死亡细胞数量较多,细胞大小各异:古草生机汤低剂量组的结缔组织较其他3组更为明显,古草生机汤高剂量组的细胞间质较低剂量组更大,细胞死亡数量更多。
2.3 古草生机汤对H22荷瘤小鼠血清IFN-γ、TNF-α、IL-2、Fas、FasL、AST、ALT的影响 与空白组比较,模型组小鼠血清中的IFN-γ、TNF-α和IL-2平均含量明显低于空白组,分别为(283.42±37.88)pg/mL、(231.00±17.35)pg/mL和(170.09±20.71)pg/mL;阳性药组(383.01±22.17)pg/mL、(374.24±26.21)pg/mL和(335.06±28.37)pg/mL、古草生机汤低剂量组(242.33±32.47)pg/mL、(322.98±25.99)pg/mL和(296.86±19.37)pg/mL、古草生机汤高剂量组(519.28±24.54)pg/mL、(386.66±37.57)pg/mL和(372.91±48.54)pg/mL均高于模型组(均P<0.01)。模型组小鼠血清中肝功能指标AST和ALT的含量为(25.92±0.85)ng/mL和(21.60±0.94)ng/mL,显著高于空白组;阳性药组为(20.11±1.80)ng/mL和(17.74±1.28)ng/mL、古草生机汤低剂量组为(21.12±1.76)ng/mL和(17.38±0.91)ng/mL、古草生机汤低剂量组为(19.12±1.30)ng/mL和(16.20±0.69)ng/mL,3个给药组的肝功能指标均明显低于模型组(P<0.01)。模型组小鼠血清中Fas和FasL含量为(17.36±1.16)nmol/mL和(10.38±0.90)nmol/mL,明显高于空白组;阳性药组为(14.55±0.84)nmol/mL和(8.79±0.77)nmol/mL、古草生机汤低剂量组为(13.03±1.11)nmol/mL和(8.05±0.59)nmol/mL、古草生机汤高剂量组为(12.05±70.78)nmol/mL和(7.32±0.67)nmol/mL,3个给药组均明显低于模型组(均P<0.01)。古草生机汤低剂量组升高IFN-γ、TNF-α、IL-2和降低AST的功效明显高于阳性药组(P<0.01,P<0.05),古草生机汤高剂量组降低ALT的功效明显高于阳性药组(P<0.05),古草生机汤低、高剂量组降低Fas、FasL的功效均明显高于阳性药组(P<0.05)。见图4。
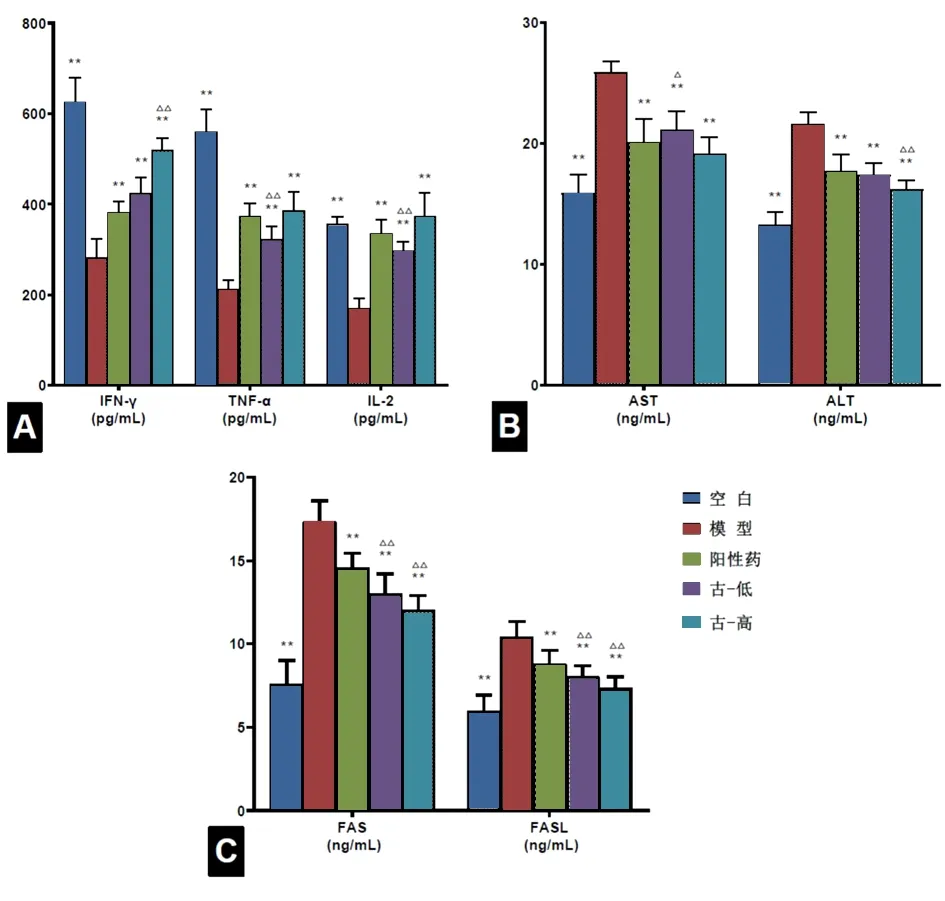
图4 各组H22荷瘤小鼠血清指标检测结果注:古-低为古草生机汤低剂量组,古-高为古草生机汤高剂量组;与模型组比较,**P<0.01;与阳性药组比较,△P<0.05,△△P<0.01
2.4 古草生机汤对H22荷瘤小鼠实体瘤组织中Bax和Bcl-2 mRNA表达的影响 阳性药组、古草生机汤低剂量组、古草生机汤高剂量组均能够上调瘤组织中Bax mRNA的表达,下调Bcl-2 mRNA的表达,与模型组比较,差异有统计学意义(P<0.01)。古草生机汤高剂量组的Bax和Bcl-2 mRNA表达量与阳性药组接近,古草生机汤低剂量组略逊于阳性药组。见图5。
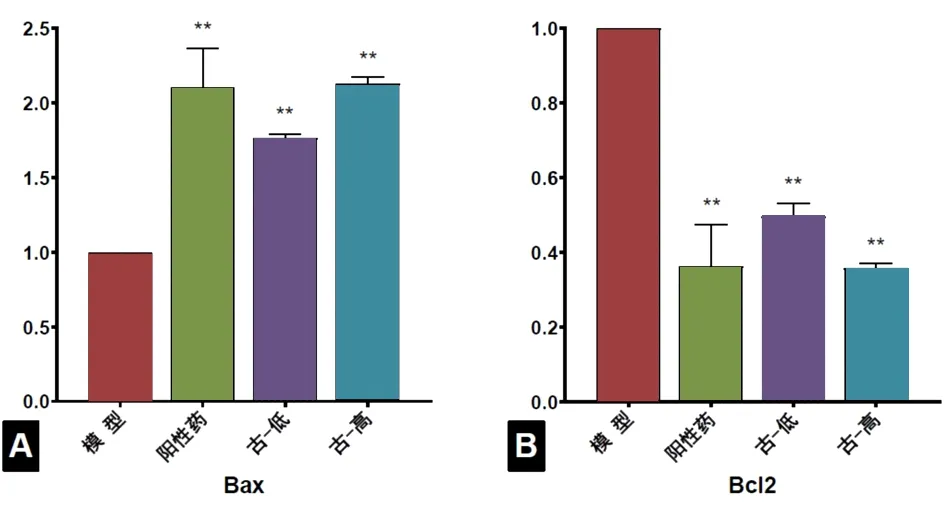
图5 各组H22荷瘤小鼠瘤组织中Bax和Bcl-2mRNA相对表达量注:古-低为古草生机汤低剂量组,古-高为古草生机汤高剂量组;与模型组比较,*P<0.05,**P<0.01
3 讨论
肝癌是世界范围内发病率高、致死率高的一类恶性肿瘤。目前,肝恶性肿瘤的临床治疗方法以手术、化疗和放疗为主,常用的化疗药物存在一定的不良反应[3],有明显的细胞毒性,对正常细胞的杀伤力大,容易造成肝肾功能损伤以及多重耐药等现象[4],且能够对机体的免疫功能造成不同程度的影响[5]。中药在治疗恶性肿瘤方面具有不良反应小、耐药性低的特点,还可以在一定程度上保护脏器功能、调节自身免疫、提高患者的生命质量,在恶性肿瘤的临床治疗上有一定的应用前景[6]。
本研究在评价古草生机汤在对抗癌的同时,着重分析其在抗体质量消耗、调节机体免疫、脏器保护等方面的功效。从模型组小鼠较低的体质量增长率可以看出,肝癌对小鼠的体质量影响较大,能够影响其体质量增长,阳性药组和古草生机汤低、高剂量组的小鼠体质量增长率均明显高于模型组,显示出古草生机汤可在一定程度上抑制肝癌对小鼠体质量的影响。胸腺和脾脏是机体重要的免疫器官,当恶性肿瘤发生和发展时,机体免疫器官会受到严重影响并发生明显的变化,出现胸腺萎缩、脾脏肿大的现象,而且其程度与肿瘤病情发展相关[7]。本实验通过计算胸腺、脾脏指数来反映各组小鼠的胸腺萎缩、脾脏肿大程度,从所得结果可知,古草生机汤能明显提高H22荷瘤小鼠的胸腺指数并降低小鼠的脾脏指数,减轻肿瘤对小鼠胸腺、脾脏2个免疫器官的影响。
肿瘤的形成与发展是极为复杂的过程,目前认为细胞外调节因子及细胞内信息系统失控可导致细胞内分子紊乱,从而引起恶变和不可控制的增殖,机体依靠自身的细胞和细胞因子等活性物质调节免疫功能,以起到对肿瘤细胞的监视和特异性杀伤作用[8]。IFN-γ对机体免疫系统具有重要的调节作用,是机体发挥免疫功能、消除体内病原的重要因子之一,对机体的免疫和抑制肿瘤有重要的作用[9]。TNF-α是由T细胞、单核巨噬细胞等产生的细胞因子,是恶性肿瘤微环境中常见且具有一定代表性的细胞因子,能诱导肿瘤细胞凋亡,在调节免疫功能与抗肿瘤免疫中起到重要作用[10]。临床研究表明,TNF-α水平的异常,对机体内环境的稳定会产生重大影响,可造成患者免疫功能异常,诱导肿瘤的发生及病情的发展[11]。IL-2是机体免疫功能调节的重要细胞因子,能够促进T细胞的增殖与活化,刺激自然杀伤细胞的增殖,在自然杀伤细胞和T淋巴细胞中同时分泌INF-γ,增强免疫细胞对肿瘤细胞的杀伤作用[12]。从本实验结果可知,当肝癌细胞在小鼠体内增长时,模型组小鼠血清中的免疫细胞因子IFN-γ、TNF-α、IL-2均明显下降,古草生机汤可显著升高小鼠血清中此3种指标,且其调节作用随给药浓度的升高而增强。依此推断:古草生机汤可通过对机体免疫调节来对抗肝肿瘤的发展。
Fas是细胞表面重要的死亡受体,是细胞凋亡的信号分子。Fas与其FasL结合,活化并转导凋亡信号,是诱导肿瘤细胞凋亡的重要途径之一[13]。研究表明,恶性肿瘤患者血清中可溶性Fas和FasL显著升高,化疗后二者明显降低[14]。本实验结果与上述研究相同,模型组H22荷瘤小鼠血清中的Fas和FasL显著升高,阳性药组和古草生机汤低、高剂量组的Fas和FasL明显降低。由此可见,古草生机汤能够在一定程度上调节Fas和FasL,可能是其诱导肿瘤细胞凋亡的作用之一,但具体机制还需要进一步探究和验证。
当肝脏发生病变时,肝细胞过度合成ALP,通过淋巴管和肝窦进入血液循环。既往研究证实,原发性肝癌小鼠的癌细胞大量增殖过程中,小鼠血清中AST和ALT的含量迅速增加[15]。本实验中,模型组小鼠血清中的AST、ALT含量较空白组显著升高;古草生机汤小鼠血清中的AST、ALT含量均明显降低,由此可见古草生机汤在抗肝癌的同时能够起到保护小鼠肝脏功能的作用。
Bax为促凋亡基因,Bcl-2为原癌基因之一,是细胞存活促进因子,Bax和Bcl-2通过形成同源或异源二聚体来调节细胞凋亡[16]。当Bax蛋白与自身形成同源二聚体时,可诱导细胞凋亡;当Bax蛋白与Bcl-2蛋白结合形成异源二聚体时,则会抑制Bcl-2蛋白对细胞凋亡的抑制功能[17]。因此,当二者表达水平达到平衡时则细胞正常生存;当Bcl-2的表达量多于Bax,Bcl-2与Bax结合成异源二聚体抑制细胞凋亡[18];当Bcl-2表达量少于Bax,Bax与Bax形成同源二聚体促进细胞凋亡[19]。研究表明,肿瘤细胞能够通过上调Bcl-2下调Bax从而逃避凋亡[20]。本实验中,古草生机汤可显著上调H22荷瘤小鼠肿瘤组织中Bax mRNA的相对表达量,下调Bcl-2的表达量,使Bax的表达量多于Bcl-2,促进肿瘤细胞凋亡,从而发挥抗肿瘤的作用。
综上所述,本研究初步证实古草生机汤具有一定的体内抗肝肿瘤活性,其作用机制可能与其促进肿瘤细胞凋亡、调节机体免疫有关,且在抑制肿瘤的同时对肝脏功能有一定的保护作用,但其具体机制还需要进一步探究。
利益冲突声明:无。

