稻纵卷叶螟转录因子CncC对杆状病毒CnmeGV感染的响应及功能
张楠,韩光杰,刘琴,李传明,祁建杭,陆玉荣,夏杨,徐健
稻纵卷叶螟转录因子CncC对杆状病毒CnmeGV感染的响应及功能
张楠,韩光杰,刘琴,李传明,祁建杭,陆玉荣,夏杨,徐健
江苏里下河地区农业科学研究所/国家农业微生物扬州观测实验站,江苏扬州 225007
【目的】研究稻纵卷叶螟()转录因子CncC(Cap‘n’Collar Isoform C)及其调控的抗氧化酶基因在抗稻纵卷叶螟颗粒体病毒(Cnaphalocrocis medinalis granulovirus,CnmeGV)感染中的作用,进一步丰富昆虫抗杆状病毒感染的免疫调控机制研究。【方法】使用RT-PCR克隆得到稻纵卷叶螟()cDNA全长序列并分析其蛋白结构;以106OB/mL浓度的CnmeGV或同浓度的CnmeGV和1 mmol·L-1CncC抑制剂——ML385混合液饲喂稻纵卷叶螟3龄幼虫,感染后6—48 h取样,分析ML385对CnmeGV诱导的稻纵卷叶螟丙二醛(MDA)含量变化的影响,同时采用RT-qPCR分析病毒DNA复制水平、稻纵卷叶螟、谷胱甘肽过氧化物酶-3(,)、锰超氧化物歧化酶(,)和硫氧还蛋白过氧化物酶(,)等基因的表达水平,并每隔24 h统计幼虫死亡数,绘制10 d内幼虫的Kaplan-Meier生存曲线。使用1 mmol·L-1ML385或1 mmol·L-1ML385和200 μg·mL-1抗氧化剂N-乙酰-L-半胱氨酸(NAC)混合液饲喂感染的幼虫,使用RT-qPCR分析不同时间病毒DNA复制水平。【结果】cDNA全长为3 404 bp,包括321 bp的5-UTR,847 bp的3-UTR和2 211 bp的ORF,编码一个长度为736 aa的蛋白,预测蛋白质分子质量为75.8 kDa。稻纵卷叶螟感染CnmeGV后丙二醛含量在感染的前12 h内显著上调,随后在24 h恢复到正常水平,而在48 h低于对照组。病毒感染导致在12、24和48 h显著上调表达,分别为对照组的1.56、2.16和2.63倍,NAC处理显著降低了CnmeGV诱导的表达上调的倍数,分别降低至对照组的48.12%、59.83%和56.32%。ML385处理导致病毒基因拷贝数在12和24 h分别增至对照组的1.79和1.76倍,同时导致稻纵卷叶螟感染CnmeGV 10 d后的死亡率显著升高,从单CnmeGV处理组的73.33%升至94.14%,而NAC处理能够减轻由于CncC抑制导致的病毒基因拷贝数的上调。CnmeGV感染分别导致表达量在感染后48 h上调至对照组的3.68倍,表达量在12、24和48 h分别上调至对照组的1.73、2.62和2.77倍,表达量在12和24 h分别上调至对照组的1.76和2.10倍,但48 h恢复至对照组水平。使用NAC或CncC抑制剂处理感病幼虫发现,、和对CnmeGV感染的响应被显著削弱。【结论】介导了CnmeGV感染诱导的、和上调表达,降低CnmeGV感染导致的氧化应激,从而限制病毒在其体内的复制并降低氧化损伤。
稻纵卷叶螟;稻纵卷叶螟颗粒体病毒;CncC转录因子;氧化应激;抗氧化基因;杆状病毒
0 引言
【研究意义】稻纵卷叶螟()是水稻上重要的迁飞性害虫之一,幼虫通过卷叶取食危害,严重时可导致水稻出现大片白叶,影响水稻产量[1]。目前生产上主要采用化学杀虫剂对其进行控制,但化学农药的频繁使用已导致稻纵卷叶螟抗药性显著上升[2],因此,亟需寻求绿色高效的防控技术。杆状病毒科是具有大型双链DNA基因组的无脊椎动物病毒,目前根据病毒基因组的比较,将杆状病毒科分为4个属:甲型杆状病毒属(,鳞翅目特异性核多角体病毒)、乙型杆状病毒属(,鳞翅目特异性颗粒体病毒)、丙型杆状病毒属(,膜翅目特异性核多角体病毒)和丁型杆状病毒属(,双翅目特异性核多角体病毒)[3-5],杆状病毒作为一种新型的生物杀虫剂,具有毒力高、专一性强、不易产生抗性和环境稳定性好等特性[6],有希望成为防治农业害虫的首选生物农药。1979年,研究人员首次从广东省恩平县水稻田稻纵卷叶螟幼虫体内分离得到一株可感染稻纵卷叶螟的杆状病毒——稻纵卷叶螟颗粒体病毒(Cnaphalocrocis medinalis granulovirus,CnmeGV)[7],其在田间可有效控制稻纵卷叶螟种群数量,应用前景广泛[8]。同时又有研究发现CnmeGV感染稻纵卷叶螟的预期初始死亡时间约为8.4 d,致死中时间为20.16—21.98 d[9],这一特性导致感染的幼虫仍可取食叶片危害,严重限制其推广应用。因此,探明稻纵卷叶螟对杆状病毒的防御机制将为增强杆状病毒杀虫剂应用效果提供有力的技术支撑。【前人研究进展】在哺乳动物中研究发现,病毒诱导的氧化应激是病毒感染引起的炎症反应和组织损伤的一个关键致病机制[10]。因此,清除体内多余的活性氧(reactive oxygen species,ROS)对于保护细胞免受病毒感染损伤至关重要[11]。在昆虫中,病毒感染同样会导致宿主氧化应激损伤,例如,使用表达锰超氧化物歧化酶基因(-)的重组苜蓿银纹夜蛾核多角体病毒(Autographa californica multiple nucleopolyhedrovirus,AcMNPV)感染粉纹夜蛾()细胞系Tn-5B1-4后,其生存时间显著高于感染野生型AcMNPV的细胞[12]。棉铃虫()感染棉铃虫核多角体病毒(Helicoverpa armigera nucleopolyhedrovirus,HearNPV)后,其体内会产生过量的ROS,导致血淋巴中的丙二醛(MDA)浓度显著升高[13]。进一步研究发现,HearNPV感染棉铃虫诱导的高水平ROS限制了幼虫的生长和发育[14]。另外,硫氧还蛋白过氧化物酶基因()的敲低导致棉铃虫对HearNPV的易感性显著增加[13]。对稻纵卷叶螟的研究发现,9种抗氧化酶基因和4种抗氧化蛋白基因mRNA表达响应CnmeGV的感染而上调,其中包括谷胱甘肽过氧化物酶-3基因(-)、-和[15]。杆状病毒的感染会造成昆虫氧化损伤,并激活昆虫抗氧化酶系统。由于昆虫不像脊椎动物那样拥有完整的免疫系统,抗氧化酶系统在昆虫防御病毒感染中就起着更为关键的作用,然而对于昆虫在感染杆状病毒过程中的抗氧化机制研究还较少。抗氧化反应通路的关键转录因子——核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)属于亮氨酸拉链家族。在正常生理条件下,Kelch ECH结合蛋白1(Keap1)结合Nrf2蛋白,使其定位于细胞质中,最终被蛋白酶体降解。在氧化胁迫下,Keap1与Nrf2蛋白解离,Nrf2易位至细胞核,与小分子Maf蛋白结合到靶基因启动子中的抗氧化反应元件(antioxidant responsive element,ARE),加速抗氧化基因的转录[16-17]。Nrf2通过诱导多种关键抗氧化基因的表达来消除细胞中过量ROS的积累,包括谷胱甘肽代谢酶[18-19]、参与硫氧还蛋白代谢的酶[20]以及多种过氧化物代谢酶[19,21],因此Nrf2在细胞抗氧化防御中具有重要作用。Nrf2在昆虫中又被称为Cap ‘n’ Collar Isoform C(CncC)。在黑腹果蝇()中,使用RNA干扰(RNAi)技术敲减的表达,显著降低了果蝇取食百草枯后的存活率。相反,过表达则分别使雌、雄虫存活率升高[22]。同样在果蝇的研究中发现,CncC通过调控等抗氧化基因表达显著降低了肠道干细胞中的ROS水平,导致肠道干细胞的增殖受到抑制,维持了肠道的稳态[23]。Nrf2调节病原微生物诱导的ROS生成,在细胞消除细菌和病毒等病原体的过程中具有同样重要的作用[24]。甲型流感病毒(H1N1 virus)感染人鼻黏膜上皮细胞(HNEpC)会引起细胞内ROS水平的严重失调,mRNA的敲减则显著增强了H1N1病毒在细胞中的复制[25]。有研究显示,使用Nrf2激活剂激活Nrf2后,鲤春病毒血症病毒(SVCV)在胖头鲤肌肉细胞系(FHM)中的复制水平被显著降低,而的敲减导致病毒-的转录水平显著高于对照组[26]。在甜菜夜蛾()中,敲减显著下调过氧化物酶基因的表达,幼虫感染囊泡病毒后病毒滴度和幼虫死亡率均显著上升[27]。【本研究切入点】已有多项研究揭示了Nrf2通过调节抗氧化酶参与宿主防御病原微生物在感染过程中的作用。然而,昆虫CncC通路响应杆状病毒感染调控抗氧化系统的功能还未见报道。【拟解决的关键问题】克隆稻纵卷叶螟同源基因的全长序列,分析响应CnmeGV感染引起氧化应激的表达模式,明确其通过调节稻纵卷叶螟抗氧化能力以抵抗病毒感染的作用。
1 材料与方法
试验于2022年在江苏里下河地区农业科学研究所完成。
1.1 试虫与供试病毒
将稻纵卷叶螟成虫按雌雄比1﹕1配对,放入1 L的杯口盖有保鲜膜的塑料水杯中交配产卵。幼虫使用玉米幼苗饲养于温度(28±1)℃、相对湿度80%、光照强度6 000 lx的生化培养箱。饲养繁殖多代后,挑选健康、虫体大小一致的3龄幼虫供试。CnmeGV原始毒株为实验室保存,以无菌水稀释至1×106OB/mL后喷施于玉米叶片,供试虫取食以增殖病毒。
1.2 CmCncC克隆
利用家蚕()序列在稻纵卷叶螟转录组数据库[15]中检索稻纵卷叶螟同源基因,设计两对特异性引物(表1)进行中间片段的RT-PCR、克隆和测序,拼接获得中间片段序列。根据测序结果分别在5和3端设计两条特异性引物(表1),使用cDNA末端快速扩增(RACE)技术进行巢式PCR,并克隆和测序,与上述获得的中间片段拼接获得全长cDNA。总RNA提取和单链cDNA合成以及RACE具体方法分别参照Qiagen公司RNeasy Mini Kit和宝生物工程(大连)有限公司PrimescriptTMFirst-Strand cDNA Synthesis kit以及SMARTTMRACE cDNA Amplification试剂盒(Clontech)说明书。
1.3 稻纵卷叶螟丙二醛含量测定
分别使用1×106OB/mL CnmeGV饲喂稻纵卷叶螟3龄幼虫,收集取食6、12、24和48 h后的试虫,以未感染幼虫作为对照(Control),使用脂质氧化检测试剂盒(碧云天生物)检测CnmeGV感染对丙二醛含量的影响。同时,使用1 mmol·L-1ML385和CnmeGV混合液饲喂稻纵卷叶螟幼虫,以使用ML385饲喂的幼虫作为对照,检测ML385对CnmeGV感染诱导的丙二醛含量的影响。所有处理设置3个生物重复组,每组收集试虫30只。
1.4 CmCncC在CnmeGV感染过程中的功能分析
1.4.1mRNA表达对CnmeGV感染的响应 分别使用CnmeGV或200 μg·mL-1NAC和CnmeGV的混合液喷于玉米叶片上,接种稻纵卷叶螟3龄幼虫,收集感染6、12、24和48 h的试虫,以未感染幼虫作为对照(Control)。使用Trizol(Invitrogen)提取RNA后,荧光定量反转录PCR(RT-qPCR)检测的表达,以稻纵卷叶螟-作为内参基因,引物见表1。所有试验设置3个生物重复组,每组收集试虫30只。
1.4.2 CmCncC抑制对CnmeGV DNA复制的影响 使用涂抹有CnmeGV或1 mmol·L-1ML385和CnmeGV混合液的玉米叶片饲喂幼虫,6、12、24和48 h后收集试虫,根据Lo等[28]和韩光杰等[29]的方法并进行稍微修改进行病毒DNA的qPCR检测,称取100 mg幼虫,使用DNAiso Reagent(Takara)提取DNA,并通过qPCR检测病毒基因拷贝数以确定病毒DNA的复制水平,引物见表1。接着,为了检测CncC的抑制是否是通过改变氧化还原状态影响病毒的复制,使用有NAC、ML385和CnmeGV混合液的玉米叶片饲喂幼虫,6、12、24和48 h后收集试虫,如上检测病毒DNA复制水平,以1 mmol·L-1ML385和CnmeGV混合液饲喂的幼虫作为对照。所有试验设置3个生物重复组,每组收集试虫30只。

表1 用于RT-PCR、RT-qPCR和RACE的引物序列
1.4.3 CmCncC抑制对CnmeGV杀虫效果的影响 首先,为了明确饲喂ML385对幼虫生存率的影响,使用涂抹有ML385的玉米叶片饲喂幼虫,每隔24 h统计试虫的死亡数,并以健康幼虫作为对照。接着使用涂抹有ML385和CnmeGV混合液的玉米叶片饲喂幼虫,每隔24 h统计试虫的死亡数,并以仅感染CnmeGV的幼虫作为对照。参见徐健等[9]方法统计虫口死亡率和死亡时间,绘制生存曲线。所有试验设置3个生物重复组,每组收集试虫30只。
1.5 GPx-3、Mn-SOD和TPx响应CnmeGV感染的表达分析
使用CnmeGV饲喂稻纵卷叶螟3龄幼虫,收集感染6、12、24和48 h的试虫,以未感染幼虫作为对照(Control)。使用Trizol(Invitrogen)提取RNA后,利用RT-qPCR分析-、-和表达量的动态变化,以稻纵卷叶螟-作为内参基因,引物见表1。接着使用NAC和CnmeGV混合液或ML385和CnmeGV混合液的玉米叶片饲喂幼虫,6、12、24和48 h后收集试虫,如上方法检测、和的mRNA表达,以CnmeGV饲喂的稻纵卷叶螟为对照。所有试验设置3个生物重复组,每组收集试虫30只。
1.6 数据分析
使用GraphPad Prism 9.0统计软件分析数据。数据表示为至少3个独立试验的平均值±标准误差(SEM)。通过检验分析基因表达量及丙二醛含量的差异,Kaplan-Meier法绘制生存曲线,并采用Log-rank检验进行生存曲线比较,<0.01或<0.05被认为具有统计学意义。
2 结果
2.1 CmCncC克隆及分析
(Genbank登录号:OQ606863)cDNA全长3 404 bp,包括321 bp的5-UTR、847 bp的3-UTR和2 211 bp的ORF,编码一个长度为736 aa的蛋白,预测蛋白质分子质量为75.8 kDa,等电点为6.36。氨基酸序列比对显示,CmCncC与小菜蛾()、棉铃虫、二化螟()、草地贪夜蛾()的CncC分别具有74.63%、75.03%、75.03%和75.03%的一致性,并且均包含有6个功能性Nrf2-ECH(Neh)同源结构域、CNC-bZIP DNA结合结构域和Keap1结合基序(DMG和ETGE)(图1)。

图中红框标注的Neh1-6为CncC的6个保守功能域,蓝框标注的为CNC-bZIP DNA结合结构域,绿框标注的为与Keap1结合基序(DMG和ETGE)
The six conserved functional domains of CncC, denoted by Neh1-6 in red boxes, are shown, as well as the CNC-bZIP DNA binding domain denoted by blue boxes, and the Keap1 binding motifs (DMG and ETGE) denoted by green boxes
图1 CmCncC与小菜蛾CncC、棉铃虫Nrf2、二化螟CncC和草地贪夜蛾CncC氨基酸序列的比对
Fig. 1 Amino acid sequence alignments of CmCncC withCncC,Nrf2,CncC andCncC
2.2 稻纵卷叶螟体内丙二醛含量分析
以丙二醛含量作为脂质过氧化指标来验证CnmeGV感染影响稻纵卷叶螟体内氧化应激的反应,结果显示在感染6和12 h后,其体内丙二醛含量显著上升至对照组(未感染CnmeGV)的4.84和17.25倍(<0.05),而在感染48 h时,丙二醛含量则降为对照组的46.23%(<0.05)(图2-A)。进一步检测了CmCncC抑制后稻纵卷叶螟丙二醛含量,结果显示ML385+CnmeGV处理导致丙二醛含量在处理6、12、24和48 h后分别显著上调至对照组(ML385处理)的7.25、23.62、3.88和2.10倍。与使用CnmeGV处理导致的丙二醛含量上调倍数比较显示,ML385处理在12、24和48 h后显著增强了病毒感染导致的丙二醛含量上调倍数(图2-B)。结果表明ML385对CmCncC的抑制能够增强CnmeGV感染导致的氧化应激损伤。
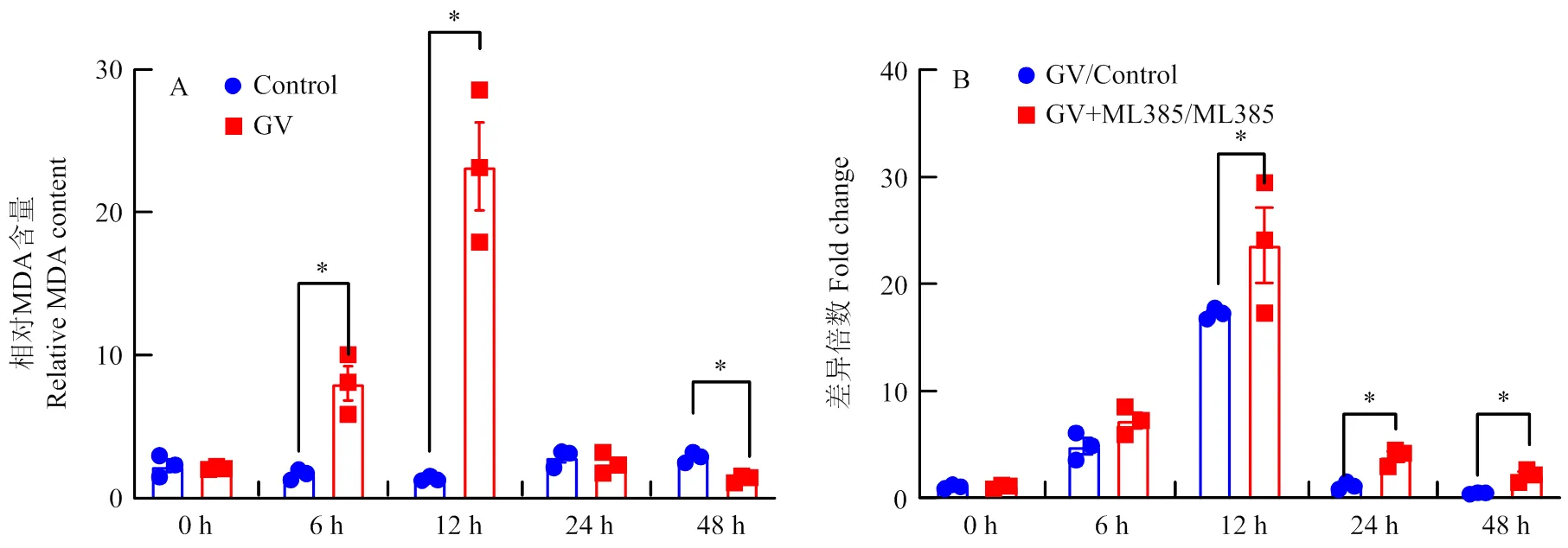
A:稻纵卷叶螟感染CnmeGV后丙二醛含量检测Detection of MDA content after GnmeGV infection;B:ML385处理对病毒诱导的丙二醛含量变化的影响The effect of ML385 treatment on virus-induced changes in MDA content
2.3 稻纵卷叶螟感染CnmeGV后CmCncC表达水平
使用CnmeGV感染稻纵卷叶螟后,RT-qPCR检测其体内mRNA表达水平的变化。结果显示,在感染12—48 h内,的表达分别上调至对照组(未感染CnmeGV)的1.56、2.16和2.63倍(<0.05)(图3-A)。NAC处理显著降低了CnmeGV诱导的表达上调的倍数,在处理12、24和48 h后,分别降低至GV/Control组比值的48.12%、59.83%和56.32%(<0.05)(图3-B)。结果表明,CnmeGV感染可能通过氧化应激途径诱导表达。
2.4 抑制CmCncC功能对CnmeGV增殖及稻纵卷叶螟生存率影响
使用CncC抑制剂(ML385)与CnmeGV共同饲喂稻纵卷叶螟,检测其体内病毒DNA复制水平,结果显示CmCncC的抑制导致病毒基因拷贝数在12和24 h分别增至对照组(饲喂CnmeGV)的1.79和1.76倍(<0.05)(图4-A)。但附加NAC处理则会减轻由CmCncC抑制导致的病毒基因拷贝数的上调(<0.05)(图4-B)。同时,检测抑制CmCncC功能对CnmeGV致死作用的影响,发现抑制剂本身对稻纵卷叶螟生长无明显影响(=0.7235)(图4-C),而抑制剂与病毒共处理导致稻纵卷叶螟10 d死亡率显著升高,从单病毒处理组的73.33%升至94.14%,两者生存曲线呈显著差异(=0.018)(图4-C)。

A:稻纵卷叶螟感染CnmeGV后CmCncC mRNA表达量检测Detection of CmCncC mRNA level after CnmeGV infection;B:NAC处理对病毒诱导的CmCncC表达变化的影响The effect of NAC treatment on virus-induced changes in CmCncC mRNA level
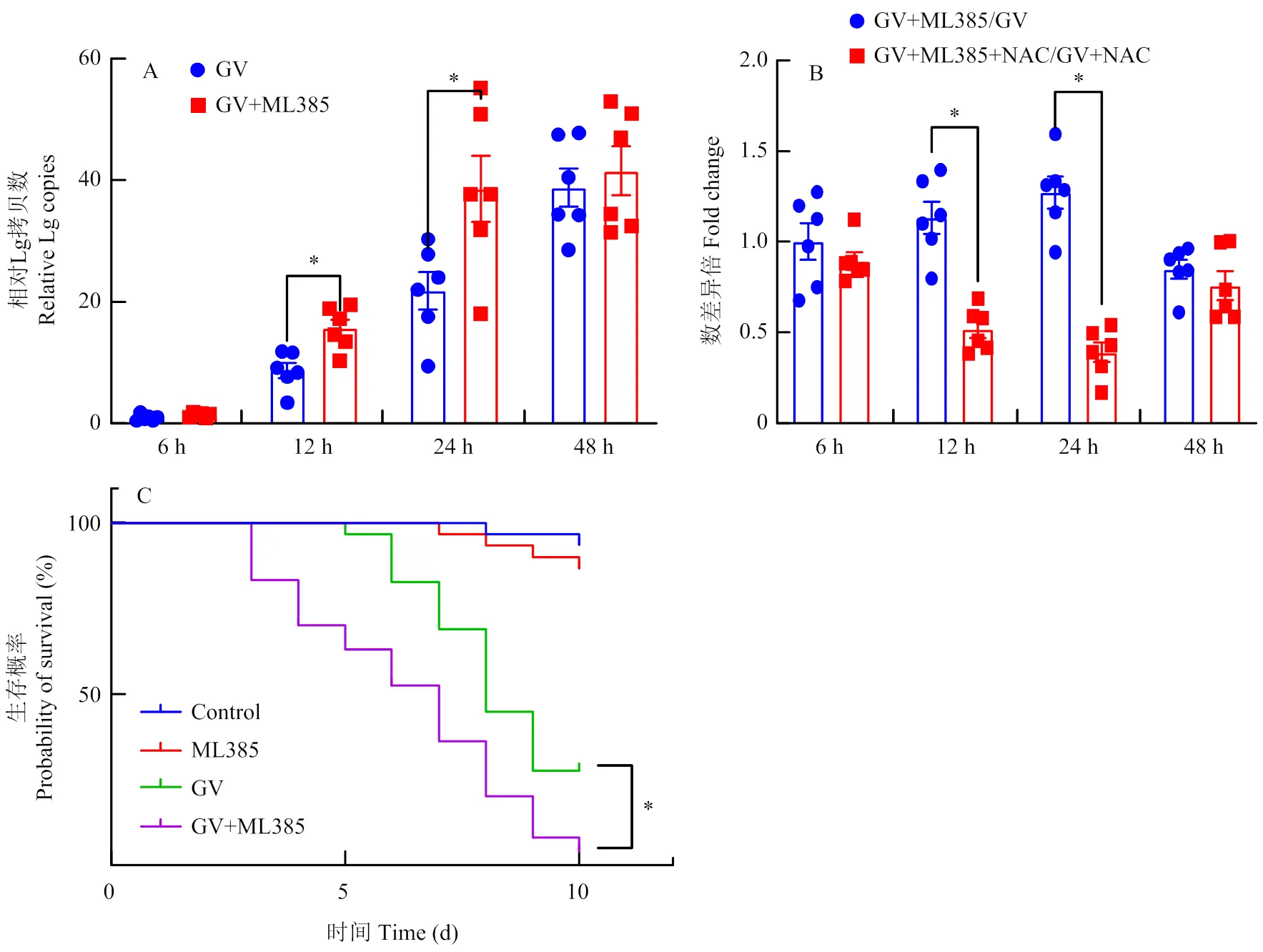
A:CnmeGV合并ML385处理后,提取DNA,检测CnmeGV granulin基因拷贝数After treatment with CnmeGV combined ML385, DNA was extracted and the copy number of the CnmeGV granulin was detected;B:NAC对抑制剂处理导致的病毒基因拷贝数变化的影响检测The effect of NAC on the changes in viral gene copy numbers caused by ML385 treatment was examined;C:病毒感染后稻纵卷叶螟的生存动态分析The survival dynamics of the C. medinalis after viral infection were analyzed
2.5 CncC介导了CnmeGV感染对GPx-3、Mn-SOD和TPx mRNA表达的诱导
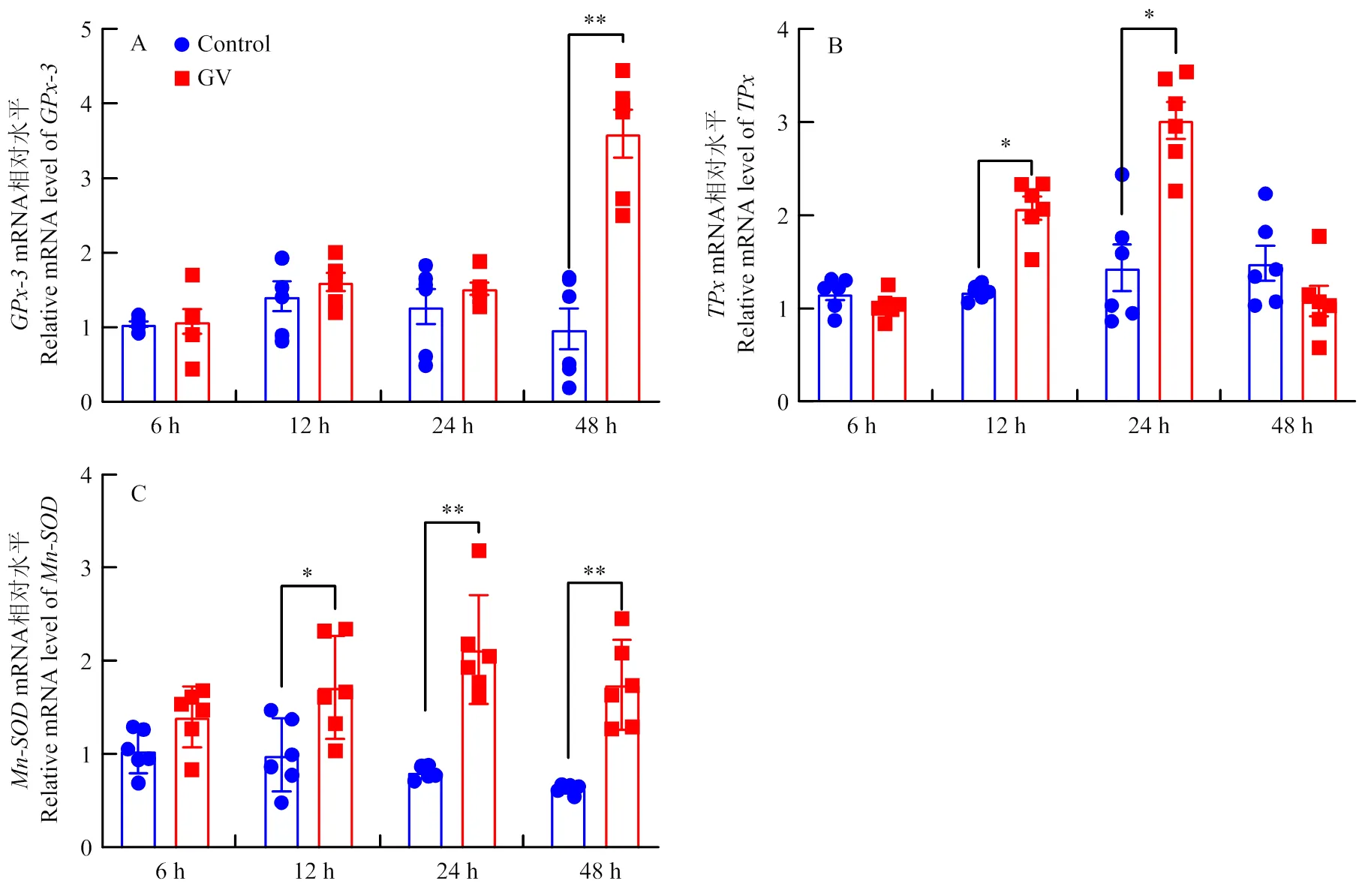
CncC通过调控抗氧化基因转录可有效防止氧化应激诱导的细胞损伤,、和等作为CncC重要的下游基因,在CncC调控宿主抗氧化应激中具有重要功能[30-32]。本研究发现,CnmeGV感染后,表达水平在48 h上调至对照组(未感染CnmeGV)的3.68倍(<0.01)(图5-A),表达水平在12和24 h分别上调至对照组的1.76和2.10倍(<0.05),但是在48 h降低至对照组水平(图5-B),表达水平在12、24和48 h分别上调至对照组的1.73(<0.05)、2.62和2.77倍(<0.01)(图5-C)。使用NAC或CncC抑制剂处理则显著降低病毒感染对、和表达的诱导作用(<0.05)(图6)。
3 讨论
3.1 稻纵卷叶螟CncC蛋白具有典型的Nrf2转录因子结构域
Nrf2是响应氧化应激的关键转录因子,在昆虫体内一般称为CncC,被氧化应激激活的CncC通过与下游基因启动子区的ARE元件结合刺激抗氧化基因转录,在保护细胞免受氧化损伤方面具有重要作用[33-34]。在果蝇和哺乳动物中的抗氧化作用已多有研究,但是在昆虫抵抗杆状病毒过程中的作用还未有报道。本研究克隆了稻纵卷叶螟同源基因的cDNA全长序列,氨基酸序列比对显示,CmCncC与小菜蛾、棉铃虫、二化螟、草地贪夜蛾的同源蛋白具有较高的一致性,且均包含有6个功能性Neh结构域、CNC-bZIP DNA结合结构域和Keap1结合基序(DMG和ETGE)(图1)。Neh1区域负责DNA识别;Neh2包含ETGE和DLG基序,这是与Keap1相互作用所必需的;Neh4和Neh 5是基因转录的反式激活域;Neh6充当降解决定子,介导细胞核中Nrf2的降解[35]。Keap1通过与Nrf2的Neh2结构域结合,将Nrf2隔离在细胞质中,形成Keap1-Nrf2复合物[36-38]。一旦进入细胞质,Keap1-Nrf2复合物就会与E3泛素连接酶结合,导致Nrf2降解并终止Nrf2信号通路[39-40]。氧化应激则使该复合物解离,导致Nrf2转移至细胞核以激活其转录因子功能。
**:差异极显著extremely significant difference (P<0.01)。下同The same as below

图6 NAC或ML385处理对CnmeGV诱导的抗氧化基因表达水平影响
3.2 CncC降低CnmeGV诱导的氧化应激以抵抗感染损伤
研究发现包括杆状病毒在内的昆虫病毒感染会导致昆虫体内产生过量ROS[27,41-42]。本研究检测了稻纵卷叶螟感染CnmeGV后体内丙二醛含量的变化,结果显示,在感染后6和12 h,丙二醛含量显著增加,而在48 h显著降低(图2),表明CnmeGV在感染前期迅速诱导大量的ROS生产,造成脂质氧化,而丙二醛在感染48 h后降低,则可能与细胞的大量死亡有关。研究结果表明在感染前期,病毒会迅速诱导宿主的氧化应激反应。这与在家蚕中的研究一致,家蚕核多角体病毒(Bombyx mori nuclearpolyhedrosisvirus)感染导致家蚕体内ROS含量随着处理时间的延长先升高后降低,在72 h时达到最高水平,在96 h则有所下降[43]。因此,为了降低氧化损伤,宿主昆虫会激活自身的抗氧化防御系统以应对病毒的感染。进一步研究发现感染CnmeGV后稻纵卷叶螟表达会在12—24 h显著上调(图3-A),而抗氧化剂NAC处理则会导致对CnmeGV的响应显著减弱(图3-B)。与此发现相似,BmNPV感染导致家蚕超氧化物歧化酶、过氧化氢酶和过氧化物酶等抗氧化酶的活性先降低后升高[43],表明杆状病毒感染会引起宿主抗氧化防御系统的响应。使用ML385处理发现,CmCncC的抑制进一步提高了病毒感染导致的丙二醛含量升高(图2),并显著增加病毒复制和幼虫死亡率(图4-A、4-C),而CmCncC抑制导致病毒复制的增强会在一定程度上被NAC处理所拯救(图4-B),这些结果表明诱导宿主的抗氧化功能对于保护宿主免受病毒引起的氧化损伤具有重要的作用。有研究指出,人树突状细胞感染登革热病毒后,会诱导细胞内ROS水平增加,而由Nrf2调节的抗氧化通路的激活有助于通过维持氧化还原稳态来调节细胞抗病毒和凋亡反应[44]。然而在埃及伊蚊()中发现,中肠中敲减导致氧化应激水平的上调则会显著降低中肠中寨卡病毒的感染,这可能由于控制下的抗氧化机制在促进氧化还原平衡和中肠组织稳态的同时,也减弱了中肠屏障感染的作用[45],因此有必要进一步研究在稻纵卷叶螟不同组织部位发挥功能的差异性。
3.3 CncC通过调控GPx-3、Mn-SOD和TPx mRNA表达参与减轻病毒感染诱导的氧化应激
Nrf2/ARE通路是迄今为止发现的最重要的内源性抗氧化信号通路之一。当体内氧化还原平衡失调时,Nrf2被激活,通过结合ARE来调节抗氧化基因的表达,例如-、-和等[30,46]。在骨髓间充质干细胞研究中,氧化应激促进Keap1-Nrf2复合物的解离,从而激活Nrf2,激活的Nrf2进入细胞核,启动和等抗氧化酶基因的表达[47]。暴露于过量ROS时,昆虫体内的CncC同样会被激活。近期在赤拟谷盗()的研究中指出,由溴氰菊酯引起的ROS过量导致昆虫体内AMP依赖的蛋白激酶(AMPK)被磷酸化激活,激活的AMPK又使CncC磷酸化从而也被激活[48]。之前有研究显示,核多角体病毒感染棉铃虫后会导致过量ROS的产生,并诱导表达显著上调,同时的敲减则显著增加棉铃虫对病毒的敏感性[13]。在家蚕和果蝇研究中也发现,氧化应激诱导转录因子CncC参与了对表达的调控[23,30]。这些报道与本研究结果一致,在稻纵卷叶螟中,、-和表达会响应CnmeGV感染显著上调(图5),并且NAC或CncC抑制剂处理都会在一定程度上削弱CnmeGV感染对这些基因表达的诱导(图6),这些结果表明作为响应氧化应激的转录因子,可能在病毒感染期间参与了对、和表达的调控以减轻氧化损伤,但CmCncC是否能结合这3个基因的启动子区域进而直接调控这3个基因的转录还需要进一步的实验验证。
由于昆虫的抗病毒机制,杆状病毒制剂的杀虫速度慢于传统化学农药,杆状病毒杀虫剂的杀虫速度因昆虫的抗病毒机制而变得很慢。因此,了解昆虫抗病毒感染的免疫机制将有助于杆状病毒杀虫剂的推广应用。本研究从CnmeGV感染引起氧化损伤的角度出发,分析了重要抗氧化转录因子CncC在抗病毒过程中的作用,阐明了昆虫可通过CncC信号通路调节抗氧化基因表达,减少氧化损伤的功能。该结果为进一步明确害虫免疫杆状病毒的机制打下基础,为增强杆状病毒杀虫剂的杀虫效果提供了潜在靶标,有利于相关产品的推广与应用。
4 结论
稻纵卷叶螟CncC属于昆虫Cap ‘n’ Collar家族,具有完整的CncC结构域,其通过介导杆状病毒CnmeGV感染引起的、和mRNA表达上调,减轻了感染导致的氧化损伤。结果揭示了CncC的抗氧化功能对昆虫免疫杆状病毒的重要作用,为通过破坏稻纵卷叶螟的抗氧化能力提高杆状病毒的杀虫效果打下理论基础。
[1] 王凤英, 张孝羲, 翟保平. 稻纵卷叶螟的飞行和再迁飞能力. 昆虫学报, 2010, 53(11): 1265-1272.
WANG F Y, ZHANG X X, ZHAI B P. Flight and re-migration capacity of the rice leaffolder moth,(Guenée) (Lepidoptera: Crambidae). Acta Entomologica Sinica, 2010, 53(11): 1265-1272. (in Chinese)
[2] ZHANG S K, REN X B, WANG Y C, SU J. Resistance in(Lepidoptera: Pyralidae) to new chemistry insecticides. Journal of Economic Entomology, 2014, 107(2): 815-820.
[3] JEHLE J A, BLISSARD G W, BONNING B C, CORY J S, HERNIOU E A, ROHRMANN G F, THEILMANN D A, THIEM S M, VLAK J M. On the classification and nomenclature of baculoviruses: a proposal for revision.Archives of Virology, 2006, 151(7): 1257-1266.
[4] 类承凤, 胡葭, 何峰, 沈蜜, 孙修炼. 杆状病毒新的分类地位和书写方式. 中国生物防治学报, 2021, 37(4): 646-650.
LEI C F, HU J, HE F, SHEN M, SUN X L. New taxonomic status and name writing of the baculoviruses. Chinese Journal of Biological Control, 2021, 37(4): 646-650. (in Chinese)
[5] MIELE S A, GARAVAGLIA M J, BELAICH M N, GHIRINGHELLI P D. Baculovirus: molecular insights on their diversity and conservation. International Journal of Evolutionary Biology, 2011, 2011: 379424.
[6] DESHAYES C, SIEGWART M, PAURON D, FROGER J A, LAPIED B, APAIRE-MARCHAIS V. Microbial pest control agents: Are they a specific and safe tool for insect pest management? Current Medicinal Chemistry, 2017, 24(27): 2959-2973.
[7] 庞义, 赖涌流, 刘炬, 叶育昌. 稻纵卷叶螟幼虫颗粒体病毒. 微生物学通报, 1981(3): 103-104.
PANG Y, LAI Y L, LIU J, YE Y C. A new granulovirus from naturally-infected Asiatic rice leafroller,. Microbiology China, 1981(3): 103-104. (in Chinese)
[8] XU J, LIU Q, LI C M, HAN G J. Field effect ofgranulovirus (CnmeGV) on the pest of rice leaffolder. Journal of Integrative Agriculture, 2019, 18(9): 2115-2122.
[9] 徐健, 李传明, 韩光杰, 徐彬, 祁建杭, 孙俊, 刘琴. 颗粒体病毒(CnmeGV)对稻纵卷叶螟的感染及害虫种群增长的影响. 江苏农业学报, 2018, 34(1): 29-33.
XU J, LI C M, HAN G J, XU B, QI J H, SUN J, LIU Q. The effect ofgranulovirus (CnmeGV) on larva infection and population regulation of rice leaffolder. JiangsuJournal of Agricultural Sciences, 2018, 34(1): 29-33. (in Chinese)
[10] HOSAKOTE Y M, JANTZI P D, ESHAM D L, SPRATT H, KUROSKY A, CASOLA A, GAROFALO R P. Viral-mediated inhibition of antioxidant enzymes contributes to the pathogenesis of severe respiratory syncytial virus bronchiolitis. American Journal of Respiratory and Critical Care Medicine, 2011, 183(11): 1550-1560.
[11] LIU M, CHEN F, LIU T, CHEN F, LIU S, YANG J. The role of oxidative stress in influenza virus infection. Microbes and Infection, 2017, 19(12): 580-586.
[12] WANG Y, OBERLEY L W, HOWE D, JARVIS D L, CHAUHAN G, MURHAMMER D W. Effect of expression of manganese superoxide dismutase in baculovirus-infected insect cells. Applied Biochemistry and Biotechnology, 2004, 119(2): 181-193.
[13] ZHANG S, SHEN Z, LI Z, WU F, ZHANG B, LIU Y, ZHANG Q, LIU X. Identification of a thioredoxin peroxidase gene involved in resistance to nucleopolyhedrovirus infection inwith RNA interference. Journal of Insect Physiology, 2015, 82: 17-27.
[14] TIAN Z, ZHA M, CAI L, MICHAUD J, CHENG J, SHEN Z, LIU X, LIU X. FoxO-promoted peroxiredoxin1 expression induced bysingle nucleopolyhedrovirus infection mediates host development and defensive responses. Ecotoxicology and Environmental Safety, 2022, 234: 113414.
[15] HAN G, LIU Q, LI C, XU B, XU J. Transcriptome sequencing revealsagainst baculovirus infection by oxidative stress. Molecular Immunology, 2021, 129: 63-69.
[16] WILDING C S. Regulating resistance: CncC: Maf, antioxidant response elements and the overexpression of detoxification genes in insecticide resistance. Current Opinion in Insect Science, 2018, 27: 89-96.
[17] ZHANG D D, LO S C, CROSS J V, TEMPLETON D J, HANNINK M. Keap1 is a redox-regulated substrate adaptor protein for a Cul3-dependent ubiquitin ligase complex. Molecular and Cellular Biology, 2004, 24(24): 10941-10953.
[18] THIMMULAPPA R K, MAI K H, SRISUMA S, KENSLER T W, YAMAMOTO M, BISWAL S. Identification of Nrf2-regulated genes induced by the chemopreventive agent sulforaphane byoligonucleotide microarray. Cancer Research, 2002, 62(18): 5196-5203.
[19] RANGASAMY T, CHO C Y, THIMMULAPPA R K, ZHEN L, SRISUMA S S, KENSLER T W, YAMAMOTO M, PETRACHE I, TUDER R M, BISWAL S. Genetic ablation of Nrf2 enhances susceptibility to cigarette smoke-induced emphysema in mice. The Journal of Clinical Investigation, 2004, 114(9): 1248-1259.
[20] MOTOHASHI H, O’CONNOR T, KATSUOKA F, ENGEL J D, YAMAMOTO M. Integration and diversity of the regulatory network composed of Maf and CNC families of transcription factors. Gene, 2002, 294(1/2): 1-12.
[21] MAHER J, YAMAMOTO M. The rise of antioxidant signaling—the evolution and hormetic actions of Nrf2. Toxicology and Applied Pharmacology, 2010, 244(1): 4-15.
[22] SYKIOTIS G P, BOHMANN D. Keap1/Nrf2 signaling regulates oxidative stress tolerance and lifespan in. Developmental Cell, 2008, 14(1): 76-85.
[23] HOCHMUTH C E, BITEAU B, BOHMANN D, JASPER H. Redox regulation by Keap1 and Nrf2 controls intestinal stem cell proliferation in. Cell Stem Cell, 2011, 8(2): 188-199.
[24] BATTINO M, GIAMPIERI F, PISTOLLATO F, SUREDA A, DE OLIVEIRA M R, PITTALA V, FALLARINO F, NABAVI S F, ATANASOV A G, NABAVI S M. Nrf2 as regulator of innate immunity: A molecular Swiss army knife! Biotechnology Advances, 2018, 36(2): 358-370.
[25] KESIC M J, SIMMONS S O, BAUER R, JASPERS I. Nrf2 expression modifies influenza A entry and replication in nasal epithelial cells. Free Radical Biology and Medicine, 2011, 51(2): 444-453.
[26] 邵军辉. 靶向于Nrf2-ARE信号的抗鲤春病毒血症病毒研究[D]. 武汉: 华中农业大学, 2016.
SHAO J H. The antiviral research against spring viraemia of carp virus targeting Nrf2-ARE[D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese)
[27] JIN R, XIAO Z, NAKAI M, HUANG G H. Insight into the regulation of the Nrf2 pathway in response to ascovirus infection in. Pest Management Science, 2023, 79(3): 1123-1130.
[28] LO H R, CHAO Y C. Rapid titer determination of baculovirus by quantitative real-time polymerase chain reaction. Biotechnology Progress, 2004, 20(1): 354-360.
[29] 韩光杰, 刘琴, 李传明, 祁建杭, 徐彬, 陆玉荣, 徐健. 稻纵卷叶螟颗粒体病毒的持续感染及检测. 中国农业科学, 2020, 53(19): 3988-3995. doi: 10.3864/j.issn.0578-1752.2020.19.012.
HAN G J, LIU Q, LI C M, QI J H, XU B, LU Y R, XU J. The persistent infection and detection ofgranulovirus in. Scientia Agricultura Sinica, 2020, 53(19): 3988-3995. doi: 10.3864/j.issn.0578-1752.2020.19.012. (in Chinese)
[30] 胡景生. 家蚕CncC/keap1-ARE通路的关键基因克隆及其功能分析[D]. 苏州: 苏州大学, 2017.
HU J S. Cloning and functional analysis of key genes in CncC/keapl-ARE pathway,[D]. Suzhou: Soochow University, 2017. (in Chinese)
[31] VRAILAS-MORTIMER A, DEL RIVERO T, MUKHERJEE S, NAG S, GAITANIDIS A, KADAS D, CONSOULAS C, DUTTAROY A, SANYAL S. A muscle-specific p38 MAPK/Mef2/MnSOD pathway regulates stress, motor function, and life span in. Developmental Cell, 2011, 21(4): 783-795.
[32] WANG Z, HAN N, ZHAO K, LI Y, CHI Y, WANG B. Protective effects of pyrroloquinoline quinine against oxidative stress-induced cellular senescence and inflammation in human renal tubular epithelial cells via Keap1/Nrf2 signaling pathway. International Immunopharmacology, 2019, 72: 445-453.
[33] LEE J M, JOHNSON J A. An important role of Nrf2-ARE pathway in the cellular defense mechanism. BMB Reports, 2004, 37(2): 139-143.
[34] INNAMORATO N G, ROJO A I, GARCIA-YAGUE A J, YAMAMOTO M, DE CEBALLOS M L, CUADRADO A. The transcription factor Nrf2 is a therapeutic target against brain inflammation. The Journal of Immunology, 2008, 181(1): 680-689.
[35] KANSANEN E, KUOSMANEN S M, LEINONEN H, LEVONEN A L. The Keap1-Nrf2 pathway: Mechanisms of activation and dysregulation in cancer. Redox Biology, 2013, 1(1): 45-49.
[36] KOBAYASHI A, KANG M I, OKAWA H, OHTSUJI M, ZENKE Y, CHIBA T, IGARASHI K, YAMAMOTO M. Oxidative stress sensor Keap1 functions as an adaptor for Cul3-based E3 ligase to regulate proteasomal degradation of Nrf2. Molecular and Cellular Biology, 2004, 24(16): 7130-7139.
[37] ITOH K, WAKABAYASHI N, KATOH Y, ISHII T, IGARASHI K, ENGEL J D, YAMAMOTO M. Keap1 represses nuclear activation of antioxidant responsive elements by Nrf2 through binding to the amino-terminal Neh2 domain. Genes and Development, 1999, 13(1): 76-86.
[38] SUN Z, ZHANG S, CHAN J Y, ZHANG D D. Keap1 controls postinduction repression of the Nrf2-mediated antioxidant response by escorting nuclear export of Nrf2. Molecular and Cellular Biology, 2007, 27(18): 6334-6349.
[39] APOPA P L, HE X, MA Q. Phosphorylation of Nrf2 in the transcription activation domain by casein kinase 2 (CK2) is critical for the nuclear translocation and transcription activation function of Nrf2 in IMR-32 neuroblastoma cells. Journal of Biochemical and Molecular Toxicology, 2008, 22(1): 63-76.
[40] HE X, MA Q. NRF2 cysteine residues are critical for oxidant/ electrophile-sensing, Kelch-like ECH-associated protein-1-dependent ubiquitination-proteasomal degradation, and transcription activation. Molecular Pharmacology, 2009, 76(6): 1265-1278.
[41] LI Z Q, SONG X H, WANG M, WANG S, HUANG G H. Melanization induced byascovirus 3h promotes viral replication. Insect Science, 2021, 28(2): 472-484.
[42] YANG C J, REN G H, DU X X, LI S W, QIAN Y R, HUANG G H, YU H. Comparisons of pathogenic course of twoascovirus isolates (HvAV-3i and HvAV-3j) in four noctuid (Lepidoptera) pest species. Journal of Invertebrate Pathology, 2022, 189: 107734.
[43] SHI G, KANG Z, LIU H, REN F, ZHOU Y. The effects of quercetin combined with nucleopolyhedrovirus on the growth and immune response in the silkworm (). Archives of Insect Biochemistry and Physiology, 2021, 108(2): e21839.
[44] OLAGNIER D, PERI S, STEEL C, VAN MONTFOORT N, CHIANG C, BELJANSKI V, SLIFKER M, HE Z, NICHOLS C N, LIN R, BALACHANDRAN S, HISCOTT J. Cellular oxidative stress response controls the antiviral and apoptotic programs in dengue virus-infected dendritic cells. PLoS Pathogens, 2014, 10(12): e1004566.
[45] BOTTINO-ROJAS V, TALYULI O A C, CARRARA L, MARTINS A J, JAMES A A, OLIVEIRA P L, PAIVA-SILVA G O. The redox-sensing geneaffects intestinal homeostasis, insecticide resistance, and Zika virus susceptibility in the mosquito.The Journal of Biological Chemistry, 2018, 293(23): 9053-9063.
[46] MISRA J R, LAM G, THUMMEL C S. Constitutive activation of the Nrf2/Keap1 pathway in insecticide-resistant strains of. Insect Biochemistry and Molecular Biology, 2013, 43(12): 1116-1124.
[47] ZHANG F, YAN Y, PENG W, WANG L, WANG T, XIE Z, LUO H, ZHANG J, DONG W. PARK7 promotes repair in early steroid- induced osteonecrosis of the femoral head by enhancing resistance to stress-induced apoptosis in bone marrow mesenchymal stem cells via regulation of the Nrf2 signaling pathway. Cell Death and Disease, 2021, 12(10): 940.
[48] JIANG H, MENG X, ZHANG N, GE H, WEI J, QIAN K, ZHENG Y, PARK Y, REDDY PALLI S, WANG J. The pleiotropic AMPK-CncC signaling pathway regulates the trade-off between detoxification and reproduction. Proceedings of the National Academy of Sciences of the United States of America, 2023, 120(10): e2214038120.
Response and function of the transcription factor CncC ininfected with baculovirus CnmeGV
ZHANG Nan, HAN GuangJie, LIU Qin, LI ChuanMing, QI JianHang, LU YuRong, XIA Yang, XU Jian
Lixiahe District Institute of Agricultural Sciences in Jiangsu/National Agricultural Experimental Station for Agricultural Microbiology in Yangzhou, Yangzhou 225007, Jiangsu
【Objective】The objective of this study is to research the role of transcription factor CncC (Cap ‘n’ Collar Isoform C) ofand its regulation of antioxidant enzyme genes in the infection ofCnaphalocrocis medinalis granulovirus (CnmeGV), and to further enrich the study of immune regulation mechanism of insects against baculovirus.【Method】The full-length cDNA sequence ofin() was cloned by RT-PCR, and its protein structure was analyzed. Third instar larvae ofwere fed with 106OB/mL concentration of CnmeGV or a mixture of the same concentration of CnmeGV and 1 mmol·L-1CncC inhibitor ML385. Samples were taken 6-48 h after infection to analyze the effect of ML385 on the change of malondialdehyde (MDA) content induced by CnmeGV, and viral DNA replication levels, the expression levels of,-(-),(-), and() were analyzed by RT-qPCR. The number of larval deaths was counted every 24 hours, and the Kaplan-Meier survival analysis of the larvae within 10 d was conducted. Infected larvae were fed with 1 mmol·L-1ML385 or a mixture of 1 mmol·L-1ML385 and 200 μg·mL-1antioxidant N-acetyl-L-cysteine (NAC), and viral DNA replication levels at different times were analyzed using RT-qPCR.【Result】The full length cDNA ofwas 3 404 bp, including a 321 bp 5-UTR, an 847 bp 3-UTR, and a 2 211 bp ORF that encoded a protein of 736 amino acids. The predicted molecular weight of the protein was 75.8 kDa. The MDA content insignificantly increased within the first 12 h of CnmeGV infection and returned to normal levels at 24 h, but was lower than the control group at 48 h. The expression ofwas significantly up-regulated at 12, 24, and 48 h after viral infection, by 1.56, 2.16, and 2.63 folds of the control group, respectively. NAC treatment significantly reduced the fold increase ofexpression induced by CnmeGV, to 48.12%, 59.83%, and 56.32% of the control group, respectively. Treatment with the ML385 caused an increase in viral gene copy number to 1.79 and 1.76 folds of the control group at 12 and 24 h, respectively, and significantly increased the mortality rate ofinfected with CnmeGV 10 d after treatment, from 73.33% to 94.14%. NAC treatment partially alleviated the up-regulation of viral gene copy number caused by CncC inhibition. CnmeGV infection led to a 3.68-fold increase in-expression level at 48 h after infection, and 1.73-, 2.62-, and 2.77-folds increase in-expression level at 12, 24, and 48 h after infection, respectively. The expression level ofincreased by 1.76 and 2.10 folds at 12 and 24 h after infection, respectively, but returned to the control group level at 48 h, and treatment with NAC or the CncC inhibitor significantly weakened the responses of-,-, andto CnmeGV infection.【Conclusion】CmCncC mediates the CnmeGV infection-induced up-regulation of-,-andmRNA levels and reduces oxidative stress caused by CnmeGV infection, thereby limiting virus replication, and reducing oxidative damage.
; Cnaphalocrocis medinalis granulovirus (CnmeGV); CncC transcription factor; oxidative stress; antioxidant gene; baculovirus

10.3864/j.issn.0578-1752.2023.13.005
2023-03-21;
2023-05-13
江苏省自然科学基金(BE20191216)、江苏省自主创新资金项目(CX[20]1004)、江苏省“333”优秀青年人才项目(苏人才办[2022]21号)、扬州市现代农业项目(YZ2021034)
张楠,E-mail:znfezhangnan@hotmail.com。韩光杰,E-mail:hanguangjie177@163.com。张楠和韩光杰为同等贡献作者。通信作者徐健,E-mail:bio-xj@163.com
(责任编辑 岳梅)

