Smad7介导TGF-β信号通路对绵羊卵泡颗粒细胞增殖的影响
郭泽媛,杜张胜,张雅琦,陈春路,马晓燕,成颖,王锴,吕丽华
介导TGF-β信号通路对绵羊卵泡颗粒细胞增殖的影响
郭泽媛,杜张胜,张雅琦,陈春路,马晓燕,成颖,王锴,吕丽华
山西农业大学动物科学学院,山西太谷 030801
【目的】卵泡发育是一个复杂的调控过程,其中绵羊卵泡颗粒细胞(granulosa cells, GCs)的增殖,分化会直接影响卵泡的发育状况。TGF-β信号通路在绵羊卵巢发育和卵泡生长过程中起着重要作用,作为TGF-β信号通路关键性的抑制基因也发挥重要作用,通过探究介导TGF-β信号通路对绵羊卵泡 GCs增殖凋亡的影响,为进一步研究在卵泡GCs增殖凋亡过程中的调控作用提供依据。【方法】选取4—6月龄未怀孕的晋中健康杜湖杂交母羊20只,屠宰后采集双侧卵巢组织,分离培养卵泡颗粒细胞,细胞免疫荧光鉴定,细胞免疫荧光的表达定位,CCK8法测定细胞增殖情况,绘制生长曲线;细胞传代后外源添加不同浓度激动剂积雪草苷(asiaticoside,AS)(0、100、200、400、600 ng·mL-1)培养绵羊卵泡GCs,选择AS最佳作用浓度处理二代颗粒细胞,采用实时荧光定量PCR和Western blotting检测TGF-β信号通路中关键基因及细胞凋亡和周期相关基因表达水平;合成3个siSmad7,转染至卵泡GCs中,选择干扰效果最佳的,采用实时荧光定量PCR和Western blotting检测TGF-β信号通路中关键基因及细胞凋亡和周期相关基因表达水平。【结果】在绵羊卵泡GCs中有表达;200 ng·mL-1AS能极显著上调在GCs的表达(<0.01),siSmad7-1对绵羊卵泡GCs的转染效果最佳(<0.01);上调能显著增加TGF-β信号通路,和的表达量(<0.05),极显著增加TGF-β信号通路的表达(<0.01),显著增加凋亡相关基因的表达量(<0.05),极显著增加凋亡相关基因和的表达量(<0.01),显著升高细胞周期相关基因和的表达量(<0.05),极显著升高细胞周期相关基因的表达量(<0.01),而的表达量显著降低(<0.05);siRNA显著降低TGF-β信号通路,和的表达量(<0.05),极显著降低TGF-β信号通路的表达量(<0.01),显著降低凋亡相关基因的表达量(<0.05),极显著降低凋亡相关基因和的表达量(<0.01),极显著降低细胞周期相关基因,和的表达量(<0.01),极显著升高的表达量(<0.01);CCK8分析显示,上调,GCs的增殖率在24和48 h显著下调(<0.01),siRNA在24和72 h显著升高GCs的增殖率(<0.05),在48 h极显著升高GCs的增殖率(<0.01)。【结论】介导TGF-β信号通路抑制绵羊卵泡GCs增殖和促进细胞凋亡。
积雪草苷;siRNA;;TGF-β信号通路;绵羊;颗粒细胞
0 引言
【研究意义】颗粒细胞作为哺乳动物卵巢卵泡的重要组成部分,在维持雌性动物生殖功能中起着重要作用[1]。颗粒细胞的增殖分化可促进卵泡发育和卵母细胞成熟,其凋亡是卵泡闭锁的主要原因,而其抗氧化能力也有利于保护卵母细胞免受氧化损伤[2-4]。转化生长因子β(TGF-β)超家族是哺乳动物中最大和最重要的生长因子家族之一,广泛参与生殖调节[5]。TGF-β信号通路中断会导致生殖障碍和癌症的发展[6]。【前人研究进展】Smad蛋白是TGF-β信号通路的细胞内组成部分。在哺乳动物中,已经鉴定出8种Smad蛋白,并被分为受体调控的SMADs(SMAD1、2、3、5和8)、常见的SMAD(SMAD4)和抑制性SMADs(SMAD6和SMAD7);其中Smad7是Smad信号蛋白家族中的抑制型亚家族,对TGF-β信号通路起负调节作用[7-8]。TGF-β/Smads信号通路在卵泡生长发育过程中有重要的调控作用。积雪草苷(asiaticoside,AS)是由积雪草中提取的一种三萜类化合物,是的激动剂,能显著上调的表达量。TANG等[9]的研究表明AS能增加Smad7蛋白和mRNA的表达。QUEZADA等[10]的研究表明主要定位于卵母细胞,而在腔前和腔卵泡的卵泡细胞和颗粒细胞中表达,进一步研究也表明介导TGF-β诱导的小鼠颗粒细胞凋亡,表明的失调可能损害卵泡形成。李碧筠等研究表明抑制山羊卵泡颗粒细胞的增殖和雌二醇分泌,促进凋亡和孕酮的合成,并且抑制、的表达,进而调节卵泡的发育与闭锁。GAO等[11]的研究确定了是小鼠颗粒细胞中关键TGF-β超家族信号的负调控因子。【本研究切入点】近年来,对于绵羊卵泡发育过程已有较多研究,然而抑制性Smads的作用仍然是这一领域缺失的部分,关于在绵羊卵泡GCs中的发育中的作用机制尚未见报道。因此,本研究意在探讨在卵巢TGF-β信号转导中的功能。【拟解决的关键问题】以绵羊卵泡GCs为研究对象,对在绵羊卵泡GCs中进行定位。通过外源添加AS和转染siRNA,进而探究对TGF-β信号通路关键因子和对细胞增殖、凋亡和周期相关基因的影响。研究结果可进一步为在绵羊卵泡中的生物学功能及作用机制奠定理论基础。
1 材料与方法
1.1 组织材料
2021年11月,在山西省晋中市太古区绵羊屠宰基地挑选4—6月龄体况良好的健康母羊20头,屠宰后采集有不同大小卵泡的双侧卵巢,剪去多余的组织,酒精消毒,放入灭菌的4 ℃DPBS缓冲液中,在冰上30 min内运至山西农业大学实验室。
1.2 主要试剂
Smad7 Rabbit pAb 购于ABclonal公司;β-actin polyclonal antibody购于BioWorld(美国);Asiaticoside(积雪草苷)购于MedChenExpress公司;PBS 缓冲液购于索莱宝(北京);双抗购于索莱宝(北京);DMEM/F12基础培养液购于博士德(武汉);胎牛血清(FBS)购于CellMax(澳大利亚);胰蛋白酶购于Gibco(美国);二甲基亚砜(DMSO)购于索莱宝;RNAiso Plus购于Takara(日本);PrimeScript™ RT reagent Kit with gDNA Eraser购于Takara;TB Green Premix Ex Taq Ⅱ 购于Takara;CCK-8购于Dojindo(日本);4%多聚甲醛购于博士德;FITC-goat anti-rabbit IgG购于博士德;蛋白上样缓冲液购于博士德,SDS-PAGE凝胶制备试剂盒购于索莱宝;LipoFiter 3.0TM购于汉恒(上海)。
1.3 试验方法
1.3.1 绵羊卵泡GCs的收集和培养 卵巢用灭菌的DPBS冲洗干净,分离直径为3—5 mm的卵泡,放入盛有DMEM/F12培养液的表面皿中,逐一将其剪开并用刮刀轻轻刮取卵泡内的GCs,用细胞筛过滤除去组织杂质,收集培养液于无菌的EP管中,1 000 r/min离心5 min,弃上清,将GCs重悬于完全培养基中,在37 ℃,含5% CO2的细胞培养箱中培养。贴壁GCs长满培养皿后可进行传代和冻存。
1.3.2 卵泡颗粒细胞的鉴定与在颗粒细胞中的表达定位 将无水乙醇浸泡的盖玻片放入6孔细胞培养板中,将培养获得的贴壁细胞消化,计数,按1×105个/mL密度取一滴细胞悬液滴加到盖玻片上,并将整个6孔板置于37 ℃,5% CO2细胞培养箱中过夜爬片。次日,弃培养基,PBS清洗3次,每次5 min。每孔加500 μL 4%多聚甲醛固定30 min,PBS清洗3次;后向6孔板中加500 μL 1% TritonX-100溶液通透30 min,PBS清洗3次;每孔中加入500 μL 1% BSA溶液封闭1 h,PBS清洗1次;每孔中加入200 μL rabbit anti-Smad7和rabbit anti-FSHR稀释液,阴性对照加 200 μL PBS,4 ℃过夜孵育;回收一抗,PBS清洗3次,每次5 min;FITC-goat anti-rabbit IgG稀释液避光孵育1 h,PBS避光清洗3次,每次5 min;加入DAPI染液避光孵育20 min后再次清洗3次,使用倒置荧光显微镜观察拍照。
1.3.3 AS处理和siRNA转染颗粒细胞 将GCs接种到6孔细胞培养板内,待细胞密度长到80%时,向细胞中添加不同浓度(0、100、200、400、600 ng·mL-1)的的激动剂Asiaticoside,每个浓度的培养孔做3个技术重复,48 h后提取RNA。
用于基因干扰试验的及无义序列siRNA(NC)由上海生工生物工程有限公司设计及合成,这些RNA的序列如下:siSmad7-1:5′-CCAGAUACC CGAUGGAUUUTT-3′,siSmad7-2:5′-UGGCAUACUG GGAGGAGAATT-3′,siSmad7-3:5′‑CAGAAAGUAC GGAGCAAAATT-3′,Negative Control:5′-UUCUCCG AACGUGUCACGUTT-3′。将颗粒细胞接种到6孔板中,待细胞融合度达到60%以上,参照LipoFiter 3.0TM说明书步骤进行转染试验。
1.3.4 CCK8检测细胞增殖 颗粒细胞长满培养皿时,消化、计数,按1×105个/mL密度接种于96孔板,放置在37 ℃,5% CO2培养箱中过夜培养。在细胞中添加激动剂与小干扰,分为对照组和试验组,将培养板放置培养箱中继续培养24、48 和 72 h。等细胞试验处理完毕后,向每个孔加入CCK-8试剂10 µL,在此过程中尽量不要产生气泡。将96孔板继续放置培养箱培养3 h,之后用酶标仪测定其在450 nm处的吸光度。
1.3.5 总RNA提取和cDNA合成 Trizol法提取总RNA,提取步骤按RNAiso Plus试剂盒说明书进行。按照PrimeScriptTMRT reagent Kit With gDNA Eraser试剂盒说明书合成cDNA。
1.3.6 引物的合成 在NCBI中设计定量引物并由上海生工合成,引物信息如表1所示。
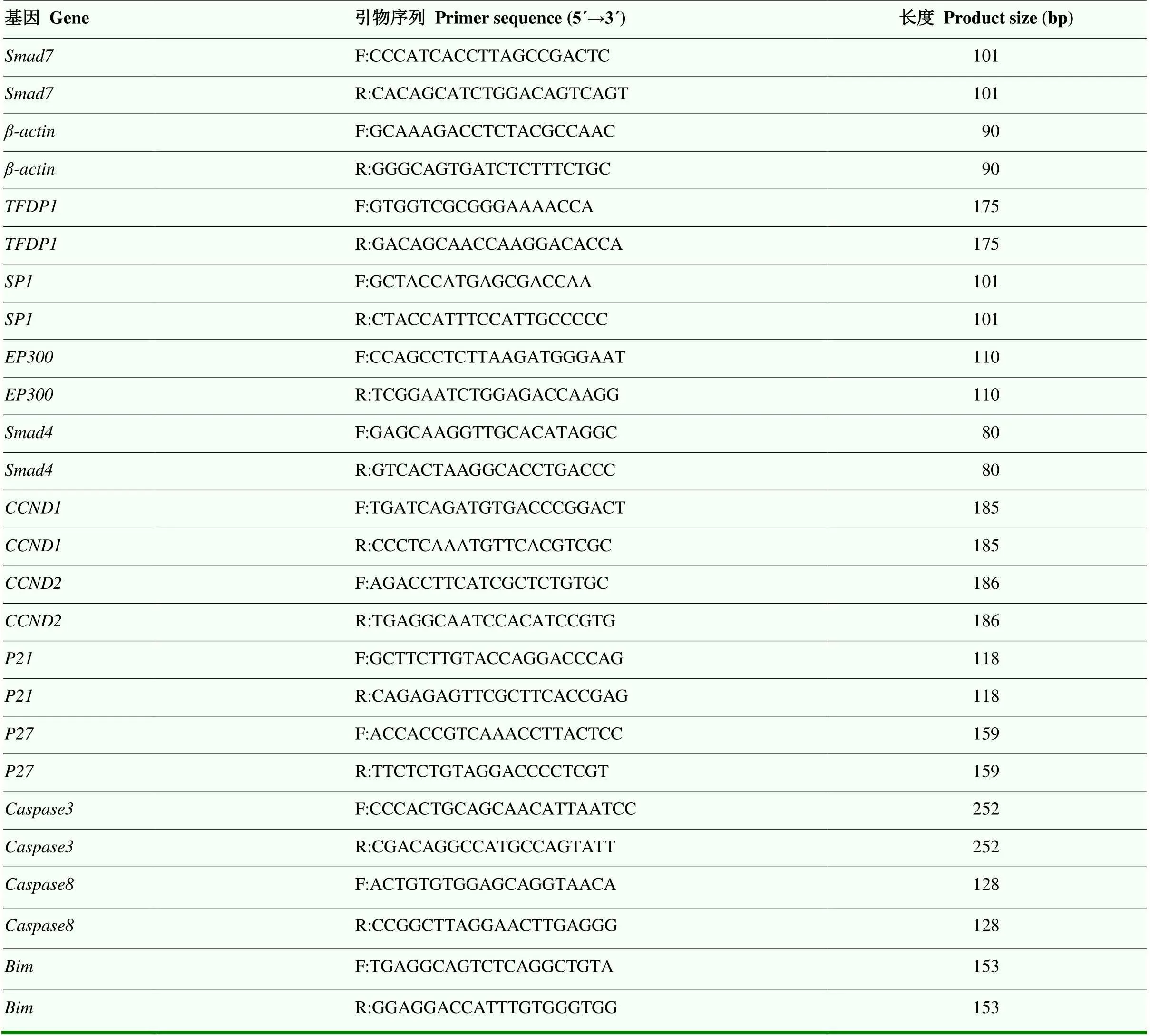
表1 实时荧光定量PCR引物
1.3.7 qRT-PCR 培养试验中的cDNA为模板,根据TB Green Premix Ex Taq Ⅱ试剂盒的操作说明建立qRT-PCR反应体系。使用CFX Connect TM Real-Time System 进行反应,反应条件为95°C 30 s,95°C 5 s,60°C 30 s,总共40个循环。之后进行熔解曲线分析,验证PCR产物的纯度。根据阈值循环(CT)值计算各基因相对于内参基因的表达量。
1.3.8 Western blotting检测 提取GCs的总蛋白,用BCA测定总蛋白浓度,根据SDS-PAGE Gel Kit说明书配置10%的分离胶和5%的浓缩胶,蛋白上样缓冲液与蛋白样品以1﹕4比例混合,100 ℃ 10 min蛋白变性后,上样至凝胶加样孔,上样量为20 μL,80 V 30 min浓缩胶电泳;120V 50min分离胶电泳。将目的条带所在的胶条进行割胶,与NC膜贴合,100 V 90 min,进行转膜电泳。5 %封闭蛋白干粉封闭90 min。一抗4 ℃孵育过夜14 h,试验组Smad7兔抗以1﹕1 000稀释,对照组一抗β-actin兔多克隆抗体以1﹕10 000稀释,TBST清洗10 min,重复3次;二抗室温孵育90 min,以1﹕15 000稀释,TBST清洗10 min,重复3次;NC膜在凝胶成像系统进行曝光。采用ImageJ软件对Western blot蛋白条带进行灰度值分析。
1.4 数据分析
qRT-PCR结果采用2-ΔΔCt的计算方法,将各个目的基因与内参基因的CT值按照2-ΔΔCt算法,得出相对表达量。Western blotting结果用ImageJ软件对Western blotting蛋白条带进行灰度值分析,得出相对表达量。利用SPSS 22.0软件对数据进行分析,采用单因素方差分析和显著性检验的方法,所有数据均以“平均数±标准误(Mean±SEM)”表示,<0.05表示差异显著,<0.01表示差异极显著。
2 结果
2.1 颗粒细胞的免疫荧光鉴定
DAPI染液使细胞核呈蓝色,FSHR的一抗和二抗的结合使含有 FSHR 蛋白的细胞呈现绿色荧光。将不同激发光下的图像混合发现所有细胞均带有绿色荧光(图1)。GCs 特异性FSHR 的表达证明试验采集的原代 GCs 纯度较高,不含其他杂细胞。
2.2 Smad7在绵羊卵泡颗粒细胞中的定位
细胞免疫荧光结果如图2所示,表明在颗粒细胞表面有较强的阳性信号,说明在在绵羊卵泡颗粒细胞中有表达。
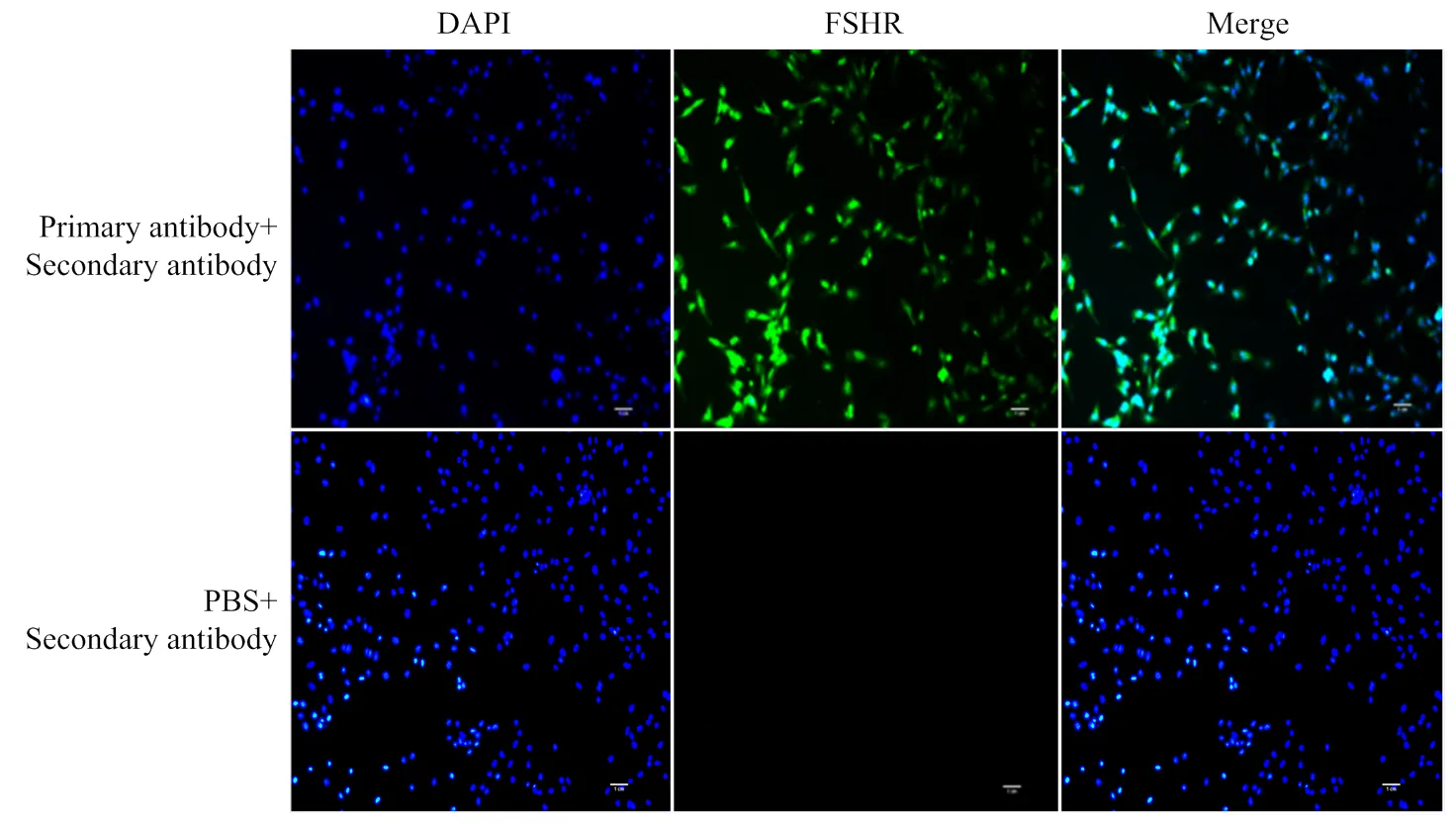
图1 绵羊GCs免疫荧光鉴定
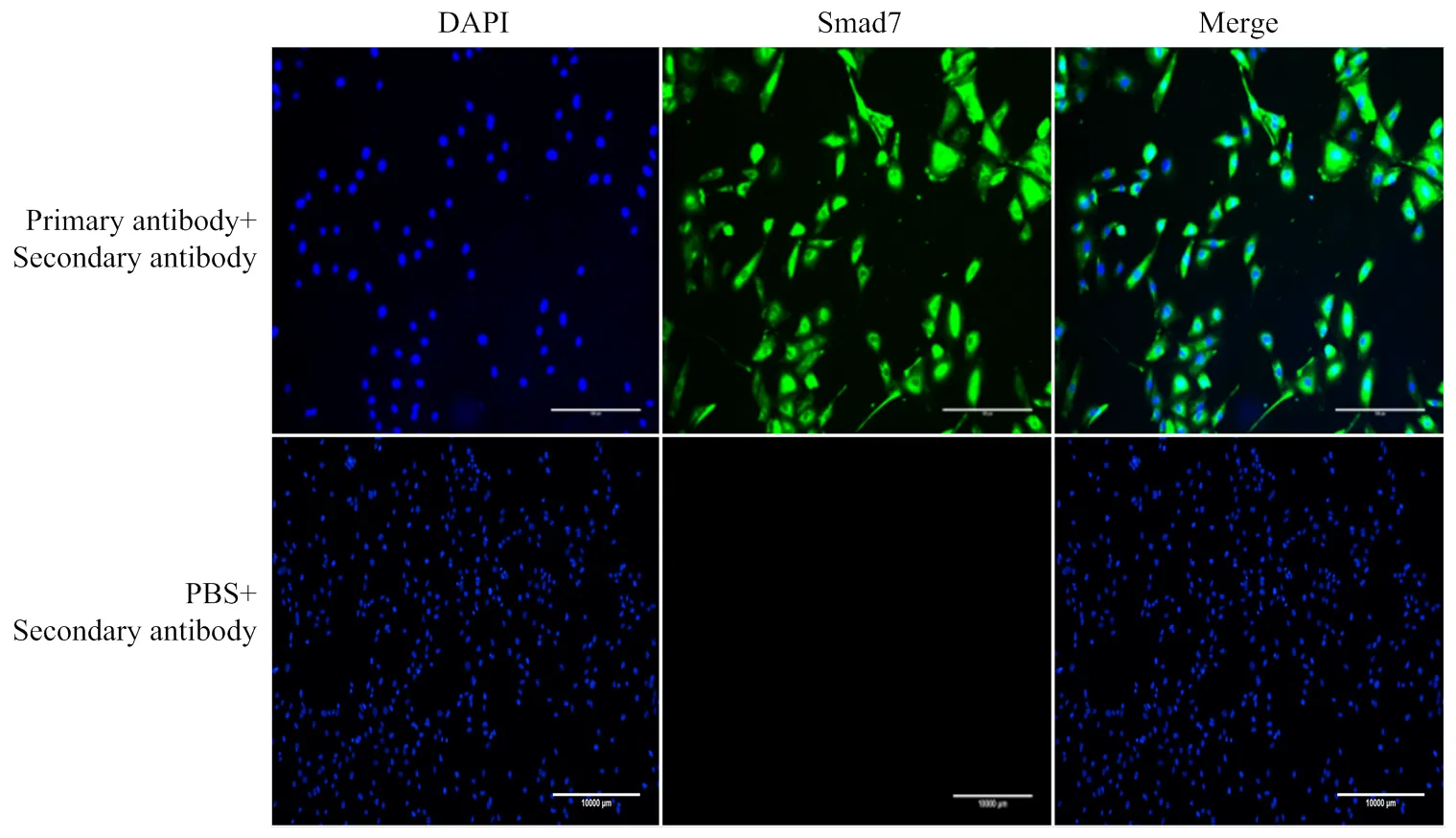
图2 绵羊卵泡颗粒细胞中Smad7免疫荧光定位
2.3 激动剂和siRNA对卵泡颗粒细胞Smad7表达的影响
激动剂和siRNA对卵泡GCs表达的影响见图3-A,添加激动剂后mRNA的相对表达量在100、200、400和600 ng·mL-1均升高,在100 ng·mL-1差异显著(<0.05),在200和400 ng·mL-1差异极显著(<0.01),在600 ng·mL-1时差异不显著。结果表明,AS可以使mRNA的相对表达量明显升高,在200 ng·mL-1时,的mRNA相对表达量最大。Western blotting的结果也表明,在200 ng·mL-1时,Smad7蛋白表达量与对照组相比极显著差异升高(<0.01)(图4)。由图3-B可见,转染siRNA后,siSmad7-1和siSmad7-2与Negative siRNA相比的相对表达量极显著降低(<0.01),siSmad7-3的的相对表达量显著降低(<0.05),表明siSmad7-1,siSmad7-2和siSmad7-3均干扰Smad7 mRNA的表达量,且siSmad7-1的干扰效果最好。Western blotting的结果表明:siSmad7-1中Smad7蛋白表达量与对照组相比显著降低(<0.05)(图5)。
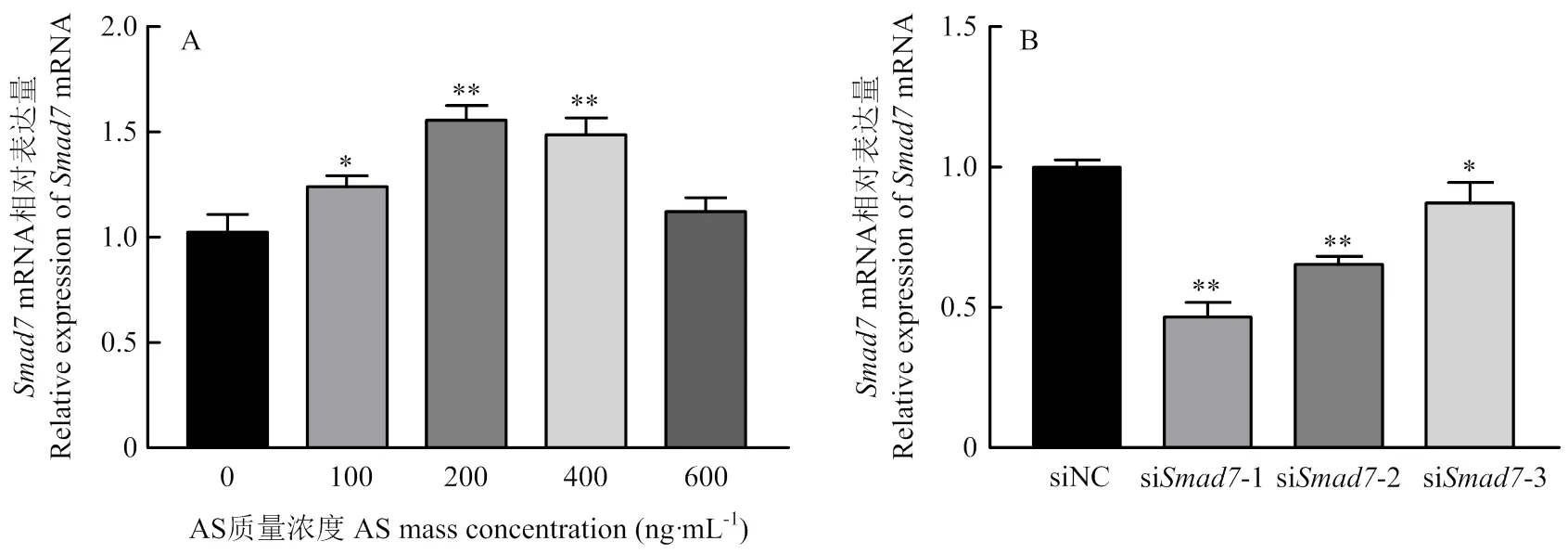
* 表示P<0.05表示差异显著,**表示P<0.01表示差异极显著。下同
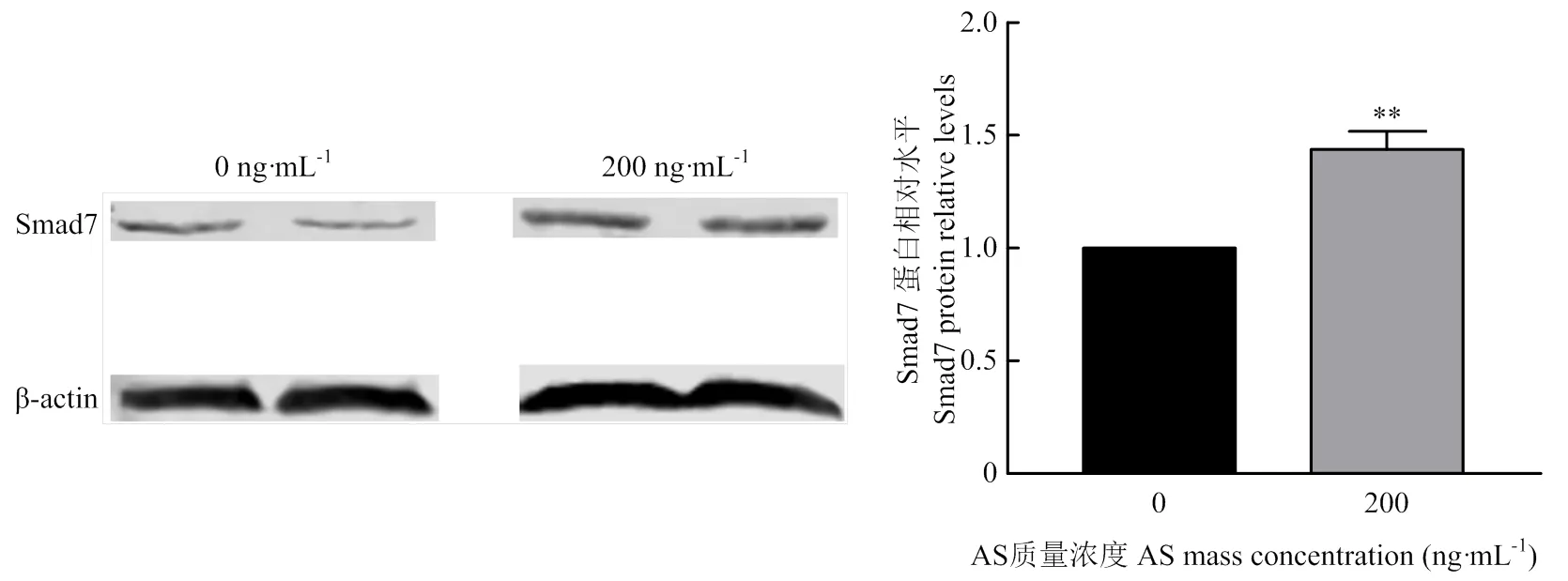
图4 200 ng·mL-1 AS处理绵羊卵泡GCs后对Smad7蛋白表达的影响
2.4 Smad7对TGF-β信号通路的影响
上调,TGF-β信号通路下游基因的表达量与对照组相比极显著上升(<0.01),,和的表达量与对照组相比显著升高(<0.05)(图6-A);siRNA组和表达量与对照组相比显著降低(<0.05),的表达量与对照组相比极显著降低(<0.01)(图6-B)。
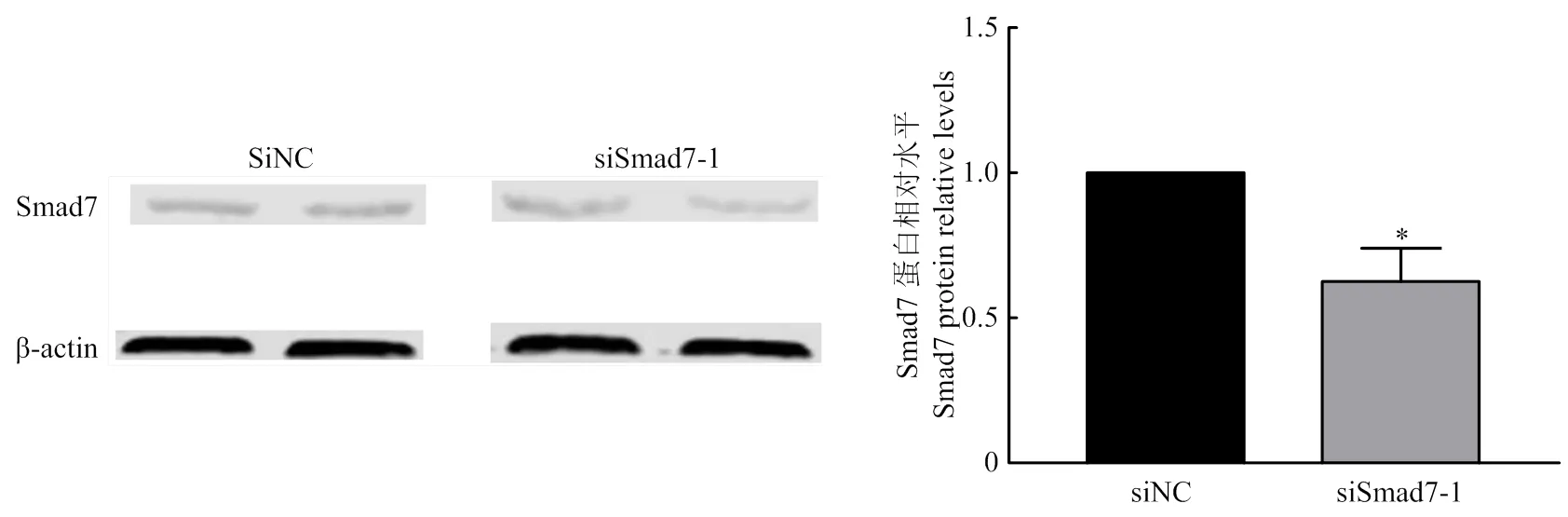
图5 siSmad7-1处理绵羊卵泡GCs后对Smad7蛋白表达的影响
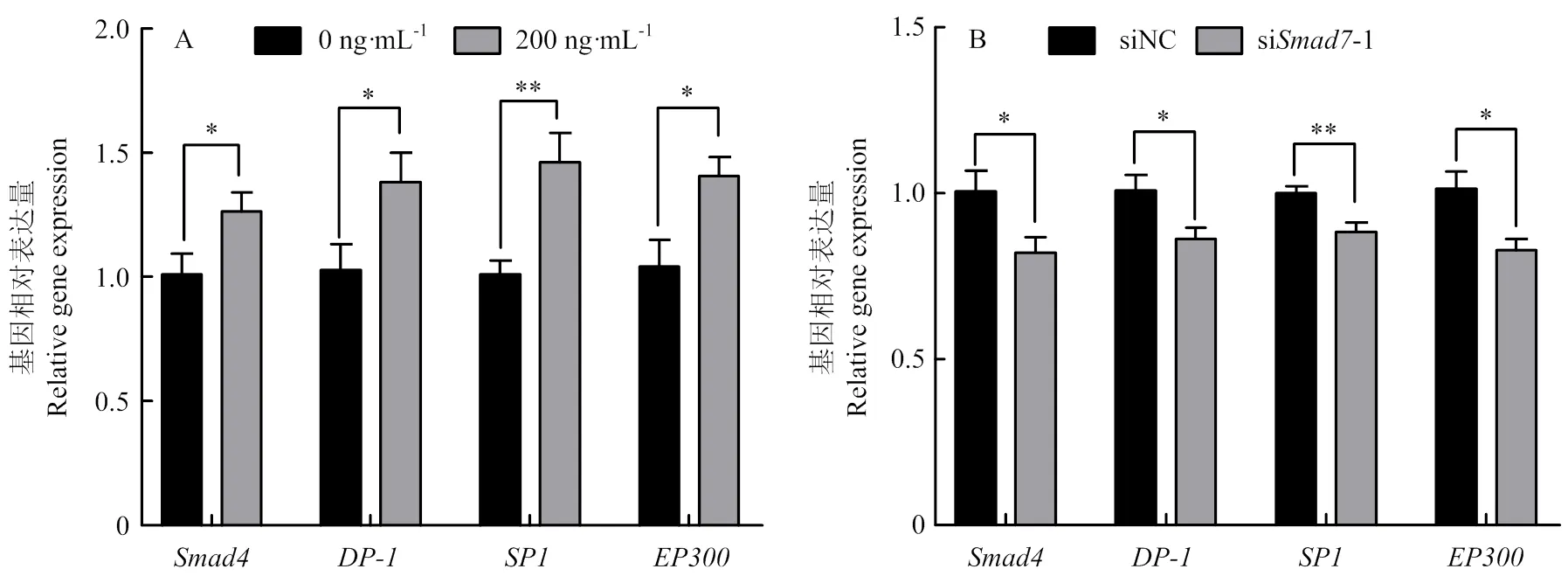
图6 Smad7对TGF-β信号通路相关基因表达水平的影响
2.5 Smad7对绵羊颗粒细胞增殖的影响
采用CCK-8检测处理绵羊卵泡颗粒细胞后在0、24、48和72 h的OD值,并计算细胞增殖率。如图7-A所示,上调后,24和48 h的细胞增殖率极显著低于对照组(<0.01);在图7-B中,siRNA,在24和72 h的细胞增殖率显著高于对照组(<0.05),在48 h细胞增殖率极显著高于对照组(<0.01)。
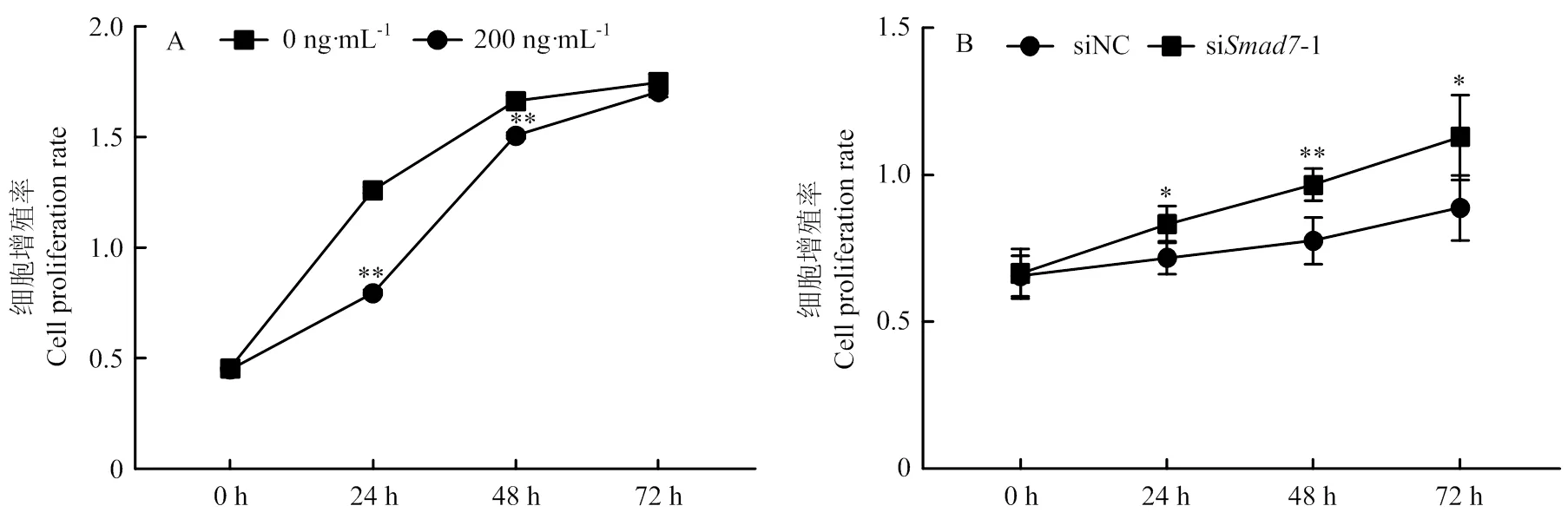
图7 Smad7上调和下调对绵羊卵泡颗粒细胞增殖率的影响
2.6 Smad7对绵羊GCs周期的影响
为探究对绵羊卵泡GCs周期的影响,通过qRT-PCR检测细胞周期相关基因的表达。如图8所示,上调时和与对照组相比表达量显著升高(<0.05),表达量极显著升高(<0.01),但的表达量与对照组相比显著降低(<0.05,图8-A);siRNA组和的相对表达量与对照组相比极显著降低(<0.01),的表达量与对照组相比极显著升高(<0.01,图8-B)。
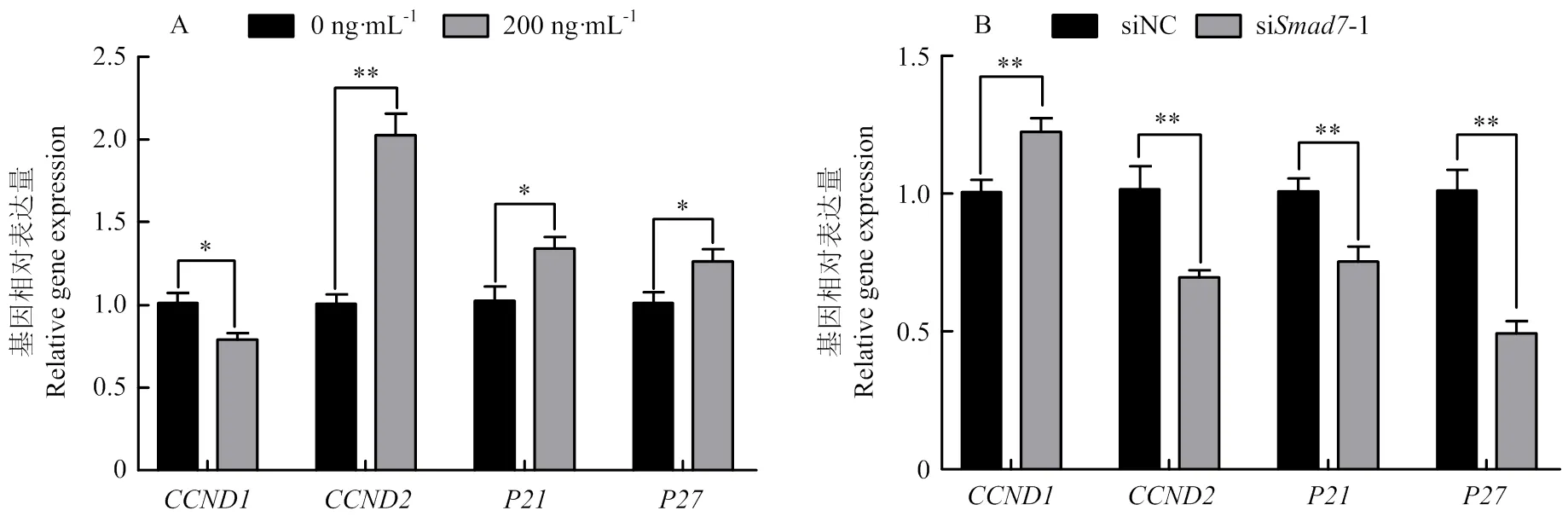
图8 Smad7上调和下调对绵羊卵泡GCs周期相关基因的影响
2.7 Smad7对绵羊颗粒细胞凋亡的影响
对绵羊GCs中凋亡相关基因的影响如图9所示,在图9-A中和的表达量极显著升高(<0.01),的表达量显著升高(<0.05);在图9-B中,和的表达量极显著降低(<0.01),的表达量显著降低(<0.05)。
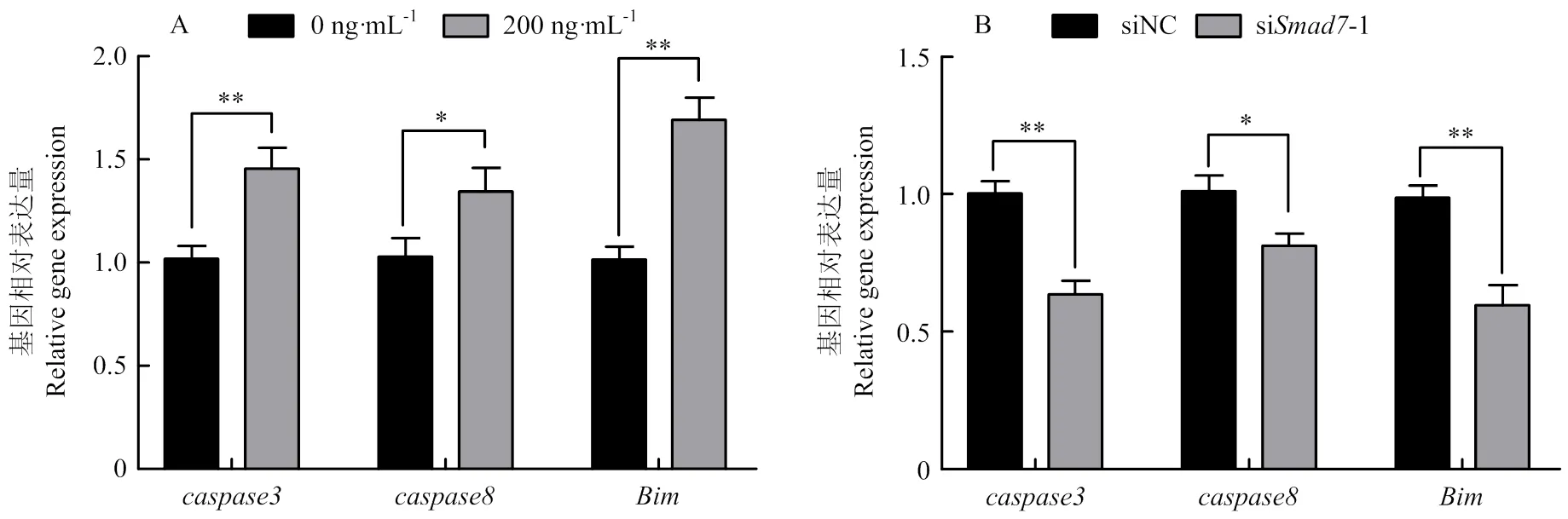
图9 Smad7对绵羊卵泡GCs凋亡相关基因的影响
3 讨论
3.1 Smad7在绵羊卵泡GCs中的定位表达
在哺乳动物卵巢中,超过99%的卵泡发生退行性闭锁,而在卵巢卵泡发育过程中,只有少数卵泡发生排卵。GCs在卵泡发育和闭锁中具有重要作用,而GCs的凋亡与卵泡闭锁密切相关[3]。编码一个属于TGF-β超家族的I-Smad,是TGF-β信号通路中的一种信号转导蛋白,在细胞增殖、分化和凋亡中具有重要作用,对于女性生殖各方面都是很重要的[12-13]。LIU等[14]研究表明沉默可以降低猪GCs的凋亡,李碧筠等[15]研究表明抑制山羊卵泡颗粒细胞的增殖。TIAN等[16]研究发现定位于小鼠卵母细胞,是在GCs中的定位、调控和功能的首次报道,提示对卵巢发育过程存在调节作用。作为确定潜在卵巢功能的第一步,本研究检测了在绵羊卵泡GCs中的表达,发现在绵羊卵泡GCs有表达,这与QUEZADA等[10]研究在小鼠卵泡GCs中表达的研究结果一致,说明在绵羊卵泡发育过程中起到的重要作用。
3.2 smad7介导TGF-β信号通路的作用机制
现代临床及药理研究显示:积雪草主含积雪草甙、羟基积雪草甙、羟基积雪草酸、积雪草酸等多种三萜类化合物,目前临床主要用于治疗及预防烧伤、外伤、手术等所致瘢痕增生,以及传染性肝炎,流行性脑脊髓膜炎、慢性肾炎等病的治疗[17]。LEE等[18]研究发现AS的作用与Smad信号通路相关,TANG等[9]研究也证实,在疤痕组织中,AS抑制胶原增生的机制主要是通过增加的表达,进而抑制TGF-βR1的病理性作用,使成纤维细胞增殖受阻。为了进一步研究在绵羊卵泡GCs中的作用,通过外源添加AS使mRNA表达量上调,研究结果发现外源添加AS,使mRNA相对表达量均显著升高,这与QI等[19]研究发现AS能显著增强抑制性的表达的结果一致。
TGF-β家族的生长因子在维持卵巢细胞的生长和分化中发挥着重要作用[20],TGF-β/Smad信号通路是调控哺乳动物卵泡生长发育和GCs增殖凋亡的主要通路[21]。TGF-β/Smads信号通路是由细胞外配体、细胞表面特异受体及细胞内Smads信号传导分子共同组成的,它们之间会形成紧密联系的级联反应,最终将细胞外信号传导进入细胞核内并调控靶基因转录,引发生物学效应。TGF-β/Smads通路中I-Smads通过阻断R-Smad和Co-Smad的激活,与活化的受体或受体激活的Smads竞争性结合形成无活性复合物来负调控此信号通路[22]。在小鼠和猪等哺乳动物的卵巢GCs中,激活TGF-β信号通路可增强GCs增殖,抑制GCs凋亡[23-25],而TGF-β信号通路失活导致GCs凋亡和滤泡闭锁[26]。Smad7属于抑制型Smad蛋白,大量实验证明其作为内源性TGF-β拮抗剂从而产生抑制TGF-β/Smad信号通路的结果,可与或竞争结合TGF-βRⅠ或,抑制/磷酸化及向细胞核转移,还可诱导与TGF-βR-I的泛素-蛋白酶体降解,通过E3泛素连接酶-Smad泛素化调节因子(Smuf1和Smurf2)从而对TGF-β1/Smad通路产生负性调节作用[27]。TGF-β/Smad信号通路已有较多研究,但仍有许多未研究的领域。本试验主要通过上调和下调的表达量,检测TGF-β/Smad信号通路下游关键基因表达量,进而研究在TGF-β/Smad信号通路中的作用。研究结果表明:mRNA相对表达量上调后,的表达量与对照组相比极显著上升,,和的表达量与对照组相比显著升高;mRNA相对表达量被干扰后,,,和表达量与之相反。PANGAS等[28]研究发现,在卵巢中特异性敲除导致小鼠卵泡功能早衰,GCs过早黄体化,生育能力下降。的表达量与对照组相比显著上调,信号通路下游的基因(transcription factor Dp-1),(转录因子特殊蛋白因子1,transcription factor Sp1)和与对照组相比差异显著,说明介导TGF-β信号通路对绵羊卵泡颗粒细胞有一定的调控作用。是TGF-β信号通路的下游基因,家族蛋白作为调节细胞周期和细胞凋亡的重要分子,正常情况下和E2F家族基因以二聚体的形式发挥作用,并且受到口袋蛋白RB和p107的调控[29-30]。属于SP/Kruppel样转录因子(Sp-like and Kruppel-like transcription factors, Sp/KLFS)家族,是该家族第1个被发现的转录因子[31]。姚一龙等[32]研究表明湖羊可抑制卵巢GCs增殖、诱导凋亡。EP300和CBP(cAMP 反应元件结合蛋白)作为转录共激活因子通过和不同转录因子结合,参与调控靶基因表达,蛋白表达变化影响细胞许多基本功能,包括增殖、细胞周期、细胞分化和DNA损伤反应等,进而影响了细胞表型[33]。
3.3 smad7介导TGF-β信号通路调控GCs增殖与凋亡
TGF-β/Smad信号通路是调控哺乳动物卵泡生长发育和GCs增殖凋亡的主要通路[21]。是TGF-β信号通路的特异性抑制剂,并在体内和体外阻断TGF-β信号转导[34-35]。Liu等[14]研究表明沉默降低猪GC细胞的凋亡,是GCs中一种促凋亡因子。本试验中通过CCK8检测上调和下调对细胞增殖率的影响,上调降低了绵羊卵泡GCs的增殖,siRNA的结果则与之相反。与前人研究-SiRNA提高猪卵巢GCs的活力,促进GCs增殖的研究结果一致[36]。P21和P27蛋白是重要的细胞周期蛋白依赖性激酶抑制剂,通过特定分子机制导致细胞周期阻滞和抑制细胞增殖[37-38]。细胞周期蛋白D1(Cyclin DI,CCNDI)和细胞周期蛋白D2(Cyclin D2,CCND2)是细胞周期蛋白D型家族(CyclinDs,CCNDs)中的成员,是细胞有丝分裂G1期到S期的限速因子,能强制性诱导细胞通过G1期限制点进入S期,正向调控细胞周期,加快增殖[39]。本试验结果表明,上调,细胞周期相关蛋白,和与对照组相比显著升高,的表达量与对照组相比显著降低,而当被干扰时,结果与之相反。这表明,在绵羊卵泡GCs发育过程中,通过调控周期相关基因而影响细胞的增殖和凋亡。
细胞增殖与细胞凋亡密切相关。优势卵泡选择和卵泡闭锁是通过GCs凋亡来实现[40-41]。Caspase家族成员也参与程序性细胞死亡的过程,某些Caspases缺失导致细胞凋亡严重缺陷[42]。Caspase3作为凋亡途径下游,导致底物酶解的蛋白酶,是细胞凋亡过程中最关键的执行者。在本研究中,通过调节的表达,从而影响,和的表达,诱导细胞凋亡,表明在GCs凋亡中发挥重要调控作用。Quezada等[10]研究发现,在小鼠中,当过表达时,GCs中的细胞凋亡明显增加,而当被沉默时,GCs中TGF-β诱导的细胞凋亡被阻断。
4 结论
在绵羊卵泡颗粒细胞中有表达;介导TGF-β信号通路抑制绵羊卵泡颗粒细胞增殖并促进细胞凋亡。该结果可为在绵羊卵泡中的生物学功能及作用机制研究提供理论基础。
[1] 吴玉萍, 赵茴茴, 周玉霞, 汪丽萍. 颗粒细胞在卵母细胞发育成熟中的作用. 国际生殖健康/计划生育杂志, 2017, 36(6): 503-506.
WU Y P, ZHAO H H, ZHOU Y X, WANG L P. The role of granulosa cells in oocyte maturation. Journal of International Reproductive Health/Family Planning, 2017, 36(6): 503-506. (in Chinese)
[2] 卢翠玲, 杨巍, 胡召元, 刘以训. 颗粒细胞的增殖分化及其在卵泡发育中的作用. 科学通报, 2005, (21): 2341-2347.A.
LU C L, YANG W, HU Z Y, LIU Y X. Proliferation and differentiation of granulosa cells and their role in follicular development. Chinese Science Bulletin, 2005, (21): 2341-2347.A. (in Chinese)
[3] MATSUDA F, INOUE N, MANABE N, OHKURA S. Follicular growth and atresia in mammalian ovaries: regulation by survival and death of granulosa cells. The Journal of Reproduction and Development, 2012, 58(1): 44-50.
[4] TIWARI M, TRIPATHI A, CHAUBE S K. Presence of encircling granulosa cells protects against oxidative stress-induced apoptosis in rat eggs cultured. Apoptosis, 2017, 22(1): 98-107.
[5] GONG X Y, MCGEE E A. Smad3 is required for normal follicular follicle-stimulating hormone responsiveness in the mouse. Biology of Reproduction, 2009, 81(4): 730-738.
[6] MIDDLEBROOK B S, ELDIN K, LI X H, SHIVASANKARAN S, PANGAS S A. Smad1-Smad5 ovarian conditional knockout mice develop a disease profile similar to the juvenile form of human granulosa cell tumors. Endocrinology, 2009, 150(12): 5208-5217.
[7] WANG C, GU S, CAO H H, LI Z T, XIANG Z, HU K B, HAN X D. miR-877-3p targets Smad7 and is associated with myofibroblast differentiation and bleomycin-induced lung fibrosis. Scientific Reports, 2016, 6(1): 1-11.
[8] LÖNN P, MORÉN A, RAJA E, DAHL M, MOUSTAKAS A. Regulating the stability of TGFβ receptors and Smads. Cell Research, 2009, 19(1): 21-35.
[9] TANG B, ZHU B, LIANG Y Y, BI L K, HU Z C, CHEN B, ZHANG K, ZHU J Y. Asiaticoside suppresses collagen expression and TGF-β/smad signaling through inducing Smad7 and inhibiting TGF-βRI and TGF-βRII in keloid fibroblasts. Archives of Dermatological Research, 2011, 303(8): 563-572.
[10] QUEZADA M, WANG J K, HOANG V, MCGEE E A. Smad7 is a transforming growth factor-beta–inducible mediator ofapoptosis in granulosa cells. Fertility and Sterility, 2012, 97(6): 1452-1459.e6.
[11] GAO Y, WEN H X, WANG C, LI Q L. SMAD7 antagonizes key TGFβ superfamily signaling in mouse granulosa cells. REPRODUCTION, 2013, 146(1): 1-11.
[12] KUO S W, KE F C, CHANG G D, LEE M T, HWANG J J. Potential role of follicle-stimulating hormone (FSH) and transforming growth factor (TGFβ1) in the regulation of ovarian angiogenesis. Journal of Cellular Physiology, 2011, 226(6): 1608-1619.
[13] MASSAGUÉ J. TGFβ signalling in context. Nature Reviews Molecular Cell Biology, 2012, 13(10): 616-630.
[14] LIU J Y, YAO W, YAO Y, DU X, ZHOU J L, MA B Q, LIU H L, LI Q F, PAN Z X. miR-92a inhibits porcine ovarian granulosa cell apoptosis by targetinggene. FEBS Letters, 2014, 588(23): 4497-4503.
[15] 李碧筠, 黄思艺, 王钰锟, 王磊, 何莉娜, 唐雪, 徐德军, 赵中权. SMAD7对山羊卵泡颗粒细胞增殖、凋亡的影响. 畜牧兽医学报, 2022, 53(8): 2548-2557.
LI B J, HUANG S Y, WANG Y K, WANG L, HE L N, TANG X, XU D J, ZHAO Z Q. Effects of SMAD7 on proliferation and apoptosis of goat follicular granulosa cells. Acta Veterinaria et Zootechnica Sinica, 2022, 53(8): 2548-2557. (in Chinese)
16] TIAN X, HALFHILL A N, DIAZ F J. Localization of phosphorylated SMAD proteins in granulosa cells, oocytes and oviduct of female mice. Gene Expression Patterns, 2010, 10(2/3): 105-112.
[17] 马继伟, 王宏天, 刘浩飞, 董磊鹏, 丁元, 白继琼, 张翥, 东莉洁. 积雪草对转染TGF-β1基因的大鼠肾小球系膜细胞Smad 2/3、Smad 7和胶原蛋白Ⅳ表达的影响. 中国应用生理学杂志, 2018, 34(2): 122-125, 149.
MA J W, WANG H T, LIU H F, DONG L P, DING Y, BAI J Q, ZHANG Z, DONG L J. Effects of centellaasiatica granule on the expression of Smad 2/3, Smad 7 and collagen Ⅳ in the mesangial cells stably expressed TGF-β1. Chinese Journal of Applied Physiology, 2018, 34(2): 122-125, 149. (in Chinese)
[18] LEE J, JUNG E, KIM Y, PARK J, PARK J, HONG S, KIM J, HYUN C, KIM Y S, PARK D. Asiaticoside induces human collagen I synthesis through TGFbeta receptor I kinase (TbetaRI kinase)- independent Smad signaling. Planta Medica, 2006, 72(4): 324-328.
[19] QI S H, XIE J, PAN S, XU Y, LI T, TANG J, LIU X, SHU B, LIU P. Effects of asiaticoside on the expression of Smad protein by normal skin fibroblasts and hypertrophic scar fibroblasts. Clinical and Experimental Dermatology, 2008, 33(2): 171-175.
[20] ROSAIRO D, KUYZNIEREWICZ I, FINDLAY J, DRUMMOND A. Transforming growth factor-beta: its role in ovarian follicle development. Reproduction (Cambridge, England), 2008, 136(6): 799-809.
[21] 周敏, 冯强, 黄丽波, 杨在宾, 杨维仁, 姜淑贞. 转化生长因子β1/Smads信号传导通路在哺乳动物卵巢发育中的调控作用及其作用机制. 动物营养学报, 2017, 29(7): 2283-2288.
ZHOU M, FENG Q, HUANG L B, YANG Z B, YANG W R, JIANG S Z. Regulation and mechanism of transforming growth factor-β1/ smads signaling pathway on development of ovaries in mammalian. Chinese Journal of Animal Nutrition, 2017, 29(7): 2283-2288. (in Chinese)
[22] LIU S J, DE BOECK M, VAN DAM H, TEN DIJKE P. Regulation of the TGF-β pathway by deubiquitinases in cancer. The International Journal of Biochemistry & Cell Biology, 2016, 76: 135-145.
[23] YAO G D, YIN M M, LIAN J, TIAN H, LIU L, LI X, SUN F. microRNA-224 is involved in transforming growth factor-β-mediated mouse granulosa cell proliferation and granulosa cell function by targeting Smad4. Molecular Endocrinology, 2010, 24(3): 540-551.
[24] LIU J Y, DU X, ZHOU J L, PAN Z X, LIU H L, LI Q F. microRNA-26b functions as a proapoptotic factor infollicular granulosa cells by targeting sma-and mad-related protein 4. Biology of Reproduction, 2014, 91(6): 146, 1-12.
[25] DU X, ZHANG L F, LI X Y, PAN Z X, LIU H L, LI Q F. TGF-β signaling controls FSHR signaling-reduced ovarian granulosa cell apoptosis through the SMAD4/miR-143 axis. Cell Death & Disease, 2016, 7(11): e2476.
[26] ZHOU J L, LIU J Y, PAN Z X, DU X, LI X Y, MA B Q, YAO W, LI Q F, LIU H L. The let-7g microRNA promotes follicular granulosa cell apoptosis by targeting transforming growth factor-β type 1 receptor. Molecular and Cellular Endocrinology, 2015, 409: 103-112.
[27] RUAN Y H, ZHANG Z G, ZHANG X R, LIU C, GUO M Y. The expressions of TGF-beta1 and Smad 2 mRNA on diseased glomeruli and their significance in the development of glomerulosclerosis. Chinese Journal of Pathology, 2002, 31(4): 314-317.
[28] PANGAS S A, LI X H, ROBERTSON E J, MATZUK M M. Premature luteinization and cumulus cell defects in ovarian-specific Smad4 knockout mice. Molecular Endocrinology, 2006, 20(6): 1406-1422.
[29] KENT L N, LEONE G. The broken cycle: E2F dysfunction in cancer. Nature Reviews Cancer, 2019, 19(6): 326-338.
[30] HUANG J H, WANG Y N, LIU J L, CHU M, WANG Y D. TFDP3 as E2F unique partner, has crucial roles in cancer cells and testis. Frontiers in Oncology, 2021, 11: 742462.
[31] PHILIPSEN S, SUSKE G. A tale of three fingers: the family of mammalian Sp/XKLF transcription factors. Nucleic Acids Research, 1999, 27(15): 2991-3000.
[32] 姚一龙, 李隐侠, 安外尔·热合曼, 张俊, 孟春花, 王慧利, 钱勇, 曹少先. 湖羊Sp1基因CDS区克隆及其对颗粒细胞增殖和凋亡的影响. 畜牧兽医学报, 2017, 48(11): 2098-2106.
YAO Y L, LI Y X, ANWAIER ·REHEMAN, ZHANG J, MENG C H, WANG H L, QIAN Y, CAO S X. Cloning of Sp1Gene CDS region of hu sheep and its effect on proliferation and apoptosis of granulosa cells. Chinese Journal of Animal and Veterinary Sciences, 2017, 48(11): 2098-2106. (in Chinese)
[33] 张才, 朱仲玲, 阎昭. EP300/CBP在肿瘤中的研究现状和进展. 天津医科大学学报, 2020, 26(5): 502-505.
ZHANG C, ZHU Z L, YAN Z. Research status and progress of EP300/CBP in tumor. Journal of Tianjin Medical University, 2020, 26(5): 502-505. (in Chinese)
[34] MIYAZAWA K, MIYAZONO K. Regulation of TGF-β family signaling by inhibitory smads. Cold Spring Harbor Perspectives in Biology, 2017, 9(3): a022095.
[35] YAN X H, LIAO H W, CHENG M Z, SHI X J, LIN X, FENG X H, CHEN Y G. Smad7 protein interacts with receptor-regulated smads (R-smads) to inhibit transforming growth factor-β (TGF-β)/ smad signaling. Journal of Biological Chemistry, 2016, 291(1): 382-392.
[36] 张亮. miR-21-5p靶向Smad7调控猪卵巢颗粒细胞凋亡的分子机制研究[D]. 合肥: 安徽农业大学, 2019.
ZHANG L. The molecular mechanism of miR-21-5p regulates apoptosis ofcells by targeting Smad7[D]. Hefei: Anhui Agricultural University, 2019. (in Chinese)
[37] ABBAS T, DUTTA A. p21 in cancer: intricate networks and multiple activities. Nature Reviews Cancer, 2009, 9(6): 400-414.
[38] ABBASTABAR M, KHEYROLLAH M, AZIZIAN K, BAGHERLOU N, TEHRANI S S, MANIATI M, KARIMIAN A. Multiple functions of p27 in cell cycle, apoptosis, epigenetic modification and transcriptional regulation for the control of cell growth: a double-edged sword protein. DNA Repair, 2018, 69: 63-72.
[39] MJELLE R, HEGRE S A, AAS P A, SLUPPHAUG G, DRABLØS F, SÆTROM P, KROKAN H E. Cell cycle regulation of human DNA repair and chromatin remodeling genes. DNA Repair, 2015, 30: 53-67.
[40] MANABE N, GOTO Y, MATSUDA-MINEHATA F, INOUE N, MAEDA A, SAKAMAKI K, MIYANO T. Regulation mechanism of selective atresia in porcine follicles: regulation of granulosa cell apoptosis during atresia. The Journal of Reproduction and Development, 2004, 50(5): 493-514.
[41] ZHANG J B, XU Y X, LIU H L, PAN Z X. microRNAs in ovarian follicular atresia and granulosa cell apoptosis. Reproductive Biology and Endocrinology, 2019, 17(1): 9.
[42] CHANG H Y, YANG X. Proteases for cell suicide: functions and regulation of caspases. Microbiology and Molecular Biology Reviews: MMBR, 2000, 64(4): 821-846.
Effects of Smad7-Mediated TGF-β Signaling Pathway on Proliferation of Sheep Granulosa Cells
GUO ZeYuan, DU ZhangSheng, ZHANG YaQi, CHEN ChunLu, MA XiaoYan, CHENG Ying, WANG Kai, LÜ LiHua
College of Animal Science, Shanxi Agricultural University, Taigu 030801, Shanxi
【Background】Follicle development is a complex regulatory process, in which the proliferation and differentiation of ovine follicular granulosa cells (Granulosa Cells, GCs) will directly affect the development of follicles. TGF-β signaling pathway plays an important role in sheep ovarian development and follicle growth, andalso plays an important role as a key inhibitor of TGF-β signaling pathway. 【Objective】In this study, the effect of-mediated TGF-β signaling pathway on the proliferation and apoptosis of ovine follicular GCs was explored to provide a basis for further research on the regulatory role of【Method】20 non-pregnant Jinzhong Duhu hybrid ewes aged 4-6 months were selected. After slaughtering, bilateral ovaries were collected, and GCs were isolated and cultured in vitro. And then,cell and expression localization ofcells was identified by immunofluorescence, the cell proliferation was measured by CCK8 method, and the growth curve was drawn. After the cells were passaged, different concentrations ofagonist Asiaticoside AS (0, 100, 200, 400, 600 ng·mL-1) were added exogenously, and the optimal concentration of AS was selected to treat the second generation GCs. The expression levels of key genes as well as apoptosis and cycle-related genes in the TGF-β signaling pathway were detected using qRT-PCR and Western blotting. Three siSmad7s were synthesized and transfected into follicular GCs, and the one with the best interference effect was selected. The expression levels of key genes in the TGF-β signaling pathway, apoptosis and cycle-related genes were detected by qRT-PCR and Western blotting. 【Result】was expressed in ovine follicular GCs; 200 ng·mL-1AS could significantly up-regulate the expression of<0.01), siSmad7-1 could effectively transfected ovine follicle GCs (<0.01); Up-regulation ofcould significantly increase the expressions of,and<0.05), extremely significantly increase the expression of<0.01), and significantly increase the expression of apoptosis-related gene(<0.05), extremely significantly increased the expressions of apoptosis-related genesand(<0.01), significantly increased the expressions of cell cycle-related genesand(<0.05), extremely significantly increased the expression of cell cycle-related gene(<0.01), while the expression ofwas significantly decreased (<0.05);siRNA significantly decreased the expressions of,and<0.05), extremely significantly decreased the expression of<0.01), and significantly decreased the apoptosis-related gene(<0.05), extremely significantly decreased the expressions of apoptosis-related genesand(<0.01), extremely significantly decreased the expressions of cell cycle-related genes,and(<0.01), extremely significantly increased the expression of(<0.01); CCK8 analysis demonstrated into that whenwas up-regulated, the proliferation rate of GCs was significantly down-regulated at 24 h and 48 h (<0.01).siRNA significantly increased the proliferation rate of GCs at 24 h and 72 h (<0.05), which also extremely significantly increased the proliferation rate of GCs (<0.01).【Conclusion】In summary, it was suggested thatmediated TGF-β signaling pathway to inhibit the proliferation of ovine follicular GCs and to promote cell apoptosis.
asiaticoside (AS); siRNA;; TGF-β signaling pathway; sheep; granulosa cells

10.3864/j.issn.0578-1752.2023.13.013
2022-05-06;
2023-02-13
山西省基础研究计划(20210302123393)、山西省现代农业产业技术体系建设专项资金、大同市重点研发计划(农业,2021027)
郭泽媛,E-mail:gzy15581741973@163.com。通信作者吕丽华,E-mail:lihualvsxau@126.com
(责任编辑 林鉴非)

