巴丹吉林沙漠东南缘沙米群落分布与土壤因子的关系
姜生秀,赵 鹏,徐高兴,段晓峰
(甘肃省治沙研究所,甘肃省荒漠化与风沙灾害防治国家重点实验室,兰州 730070)
植物与土壤相互作用关系是生态学领域研究热点[1]。土壤特性对全球干旱半干旱生态系统的初级生产力具有决定性作用[2]。土壤氮、磷、钾营养元素与荒漠灌木的生存密切相关,进而影响着荒漠化的发展方向[3-4]。土壤养分供应的变化会对草地物种组成、植物多样性和初级生产力产生重要影响[5]。土壤盐度、有机质和钠、钾、磷(Na、K、P)元素浓度是巴基斯坦境内塔尔沙漠植物分布的主导生态因子[6]。美国莫哈维沙漠土壤特性影响着荒漠植物冠层枯梢病的发生[7]。土壤养分和质地共同决定着黑河流域荒漠植物群落的分布格局[8]。巴丹吉林沙漠南缘0-20 cm表层土壤Ba、Ce含量对灌木层植被有显著的影响,同时Ni、Cu含量也显著影响草本层植被[9]。由此可见,土壤特性对荒漠植物的生长与分布具有显著的影响,相关研究可为荒漠植被科学保育提供理论依据[10]。
沙米(Agriophyllumsquarrosum)又名沙蓬,为苋科沙蓬属一年生草本,广泛分布于中亚干旱和半干旱沙漠流动沙丘,生态经济价值显著[11]。随着沙丘流动程度的降低,沙米通过土壤种子库的自我调节适应恶劣风沙环境[12]。沙米种子休眠/萌发受季节降水和土壤温度的调节[13],生长和繁殖力对降雨波动的塑性响应,使其能够适应当前不可预测的环境[14]。沙米种子具有较高的营养价值,可作为未来应对气候变化的潜在可驯化粮食作物[15]。然而,目前土壤特性对沙米群落分布有何影响尚不清楚,制约着沙米的人工驯化栽培。为此,本研究通过对沙米天然群落的野外调查,结合室内分析,运用数量生态学方法,研究了沙米天然群落分布的土壤调控机制,以期为沙米人工驯化栽培提供理论依据。
1 材料和方法
1.1 研究区概况
巴丹吉林沙漠东南缘的民勤绿洲属典型温带大陆性荒漠气候。年降水量为115.41 mm,多集中在每年的7-9月。多年日平均气温7.6 ℃,≥10 ℃积温为3 036.4 ℃,年均日较差15.2 ℃。年均水面蒸发量为2 664.00 mm,无霜期189 d;年平均风速2.5 m/s,年均大风时间25.1 d,西北风为主导风向。植被类型以耐旱小灌木和草本植物为主,有天然种子植物23个科,73个属,123个种[11]。典型植物种有白刺(Nitrariatangutorum)、梭梭(Halxylonammodendron)、多枝柽柳(Tamarixramosissima)、黑果枸杞(Lyciumruthenicum)、盐爪爪(Kalidiumfoliatum)、沙蒿(Artemisiaarenaria)、芦苇(Phragmitesaustralis)、沙蓬(Agriophyllumsquarrosum)、雾冰藜(Bassiadasyphylla)、猪毛菜(Salsolacollina)和碟果虫实(Corispermumpatelliforme)等。
1.2 野外调查
2018年9月,采用样线与样方相结合的方法,在巴丹吉林沙漠东南缘沙米群落典型分布区设置样地8个(图1),每个样地设置10 m×10 m灌木样方8个,同时在每个灌木样方内沿对角线设置3个1 m×1 m的草本样方。共调查灌木样方64个,草本样方192个,统计样方内植物种的种类、个体数、盖度、高度。用GPS记录样地经纬度、海拔。

图1 巴丹吉林沙漠东南缘沙米群落调查样带分布Fig.1 Distribution of investigation transect of A. squarrosum community in southeastern Badain Jaran Desert
1.3 土壤样品采集与分析
每个灌木样方内通过剖面法采集土壤样品,随机取3个重复,采样深度100 cm,分0-5 cm、5-20 cm、20-40 cm、40-60 cm、60-80 cm、80-100 cm共6层。3个重复土壤样品混合均匀后带回实验室,风干、过2 mm的筛去除砾石和其他杂物,进行土壤理化性质测定,取平均值。
参照中华人民共和国农业行业标准NY/T 1121.7-2014土壤检测标准,用电子天平(1/1000 g)称取土样鲜重,置于电热恒温鼓风干燥箱,在105 ℃高温烘干12 h至恒重,待冷却后称其干重。
土壤含水量=(土壤鲜重-土壤干重)/土壤干重×100。
土壤有机质测定采用重铬酸钾容量法;全氮测定采用凯氏法;速效磷测定采用0.5 mol/L碳酸氢钠熔融—钥锑抗比色法;土壤机械组成用马尔文激光粒度仪测定;土壤pH值采用pH计(pHS-3C,雷磁)测定,水土比为5∶1;电导率值采用DDSJ-308电导率仪测定,水土比为5∶1。将0-100 cm土层范围内的每一层土壤样品理化性质分析测定值取平均值代表灌木样方的土壤理化性质。
1.4 数据处理
1.4.1 重要值物种重要值计算采用日本学者沼田真(1979)的计测方法[16],公式为:
重要值=(相对密度+相对频度+相对盖度+相对高度)/4
1.4.2 双向指示种分析双向指示种分析(two-way indicator species analysis,TWINSPAN)采用WinTWINS 2.3软件。
1.4.3 典范对应分析典范对应分析(canoaical correspondence analysis,CCA)采用国际标准生态学软件CANOCO5.0。
2 结果与分析
2.1 群落特征
作为流动沙丘先锋植物,沙米主要分布于半固定、流动沙丘。
由于对风沙环境具有较强的适应能力,沙米与梭梭、白刺、沙拐枣、芦苇等典型荒漠植物混生,形成灌木-草本固沙植被群落。由表1可知,沙米群落共包括植物种21个,苋科植物8个种,禾本科、菊科各3个植物种,柽柳科2个植物种,蒺藜科、豆科、茄科、蓼科和白花丹科各1个植物种。

表1 巴丹吉林沙漠东南缘沙米群落物种重要值Table 1 Species important values of A. squarrosum communities in the southeastern margin of the Badain Jaran Desert
调查群落64个样方中沙米累计重要值最大为1 227.156,其次为梭梭、沙拐枣和白刺,分别为1 198.398、785.052和786.899。
TWINSPAN双向指示种分类第三层分类将沙米群落划分为7个群丛,包括(图2):
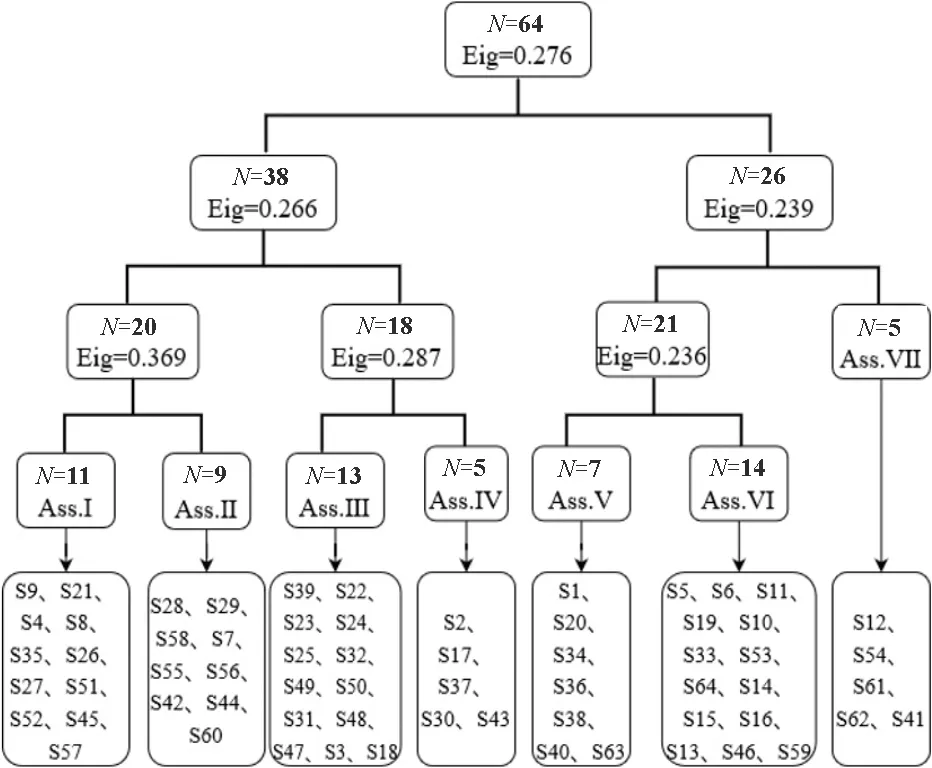
S1-S64为样方号,N表示样方个数,Eig表示特征值,Ass.表示群从,Ⅰ~Ⅻ表示群丛编号。图2 巴丹吉林沙漠东南缘沙米群落的双向指示种分类S1-S64 is the quadrat number, and N is the number of quadrats, Eig represents characteristic values, Ass. represents group slaves, and Ⅰ-Ⅻ represents group number.Fig.2 TWINSPAN classification of A. squarrosum communities in southeastern margin of Badain Jaran Desert
(1)沙米群丛I,群丛盖度12%,包括样方9、21、4、8、35、26、27、51、52、45和57,伴生种有白刺、芦苇、沙拐枣、沙蒿、画眉草、盐生草、黄花补血草、猪毛菜、雾冰藜和碟果虫实。
(2)沙米群丛Ⅱ,群丛盖度15%,包括样方28、29、58、7、55、56、42、44和60,伴生种有白刺、盐生草、柽柳、红砂、猪毛菜、雾冰藜、画眉草、黄花补血草和碟果虫实。
(3)沙米群丛Ⅲ,群丛盖度16%,包括样方39、22、23、24、25、32、49、50、31、47、48、3和18,伴生种有白刺、梭梭、芦苇、沙拐枣、猪毛菜、画眉草、盐生草、雾冰藜、碟果虫实和黄花补血草。
(4)沙米群丛Ⅳ,群丛盖度17%,包括样方2、17、37、30和43,伴生种有白刺、梭梭、沙拐枣、柽柳、红砂、猪毛菜、黄花补血草和雾冰藜。
(5)沙米群丛Ⅴ,群丛盖度13%,包括样方1、20、34、36、38、40和63,伴生种有梭梭、沙拐枣、沙蒿、柽柳、红砂、猪毛菜、黄花补血草和雾冰藜。
(6)沙米群丛Ⅵ,群丛盖度8%,包括样方5、6、11、19、10、33、53、64、14、15、16、13、46和59,伴生种有沙拐枣、梭梭、芦苇、红砂、猪毛菜、黄花补血草和雾冰藜。
(7)沙米群丛Ⅶ,群丛盖度10%,包括样方12、54、61、62和41,伴生种沙拐枣、沙蒿、猪毛菜、盐生草和雾冰藜。
2.2 土壤特性
由表2可知,沙米群丛由Ⅰ到Ⅶ的演变体现了土壤理化因子梯度变化。
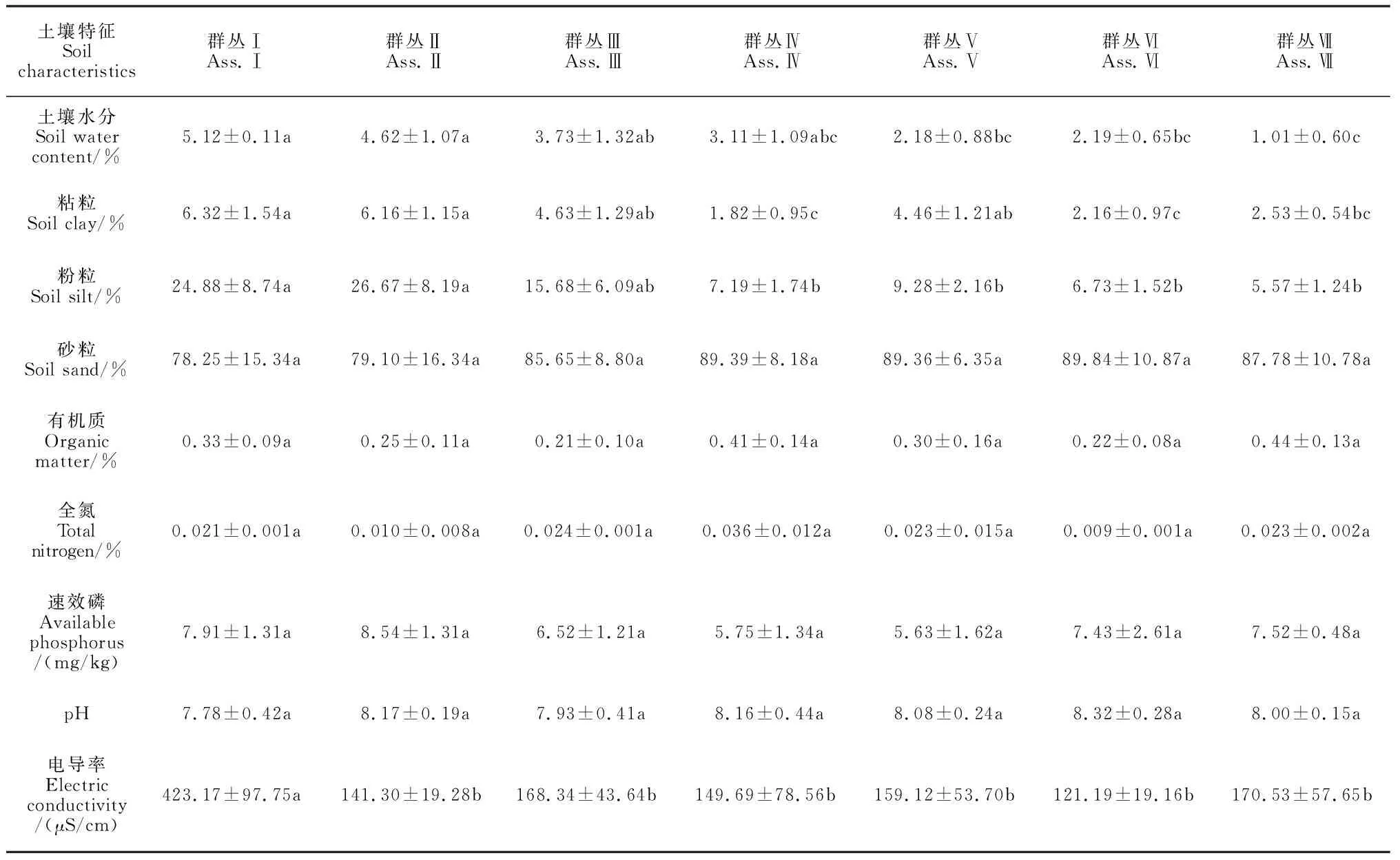
表2 巴丹吉林沙漠东南缘沙米群丛的土壤特性Table 2 Soil characteristics of A. squarrosum communities in the southeastern margin of the Badain Jaran Desert
沙米群落土壤水分介于1.01%~5.12%,群丛Ⅲ土壤含水量最高,为5.12%,显著高于群丛Ⅴ、群丛Ⅵ和群丛Ⅶ(P<0.05)。
粘粒介于1.82%~6.86%,粉粒介于5.57%~26.67%,群丛Ⅰ、群丛Ⅱ粘粒和粉粒均显著高于群丛Ⅳ、群丛Ⅵ和群丛Ⅶ(P<0.05);砂粒含量介于78.25%~89.84%,各群丛之间均无显著性差异(P>0.05)。
各群丛土壤有机质、全氮、速效磷、pH和电导率呈波动变化,有机质介于0.21%~0.44%,全氮介于0.009%~0.036%,速效磷介于5.63~8.54 mg/kg,pH介于7.78~8.32,且各群丛有机质、全氮、速效磷和pH之间均无显著性差异(P>0.05);土壤电导率介于121.19~423.17 μS/cm,群丛Ⅰ显著高于其他群丛(P<0.05)。
2.3 沙米群落CCA排序
通过前项选择消除土壤环境因子共线效应[19]。沙米群落DCA排序轴最大长度为2.30,选择线性模型(RDA)。
但CCA排序法更适合于沙地植被分布格局研究及其环境解释[20]。
CCA排序结果表明,沙米群落总变异方差1.50,土壤因子解释了30.8%的沙米群丛总变差。所有典范排序轴通过统计检验(F=1.6,P=0.006),CCA排序前2轴特征值占总特征值的56.89%,包含了绝大部分信息,故采用前2轴分析沙米群落分布与土壤因子的关系(表3)。

表3 腾格里沙漠东南缘沙米群落的CCA排序Table 3 CCA ordination of A. squarrosum communities in the southeastern margin of the Badain Jaran Desert
沙米群落物种分布与环境因子的关系见图3,土壤水(SW)、有机质(SOM)与CCA第1轴正相关,土壤水分与第1轴负相关,其中全氮与CCA第1轴正相关性最强,表明CCA第1轴代表生境养分的变化梯度。
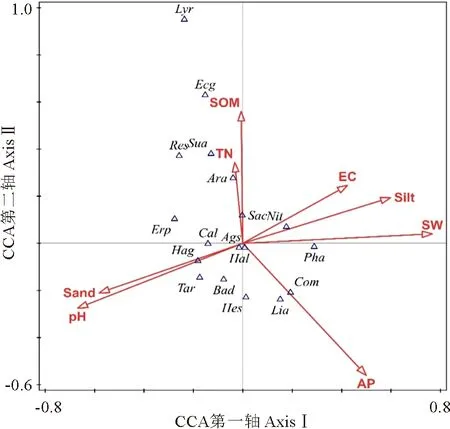
Tar.柽柳;Res.红砂;Hes.花棒;Ags.沙米;Lia.黄花矶松;Bad.五星蒿;Hag.盐生草;Sac.猪毛菜;Erp.画眉草;Pha.芦苇;Com.虫实;Lyr.黑果枸杞;Sua.刺蓬;Ara.沙蒿;Ecg.砂蓝刺头;Cal.沙拐枣;Peh.骆驼蓬;Nit.白刺;Eps.麻黄;Zyo.霸王;Soc.苦豆子;Nsm.沙葱。箭头代表环境因子:SW.土壤水分;Silt.土壤粉粒;EC.电导率;SOM.有机质;TN.全氮;Sand.砂粒;AP.速效磷。图3 腾格里沙漠东南缘沙米群落优势种分布与土壤因子CCA排序图Tar. Tamarix chinensis; Res. Reaumuria songarica; Hes. Hedysarum scoparium; Ags. Agriophyllum squarrosum; Lia. Limonium aureum; Bad. Bassia dasyphylla; Hag. Halogeton glomeratus; Sac. Salsola collina; Erp. Eragrostis pilosa; Pha. Phragmites australis; Com. Corispermum hyssopifolium; Lyr. Lycium ruthenicum; Sua. Salsola ruthenica; Ara. Artemisia desertorum; Ecg. Echinops gmelini; Cal. Calligonum mongolicum; Peh. Peganum harmala; Nit. Nitraria tangutorum; Eps. Ephedra sinica; Zyo. Sarcozygium xanthoxylon; Soc. Sophora alopecuroides; Nsm. Allium mongolicum. Arrow represents environmental factors: SW. Soil moisture, Silt. Oil silt; EC. Electrical conductivity; SOM. Organic matter; TN. Total nitrogen; Sand. Soil sand; Ap. Available phosphorus.Fig.3 CCA ordination diagram of species distribution and soil factors of A. squarrosum communities in the southeastern margin of the Badain Jaran Desert
土壤砂粒含量(Sand)、pH与CCA第2轴负相关,土壤水分、全氮含量与第2轴呈正相关,表明CCA排序第2轴代表生境土壤粒度和水分环境梯度。
红砂、砂蓝刺头、沙葱、麻黄、黑果枸杞分布在全氮和有机质含量较高的生境。沙拐枣等耐旱植物分布在CCA排序第二轴下方,代表土壤砂粒含量较高的流动沙丘生境。白刺、芦苇、苦豆子的分布生境土壤水分条件较好。
沙米群落样方与土壤因子的CCA排序图直观地表现了各群丛类型空间分布与环境因子间的密切关系(图4)。TWINSPAN分类结果在CCA样方-环境因子排序图中聚集显示,沙米群丛类型的空间分布变化基本反映了CCA排序前两轴的环境梯度。
沙米7个群丛类型空间分布既相互独立,又交叉重叠,大致反映了生境土壤养分、水分和砂粒含量的梯度变化。
群丛Ⅰ、群丛Ⅲ主要分布在CCA排序图左上方,生境土壤具有较高的水分、粉粒及电导率,土壤水盐含量较高;群丛Ⅱ在CCA排序图均有分布,分布区域较广。
群丛Ⅵ分布在CCA排序图第一轴左下方,生境土壤砂粒含量较高,多为流动沙丘。
蒙特卡洛检验(Monte Carlo)结果见表4,在边际影响下,环境因子对沙米群落总方差的解释贡献率大小排序为土壤水分(6.8%)>pH(6.7%)>速效磷(5.6%)>土壤粉粒(4.8%)>全氮(4.7%)>土壤砂粒(4.6%)>土壤电导率(4.0%)>有机质(3.6%)。
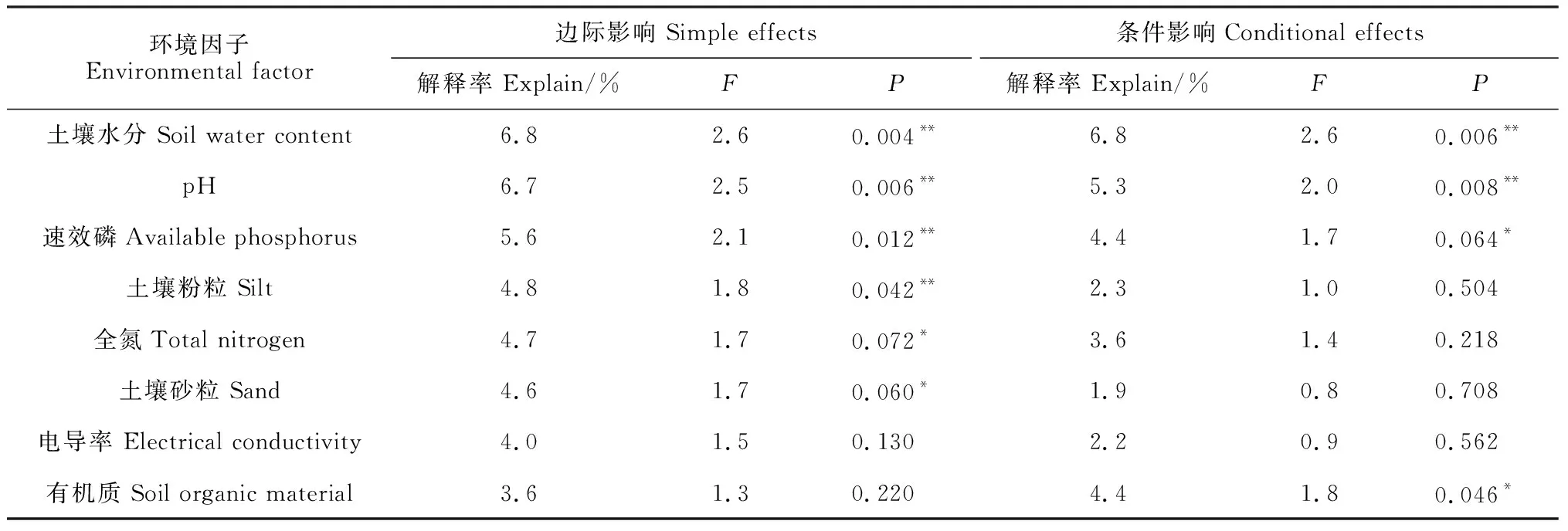
表4 环境因子的蒙特卡洛检验Table 4 Monte Carlo test of environmental factors
土壤环境因子达到显著和极显著水平的有全氮、土壤砂粒(P<0.01),土壤水分、pH、速效磷、土壤粉粒(P<0.05)。
条件影响下,环境因子对沙米群落总方差的解释率大小排序为土壤水分(6.8%)>pH(5.3%)>速效磷(4.4%)>有机质(4.4%)>全氮(3.6%)>土壤粉粒(2.3%)>土壤电导率(2.2%)>土壤砂粒(1.9%)。达到显著和极显著水平的环境因子有土壤速效磷、粉粒、有机质(P<0.01),土壤水分、pH(P<0.05)。其中,pH、土壤水分、有机质、速效磷是沙米群落物种分布最重要的环境因子。
3 讨 论
长期风沙环境下沙米进化出独特多样的生态适应策略。沙米土壤种子库选择在适宜环境条件时快速萌发,提高了幼苗存活机会,以更好适应流沙生境[21]。植冠种子库可减缓季节性干旱、风蚀沙埋等不利环境对种子供应和幼苗生成造成的威胁,提高沙生植物种群更新和定居的成功率[22]。沙米冠层种子库和土壤种子库的风险分散对策能使沙米种群成功地应对不可预测的沙漠环境[23]。沙米种群动态随沙漠生态系统的植被恢复而变化。流动沙丘栽植固沙灌木5年后,沙米种群密度不变,但盖度降低6%。15年后,密度和盖度不足流动沙丘种群的1%。25年后,由于种子库的贫化、表土的改良、生物土壤结皮的形成以及种子萌发的光抑制,沙米种群衰退,逐渐被更稳定的群落替代。沙米种群的衰退过程记录了沙丘生境的改善,可作为荒漠化逆转的指标[24]。本研究沙米分布区土壤水分介于1.01%~5.12%。土壤电导率介于121.19~423.17 μS/cm,全氮介于0.009%~0.036%,速效磷介于5.63~8.54 mg/kg,pH介于7.78~8.32,粘粒介于1.82%~6.86%,粉粒介于5.57%~26.67%,砂粒含量介于78.25%~89.84%。可以看出,沙米能适应贫瘠、干旱及盐碱土壤生境,具有较强的生态适应性。7个沙米群丛类型的演变体现了以土壤水分为主导的土壤因子梯度。
土壤因子通过影响荒漠植物种子萌发、幼苗生长等过程调控物种的分布,但不同荒漠植物的土壤限制因子也不同。土壤物理条件的变化限制了沙拐枣在固定沙丘的克隆繁殖和出苗[25],同时土壤养分也与沙拐枣属不同种果实的大小密切相关[26]。土壤pH和质地是美国西南部索诺兰沙漠植物种分布的重要生态因子[27]。土壤水分、盐分和质地共同影响着黑河下游荒漠植物物种多样性的分布格局[28]。土壤氮和硫含量对艾比湖湿地植物多样性具有显著的正向影响[29]。土壤因子对盐碱地疏叶骆驼刺生长和耐盐性的解释率分别为:钾离子占18.2%,其次是土壤pH 13.1%和土壤全磷11.6%[30]。土壤理化性质pH、电导率对贺兰山低山区种子库物种多样性影响最为显著[31]。青海省大果圆柏林地土壤有机质、全钾含量和pH是影响群落物种多样性的主导因子[32]。骆驼刺幼苗的生物累积、叶片和细根功能性状均受到水氮交互作用的显著影响[33]。减雨施氮提高了短花针茅荒漠草原物种丰富度和优势度指数。增雨施氮处理显著增加了群落地上生物量,有利于降低群落的生态优势度,水分和氮素有互作效应,对群落组成有一定的影响[34]。腾格里沙漠东南缘土壤全氮、有机质及入渗速率决定着草方格内沙米的分布格局[35]。与上述结论一致,本研究发现沙米群落分布的影响因子达到显著和极显著水平的有土壤速效磷、粉粒和有机质(P<0.01),土壤水分、pH(P<0.05)。其中,pH、土壤水分、有机质、速效磷是沙米群落物种分布最重要的环境因子。
4 结 论
巴丹吉林沙漠东南缘沙米7个群丛的演变体现了以土壤水分、pH、速效磷、有机质为主的环境梯度变化。土壤因子解释沙米群落变差的30.8%,各环境因子的解释率大小排序为土壤水分(6.8%)>pH(5.3%)>速效磷(4.4%)>有机质(4.4%)>全氮(3.6%)>土壤粉粒(2.3%)>土壤电导率(2.2%)>土壤砂粒(1.9%)。其中,土壤水分是沙米群落物种分布最重要的环境调控因子,同时在人工栽培过程应注重土壤有机质和速效磷条件的改善与管理。

