基于自主神经系统研究厚朴三物汤调控胃肠动力的作用机制
毛宇东,吴发洪,王满才,魏航之,张 炜,张有成
(兰州大学第二医院,甘肃 兰州 730030)
胃肠动力障碍性疾病(disorder of gastrointestinal motility diseases,DGIMD) 是一类较多见的肌肉运动和神经调节异常性疾病,是多种不同类型的功能性消化疾病如功能性消化不良、特发性肠梗阻、便秘、胃食管反流病、肠易激综合征、胃轻瘫等所具有的共同病理变化[1]。DGIMD 多表现为慢性发病,高龄、生活环境较差、全身或消化道感染、麻醉与手术、精神异常等因素均可作为诱因导致胃肠动力障碍[2]。该病难以完全治愈,给患者的生活带来极大不便。目前临床主要以心理治疗和药物治疗为主,心理治疗往往只对少部分患者有一定疗效。药物治疗主要应用5-HT 受体激动剂、多巴胺受体拮抗剂等促胃肠动力药物,对部分患者有效,但覆盖率往往不足,且可引起患者全身不适、心律失常、致癌等多种不良反应[3-4]。DGIMD 的常见临床表现为易饱及餐后腹胀、腹痛腹胀、便秘,在中医中一般被称为“痞满证”[5]。 厚朴三物汤源自于医圣张仲景所著的《金匮要略》一书,由厚朴、大黄、枳实组成,是治疗“痞满证”的经典方,但其作用机制仍不明确。本研究基于自主神经系统的交感神经系统探讨了DGIMD的发病机制及厚朴三物汤对胃肠动力调控的作用机制。
1 实验材料与方法
1.1动物 雄性SD大鼠40只,体重(220±30)g,购于中国农业科学院兰州兽医研究所,证书编号:SCXK(Gan)2015-0001,购买后于实验室饲养7 d保证其对环境的适应,待其无明显焦躁且体重正常增长至实验要求后进行实验。饲养环境:自由进食进水,温度20~25 ℃,湿度50%~60%,光照明暗交替各12 h。本实验已获兰州大学第二医院动物伦理委员会的审核批准(编号:D2021-337)。
1.2药物 将厚朴、大黄、枳实按8∶4∶3的比例熬制成药液,冷冻干燥得到粉末,产粉率约为25%。所用药物均由德生堂集团有限公司提供,厚朴、大黄、枳实批号依次为20202301,20202808,20200900,药材经由兰州大学第二医院药学部谢明全中药师鉴定,符合2020年版《中华人民共和国药典》相关要求。彼迪盐酸酚苄明片(广东彼迪药业有限公司,国药准字H44021427,规格:10 mg/粒),亚邦盐酸普萘洛尔片(江苏亚邦爱普森药业有限公司,国药准字H32020133,规格:10 mg/粒)。
1.3试剂 去甲肾上腺素转运体(NET)抗体(货号:bs-10186R),肾上腺素能受体β1抗体(货号:bs-20177R),肾上腺素能受体β2抗体(货号:bs-21452R),α1肾上腺素能受体抗体(货号:bs-0600R),α2肾上腺素能受体抗体(货号:bs-1062R),3-磷酸甘油醛脱氢酶抗体(货号:bs-2188R),ECL 超敏发光液(货号:C05-07004),RIPA 裂解液(货号:C5029),SDS-PAGE loading buffer(货号:C05-03001),以上试剂均由Bioss 生物技术有限公司提供;HE 染色试剂盒(货号:G1121),葡聚糖蓝 2000(货号:D-8290),BCA 蛋白定量试剂盒(货号:PC0020),10XTBST溶液(货号:T-1081),Tris(货号:T8060),SDS(货号:S8010),甘氨酸(货号:G8200),蛋白酶磷酸酶抑制剂混合物(货号:P1261),以上试剂均由索莱宝生物科技有限公司提供;大鼠去甲肾上腺素(NE)ELISA 试剂盒(上海通蔚有限公司,TW3989),2 × SYBR Green qPCR Master Mix(武汉赛维尔生物科技有限公司,G3320),SweScript RT I First Strand cDNA Synthesis Kit(武汉赛维尔生物科技有限公司,G3330-50),左旋精氨酸(Sigma公司,V900343),PVDF 膜(美国 Millipore 公司),Western 封闭液(上海碧云天,P0252),DAB 显色试剂盒(上海碧云天,P0203)。
1.4仪器 Mulltiskan FC酶标仪(美国赛默飞世尔仪器有限公司);leica EM UC7超薄切片机(德国徕卡公司);BX53+DP74正置荧光显微镜(日本奥林巴斯);紫外分光光度计(日本岛津公司);PH仪(上海雷磁仪器有限公司);SCIENTZ-10ND真空冷冻干燥机(宁波新芝生物科技股份有限公司);电泳仪(美国 Bio-rad PowerPac);化学发光荧光成像分析系统(北京赛智创业科技有限公司);电动组织研磨仪(海德创业生物科技有限公司);QIAGEN Rotor-Gene Q实时荧光定量PCR仪(美国 Bio-rad PowerPac);Thermo Fisher SlimpAmp普通PCR仪(美国赛默飞世尔仪器有限公司);Thermo Fisher Nanodrop2000微量核酸检测仪(美国赛默飞世尔仪器有限公司)。
1.5实验方法 将40只适应1周的雄性SD大鼠按计算机数字随机法分为5组,每组8只。参考文献[6]方法,模型组、厚朴三物汤组、α受体抑制剂组、β受体抑制剂组均第1天腹腔注射20%左旋精氨酸溶液5.2 g/kg,后4 d腹腔注射20%左旋精氨酸溶液2.6 g/kg,对照组注射等体积生理盐水。第6天开始,厚朴三物汤组给予厚朴三物汤4.725 g(生药)/(kg·d)[厚朴三物汤人临床剂量为45 g/d,按220 g大鼠和60 kg成人进行体表面积换算,换算为厚朴三物汤粉末约为1.2 g/(kg·d)]灌胃,α受体抑制剂组给予酚苄明2.1 mg/(kg·d)灌胃[剂量逐渐增至4.2 mg/(kg·d)],β受体抑制剂组给予普萘洛尔2.1 mg/(kg·d)灌胃[剂量逐渐增至8.4 mg/(kg·d)],对照组与模型组给予等体积生理盐水灌胃,均每日2次,灌胃7 d。
1.6标本采集 灌胃7 d后,各组大鼠禁食不禁水24 h,戊巴比妥钠腹腔注射麻醉后剖开腹腔,于下腔静脉取血,血液样本3 000 r/min低温离心10 min后置于-80 ℃冰箱备用。超净工作台上,用预冷的PBS液行心脏灌注冲净组织内部血液,取大鼠胃、空肠、结肠,部分置于冻存管置于-80 ℃冰箱备用,部分用4%多聚甲醛固定。
1.7检测指标及方法
1.7.1小肠推进率与胃排空率 大鼠麻醉前逐个灌胃给予0.4 mL 2%蓝色葡聚糖2000,取材时自胃上端食管与直肠末端肛门处将胃肠道组织整个分离,去除粘连韧带,动作轻柔避免拉扯,平铺于手术垫巾,卷尺测量幽门括约肌至蓝色葡聚糖2000到达小肠最前端的距离及完整小肠的长度,两者距离的比值为小肠推进率。测量结束后将胃剪开,胃及胃内容物放入有4 mL超纯水的玻璃皿中,将色素充分溶于水中,将溶液转移入离心管内,以3 500 r/min速度离心15 min,取上清液于紫外可见分光光度计所配备的比色皿中,波长设为620 nm,测量其Abs值,取此值为该鼠胃色素残留值;取一支新离心管,加入2%蓝色葡聚糖2000溶液4 mL相同操作作为标准管色素Abs值,计算胃排空率。胃排空率=(1-胃残留色素Abs值/标准管色素Abs值)×100%。
1.7.2胃、空肠、结肠组织病理形态 取4%多聚甲醛固定的部分胃、空肠、结肠组织,经石蜡包埋、切片、脱蜡、梯度乙醇水化后进行HE染色,于光学显微镜下观察。
1.7.3血及胃、空肠、结肠组织中NE含量 取-80 ℃冰箱备用的血液,按试剂盒说明书,采用ELISA法检测NE含量;取部分胃、空肠、结肠组织,液氮下研磨,溶于生理盐水后3 000 r/min低温离心10 min,取上清液,采用ELISA法检测各组织中NE含量。
1.7.4胃、空肠、结肠组织中NET mRNA表达情况取出-80 ℃保存的胃、空肠、结肠组织,按照总RNA提取试剂盒与反转录试剂盒说明书的步骤提取总RNA及反转录合成cDNA。取所得到的cDNA,采用Real-time PCR试剂盒进行检测。各组均以GAPDH基因为内参,单孔扩增单基因对胃、空肠、结肠组织中NET mRNA进行PCR扩增反应。扩增反应条件为95 ℃条件下30 s预变性,95 ℃条件下15 s变性、60 ℃条件下30 s退火,40个循环,72 ℃条件下30 s扩增。检测目的基因每种样本做3次复孔。用2-ΔΔCt法分析目的基因相对表达量,各引物由武汉赛维尔生物科技有限公司合成。NET上游引物序列为5’-ACTTTGTCCTCTTTGTGCTCCTG-3’,下游引物序列为5’-GATCCATACCGTTGGCCTCCT-3’,长度为122 bp;GAPDH上游引物序列为5’-TTTGAGGGTGCAGCGAACTT-3’,下游引物序列为5’-ACAGCAACAGGGTGGTGGAC-3’,长度为142 bp。
1.7.5胃、空肠、结肠组织中NET蛋白表达情况 采用Western blot法检测:取出-80 ℃保存的胃、空肠、结肠组织,加入酶抑制剂混合物提取组织总蛋白,BCA法测定蛋白浓度,取总蛋白50 μg上样,进行十二烷基硫酸钠-聚丙烯氨酰凝胶电泳(10%浓度分离胶,80 V,30 min+100 V,50 min),低温下100 V转膜90 min后,5%脱脂奶粉封闭处理1 h,加入NET抗体(1∶1 500)、GAPDH一抗(1∶3 500),4 ℃孵育过夜,次日TBST洗膜5 min×4次后室温孵育二抗(1∶5 000)1 h,ECL超敏发光液浸泡后于凝胶成像系统成像,Image J分析蛋白条带灰度值,蛋白表达水平用目的蛋白与内参蛋白灰度值比值表示。
1.7.6胃、空肠、结肠组织中α型和β型肾上腺素能受体(α1、α2、β1、β2受体)表达情况 采用免疫组织化学法检测:石蜡切片脱蜡与复水,抗原修复,内源性过氧化物酶阻断,封闭后滴加一抗(1∶300),4 ℃湿盒中孵育过夜,辣根过氧化物酶标记二抗(1∶200),37 ℃恒温箱内孵育50 min,DAB显色剂处理5 min,苏木素复染3 min,脱水封片,镜下观察结果(×200),记录平均光密度值。

2 结 果
2.1各组大鼠小肠推进率与胃排空率比较 模型组小肠推进率与胃排空率均明显低于对照组(P均<0.05);厚朴三物汤组及α受体抑制剂组小肠推进率与胃排空率均明显高于模型组(P均<0.05);β受体抑制剂组小肠推进率与胃排空率均明显低于其他4组(P均<0.05)。见图1。

图1 对照组和胃肠动力障碍性疾病各组大鼠小肠推进率与胃排空率
2.2各组大鼠胃、空肠、结肠组织病理形态 各组大鼠胃、空肠、结肠组织解剖结构基本完整,黏膜层、黏膜下层、肌层、浆膜层未见明显损伤,腺体及肠绒毛完整,细胞结构完整,分布整齐,胞核清晰,胞质丰富,细胞间质匀称,未见炎性细胞浸润。见图2。

图2 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织HE染色表现
2.3各组大鼠血及胃、空肠、结肠组织中NE含量比较 模型组大鼠血及胃、空肠、结肠组织中NE含量均明显高于对照组(P均<0.05),各药物组大鼠血及胃、空肠、结肠组织中NE含量均明显低于模型组(P均<0.05),厚朴三物汤组大鼠血及胃、空肠、结肠组织中NE含量均明显高于α受体抑制剂组和β受体抑制剂组(P均<0.05)。见表1。
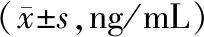
表1 对照组和胃肠动力障碍性疾病各组大鼠血及胃、空肠、结肠组织中去甲肾上腺素含量
2.4各组大鼠胃、空肠、结肠组织中NET mRNA相对表达量比较 模型组大鼠胃、空肠、结肠组织中NET mRNA相对表达量均明显低于对照组(P均<0.05);厚朴三物汤组、α受体抑制剂组大鼠胃、空肠、结肠组织中NET mRNA相对表达量均明显高于模型组(P均<0.05);β受体抑制剂组大鼠胃、结肠组织中NET mRNA相对表达量均明显高于模型组(P均<0.05),空肠组织中NET mRNA相对表达量明显低于模型组(P<0.05);厚朴三物汤组大鼠胃、空肠组织中NET mRNA相对表达量均明显低于α受体抑制剂组而明显高于β受体抑制剂组(P均<0.05)。见表2。
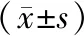
表2 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中NET mRNA相对表达量比较
2.5各组大鼠胃、空肠、结肠组织中NET蛋白表达情况比较 与对照组比较,模型组大鼠胃、结肠组织中NET蛋白相对表达量明显增高(P<0.05),空肠组织中NET蛋白相对表达量明显降低(P<0.05);与模型组比较,各药物组大鼠胃、结肠组织中NET蛋白相对表达量均明显降低(P均<0.05),空肠组织中NET蛋白相对表达量均明显增高(P均<0.05);厚朴三物汤组大鼠胃组织中NET蛋白相对表达量均明显高于α受体抑制剂组和β受体抑制剂组(P均<0.05),结肠和空肠组织中NET蛋白相对表达量均明显低于α受体抑制剂组和β受体抑制剂组(P均<0.05)。见图3及表3。
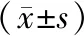
表3 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中NET蛋白相对表达量比较

图3 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中NET蛋白表达情况
2.6各组大鼠胃、空肠、结肠组织中α1受体蛋白表达情况比较 各组大鼠胃组织中α1受体蛋白阳性表达平均光密度值比较差异均无统计学意义(P均>0.05)。与对照组比较,模型组大鼠空肠组织中α1受体蛋白阳性表达平均光密度值明显降低(P<0.05),结肠组织中α1受体蛋白阳性表达平均光密度值明显增高(P<0.05);与模型组比较,厚朴三物汤组和α受体抑制剂组大鼠空肠组织中α1受体蛋白阳性表达平均光密度值均明显增高(P均<0.05),结肠组织中α1受体蛋白阳性表达平均光密度值均明显降低(P均<0.05);且厚朴三物汤组大鼠结肠组织中α1受体蛋白阳性表达平均光密度值明显低于α受体抑制剂组(P<0.05)。见图4及表4。
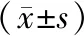
表4 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中α1受体蛋白阳性表达平均光密度值比较
2.7各组大鼠胃、空肠、结肠中α2受体蛋白表达情况比较 与对照组比较,模型组大鼠胃、结肠组织中α2受体蛋白阳性表达平均光密度值均明显增高(P均<0.05),空肠组织中α2受体蛋白阳性表达平均光密度值明显降低(P<0.05);与模型组比较,厚朴三物汤组和α受体抑制剂组大鼠胃组织中α2受体蛋白阳性表达平均光密度值均明显降低(P均<0.05),空肠、结肠组织中均无明显变化(P均>0.05)。见图5及表5。
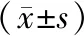
表5 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中α2受体蛋白阳性表达平均光密度值比较

图5 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中α2受体蛋白阳性表达情况(免疫组化染色,×20)
2.8各组大鼠胃、空肠、结肠组织中β1受体蛋白表达情况比较 与对照组比较,模型组大鼠胃、结肠组织中β1受体蛋白阳性表达平均光密度值均明显增高(P均<0.05),空肠组织中β1受体蛋白阳性表达平均光密度值明显降低(P<0.05);与模型组比较,厚朴三物汤组大鼠胃、结肠组织中和β受体抑制剂组大鼠胃组织中β1受体蛋白阳性表达平均光密度值均无明显变化(P均>0.05),空肠组织中β1受体蛋白阳性表达平均光密度值均明显增高(P均<0.05);厚朴三物汤组大鼠胃组织中β1受体蛋白阳性表达平均光密度值明显低于β受体抑制剂组而结肠组织中β1受体蛋白阳性表达平均光密度值明显高于β受体抑制剂组(P均<0.05)。见图6及表6。
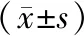
表6 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中β1受体蛋白阳性表达平均光密度值比较

图6 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中β1受体蛋白阳性表达情况(免疫组化染色,×20)
2.9各组大鼠胃、空肠、结肠组织中β2受体蛋白表达情况比较 与对照组比较,模型组大鼠胃、空肠组织中β2受体蛋白阳性表达平均光密度值均明显增高(P均<0.05),结肠组织中无明显变化(P>0.05);与模型组比较,厚朴三物汤组和β受体抑制剂组大鼠胃组织中β2受体蛋白阳性表达平均光密度值均明显降低(P均<0.05),结肠组织中β2受体蛋白阳性表达平均光密度值均明显增高(P均<0.05),空肠组织中β2受体蛋白阳性表达平均光密度值厚朴三物汤组大鼠明显增高而β受体抑制剂组大鼠明显降低(P均<0.05);厚朴三物汤组大鼠空肠组织中β2受体蛋白阳性表达平均光密度值明显高于β受体抑制剂组(P<0.05)。见图7及表7。
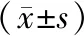
表7 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中β2受体蛋白阳性表达平均光密度值比较

图7 对照组和胃肠动力障碍性疾病各组大鼠胃、空肠、结肠组织中β2受体蛋白阳性表达情况(免疫组化染色,×20)
3 讨 论
自主神经系统中的交感神经系统和副交感神经系统在作用机制上常互相拮抗,应激会抑制迷走神经转而刺激交感神经系统[7],导致自主神经系统的平衡被打破,如克罗恩病患者交感神经活动会减弱[8],溃疡性结肠炎患者常出现迷走神经功能障碍[9]。肠应激综合征患者的中枢感觉过程发生相应改变[10],这被称为中枢敏化综合征[11-12],是一种自主神经障碍,它是脑-肠功能障碍的标志,其表现为低副交感神经张力和高交感神经张力,并且与消极或积极的情感调节无关[13]。术后肠梗阻(胃排空的延迟以及肠运输时间延长)亦属于胃肠动力障碍的一种[14],胃与小肠功能一般在24~48 h内基本恢复正常,而结肠往往需要更长的时间(最多可达72 h),而胃肠动力完全恢复至正常状态则需要更久,在这一过程中,交感肾上腺素能和迷走神经非肾上腺素能抑制传出通路起着至关重要的作用[15]。大多数功能性消化不良患者的副交感神经系统活动减弱,大约一半交感神经系统活动增强,并且这种表现在白天比在夜间更明显[16]。还有研究表明,在肠道水平切断迷走神经对实验诱导的结肠炎没有影响,而交感神经切断术或合并迷走神经切断术使结肠炎的临床参数恶化[17]。α2肾上腺素能受体激活可加速急性结肠炎的进展,而β3肾上腺素能受体激活可改善实验性结肠炎,用受体激动剂或神经刺激局部激活肠内β2肾上腺素能受体可能对炎症性肠病患者有益[18]。另外交感-肾上腺髓质轴(SAM轴)的激活是炎症应激源和心理的共同因素,急性应激使机体有准备的应对外界刺激,但如果外界压力是持续的或严重的,压力调节就会走向失衡,甚至可以改变目标基因的表达,从而导致持续的器官功能障碍,这亦可能会造成相应胃肠消化道炎症及损伤[19],并导致胃肠动力障碍。
NE是由脑中交感节后神经元和肾上腺素能神经末梢共同分泌合成的儿茶酚胺物质,它即负责交感节后神经元传递信息,同时又由肾上腺髓质产生,作用于全身产生不同效用,其微量但高效。肾上腺素能受体与NE结合后发挥抗炎与促炎的双重作用,其中NE作用于单核细胞的β2肾上腺素能受体产生抗炎效果,作用于α肾上腺素能受体产生促炎效果[20]。从定义方面NE可以分为周围型和中枢型,血浆中NE含量是直接体现交感神经功能的有效且敏感的指标。NET是能转运神经递质的一种单胺类转运蛋白, 属于溶质转运蛋白转运体家族,其主要负责NE的再摄取,这是释放NE失活的主要机制[21],对维持突触内稳态很重要。NET是去甲肾上腺素能神经元的标志性蛋白,交感神经细胞是NET的主要来源,它们的轴突投射到肠道,因此NET在决定交感神经胃肠道分布方面起着重要作用[22-24]。Song等[24]研究表明,功能性消化不良大鼠胃体肌层的肾上腺素能反应性增强,NE含量升高,NET和β1肾上腺素受体、β2肾上腺素受体表达上调。
厚朴三物汤以厚朴行气消满,枳实、大黄导滞泻热。课题组前期实验发现厚朴三物汤对胃肠动力的促进作用可能是由自主神经系统的多种神经递质与受体共同作用完成的,并且可在一定程度上影响消化液的分泌量[25]。本实验发现,与对照组比较,模型组大鼠的胃排空率、小肠推进率均降低;血及胃、空肠、结肠组织中NE含量升高;胃、空肠、结肠组织中NET mRNA表达量和空肠组织中NET蛋白相对表达量降低,胃、结肠组织中NET蛋白相对表达量升高;结肠组织中α1、α2、β1受体蛋白阳性表达平均光密度值,胃组织中α2、β1、β2受体蛋白阳性表达平均光密度值,空肠组织中β2受体蛋白阳性表达平均光密度值均明显增高;空肠组织中α1、α2、β1受体蛋白阳性表达平均光密度值均明显降低。与模型组比较,厚朴三物汤组小肠推进率与胃排空率均增高;血及胃、空肠、结肠组织中NE含量均降低;胃、空肠、结肠组织中NET mRNA表达量和空肠组织中NET蛋白相对表达量均升高,胃、结肠组织中NET蛋白相对表达量降低;结肠组织中α1受体蛋白和胃组织中α2、β2受体蛋白阳性表达平均光密度值均明显降低,空肠组织中α1、β1、β2受体蛋白和结肠组织中β2受体蛋白阳性表达平均光密度值均明显增高。由于交感神经系统具有在环境急剧变化时保证正常生理状态的能力,其相关基因的表达量随时间的变化波动明显,存在明显的峰值和谷值,胃肠动力障碍大鼠NET mRNA表达量在应急初期短时间内表达上调,并随着造模应激源的消失与体内的负反馈效应开始迅速降解以防止过度应激对组织造成损伤,且应激越剧烈相应的负反馈也往往越强,mRNA在应激过后迅速下降,但蛋白降解速度往往较慢,维持了相对长时间的上调,故NET蛋白和mRNA表达不一致。
综上所述, NET蛋白和α2、β1、β2受体蛋白高表达及NE在胃肠道局部组织与外周血的高含量是导致胃肠动力障碍的重要原因;厚朴三物汤在胃与结肠局部可能有着类似于α2受体抑制剂的效果,下调NET蛋白和α2、β1、β2受体蛋白表达及降低胃肠道局部组织与外周血中NE含量可能是其有效治疗DGIMD的原因。除此以外,研究还发现空肠在机制调节上与胃、结肠不同,具体原因有待进一步明确。厚朴三物汤由3味药物熬制而成,作用靶点多样,各成分在调节胃肠动力中的作用仍需进一步探索,其对脑肠轴中枢神经系统的影响有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。

