梅花鹿活体麻醉采血试验研究
●崔鹤馨 田来明 尚丽元 孙兴忠 刘沂霖 苑冬梅 呼延含蓉 陈 琦 李 男 付晓霞
(1.吉林省畜牧兽医科学研究院 吉林 长春 130021;2.吉林省动物疫病预防控制中心 吉林 长春 130021;3.长春市农业科学院 吉林 长春 130111)
梅花鹿是珍贵的国家一级保护动物,不仅具有极高的经济价值和观赏价值,其营养价值和药用价值也备受关注。近年来人们对鹿血制品的研发较为活跃,以鹿血为原料的药品和保健品种类众多[1]。鹿血自古以来被视为滋补上品,其营养成分和药理作用与鹿茸大同小异[2],但更趋于广谱性。现代临床及动物实验均证明,鹿血具有增强免疫功能、抗疲劳、抗辐射、治疗贫血、改善性功能、促进伤口愈合等多种功效[3]。生产用鹿血主要依靠锯茸和屠宰鹿只时获取,采集时间和采集量严格受限,导致鹿血资源匮乏,价格昂贵。梅花鹿活体采血是解决生产中鹿血可持续采集利用的有效途径,对其开展试验研究,为科学合理地进行活体采血提供技术依据。
1 材料与方法
1.1 试验动物 梅花鹿由吉林省博文鹿业良种繁育有限公司提供。选择公鹿3头,年龄2~7锯,平均体重(100±0.5) kg;选择母鹿3头,2~6产,平均体重(75±0.5) kg。健康无病,营养均衡,精神状态良好。
1.2 试验药品 麻药眠乃灵、解药苏醒灵均购自吉林省华牧动物保健品有限公司。
1.3 试验方法
1.3.1 试验设计 公鹿和母鹿各1组,公鹿组采血量600 mL/头,母鹿组采血量500 mL/头。
1.3.2 血液采集和保存 按每100 kg体重用麻药0.1~0.3 mL的标准,以麻醉枪或吹管方法将药液直接注入梅花鹿肌肉,麻醉后使其侧躺,观察心跳、呼吸及眼球转动是否正常。应用16~20#针在鹿只的颈静脉或胫前静脉处采血,无菌收集血液于预先注入枸橼酸钠抗凝剂的采血袋。采血完成后,立即给鹿只补充等量的5%~10%葡萄糖水或生理盐水。待鹿苏醒,自行站起,方可离开采血地点。血液短期低温保存,长期需冷冻保存,防止腐败变质。
1.3.3 采血前后血液指标的测定 采血当日计为0 d,于采血后0,10,20,30,40 d,采用日本Sysmex 公司的F820血球计数仪分别测定鹿血液的红细胞数(RBC)、红细胞压积(HCT)和血红蛋白(HGB)。以梅花鹿采血0 d的各血项指标的平均值作对照。
2 结果与分析
2.1 公鹿活体采血不同时间血液指标及恢复情况
表1为成年公鹿血液正常指标,平均红细胞数(RBC)8.39×1012/L、红细胞压积(HCT)0.461、血红蛋白(HGB)123 g/L。表2为公鹿采血后10,20,30,40 d血液指标,发现成年公鹿采血30 d后机体基本恢复至采血前水平,红细胞数(RBC)恢复至99.1%,红细胞压积(HCT)恢复至100.6%,血红蛋白(HGB)恢复至100.9%;采血40 d后红细胞数(RBC)恢复至采血前的101.5%,红细胞压积(HCT)恢复至104.6%,血红蛋白(HGB)恢复至102.7%,均超过采血前机体水平。
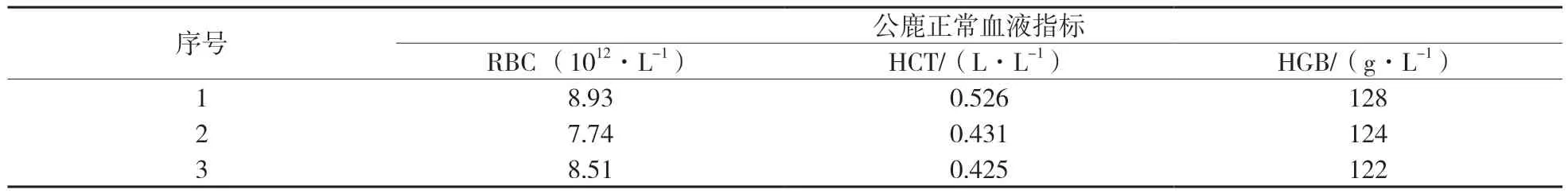
表1 公鹿活体采血正常血液指标

表2 公鹿活体采血后不同时间血液指标及恢复情况
2.2 母鹿活体采血不同时间血液指标及恢复情况
表3为成年母鹿血液正常指标,平均红细胞数(RBC)8.01×1012/L、红细胞压积(HCT)0.443、血红蛋白(HGB)126 g/L。表4为母鹿采血后10,20,30,40 d血液指标,发现成年母鹿采血30 d后机体基本恢复至采血前水平,红细胞数(RBC)恢复至98.8%,红细胞压积(HCT)恢复至102.5%,血红蛋白(HGB)恢复至100.8%,红细胞数(RBC)基本恢复至采血前水平,红细胞压积(HCT)和血红蛋白(HB)均超过采血前水平;采血40 d后红细胞数(RBC)恢复至采血前的103.7%,红细胞压积(HCT)恢复至105.2%,血红蛋白(HB)恢复至103.2%,均超过采血前机体水平。
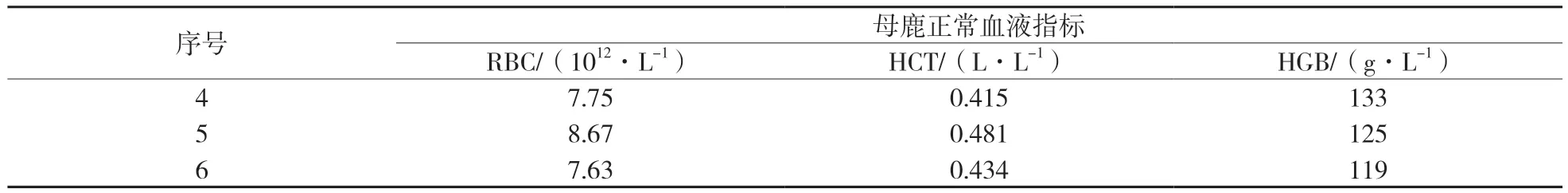
表3 母鹿活体采血正常血液指标

表4 母鹿活体采血后不同时间血液指标及恢复情况
3 讨论
3.1 采血量的确定
梅花鹿活体采血量取决于体循环中的血液总量,即血液总量越大,活体采血量就越大,一次性采血量达到20%就可导致梅花鹿出现生理应激、休克甚至死亡。清华大学实验动物中心的动物采血基本原则规定,动物血液收集的单次最大量不能超过动物全身血液总量的10%。一般动物的血液量占活体体重的7%~8%,张建波等[4]通过屠宰鹿只取血量的统计,得出公鹿血量为其体重的8.57%~9.17%,母鹿血量为其体重的7.5%~8.75%,略高于平均数据,这可能与梅花鹿年龄、体重、性别、健康、营养状况、放血方式不同有关。为了动物健康考虑,采血量应该选取推荐量的下限,因此本研究按照血量占比体重7%计算:公鹿平均体重100 kg/头,单次最大采血量600 mL/头;母鹿平均体重75 kg/头,单次最大采血量500 mL/头。
3.2 采血间隔时间的确定
对梅花鹿进行活体采血,除血容量减少,血液中的红细胞数、血红蛋白量和红细胞压积也会发生相应的变化,血液指标能客观反映机体的健康水平。张建波等[4]认为一次性采血600 mL/头,间歇期15 d对产茸量、机体的食欲精神均无影响。一般采血后失去的水分和无机盐2 h内可得以恢复,蛋白质、白细胞和血小板3 d内也可恢复,恢复较慢的是红细胞,因此采血间隔时间主要取决于红细胞更新率,即红细胞更新越快,采血间隔时间越短。赵宝华等[5]报道梅花鹿一次性采血200~250 mL/头后,需间隔30 d,血项指标得以恢复。李树明等[6]报道对梅花鹿一次性采血500 mL/头后血液生理生化各指标显著下降,40~50 d后基本恢复至采血前正常水平。本研究分别对公鹿一次性采血600 mL/头、母鹿一次性采血500 mL/头后,对不同时间的红细胞数(RBC)、红细胞压积(HCT)和血红蛋白(HGB)进行测定,发现30 d后机体基本恢复至采血前水平,与上述报道结果存在差异,这可能与个体差异和营养水平有关。
3.3 采血后的营养供给
采血后为尽快恢复梅花鹿机体水平,不影响其生长性能,应及时补充水分,加强蛋白质、维生素、无机盐、微量元素(铁、铜、锌等)和叶酸等的摄入量。采血后,鹿只饲料中的蛋白质占比应提升5%,同时每头鹿每天饲喂0.1 kg豆浆,食盐量比平时高5 g,维生素和微量元素比平时量提高1%。
3.4 注意事项
出现麻醉过敏时,应停止采血,按麻醉药品说明书剂量注射苏醒药并同时肌注肾上腺素;采血过程中,速度不宜过快,剂量不宜过大,当出现异常时,如鹿只呼吸急促、心跳加速或眼球转动加快等,应停止采血并马上注射苏醒药和肾上腺素;若采血造成采血部位肿胀,应及时处理消肿散瘀;采用麻醉保定方式采血的鹿只苏醒后不应立即采食,应隔顿饲喂;麻醉后出现鹿只不采食现象,应驱赶其加强运动,同时注射促消化药物。
4 结论
梅花鹿公鹿每次采血量按≤6 mL/kg·bw,母鹿每次采血量按体重≤6.67 mL/kg·bw计算,两次采血至少间隔30 d,可维持梅花鹿活体正常机能。

