1例3D打印技术辅助手术治疗成人巨大纵隔淋巴管瘤的病例报告
覃 健 龙小毛 蒋 伟 韦海明
(广西壮族自治区人民医院心胸血管外科,广西南宁市 530021)
淋巴管瘤属于相对少见的淋巴管源性非真性肿瘤,是起源于间胚叶组织的一种良性肿瘤,常见于儿童时期,全身各组织器官均可发病,多发于颈部及腋窝,发病与人体淋巴组织分布相关,有向轴性分布的特点[1]。目前淋巴管瘤的病因尚未完全明确,多数学者认为其是淋巴管先天发育畸形或者某些原因引起发病部位淋巴液排出障碍造成淋巴液潴留导致淋巴管扩张、增生而形成[2-4]。研究表明,纵隔淋巴管瘤占纵隔肿瘤的0.7%~4.5%[5],传统的影像学方法难以完全了解其解剖结构,而3D打印技术可以提供完整的三维图像,医生可以从多层次、多方位的角度对病灶区域进行详细的观察,弥补传统影像学诊断方法的不足,提高诊断的准确性。本文回顾性分析在3D打印技术辅助下治疗的1例巨大淋巴管瘤患者的临床资料,为临床治疗该类患者提供参考。
1 病例资料
患者男性,47岁,因自觉发现左侧胸部肿块3月于2021年8月6日入住我院。患者3个月前自觉发现左侧胸壁隆起肿块,直径约5 cm,无压痛,伴咳嗽,无胸闷、气促、呼吸困难、咳痰、咯血、午后发热、盗汗等不适。患者30余年前有颈部淋巴管瘤切除史(具体不详)。入院时体格检查:全身浅表淋巴结未触及肿大。左侧锁骨上窝可见约3 cm陈旧性瘢痕,气管居中,甲状腺视诊及触诊无明显异常。胸廓双侧对称,左侧胸壁可见大小约4 cm×5 cm肿物,质软,边界清晰,无粘连,无压痛,余查体无特殊。血常规检查提示白细胞计数为5.61×109/L,红细胞计数为5.40×1012/L,血红蛋白水平为171 g/L。肝肾功能、凝血功能、乙肝及免疫四项等检查未见明显异常。胸部增强CT扫描可见前纵隔、左前上胸壁、左侧乳腺、腋窝有巨大囊性占位,CT值约18 Hu,较大横截面范围约26.0 cm×11.6 cm,边界清,病灶内部增强CT扫描未见强化,部分病灶周边似强化,病灶包绕心脏大血管,两肺受压体积缩小,右肺中叶支气管受压变窄,提示:(1)前纵隔、左前上胸壁、左侧乳腺、腋窝囊性占位、脾脏多发囊性占位;淋巴管瘤?(2)左肺下叶外基底段炎性结节可能性大。(3)右肺、左肺上叶下舌段纤维性病灶。(4)心包少量积液。见图1。
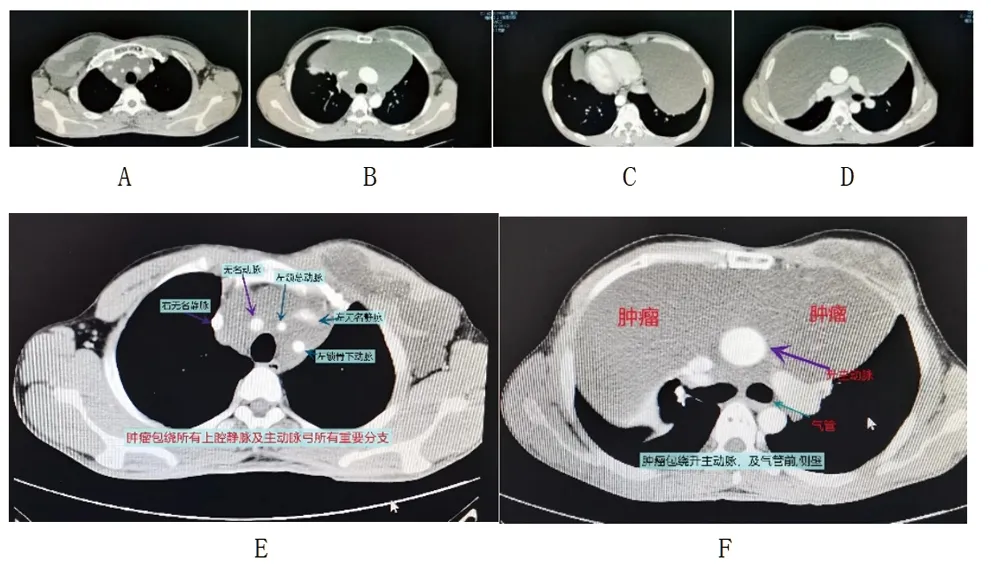
图1 患者胸部增强CT扫描结果
将患者DICOM格式的胸部增强CT图像数据导入珠海赛纳三维科技有限公司研发的Sailner J401 Pro型仪器,自动生成三维虚拟图像,包括处理后的三维动画、肺内血管分布模式图、虚拟肺段划分模式图,以及详细的肺段(包括亚段)及病灶量化体积数据。3D打印技术结果提示:肿瘤位置与纵隔内血管的相互关系极为复杂,肿瘤上部包裹升主动脉、主动脉弓、无名动脉、左颈总动脉、左锁骨下动脉、上腔静脉及左无名静脉,瘤体沿组织间隙向下生长,向左包裹部分心包并压迫左肺,向右贴着心包与胸膜间隙向下生长,压迫右肺与膈肌,与心包、胸膜、气管前壁等组织关系密切。见图2。
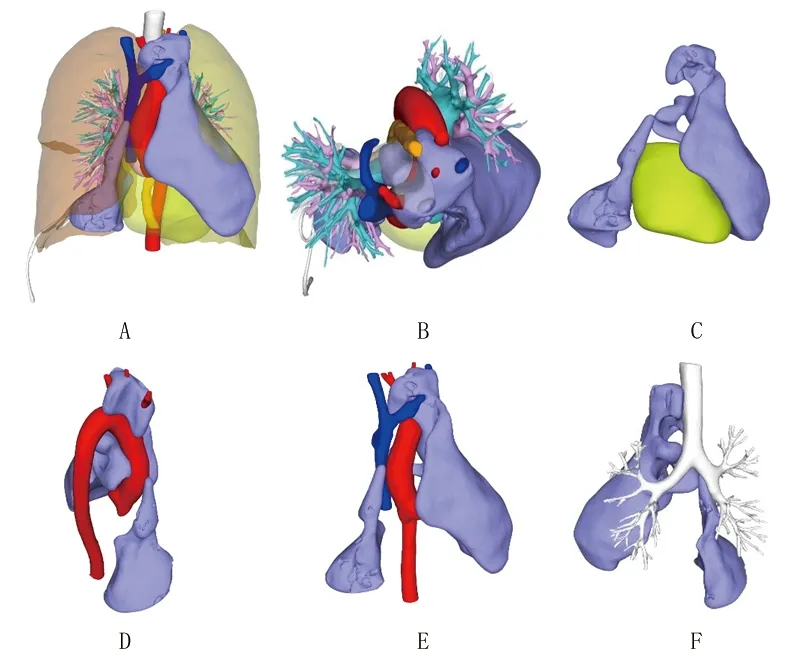
图2 患者肿瘤的3D打印图片
参考3D打印技术的结果,考虑患者的肿瘤体积大、侵犯组织多,且与周围组织关系复杂,不宜使用胸腔镜及小切口路径治疗,宜选择正中开胸进行开放手术治疗。完善各项术前检查后,采用全身麻醉,患者取仰卧位,术者常规消毒、铺巾。锯开胸骨,术中探查可见肿瘤位于前纵隔,呈囊性,质软,凸向两侧胸腔,右侧约12 cm×13 cm×8 cm,左侧约14 cm×12 cm×10 cm,肿瘤包裹部分心包、两侧部分胸膜、上腔静脉、左右无名静脉、主动脉、无名动脉、颈总动脉、左锁骨下动脉、左交感神经及气管前壁,呈浸润性生长,凸向胸腔的肿瘤为游离的囊性肿瘤,剩余部分的肿瘤包裹血管、心包等组织,粘连严重。于右侧囊壁开口吸干囊液,翻起肿瘤,自上而下沿着肿瘤包膜仔细分离上腔静脉、左右无名静脉、主动脉、无名动脉、颈总动脉、左锁骨下动脉、左交感神经、气管前壁。由于肿瘤与部分心包及胸膜粘连,分离困难,因此剥脱部分心包及胸膜,将胸腔内肿瘤完整摘除,然后使用牛心包片重建心包。分别于左侧胸壁及腋窝切开皮肤,逐层分离,暴露肿瘤,沿着肿瘤包膜完整切除胸壁及腋窝部位的肿瘤,充分止血后留置引流管(引流管留置17 d,引流液<50 mL/d时可拔除引流管),缝合切口关胸(见图3)。术后病理检查提示肿瘤组织可见大量管腔结构,部分相互吻合,管腔衬覆单层扁平上皮,管壁多为纤维组织,部分见少量无序的平滑肌束,局部见少量脂肪及胸腺组织,散在淋巴单核细胞及嗜酸性粒细胞浸润。免疫组化分析结果提示CD31(+),CD34(+),D2-40(+),V-Ets禽红母细胞病病毒E26癌基因同源(V-Ets avian erythroblastosis virus E26 oncogene homolog,ERG)(+),Ki-67(<1%+),Glut-1(-)。术后病理检查诊断为海绵状淋巴管瘤。见图4。患者术后6个月、12个月复查CT,均未见肿瘤复发征象。
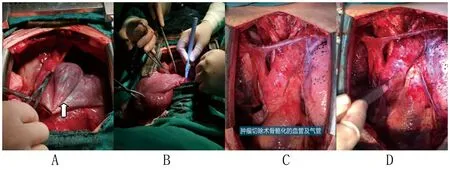
图3 患者术中图片
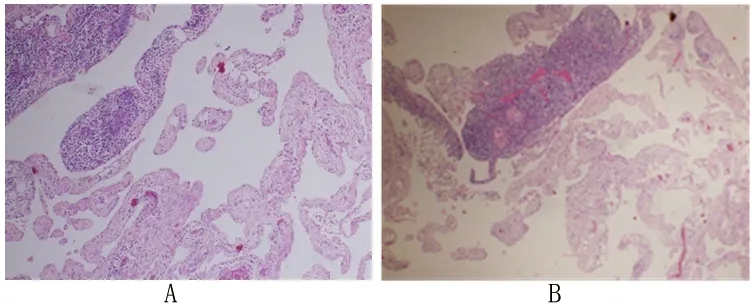
图4 术后肿瘤组织病理图片(HE染色,×100)
2 讨 论
淋巴管瘤按Wegner分类可分为单纯性淋巴管瘤、海绵状淋巴管瘤和囊状淋巴管瘤[6],根据肿瘤性质可分为良性淋巴管瘤与恶性淋巴管瘤,其中良性淋巴管瘤包括原发性淋巴管瘤、继发性淋巴管瘤,恶性淋巴管瘤包括淋巴管(内皮)肉瘤、淋巴管平滑肌肉瘤[7]。淋巴管瘤发病率较低,无特异性临床症状,当瘤体增大压迫周围组织时可产生相应的症状,如压迫肺部可有呼吸困难、咳嗽、咳痰等症状,若淋巴管瘤出现破裂、出血、感染等,可出现胸腔积液、胸痛、发热等症状。无症状的淋巴管瘤诊断困难,常在健康体检时被发现。目前临床上多采用超声检查及CT扫描诊断淋巴管瘤,其中彩色多普勒超声检查经济快捷,可确定淋巴管瘤的部位及数量,但易受骨骼、气体的阻挡而影响检查质量,对于位置较深的淋巴管瘤不容易确定其具体位置及毗邻关系。CT扫描可显示淋巴管瘤的位置及毗邻关系,其在CT影像中主要表现为较大的多囊状低密度肿物,密度均匀,肿物多为浸润性生长或随周围结构塑形,可深入血管、气管或肌肉之间,多数边缘欠清晰,肿块内可见囊壁或分隔,增强CT扫描肿块的内容物无强化,囊壁可以有轻度强化[8],但CT扫描为二维图像,立体感较差,术者通常需要将二维图像构思成三维图像,这需要丰富的阅片经验及良好的空间想象思维。3D打印技术可将二维及三维影像转换成实体模型,清晰、立体地呈现病灶的解剖特征,以及病灶与周围组织结构的毗邻关系,一方面有利于术者为患者制订个体化、精准化的治疗方案,另一方面便于术者在术前模拟演练手术操作,观察病灶与周围组织结构的毗邻关系,减少医源性损伤。此外,通过3D打印技术建立实体模型,患者及其家属可以更直观地了解手术方案,提高患者满意度及依从性,进而提升治疗效果[9]。
随着医疗技术的发展,淋巴管瘤的治疗方法逐渐多样化,目前临床上的治疗方法包括手术治疗、囊液抽吸治疗、注射硬化剂治疗、化疗、放疗、射频消融治疗、激光治疗等[10-14]。手术切除仍是淋巴管瘤的首选治疗方法,治疗效果确切,术后复发率为0~27%,完全切除瘤体能有效防止肿瘤复发[15]。对于身体条件差、手术难度大的患者可选择注射硬化剂治疗,但其治疗效果差异较大,术后可出现发热、疼痛等并发症,并且可能需要多次治疗才能达到预期效果[16-17]。本研究中的患者肿瘤巨大,累及机体重要器官,与周围组织关系复杂,选择正中开胸可以有效、完整切除肿瘤,如损伤心脏及大血管可快速建立体外循环抢救。通过3D打印技术建立实体模型,可以有效地进行术前规划,制订个性化的手术方案,利于向患者及其家属说明病情,介绍手术过程及手术风险,减少患者对手术的紧张情绪。此外,术中通过比对模型有助于减少副损伤,缩短手术时间。
3 小 结
成人纵隔淋巴管瘤较为少见,其无特殊临床症状与体征,待出现压迫症状时瘤体体积已经较大,通过3D打印技术建立肿瘤实体模型,可多角度观察淋巴管瘤的结构、大小、数目、邻近关系等,提高手术的精准度,降低手术风险。值得注意的是,淋巴管瘤复发率较高,术后需定期随访以了解有无复发。

