1种新的横向主动脉缩窄大鼠模型构建方法▲
李晓莉 蒋智渊
(广西医科大学第一附属医院心血管内科,广西南宁市 530021)
流行病学调查显示,我国18岁以上人群高血压患病率高达27.9%[1]。高血压是导致心室肥厚最重要的病因,也是导致心力衰竭的主要危险因素。理想的动物模型可以为防治高血压等心血管疾病提供研究基础。横向主动脉缩窄大鼠模型是用以研究压力负荷增加所致左心室肥厚的病理生理过程和发病机制的重要动物模型。品质良好的动物模型应该具有对实验动物创伤小、可复制率高、成模周期短、动物存活率高等特点。横向主动脉缩窄大鼠模型的构建有多种方法,传统的构建方法为经胸骨沿前正中线切开暴露主动脉弓后进行结扎[2],但该方法容易损伤滋养胸骨的大动脉和实验动物的肺脏。Wang等[3]选择经第2肋间隙作为开胸入路构建横向主动脉缩窄大鼠模型,该手术方式虽然能在一定程度上避免因损伤胸骨造成的出血,但是大鼠的肋间隙空间较小,这不仅要求术者具有熟练的操作技术,而且会延长手术时间,从而增加麻醉和手术并发症的发生。本研究对已有的横向主动脉缩窄大鼠模型的构建方法[4]进行改良,即横断距胸骨正中约0.5 cm处的左侧第3肋,经左侧第2、3肋间隙进入胸腔暴露主动脉弓并进行结扎,并分析此改良方法与经胸骨开胸构建横向主动脉缩窄大鼠模型在成功率和死亡率等方面的差异,从而优化构建主动脉弓缩窄大鼠模型的方法。
1 材料和方法
1.1 实验动物 无特定病原体级健康雄性SD大鼠36只,6~8周龄,体重(200±13)g,购于广西医科大学实验动物中心(动物许可证:SCXK桂2020-0003)。将大鼠常规饲养于温度为(25.0±0.5)℃、相对湿度为50%~60%、12 h明暗交替的环境,自由饮食。采用随机数字表法将大鼠分为实验组、胸骨切开组、对照组,每组12只。本实验所有操作步骤均严格遵守中国实验动物使用和护理的相关规定,并获得广西医科大学动物福利与伦理审查会批准同意(批准编号:202107005)。
1.2 横向主动脉缩窄大鼠模型的构建 实验组采用横断距胸骨约0.5 cm的左侧第3肋骨,经左侧第2、3肋间隙开胸后结扎主动脉弓的方法构建模型,胸骨切开组采用传统的直接开胸后结扎主动脉弓的方法构建模型,对照组的开胸方法与胸骨切开组一致,但不进行主动脉结扎缩窄操作。所有大鼠术前禁食8 h,自由饮水;术前称量大鼠体重后,经腹腔注射戊巴比妥钠40 mg/kg进行麻醉,待大鼠充分麻醉后,剃除大鼠左侧肋弓以上的体毛,随后将大鼠固定在加热垫上,并打开加热垫。经大鼠口腔插入气管针[5],确认气管针在大鼠气道后,连接KW-10型小动物呼吸机(南京卡尔文生物科技有限公司),参数设置:潮气量为3 mL/200 g,呼吸比为1 ∶1,频率为80次/(min·200 g)。
以碘附消毒实验组大鼠左侧肋弓以上皮肤,然后剪开剑突至大鼠左锁骨外侧缘的皮肤,逐层分离大小胸肌,暴露肋骨,剪断距胸骨正中约0.5 cm处的第3肋骨,随后在横断第3肋的切口处,继续往左侧剪开皮肤、肌肉等组织以暴露第2、3肋间隙(图1A、图1B),之后用扩胸器扩开切口,暴露胸腔,分离左、右胸腺,寻找无名动脉、左锁骨下动脉和左颈总动脉,以确定主动脉弓的位置,充分暴露主动脉弓后用5号手术缝线将自制的小于大鼠横向主动脉直径的缩窄针与大鼠横向主动脉一起结扎(图1C),确认结扎完全后拔出自制缩窄针,随后观察主动脉弓缩窄处凹陷程度,若结扎处较两端血管凹陷,即可确认结扎成功。检查无出血后用生理盐水湿润的纱布擦拭胸腺等组织,逐层关胸。

图1 经左第2、3肋间隙开胸构建大鼠横向主动脉缩窄模型
以碘附消毒胸骨切开组大鼠胸部正中线至锁骨处皮肤,直接切开胸骨,然后用扩胸器垂直胸骨扩开切口,依照上述方法寻找主动脉弓并结扎缩窄。对照组开胸方法与胸骨切开组一致,但不进行后续的主动脉缩窄操作。
待大鼠恢复自主呼吸后,撤除小动物呼吸机。术后8 h恢复进食,密切观察大鼠的基本情况。为了排除手术操作者熟练程度对实验结果的影响,以上操作均由同一名术者独立完成。
1.3 观察指标
1.3.1 大鼠死亡情况及手术时间:记录实验期间大鼠的死亡情况。比较实验组与胸骨切开组的大鼠存活率及手术时间。
1.3.2 一般情况:术后每日观察各组大鼠的手术伤口有无渗血、有无脓液渗出、是否有红肿等表现,以及进食和排泄情况、体重增减情况、毛发光泽度,并通过观察大鼠嘴唇、肢体、尾巴等部位的皮肤黏膜是否红润来判断大鼠的循环情况。
1.3.3 心脏超声指标:术后4周采用心脏超声仪(Esaote公司,型号:EPX-3500HD)测量各组大鼠的心脏相关指标。通过腹腔注射戊巴比妥钠(40 mg/kg)对大鼠进行麻醉,充分麻醉后对大鼠胸部进行剃毛备皮,将其平放在操作台的保温垫上,同时使用B型和M型超声仪在胸骨旁左室长轴切面、二尖瓣腱索水平进行测量。测量指标包括舒张末期室间隔厚度(interventricular septum thickness at end diastole,IVSTd)、舒张末期左心室后壁厚度(left ventricular posterior wall thickness at end diastole,LVPWTd)、舒张末期和收缩末期左室容积,然后计算左室射血分数(left ventricular ejection fraction,LVEF),LVEF=(左室舒张期容积-左室收缩期容积)/左室舒张期容积×100%。各指标均测量3个连续的心动周期,取均值。
1.3.4 心脏组织学指标:完成心脏超声检查后,通过腹腔注射戊巴比妥钠(40 mg/kg)再次麻醉3组大鼠,剪开肋骨,用止血钳夹住主动脉并快速剪下心脏置于生理盐水,然后用50 mL注射器往主动脉注入生理盐水以冲洗干净余下的血液。取部分心脏标本,以4%多聚甲醛固定。取材完成后,取出4%多聚甲醛中的心肌组织并置于10%中性甲醛溶液固定2 d,经过蒸馏水冲洗、脱水等步骤后进行石蜡包埋切片,同时制备两份石蜡切片,一份用于HE染色,另一份用于Masson染色,最后在相应倍数的光学显微镜下观察。
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组大鼠一般情况 实验组12只大鼠中,1只在术后2 d因急性左心衰竭而死亡,最终共11只大鼠存活,存活率为91.7%。胸骨切开组12只大鼠中,2只因术中大出血而死亡,2只于术后3 d因急性心力衰竭而死亡,2只于术后7 d后因可疑肺水肿而死亡,最终共有6只大鼠存活,存活率为50.0%。实验组的存活率高于胸骨切开组(χ2=5.042,P=0.034)。对照组12只大鼠中,2只因术中大出血而死亡,1只因扩胸器压迫损伤肺造成气胸而死亡,最终共9只大鼠存活,存活率为75.0%。统计存活大鼠的手术时间,实验组的手术时间为(23.48±2.53)min,短于胸骨切开组的(36.03±3.59 )min(t=9.602,P<0.001)。
3组存活大鼠术后皆无术野渗血、伤口红肿、化脓和渗液等情况,并且每日的排泄和进食量正常。大鼠的体重在术后前两周增长最快,平均10 g/周。同时,大鼠的四肢、嘴唇和尾巴均保持红润,躯体活动也无明显异常,精神良好。
2.2 3组大鼠心脏超声指标的比较 与对照组比较,实验组和胸骨切开组大鼠的IVSTd和LVPWTd均增厚(均P<0.05),但实验组和胸骨切开组上述两个指标差异无统计学意义(均P>0.05)。3组大鼠的LVEF差异无统计学意义(P>0.05)。见表1和图2。

表1 3组大鼠心脏超声指标的比较(x±s)

图2 3组大鼠典型的经胸骨旁左室长轴切面超声影像
2.3 3组大鼠心肌组织学改变 HE染色结果显示:对照组大鼠心肌组织未见明显的炎症细胞浸润,心肌细胞形态、大小基本一致,细胞边界清晰;实验组和胸骨切开组大鼠心肌组织有较多炎症细胞浸润,心肌细胞形态各异,细胞边缘分界不明显,部分细胞体积变大、水肿。Masson染色结果显示:对照组大鼠心肌细胞排列有序,少见胶原纤维组织填充;而实验组和胸骨切开组大鼠心肌肌节排列紊乱,心肌细胞间有较多胶原纤维组织填充。见图3。
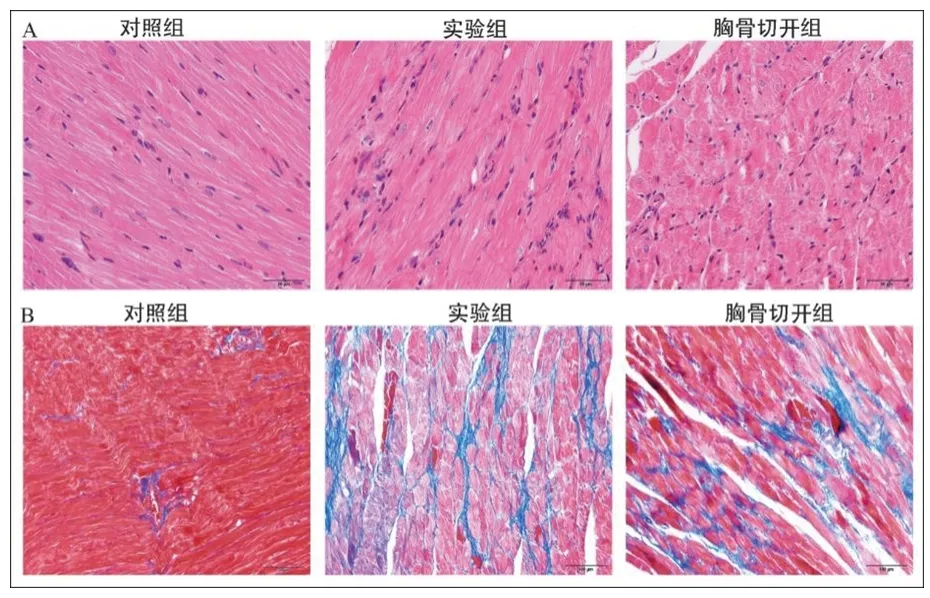
图3 3组大鼠心肌组织学变化
3 讨 论
动物模型是研究疾病发病机制的基础,理想的动物模型不仅要考虑实验动物的伦理,尽量减少手术操作对实验动物的伤害,而且还要考虑是否能很好地模拟疾病的发生和发展。横向主动脉缩窄大鼠模型是一种通过缩窄动物主动脉弓管径来增加大鼠心脏射血后负荷,利用压力负荷改变心肌形态和功能,最终达到模拟人类高血压、心力衰竭等疾病状态的动物模型,该模型对研究心血管疾病具有重要的作用。既往以主动脉弓缩窄为主的横向主动脉缩窄大鼠模型,多以大鼠正中线即胸骨作为手术入路[6],此方法虽然可以很好地显露大鼠的心脏和主动脉,但胸骨作为大鼠较大的躯干骨,具有一定数量的滋养动脉,手术过程中如操作稍有不当可损伤动脉而造成出血。本研究中,采用胸骨切开入路的胸骨切开组和对照组,皆有2只大鼠因术中出现大出血而死亡。有研究表明,经肋间隙入路逐层分离暴露手术视野的方法可在一定程度上减少术中出血量,改善大鼠的预后[7]。但是即使使用扩胸器扩张大鼠肋间隙,操作空间仍较为有限,不利于随后分离及结扎主动脉的精细操作,这有可能造成手术时间延长,以及麻醉和手术相关并发症发生率的增加。此外,使用扩胸器强行扩张容易引起肋骨变形,不利于后期实验动物的恢复。
研究表明,大鼠升主动脉经心脏发生后,在相当于第四胸椎水平穿出心包,形成主动脉弓,并向左向上走行,在相当于第2胸椎水平达到最高位置,并逐渐向足侧走行,形成降主动脉,随后在主动脉弓起点约10 mm处发出无名动脉,在主动脉弓最高位置后发出左颈总动脉和左锁骨下动脉[8]。基于大鼠的主动脉解剖特点,我们认为在近胸骨处,左侧第2、3肋间隙较易于暴露和结扎主动脉弓。因此,我们先横断距离大鼠胸骨约0.5 cm的左侧第3肋,再从左侧第2、3肋间隙进入,利用扩胸器扩开胸腔后进行后续操作。采用此方法开胸能够在扩开肋骨并拨开左右两片胸腺后快速找到主动脉弓,在较好的手术视野中进行结扎,而且此方法无须过多翻动大鼠胸腔内脏器,从而减少对实验动物的伤害。本研究结果显示,采用此方法进行建模的实验组,无论是手术存活率还是手术时间,均优于胸骨切开组(均P<0.05)。此外,实验组未出现术中大出血的情况。上述结果表明,改良的开胸结扎主动脉弓方法,不仅可以避免经胸骨切开结扎主动脉弓引发的大出血,还可以提高手术的安全性和缩短手术时间。
为了验证改良方法构建横向主动脉缩窄大鼠模型的有效性,本研究比较了3组大鼠的心脏超声指标及心脏组织学变化。结果显示,与对照组相比,实验组和胸骨切开组大鼠均出现了明显的左心室肥厚、心肌炎症和心肌纤维化,而实验组和经胸骨切开组大鼠的心脏超声指标及心脏组织学变化均无明显差异。上述结果表明改良与传统的开胸结扎主动脉弓方法均能有效构建横向主动脉缩窄诱导的压力超负荷大鼠心肌肥厚模型。
然而,本研究改良的建模方法也存在不足:(1)本研究未能建立不横断肋骨而直接经左侧第2、3肋间隙开胸结扎主动脉弓的对照组,只是推测改良方法可能优于经肋间隙开胸法,这有待今后进一步实验验证。(2)是否有比本研究改良方法更优的建模方式,还有待进一步探索。有研究表明,相比于经胸腔入路的建模方法,腹主动脉缩窄诱导的压力超负荷心肌肥厚大鼠模型具有手术安全性高、实验动物成活率较高等优点[9],但是腹主动脉缩窄的成模周期明显延长[10],故本研究并未采用此种方法构建压力超负荷心肌肥厚大鼠模型。此外,近期有研究报告,与传统方法相比,经第2肋水平切开胸骨并结扎小鼠主动脉弓的创伤性更小,手术时间更短[11]。但是,在大鼠上建模是否也可获得同样的效果,且是否优于本研究的建模方法,都有待于今后的研究进一步证实。
综上所述,与传统的经胸骨正中开胸并结扎主动脉弓方法比较,通过横断距胸骨正中约0.5 cm处的第3肋,经左侧第2、3肋间隙开胸后结扎主动脉弓的方法构建横向主动脉缩窄大鼠模型,建模成功率高,手术时间明显缩短。上述方法可以为科研工作者构建横向主动脉缩窄大鼠模型提供参考。

