人牙龈间充质干细胞条件培养液对人成纤维细胞生物学功能的影响
张洁 杨华军 赵伟 蒋巧平 李敏 胡胜杰
皮肤创伤破坏了皮肤的屏障功能及生理功能,寻找促进皮肤创面愈合的方法一直以来是临床工作的重要内容。间充质干细胞(mesenchymal stem cell,MSCs)用于皮肤创面修复及组织再生医学有一定效果[1]。牙龈间充质干细胞(gingival mesenchymal stem cells,GMSCs)是从牙龈组织中分离出来的MSCs,与其他干细胞比较,具有取材方便,扩增能力强的优点,已证实用于牙周组织再生领域可发挥重要作用[2]。但调控这一生物学过程的内在机制并不明确。近年来随着对干细胞的深入研究,发现MSCs发挥生物学效应的主要途径与其旁分泌能力有关[3]。本研究将不同浓度的人牙龈间充质干细胞条件培养液(human gingival mesenchymal stem cells derived conditioned medium,GM‐SCs-CM)作用于成纤维细胞,探讨其对成纤维细胞生物学功能的影响,旨在为其用于促进皮肤创伤愈合的治疗提供实验和基础理论依据。
1 材料和方法
1.1 主要实验试剂及仪器DMEM培养基(美国Gib‐co公司);基础培养基(上海赛百慷公司);0.25%胰蛋白酶(美国Sigma公司);青霉素-链霉素、PBS(上海源培生物科技有限公司);CO2培养箱、4℃离心机(型号:ST16R)(美国Thermo公司);SupersmartTM2×快速SYBR Green qPCR预混液、SupersmartTM6 min耐热首链cDNA合成试剂盒、SupersmartTM6 min高纯RNA提取试剂盒、SupersmartTMCell Counting Kit-8[中实基因科技(天津)有限公司];引物[生工生物工程(上海)股份有限公司];倒置荧光显微镜(天津微仪光学仪器有限公司);LC96 qPCR仪(瑞士Roche公司);CMax Plus酶标仪(SpectraMax)。
1.2 方法
1.2.1 细胞来源和培养GMSCs购自赛百慷生物技术股份有限公司,使用基础培养基传代培养,实验选用第3~4代细胞。人成纤维细胞为重庆医科大学赠送,使用DMEM培养基培养,实验选用第5代细胞。
1.2.2 GMSCs-CM制备将5×105个GMSCs接种在T25培养瓶中,用含血清替代物、血小板裂解物的生长培养基5 mL培养,2~3 d换液1次;当培养的细胞达80%融合时,去除原培养基,PBS漂洗3次,加入无添加剂的GMSCs基础培养基5 mL;培养48 h后收集细胞上清液于15 mL离心管中,500 r/min离心5 min,使用0.22 μm孔径滤过膜过滤,即得到GMSCs-CM;将收集到的GMSCs-CM采用Millpore超滤离心管浓缩(5 000 r/min,40 min,4℃),通过nanodrop仪测定浓度以备用。
1.2.3 细胞增殖实验采用CCK-8法。取对数生长期的人成纤维细胞,按2×104个/孔、100 μL/孔接种于96孔细胞培养板内,24 h后弃去培养液,分别用1、5、10、50、100 μg/mL浓度的GMSCs-CM进行细胞处理,每个浓度3个复孔,同时设置GMSCs-CM添加0 μg/mL为空白对照组,CO2培养箱继续培养72 h,弃去培养基,加入10 μL/孔CCK-8溶液,置于37℃、5% CO2的细胞箱孵育1 h,酶标仪检测450 nm波长处吸光度(optical density,OD)值。
1.2.4 细胞凋亡实验采用TUNEL法。将成纤维细胞按0.5×105个/mL密度接种在96孔板内,100 μL/孔。细胞贴壁后换无血清培养基,24 h后弃去培养液,加入0(空白对照组)、1、10、100 μg/mL浓度的GMSCs-CM,每个浓度3个复孔,孵育72 h后弃去上清液,PBS清洗细胞2次,采用TUNEL法检测细胞凋亡情况,凋亡细胞呈现绿色荧光信号。
1.2.5 Ⅰ型胶原(type I collagen,COL-1)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、α-平滑肌动蛋白(α-smooth muscle actin,α-SMA)、转化生长因子β(transforming growth factor-β,TGF-β)mRNA的检测采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)法。将成纤维细胞按照105个/mL密度接种于24孔板上贴壁培养24 h,加入0(空白对照组)、1、10、100 μg/mL浓度的GMSCs-CM,孵育24 h后弃去培养液,20 μL PBS重悬,按照RNA提取试剂盒的操作提取总RNA,在50℃5 min进行第一链cDNA合成,95℃1 min进行反转录失活反应,得到cDNA进行qRT-PCR检测COL-1、PCNA、α-SMA、TGF-β mRNA。相关基因的引物序列见表1。

表1 实时荧光定量PCR中的引物序列
1.3 统计学处理采用SPSS 25.0及GraphPad Prism 9.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 GMSCs-CM对成纤维细胞增殖能力的影响不同浓度GMSCs-CM作用下的OD值差异有统计学意义(F=6.163,P<0.05);1 μg/mL组成纤维细胞的增殖能力明显高于空白对照组(P<0.05),与空白对照组比较,GMSCs-CM浓度是5、10、50、100 μg/mL时也能促进成纤维细胞增殖,但是差异均无统计学意义(均P>0.05),见图1(插页)、表2。

图1 1 μg/mL GMSCs-CM作用72 h后成纤维细胞生长情况

表2 不同浓度GMSCs-CM作用下成纤维细胞增殖情况
2.2 GMSCs-CM对成纤维细胞凋亡情况的影响与空白对照组比较,成纤维细胞在不同浓度的GMSCs-CM作用下,细胞未发生明显的凋亡,见图2(插页)。

图2 不同浓度GMSCs-CM作用下成纤维细胞凋亡情况
2.3 不同浓度GMSCs-CM作用下成纤维细胞COL-1、PCNA、α-SMA、TGF-β mRNA表达水平的比较与空白对照组比较,GMSCs-CM浓度为1 μg/mL时COL-1 mRNA表达水平升高,差异有统计学意义(P<0.05),而随着GMSCs-CM浓度的升高,COL-1 mRNA表达水平呈下降趋势。GMSCs-CM浓度为1 μg/mL时PCNA mRNA表达水平高于空白对照组,差异有统计学意义(P<0.05)。而不同浓度GMSCs-CM作用下成纤维细胞α-SMA mRNA表达水平均低于空白对照组,差异均有统计学意义(均P<0.05)。GMSCs-CM浓度为1 μg/mL时TGF-β mRNA表达水平高于空白对照组,而其他浓度作用下表达水平均低于空白对照组,差异均有统计学意义(均P<0.05)。见表3。
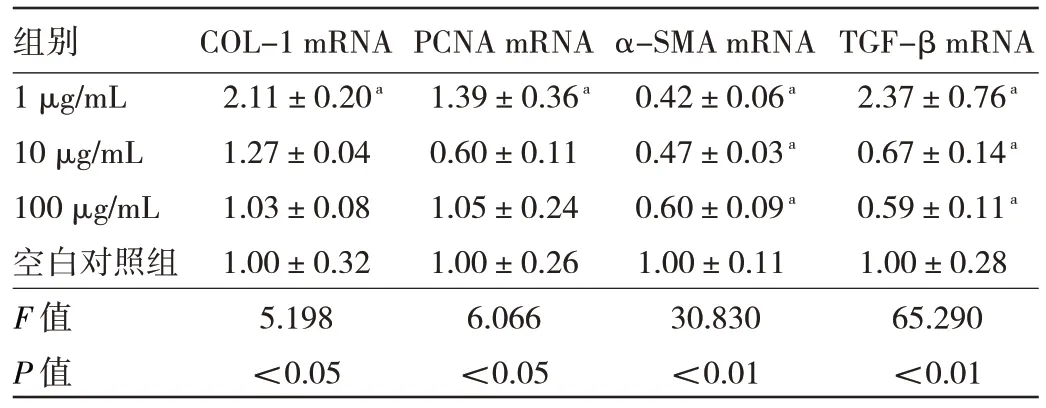
表3 不同浓度GMSCs-CM作用下成纤维细胞COL-1、PCNA、α-SMA、TGF-β mRNA表达水平的比较
3 讨论
皮肤创面愈合对维持皮肤完整性和功能性起至关重要的作用。MSCs在皮肤创面修复及组织再生医学中取得了一定的效果,是目前临床中最有价值的医疗手段。GMSCs是从牙龈中分离出的MSCs,较其他来源的成体干细胞取材方便,同时临床中发现,口腔黏膜的自身修复速度比皮肤修复速度快且很少形成瘢痕,推断这与GMSCs的生物学特性相关,但调控这一生物学过程的内在机制并不明确。近年来随着干细胞的深入研究显示,MSCs发挥生物学效应的主要依靠其旁分泌能力,通过旁分泌携带特异性信息的传导,调节靶细胞的生物学状态。MSCs-CM的使用避免了MSCs移植产生的免疫原性高、致瘤和致畸风险、直接注射会造成血管栓塞等不良反应,相比MSCs移植更加安全方便,更具有临床转化前景。基于此,笔者推测旁分泌也是GMSCs发挥修复作用的重要媒介。本研究通过使用不同浓度的GMSCs-CM作用成纤维细胞发现,GMSCs-CM对成纤维细胞的增殖能力有明显的促进作用,而对细胞凋亡无明显影响。
皮肤创面愈合过程涉及到炎细胞浸润、不同细胞的相互作用、细胞外基质的沉积和重塑、上皮的再生等,其中成纤维细胞在皮肤创面愈合中的调节作用占主导地位[4]。在创面愈合初期炎细胞浸润,起主要作用的中性粒细胞、巨噬细胞分泌炎症因子如TGF、成纤维细胞生长因子(fibroblast growth factor,FGF)、表皮生长因子(epidermal growth factor,EGF)等来作为趋化剂招募组织形成阶段所需的细胞和细胞因子,成纤维细胞募集到创面后在细胞因子的调节下进行肉芽组织的生成、血管的形成与上皮的再生[5]。
正常皮肤中的成纤维细胞数量基本恒定,皮肤损伤后,成纤维细胞生长快速地由G0期进入增殖期,以促进再生上皮化的进程从而加速创面的愈合[6]。本实验研究表明,GMSCs-CM能显著促成纤维细胞的增殖,以此影响创面愈合的再生上皮化过程。
合成COL-1的能力是成纤维细胞的典型特征,COL-1也是细胞外基质的主要成分,约占其比重的70%。在正常成人皮肤中,胶原蛋白Ⅰ与胶原蛋白Ⅲ的比例约为4∶1,在新愈合的人体皮肤中,胶原蛋白Ⅰ和胶原蛋白Ⅲ的比例约为1∶1[7]。本实验研究结果显示,在皮肤创面愈合过程中,GMSCs-CM不同浓度作用下成纤维细胞COL-1 mRNA表达水平均升高;同时发现GMSCs-CM能有效增加COL-1的表达,促进成纤维细胞的增殖,从而加速伤口愈合,且GM‐SCs-CM浓度为1 μg/mL时COL-1 mRNA表达水平最高,而随着GMSCs-CM浓度的升高,COL-1 mRNA表达水平呈下降趋势,提示1 μg/mL GMSCs-CM浓度是增加COL-1的表达促进成纤维细胞增殖的最适浓度。
TGF-β是创面愈合生理学中的一组关键细胞因子,它全程参与调节创面愈合过程的3个阶段:(1)在伤口愈合早期,TGF-β由免疫细胞分泌,充当免疫细胞的化学引诱物,调节免疫细胞功能,从而有助于炎症消退;(2)在组织形成期,TGF-β通过刺激内皮细胞迁移、分化和毛细血管形成来促进血管生成[8],同时还刺激成纤维细胞增殖,促进成纤维细胞转分化为肌成纤维细胞,并刺激细胞外基质产生,促进再生上皮化;(3)基质重塑阶段,TGF-β通过一系列严格调控,使得细胞外基质合成和降解维持平衡状态。PCNA是DNA复制和修复的重要因素,作为评价细胞增殖状态的重要指标,已证实在皮肤组织的发生和修复过程中表达增强[9]。本研究中也发现,1 μg/mL GMSCs-CM可促进TGF-β mRNA和PCNA mRNA的表达水平。
伤口愈合的中后期,成纤维细胞由原型肌成纤维细胞分化为肌成纤维细胞,肌成纤维细胞是表达α-SMA的特化细胞[10],它响应TGF的刺激并促进创面的收缩,使肉芽组织纤维化[11]。本实验研究发现,GMSCs-CM组细胞α-SMA mRNA表达水平均低于空白对照组,随着GMSCs-CM浓度的增加,α-SMA mRNA表达水平也逐渐增加。提示在创面愈合过程中提高GMSCs-CM的浓度可导致成纤维细胞纤维化,从而促进皮肤创面的收缩。
综上所述,GMSCs-CM含有大量GMSCs分泌的生物活性物质,可调节成纤维细胞的生物活性状态从而促进皮肤创面的愈合。同时,GMSCs-CM中细胞因子的浓度具有可调控性,若通过全身或者局部给药的方式精准作用于皮肤创面,可使GMSCs-CM的使用更加安全更具有临床转化前景。在此过程中,COL-1和TGF-β表达调控的机制有待进一步阐明,或可成为创面愈合的潜在治疗策略。

