miR-145-5p 在正常大鼠与2 型糖尿病大鼠骨髓间充质干细胞成骨分化中的表达比较
戴雅文,鄂玲玲,郑 颖,马小草,张 戎,时 权,刘洪臣解放军总医院研究生院,北京 00853;解放军总医院第一医学中心口腔医学研究所、口腔颌面战创伤军队重点实验室,北京 00853
全球超过5 亿人患有糖尿病,其中2 型糖尿病(type 2 diabetes mellitus,T2DM)约占90%[1]。T2DM 可引起一系列并发症,除视网膜病变、心血管疾病、肾病、神经病变等疾病外,还会导致骨丢失和骨质疏松,影响骨愈合,增加骨折的风险。随着糖尿病患者数量增加,糖尿病导致的骨代谢疾病成为全球重要的疾病负担[2-4]。有证据表明,糖尿病微环境可影响糖尿病骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)而导致机体骨代谢失衡,但其具体机制尚不清楚[5-6]。
微RNA (microRNA,miRNA) 是一类短的非编码RNA,通过靶向靶基因调控蛋白表达参与细胞增殖、凋亡、迁移等多种生物学过程,与骨代谢和骨稳态密切相关[7]。miR-145-5p 靶向SOX9 抑制正常人脂肪间充质干细胞增殖及成软骨分化[8];靶向Smad4 可降低Sox-9、Col-2A1、聚集蛋白聚糖的表达,抑制骨关节炎患者源骨髓间充质干细胞的增殖和成软骨分化[9]。miR-145-5p 还可靶向SEMA3A 降低Wnt 通路基因Wnt3a、Wnt10a 的表达,抑制2 型糖尿病大鼠脂肪间充质干细胞成骨分化[10]。然而,miR-145-5p 对2 型糖尿病股骨BMMSCs 成骨分化的影响尚不清楚。本研究比较正常大鼠与2 型糖尿病大鼠股骨BMMSCs 的增殖和成骨分化能力,初步探讨正常大鼠与2 型糖尿病大鼠股骨BMMSCs 成骨分化中miR-145-5p、SEMA3A、β-catenin 表达的差异,为进一步研究miRNA-145-5p 在糖尿病环境下影响骨代谢的分子机制提供依据。
材料与方法
1 实验动物 8 周龄SPF 级雄性Wistar 大鼠(共12 只) 购于维通利华有限公司,动物许可证号:SCXK(京)2021-0011。8 周龄雄性GK 大鼠(共12只)购于常州卡文斯实验动物有限公司,动物许可证号:SCXK(苏)2016-0010。动物实验经解放军总医院实验动物伦理委员会审核并予以批准(2021-X17-90)。
2 主要试剂和仪器 罗氏Accu-Check Active 活力型血糖仪(Roche,瑞士),低糖DMEM (Gibco,美国),胎牛血清(Gibco,美国),CCK-8 试剂盒(日本同仁,日本),结晶紫染色液(碧云天,中国),抗坏血酸(Sigma,美国),β-甘油磷酸钠(Sigma,美国),地塞米松(Sigma,美国),茜素红S 染色液(Sigma,美国),OriCell®间充质干细胞(大鼠)表面标记检测试剂盒(Cyagen, 中国),碱性磷酸酶(alkaline phosphatase,ALP) 染色液(偶氮偶联法) (Solarbio,中国),ALP 检测试剂盒(碧云天,中国),Western blot 及IP 细胞裂解液(无抑制剂) (碧云天,中国),BCA 蛋白定量试剂盒(Solarbio,中国),RNA 提取液(Servicebio,中国),ECL 化学发光试剂盒(Servicebio,中国),荧光定量PCR 仪(Bio-Rad,美国)。
3 2 型糖尿病大鼠模型建立 高脂高糖饲料喂养GK 大鼠(12 只) 构建2 型糖尿病大鼠模型,作为实验组;普通饲料喂养Wistar 大鼠(共12 只)作为对照组。8 ~ 13 周每周于固定时间测定体质量、大鼠尾静脉采血进行随机血糖检测。2 次随机血糖浓度≥16.7 mmol/L 视为2 型糖尿病模型造模成功[11]。
4 股骨BMMSCs 原代培养及传代 取正常Wistar大鼠和造模成功的GK 大鼠各12 只,腹腔注射过量戊巴比妥钠处死,分离出双侧股骨,用咬骨钳去除股骨两端,暴露骨髓腔,用5 mL 注射器吸取普通培养液(含10% 胎牛血清和1% 青链霉素的DMEM 培养液)冲洗骨髓腔,收集冲洗液于100 mm大皿中,细胞孵育箱内培养(37 ℃,5% CO2)。当细胞密度达80%融合时进行传代培养,使用第3 代Wistar 大鼠BMMSCs (WT-BMMSCs)和GK 大鼠BMMSCs (GK-BMMSCs)进行后续的实验[12]。
5 干细胞表型检测 取第3 代WT-BMMSCs 和GK-BMMSCs,PBS 洗2 次,0.25% 胰蛋白酶消化,1000 r/min 离心5 min,弃去上清液。各管加入流式细胞缓冲液重悬细胞,使细胞浓度为3 ×106/mL。取100 µL 细胞悬液放入1.5 mL EP 管,每管加入2 µL 一抗CD90、CD44、CD34、CD45、CD11b/c 混匀。4℃孵育30 min,用200 µL 流式缓冲液清洗细胞2 次。250 g 离心5 min,弃上清。每管加入100 µL 流式细胞缓冲液,加入二抗,重悬细胞。4℃孵育30 min,用200 µL 流式缓冲液清洗细胞2 次。250 g 离心5 min,弃上清。用300 µL 流式细胞缓冲液重悬细胞后流式细胞仪分析。
6 CCK-8 检测细胞生长 取第3 代WT-BMMSCs和GK-BMMSCs, 以2 × 103/孔的密度接种于96孔板(普通培养液),每组样本量为6。培养的1 ~9 d,每孔加入10 µL CCK-8 工作液,37℃孵箱孵育2 h 后,于450 nm 处检测两组细胞的吸光度值,连续检测9 d,绘制细胞生长曲线。实验重复3 次。
7 细胞集落形成实验 取第3 代WT-BMMSCs和GK-BMMSCs,胰酶消化后重悬并进行细胞计数。以1 × 102/孔的密度接种于六孔板(普通培养液),每组样本量为6。常规培养10 d,弃去原培养液,4% 多聚甲醛固定30 min,结晶紫染色5 min,PBS 清洗3 遍,拍照。计数每孔的集落数,计算集落形成率。实验重复3 次。
8 成骨诱导实验 实验分为WT-BMMSCs、GKBMMSCs、WT-BMMSCs + 成骨诱导液(osteogenic differentiation medium,OM)和GK-BMMSCs + OM四组。以2 × 105/孔的密度接种于六孔板(普通培养液),每组样本量为6。常规培养至细胞达70%融合后分别更换为普通培养液和成骨诱导液(含10%胎牛血清、1% 青链霉素、10 mmol/L β-甘油磷酸钠、50 µg/mL 抗坏血酸和1 × 10-4mmol /L 地塞米松液的DMEM 培养液) 继续培养。每3 d 换液1 次。
9 ALP 染色及半定量分析 成骨诱导7 d 后弃去诱导液,PBS 洗涤3 次,4% 多聚甲醛固定30 min,配置BCIP/NBT 染色工作液,每孔加入1 mL,室温避光孵育15 min,PBS 洗涤2 次后拍照。半定量分析:弃去原培养液,PBS 清洗2 次,每孔加入100 µL 细胞裂解液充分裂解细胞,收集裂解液于EP 管中,4℃下12000 r/min离心30 min,取上清。BCA 法测定蛋白浓度,将样品稀释为50 µg/50 µL。每孔吸取50 µL 加入96 孔板中,同时设置空白对照组和标准品组,每组设5 个复孔。加入50 µL 显色液,37℃孵育10 min,每孔加入100 µL 终止液终止反应,酶标仪于405 nm 处测定吸光度值,根据标准曲线计算ALP 表达量[13]。实验重复3 次。
10 茜素红染色观察钙化结节 成骨诱导21 d后,PBS 清洗1 次,4% 多聚甲醛固定30 min,1%茜素红染色液染色5 min,PBS 清洗后拍照。
11 实 时 定 量PCR 检 测miR-145-5p、SEMA3A、成骨相关基因和成骨通路关键蛋白的mRNA表达 实验分为WT-BMMSCs、GK-BMMSCs、WT-BMMSCs + OM 和 GK-BMMSCs + OM 四组,将细胞以2 × 105/孔的密度接种于六孔板中培养于普通培养液,每组样本量为3,待细胞达70%融合后分别更换为普通培养液和成骨诱导液继续培养7 d。每孔加入1 mL Trizol,提取细胞总RNA,使用超微量分光光度计测定RNA 浓度及纯度。逆转录合成cDNA 共20 µL 反应体系:5 ×Reaction Buffer 4 µL;Gene-specific primer 2 µL;Servicebio®RT Enzyme Mix 1 µL; RNA 10 µL;RNase free water 3 µL,程 序 设 置 为25℃变 性5 min;42℃退火30 min;85℃延伸5 s。然后配置以下反应体系:2 × qPCR Mix 7.5 µL;基因引物(上游 + 下游) 1.5 µL;cDNA 2 µL;Water Nuclease-Free 4 µL,按 照 以 下 条 件 进行PCR 扩增:95℃预变性30 s;95℃变性15 s;60℃延伸30 s,进行40 个循环,荧光定量PCR 检测各组细胞中miR-145-5p、SEMA3A,成骨相关基因COL-1、RUNX2、ALP、OCN 和成骨通路关键蛋白β-catenin 的mRNA 表达水平。引物信息见表1。ΔΔCT 法处理结果,实验重复3 次,取平均值。

表1 引物序列Tab. 1 Primer sequences
12 Western blot 检 测SEMA3A 和 成 骨 相 关 基因的蛋白表达 实验分为WT-BMMSCs、GKBMMSCs、WT-BMMSCs + OM 和GK-BMMSCs +OM 四组,将细胞以2 × 105/孔的密度接种于六孔板中培养于普通培养液,每组样本量为3,待细胞达70%融合后分别更换为普通培养液和成骨诱导液继续培养7 d。培养结束后用PBS 清洗2 遍,每孔加入RIPA 裂解液200 µL,冰上裂解5 min,4℃下12000 r/min 离心10 min,收集上清,即为总蛋白溶液。BCA 蛋白浓度测定试剂盒测定蛋白浓度。制备5% SDS-PAGE 凝胶电泳进行蛋白分离,PVDF 转膜,室温下5% 脱脂牛奶封闭30 min,加入一抗(一抗稀释比:Actin 1∶2000;ALP 1∶300; OCN 1∶300; RUNX2 1∶300;SEMA3A 1∶300) 4℃孵 育 过 夜;次 日TBST 洗3 次,每次5 min,加入二抗(二抗稀释比 1∶500)室温孵育30 min 后,TBST 洗3 次,ECL 发光液显影检测。使用Adobe 软件对Western blot 条带进行分析。实验重复3 次。
13 统 计 学 分 析 统 计 学 分 析 使 用Graphpad Prism 8 软件进行,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,Tukey 多重比较检验,P<0.05 为差异有统计学意义。
结 果
1 2 型糖尿病大鼠造模成功 通过4 周高脂高糖饲料的喂养,GK 大鼠出现血糖上升及多饮、多食、多尿现象。12 周时GK 大鼠的体质量显著低于Wistar 大鼠(P<0.001;图1),同时血糖显著高于Wistar 大鼠并维持稳定(P<0.001;图2)。连续两次检测随机血糖≥16.7 mmol/L,GK 大鼠2 型糖尿病模型造模成功。
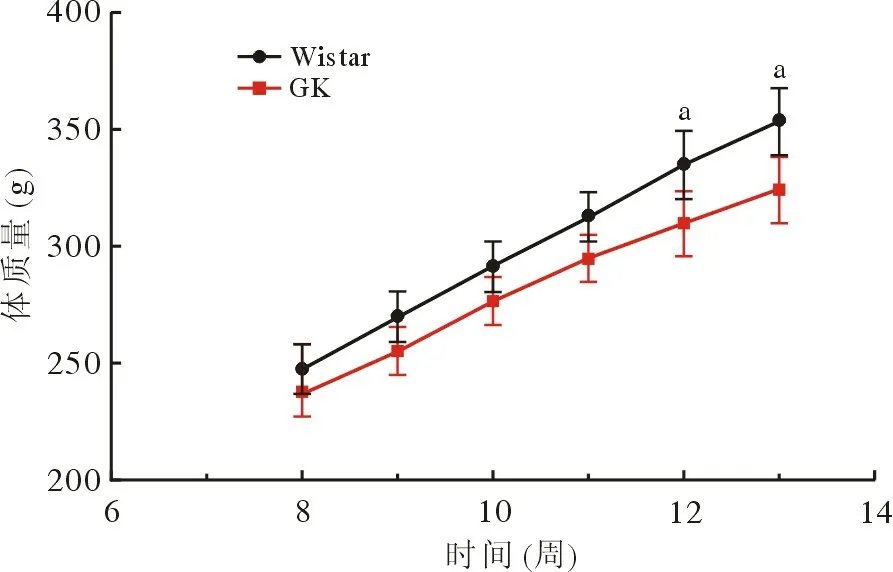
图1 8 ~ 13 周Wistar 与GK 大鼠体质量(n=12;aP<0.001,vsGK)Fig.1 Changes in body weight of Wistar and GK rats from 8 to 13weeks (n=12; aP<0.001, vsGK)
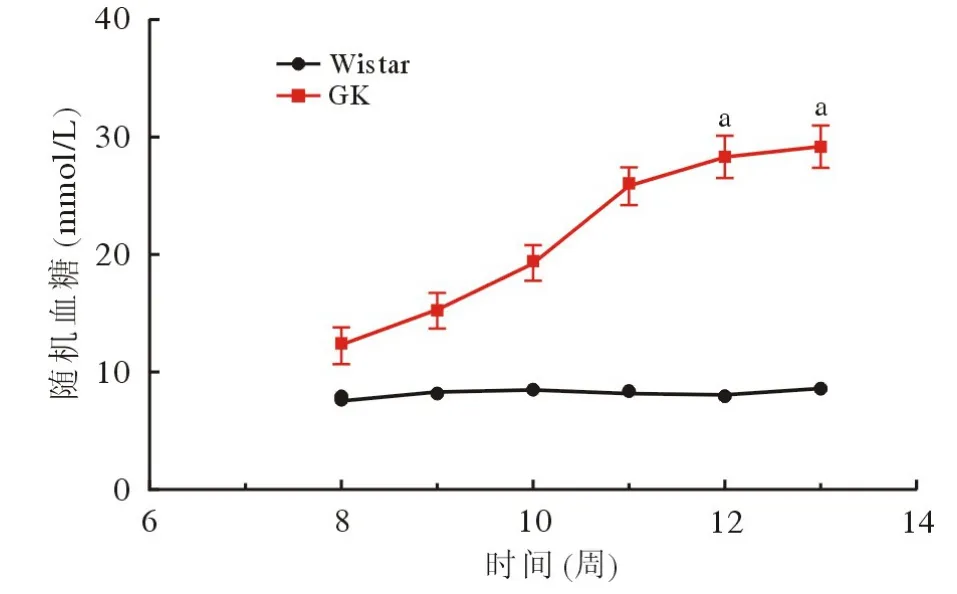
图2 8 ~ 13 周Wistar 与GK 大鼠血糖(n=12;aP<0.001,vsGK)Fig.2 Changes in blood glucose of Wistar and GK rats feom 8 to 13weeks (n=12; aP<0.001, vsGK)
2 股骨BMMSCs 分离培养及干细胞表型检测镜下见原代细胞呈长梭形或多角形,贴壁生长,夹杂着圆形高亮未贴壁的杂细胞,原代细胞培养6 ~ 8 d 可达融合,传代后细胞2 ~ 4 d 可达融合(图3)。流式细胞术进行干细胞表型检测,结果显示,体外培养的WT-BMMSCs 和GK-BMMSCs均阳性表达大鼠间充质干细胞表面标志物CD90(97.5%/99.6%) 、CD44 (98.8%/97.9%),阴性表达造血 干细 胞 标 志 物CD34 (1.49%/2.47%)、CD45(1.13%/1.55%)、CD11b/c (1.51%/1.87%)。符 合 干细胞分子表型(图4)。
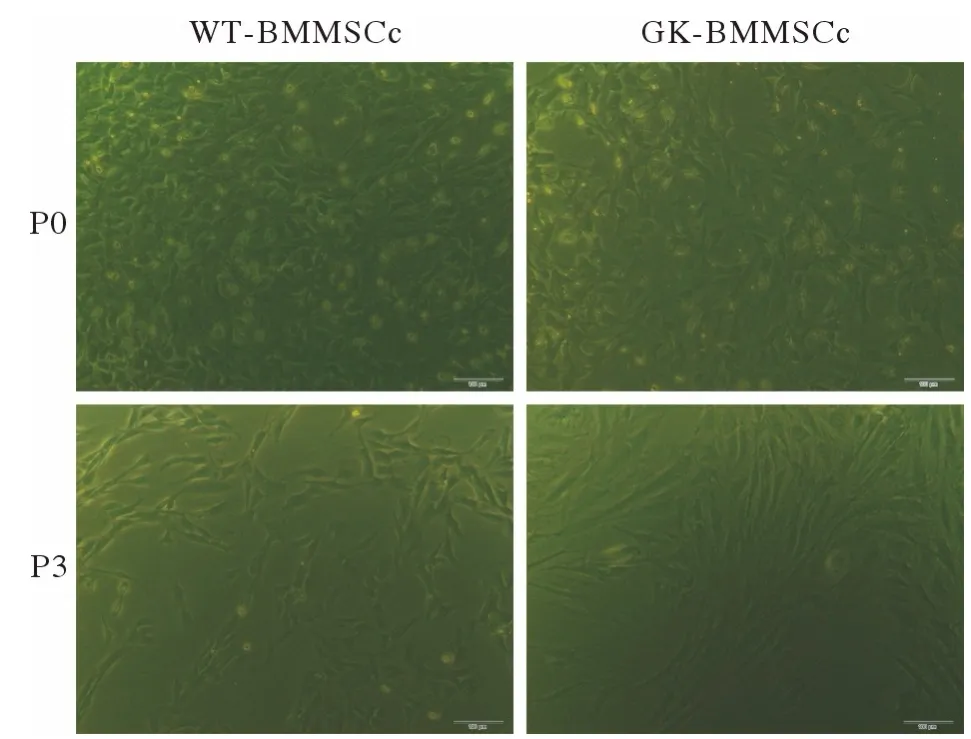
图3 倒置显微镜观察原代(P0)与第3 代(P3)正常和糖尿病大鼠BMMSCs (标尺=100 µm)Fig.3 Primary and the third generation BMMSCs derived fromnormal and type 2 diabetic rats (scale bar=100 µm)
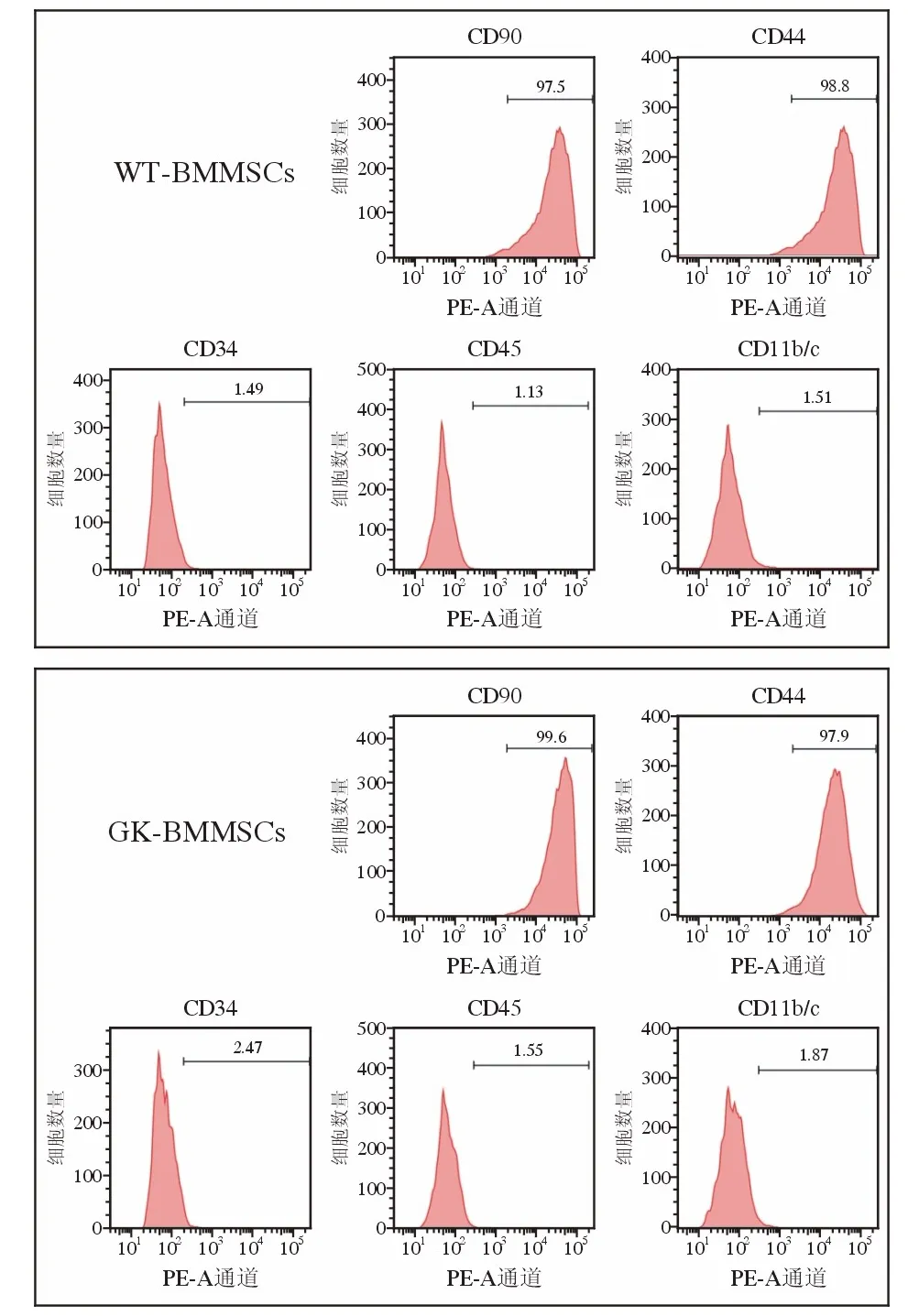
图4 流式细胞学鉴定BMMSCs 表面抗原F ig.4 Identification of BMMSCs surface antigens by flow cytometry
3 WT-BMMSCs 和GK-BMMSCs 的生物学特性比较
3.1 细胞生长曲线 CCK-8 结果显示,两组细胞的生长曲线均呈现出生长潜伏期、对数生长期和平台期,从4 d 开始,WT-BMMSCs 的增殖速率显著高于GK-BMMSCs (P<0.01;图5)。
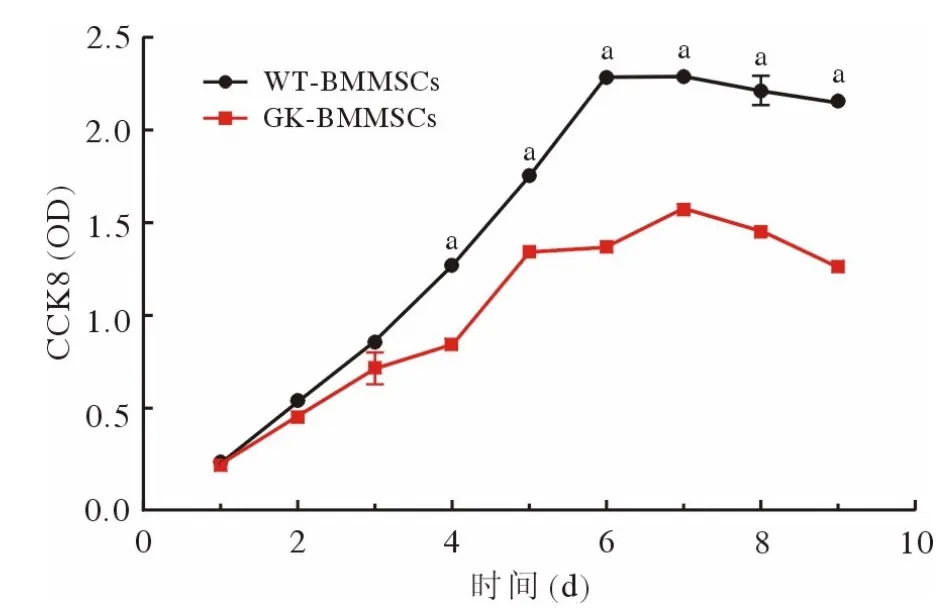
图5 CCK-8 试剂盒检测正常和糖尿病大鼠股骨BMMSCs 生长曲线(n=6;aP<0.01,vsGK)Fig.5 Detection of growth curve of BMMSCs derived from normaland type 2 diabetic rats by CCK-8 kit (n=6; aP<0.01, vsGK)
3.2 集落形成能力 结晶紫染色结果显示,WTBMMSCs 和GK-BMMSCs 培养10 d 时均有细胞集落形成,WT-BMMSCs 集落形成率显著高于GKBMMSCs (P<0.01;图6)。
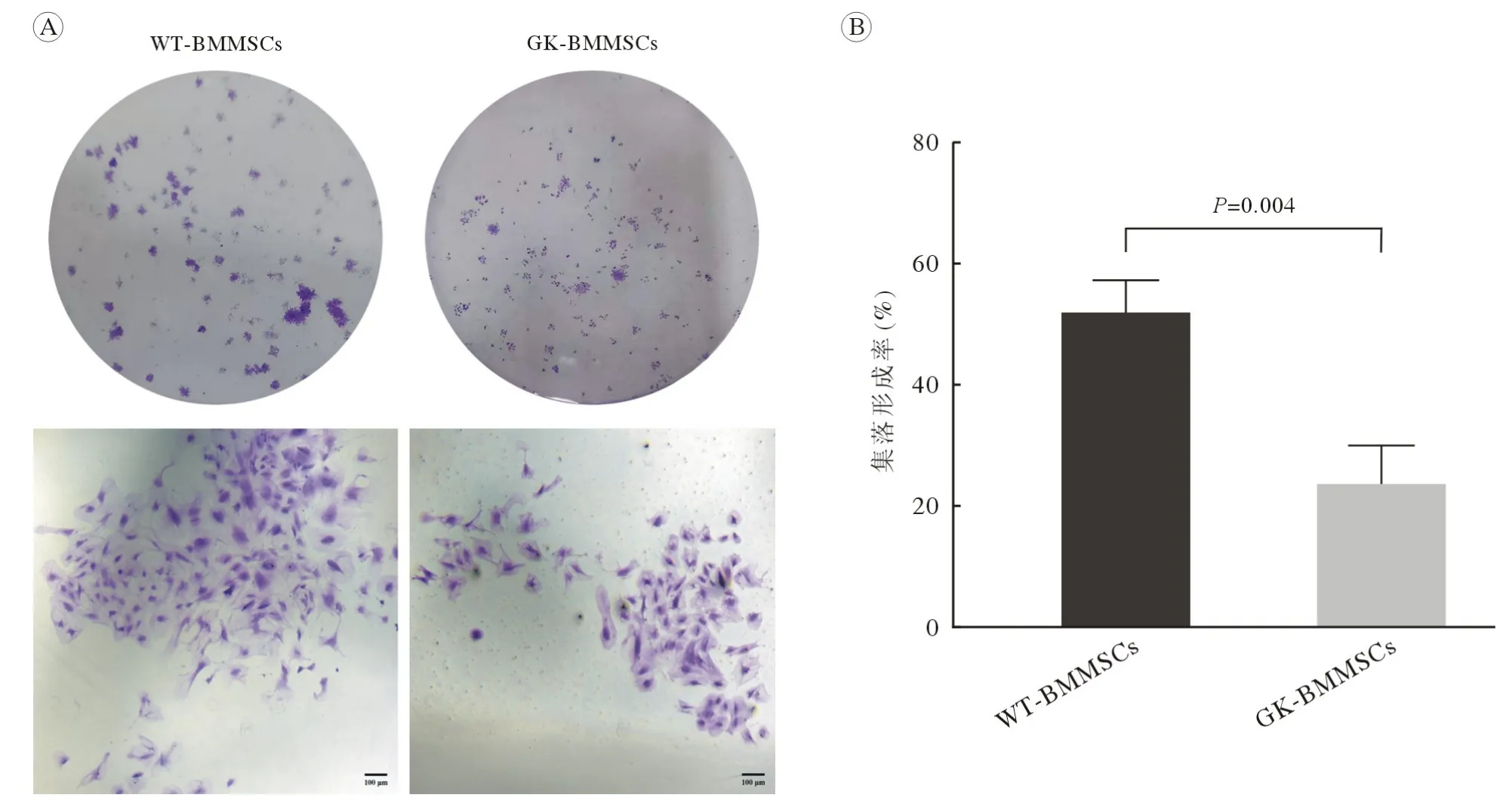
图6 正常和糖尿病大鼠股骨BMMSCs 集落形成实验A:结晶紫染色检测正常和糖尿病大鼠10 d 时股骨BMMSCs 集落形成能力(标尺=100 µm);B:正常和糖尿病大鼠股骨BMMSCs 集落形成率(n=6)Fig.6 Colony formation experiment of femoral BMMSCs in normal rats and type 2 diabetic rats A: Crystal violet staining were performed on day 10 (scale bar=100 µm); B: Colony forming efficiency of the two group (n=6)
3.3 成骨分化能力 成骨诱导7 d 后ALP 染色结果表明,WT-BMMSCs 染色较GK-BMMSCs 深,ALP 半定量检测结果与染色结果一致(P<0.001;图7A、图7B)。成骨诱导21 d 后茜素红染色结果显示,正常组和GK-BMMSCs 均出现大小不等的钙化结节,WT-BMMSCs 染色较GK-BMMSCs深(图7C)。
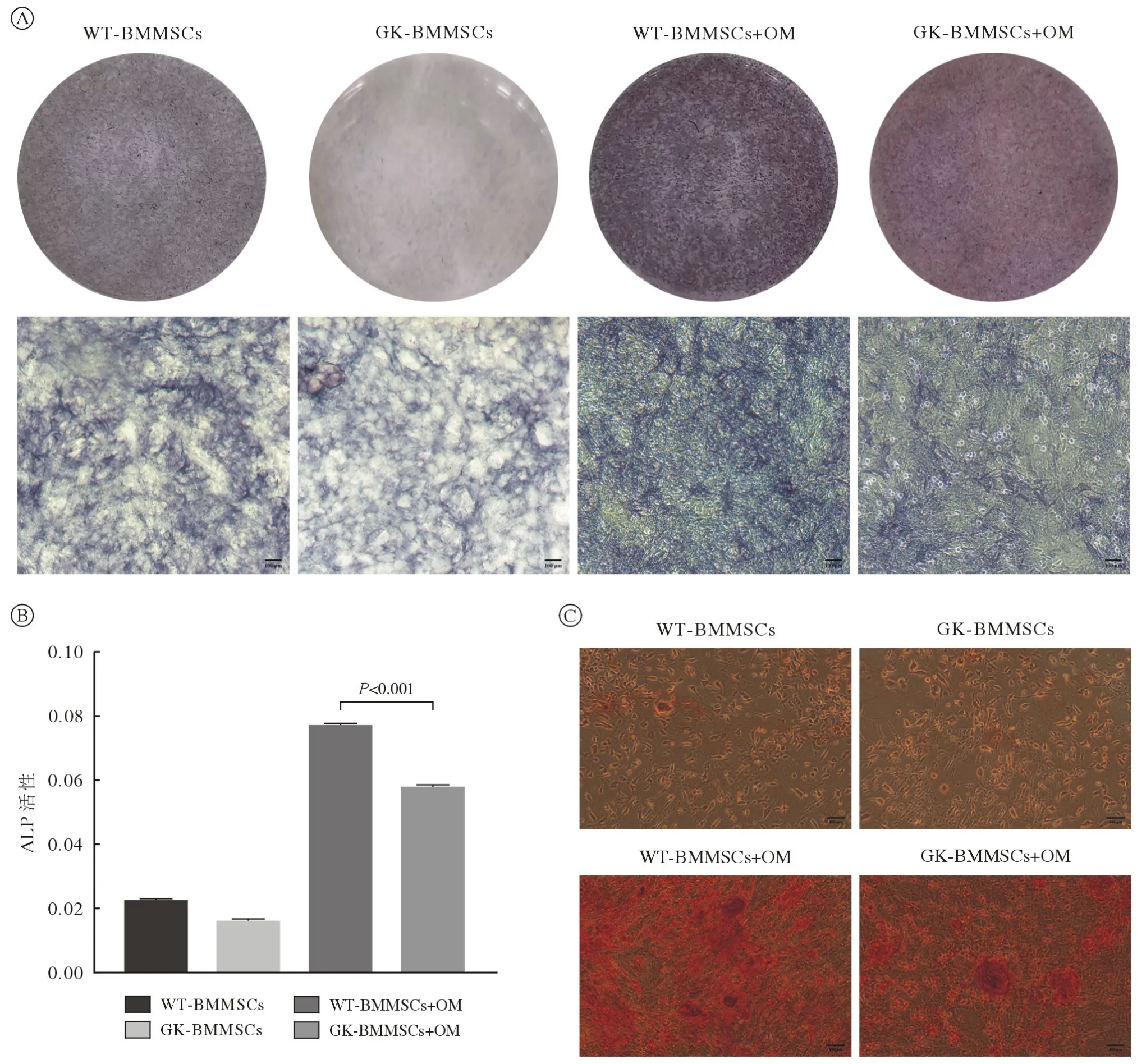
图7 正常与2 型糖尿病大鼠BMMSCs 成骨分化能力比较A:成骨诱导7 d 碱性磷酸酶染色(标尺=100 µm);B:成骨诱导7 d ALP 半定量分析 (n=6);C:成骨诱导21 d 茜素红染色显示钙化结节形成(标尺=100 µm)Fig.7 Comparison of osteogenic differentiation capacity of BMMSCs derived from normal rats and type 2 diabetic rats A: ALP staining was performed on day 7 after osteogenic differentiation (scale bar=100µm); B: Quantification of ALP activity was shown (n=6); C: ARS staining was performed on day 21 after osteogenic differentiation to show the formation of calcified nodules(scale bar=100µm)
4 WT-BMMSCs 和GK-BMMSCs 成骨分化相关基因的表达 qRT-PCR 结果显示,成骨诱导7 d时WT-BMMSCs 和GK-BMMSCs 成骨诱导组成骨分化相关基因ALP、OCN、RUNX2、COL1 的表达均显著高于未诱导组(P<0.05),而GK-BMMSCs成骨诱导组的表达显著低于WT-BMMSCs 成骨诱导组(P<0.01;图8)。Western blot 结果显示,WTBMMSCs 诱导组成骨基因ALP、OCN 表达均显著高于未诱导组,GK-BMMSCs 成骨诱导组的表达显著低于WT-BMMSCs 成骨诱导组(P<0.001),而GK-BMMSCs 成骨诱导组的表达与未诱导组无统计学差异。WT-BMMSCs 和GK-BMMSCs 成骨诱导组成骨基因RUNX2 表达均显著高于未诱导组,而GK-BMMSCs 成骨诱导组的表达显著高于WT-BMMSCs 成骨诱导组(P<0.001;图9)。
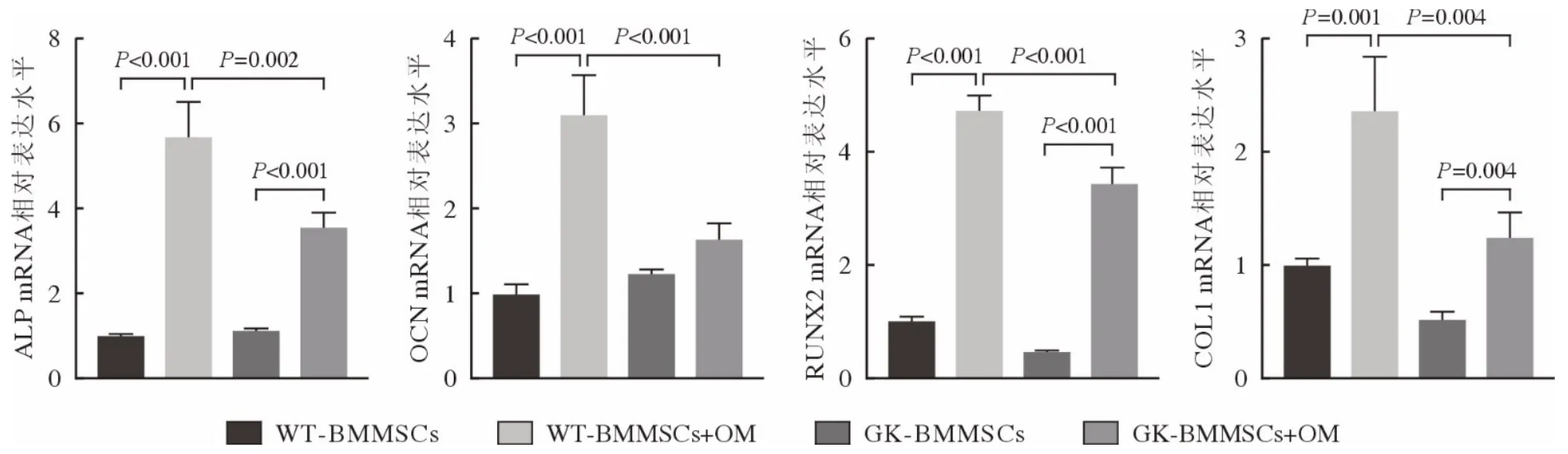
图8 成骨诱导7 d 正常与2 型糖尿病大鼠BMMSCs ALP、OCN 、RUNX2、COL1 的mRNA 表达(n=3)Fig.8 Expression level of the osteoblast differentiation-related genes ALP, OCN, RUNX2, COL1 on day 7 after osteogenic differentiation by real-time PCR (n=3)
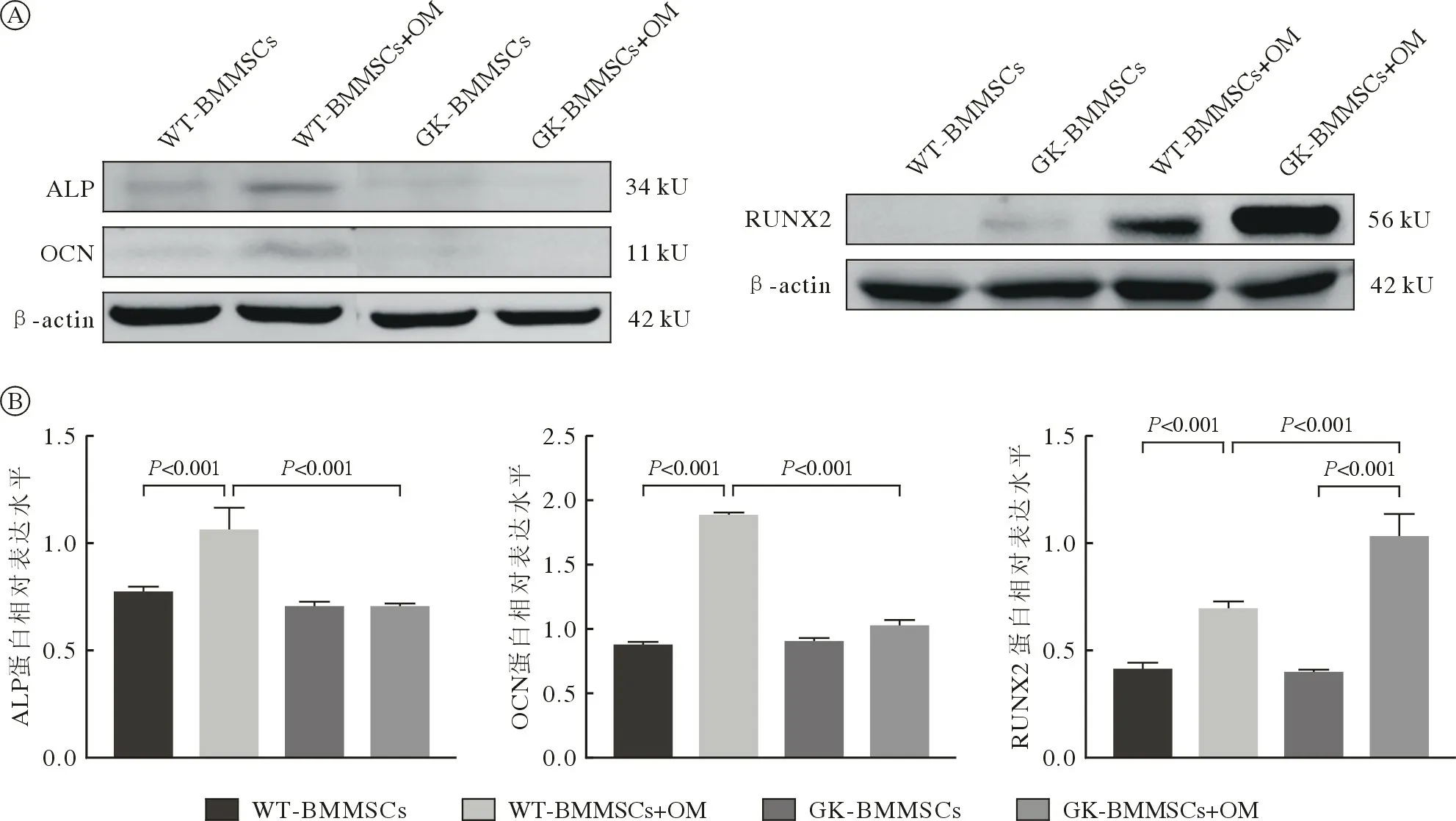
图9 成骨诱导7 d 正常与2 型糖尿病大鼠BMMSCs ALP、OCN、RUNX2 蛋白水平的表达A: ALP、OCN、RUNX2 蛋白的表达; B:ALP、OCN 、RUNX2 蛋白水平表达的定量分析(n=3)Fig.9 Western blot analysis of ALP, OCN, RUNX2 on day 7 after osteogenic differentiation A:Western blotting of ALP, OCN, RUNX2;B:Protein levels of ALP, OCN, RUNX2 quantified by densitometry (n=3)
5 WT-BMMSCs 和GK-BMMSCs成骨分化中miR-145-5p、SEMA3A 及β-catenin 的表达 qRT-PCR 结果显示,成骨诱导7 d 时WT-BMMSCs miR-145-5p表达显著低于未诱导组(P<0.05),GK-BMMSCs成骨诱导组的表达相反且显著高于WT-BMMSCs成骨诱 导 组(P<0.001)。WT-BMMSCs 和GKBMMSCs 成骨诱导组SEMA3A 的表达均显著低于未诱导组(P<0.001),GK-BMMSCs 成骨诱导组的表达显著低于WT-BMMSCs 成骨诱导组(P<0.05)。WT-BMMSCs 和GK-BMMSCs 成骨诱导组成骨通路关键蛋白β-catenin 的表达均显著高于未诱导组(P<0.01),GK-BMMSCs 成骨诱导组的表达显著低于WT-BMMSCs 成骨诱导组(P<0.01;图10)。Western blot 结果显示,WT-BMMSCs 和GK-BMMSCs 诱导组SEMA3A 表达均显著高于未诱导组,GK-BMMSCs 诱导组的表达与WTBMMSCs 诱导组无统计学差异(P<0.05;图11)。
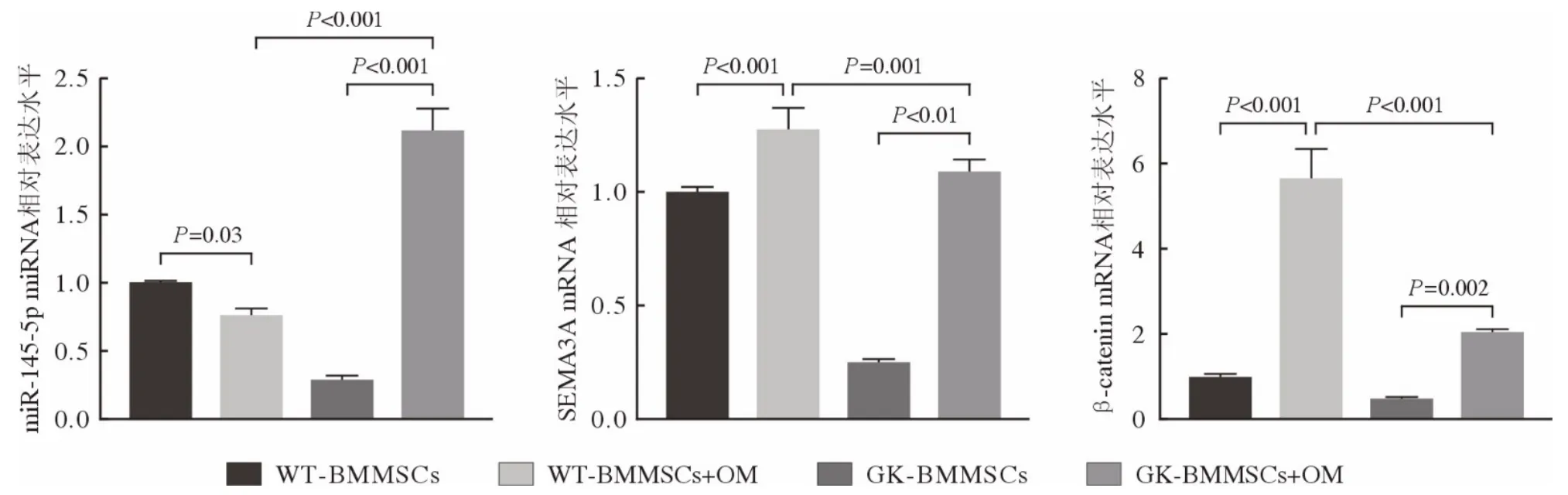
图10 成骨诱导7 d 正常与2 型糖尿病大鼠BMMSCs miR-145-5p、SEMA3A、β-catenin 的表达(n=3)Fig.10 Expression levels of miR-145-5p, SEMA3A, β-catenin on day 7 after osteogenic differentiation by real-time PCR (n=3)
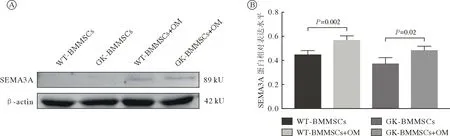
图11 成骨诱导7 d 正常与2 型糖尿病大鼠BMMSCs SEMA3A 的蛋白表达A:SEMA3A 蛋白的表达;B:SEMA3A 蛋白水平表达的定量分析(n=3)Fig.11 Western blot analysis of SEMA3A on day 7 after osteogenic differentiation A: Western blotting of SEMA3A; B: Protein levels of SEMA3A quantified by densitometry (n=3)
讨 论
糖尿病作为一种常见代谢性疾病,其引起的骨质疏松等疾病严重危害人类健康[14]。BMMSCs是理想的骨再生医学种子细胞,具有自我更新和多向分化潜能,其成骨分化功能降低是骨质疏松症发病的重要机制[13]。以往研究表明,糖尿病高糖微环境会导致BMMSCs 成骨分化能力降低从,而导致骨密度降低和骨再生障碍,其具体机制尚不十分清楚[5-6]。研究显示,miRNAs 在干细胞成骨分化中具有重要的作用。因此,本研究探讨了正常大鼠与2 型糖尿病大鼠BMMSCs 成骨分化能力及在成骨分化中miR-145-5p、SEMA3A、β-catenin表达的差异。
GK 大鼠是非肥胖自发Ⅱ型糖尿病大鼠模型,表现出与人类糖尿病相似的代谢、内分泌、血管疾病和糖尿病并发症。高血糖和胰岛素抵抗是T2DM 的主要症状。本研究中高脂高糖饲料喂养后GK 大鼠的高血糖符合T2DM 的特点。实验成功建立了稳定的2 型糖尿病大鼠模型[15]。我们培养的正常大鼠和2 型糖尿病大鼠BMMSCs 阳性表达间充质干细胞表面标志物,阴性表达造血干细胞表面标志物并能向成骨分化,符合干细胞特性[16]。2 型糖尿病大鼠BMMSCs 的增殖能力、细胞集落形成能力和成骨分化能力降低,这与以往研究结果一致[5,17],提示2 型糖尿病导致股骨BMMSCs 的功能障碍。有研究证实,干细胞在成骨分化过程中经历增殖期、分化期、矿化期和凋亡期四个阶段,而后形成骨细胞,在增殖期(1 ~7 d),增殖相关基因、COL1 和成骨分化相关基因RUNX2、OPN 高表达,ALP、OCN 低表达;在分化期(7 ~ 14 d),增殖相关基因、COL1 和成骨分化相关基因RUNX2、OPN 表达下降,ALP、OCN表达升高[18]。值得注意的是,在本研究中,培养7 d 时,2 型糖尿病大鼠BMMSCs 的增殖能力、细胞集落形成能力和成骨分化相关标志物ALP、OCN 的蛋白表达水平低于正常大鼠BMMSCs,而RUNX2 蛋白表达水平却高于正常大鼠BMMSCs。这些结果提示2 型糖尿病大鼠BMMSCs 从增殖期向分化期转变晚于正常大鼠BMMSCs。
研究表明,miR-145-5p 抑制细胞成骨成软骨分化。Zhu 等[8]报道miR-145-5p 靶向SOX9 抑制正常人脂肪间充质干细胞COL2、聚集蛋白聚糖的表达。Yu 等[19]报道miR-145-5p 抑制TLR4 信号通路降低正常人脂肪间充质干细胞成骨分化能力。Liu 等[10]报道miR-145-5p 靶向SEMA3A 降低Wnt通路基因 Wnt3a、Wnt10a 的表达,抑制2 型糖尿病大鼠脂肪间充质干细胞成骨分化相关基因ALP、RUNX2、COL1 的表达。我们的研究发现,在正常大鼠BMMSCs 成骨分化中,成骨分化相关标志物ALP、OCN、COL1、RUNX2 表达升高,miR-145-5p 表达降低,SEMA3A 和β-catenin 表达升高,这些结果与以上研究一致。提示miR-145-5p 可能通过靶向SEMA3A 调控β-catenin 来抑制正常大鼠BMMSCs 成骨分化。而在2 型糖尿病大鼠BMMSCs 成骨分化中,miR-145-5p、SEMA3A和β-catenin 表达均升高;miR-145-5p 和SEMA3A不是负向调控,可见miR-145-5p 在糖尿病源MSCs 成骨分化中有多种调控途径,其具体的调控网络仍存在争议,我们后续研究将进一步探讨。另有研究者报道在骨关节炎患者的软骨组织中,miR-145-5p 的表达显著高于非骨关节炎患者,miR-145-5p 靶向Smad4 降低 Sox-9、Col-2a1、聚集蛋白聚糖的表达,抑制骨关节炎患者源骨髓间充质干细胞的增殖和成软骨分化[9]。在我们的研究中,经成骨诱导后,2 型糖尿病大鼠BMMSCs miR-145-5p 的表达显著高于正常BMMSCs,SEMA3A和β-catenin 表达显著低于正常BMMSCs。这些结果提示miR-45-5p 在2 型糖尿病大鼠BMMSCs 成骨分化关键途径中也发挥重要的抑制作用。
综上所述,本研究结果提示,2 型糖尿病大鼠BMMSCs 细胞增殖、集落形成及成骨分化能力降低,我们推测正常大鼠BMMSCs 成骨分化中miR-145-5p 起抑制作用,2 型糖尿病大鼠BMMSCs 成骨分化中miR-145-5p 起促进作用,miR-145-5p 是否靶向SEMA3A 通过Wnt/β-catenin 调控成骨仍需要进一步研究。miR-145-5p 或许可作为治疗糖尿病引起的骨代谢疾病的关键靶点。
作者贡献戴雅文:细胞及分子生物学实验,文章撰写;鄂玲玲:课题设计,课题指导;郑颖、马小草:文章修改,文章审阅,文章校正;张戎:文献收集和整理;时权:统计分析;刘洪臣:写作指导,修订,终审论文。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:395298305@qq.com。

