晚期乳腺癌新发脑转移患者继续曲妥珠单抗治疗或更换TKI 治疗的疗效和安全性比较
陈佳欣,张会强,周金妹,吴雪雪,张少华,江泽飞,王 涛解放军医学院,北京 0085;解放军总医院第五医学中心肿瘤医学部,北京 0007;安徽医科大学,安徽 合肥 00;南方医科大学,广东 广州 5055
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2) 作为乳腺癌的驱动基因,其过度表达发生于20%的乳腺癌患者中,与患者的不良预后相关,但同时也是抗HER2 治疗的预测因子[1]。目前以抗HER2 抗体药物曲妥珠单抗为基础的方案是HER2 过度表达转移性乳腺癌患者的标准疗法[2-3]。然而约1/3 接受曲妥珠单抗治疗的患者最终会发生脑转移[4]。当伴有多个颅外转移(骨骼、肝和肺)时,HER2 阳性脑转移发生率更高[5-9]。脑转移患者治疗效果差[6-7,10],中位生存期仅17.1 ~ 23.5 个月[8,11]。研究显示,对于脑转移单发或合并颅外病灶稳定的曲妥珠单抗治疗患者,建议继续使用曲妥珠单抗治疗,可通过对颅外病灶的控制来提高总体生存率[12]。近几年,随着肿瘤靶向治疗的进步,越来越多小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)类药物在脑转移治疗中起到了积极作用[13]。拉帕替尼是靶向HER1、HER2 的可逆TKI 药物。在LANDSCAPE研究中,拉帕替尼联合卡培他滨治疗未经放疗的晚期乳腺癌脑转移患者颅内缓解率(central nervous system objective response rate,CNS-ORR)达57.1%,推迟放疗时间8.3 个月,对脑转移显示出较好是疗效[14]。吡咯替尼是靶向HER1/HER2/HER4 的不可逆强效TKI 药物。Ⅲ期PHENIX 研究显示,吡咯替尼能够推迟无症状晚期乳腺癌脑转移患者的脑部病灶进展时间[15]。在PERMEATE 研究中,吡咯替尼联合卡培他滨治疗放疗后进展的晚期乳腺癌脑转移患者CNS-ORR 为42.1%,无进展生存期(progression free survival,PFS) 为5.6 个月;治疗未经放疗的脑转移患者CNS-ORR 为74.6%,PFS为11.3 个月[16]。最新的NCCN 指南推荐对于新诊断的HER2 阳性乳腺癌脑转移患者,局部症状可控,可以首先考虑抗 HER2 药物治疗[17]。但对于在曲妥珠单抗类药物治疗过程中,颅外病灶稳定,而颅内病灶新发或进展的患者,继续抗体类药物治疗还是换用TKI 药物预后更好,并无大样本量研究数据给予临床实践指导。 因此,本项真实世界临床研究,将曲妥珠单抗治疗中颅外病灶稳定的新发脑转移患者分为继续曲妥珠单抗治疗和更换TKI 治疗两组,比较两组患者的疗效和安全性。为脑转移患者抗HER2 治疗药物选择提供临床证据。
对象与方法
1 研究对象 选取2007 年5 月 - 2021 年12 月就诊于解放军总医院第五医学中心的女性晚期乳腺癌患者。纳入标准 :(1)应用以曲妥珠单抗为基本方案治疗的晚期乳腺癌患者;(2)乳腺癌原发灶经组织病理学证实的HER2 阳性乳腺癌;(3)治疗后出现颅内转移并经MRI 证实的脑转移;(4)按照实体瘤评效标准(response evaluation criteria in solid tumors,RECIST) V1.1,至少存在1 个颅内可测量病灶;(5)重要脏器功能基本正常,ECOG 评分0 ~ 1 分,无治疗禁忌证。排除标准:(1) ECOG 评分大于2 分;(2)临床治疗数据失访者。
2 相关定义及标准 (1) HER2 表达: HER2 过表达定义为免疫组化膜染色分数为3+ 。HER2 阴性分为HER1+ 和0 分。当HER2 免疫组织化学(immunohistochemistry,IHC)评分不明确(2+)时,进行荧光原位杂交(fluorescence in situ hybridization,FISH) 检测。FISH 检测按照 ASCO/CAP 标准[18],HER2/CEP17 比值≥2.0 或 HER2 基因拷贝数≥6 时,则可判断为HER2 阳性。
(2)激素受体(hormone receptor, HR) 表达:IHC 法检测雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR) 的状态。ER、PR 免疫组织化学检测的阳性阈值为≥1%。其中 HR 阳性定义为ER 或PR 阳性,HR 阴性定义为ER 阴性且PR 阴性。
3 分组及治疗 按照治疗方案分为A、B 两组。A 组接受以曲妥珠单抗为主的治疗方案,而B 组接受以小分子TKI 治疗为主的治疗方案(本研究中包括拉帕替尼或吡咯替尼)。A、B 两组患者确诊脑转移后是否接受脑部局部治疗不做限制。
4 疗效评估 主要结局指标为总生存期(overall survival,OS) 和颅内无进展生存期(intracranial progression free Survival,IC-PFS);次要结局指标为客观缓解率和临床获益率。
指标定义: 可测量病灶均有治疗前的基线测量,定期进行影像学检查和测量,颅内病灶采用增强核磁检查评估颅内病灶大小。按照RECIST 1.1 标准:完全缓解(complete response,CR)为所有目标病灶消失;部分缓解(partial response,PR)为基线病灶长径总和缩小≥30%;进展(progressive disease,PD)为基线病灶长径总和增加超过20%,最小绝对值升高 5 mm 或出现新病灶;疾病稳定(stable disease,SD)为基线病灶长径总和有缩小但未达PR 或有增加但未达PD。客观缓解率(objective responserate,ORR) = CR + PR,临床获益率(clinical benefit rate,CBR) = CR + PR + SD≥6 个月,OS 为确诊乳腺癌至死亡时间,IC-PFS 定义为开始治疗至第1 次颅内病灶发生PD 的时间。无病生存期(disease free survival,DFS) 定义为从手术切除到局部复发的时间。
5 统计学方法 采用SPSS 22.0 完成所有统计检验。连续性变量符合正态分布以x¯±s表示,不符合正态分布以Md(IQR)表示, 两组间差异比较采用独立样本t检验(正态资料)或秩检验(偏态资料)。率的比较采用χ2检验或Fisher 精确概率检验。生存分析采用Kaplan-Meier 曲线预估无进展生存期、总生存期及置信区间,同时依据临床关注的重要指标(如HR 阳性表达) 采用log-rank 检验进行亚组生存分析。均为双侧检验,显著性水平α=0.05。
结 果
1 研 究 对 象 基 线 特 征 本 研 究 共 纳 入2007 年5 月 - 2021 年12 月就诊于解放军总医院第五医学中心的乳腺癌脑转移患者74 例,其中曲妥珠单抗组38 例,TKI 组36 例。两组患者均为女性,中位年龄分别为49.5 岁和44 岁,两组患者的中位DFS 分别为17 个月和16 个月。两组中位年龄、激素受体类型、TNM 分期、诊断时脑转移数目、是否脑膜转移、诊断脑转移后有无症状、颅外转移、既往曲妥珠单抗治疗PFS、脑部病灶是否接受局部放疗的差异均无统计学意义。患者基线信息见表1。
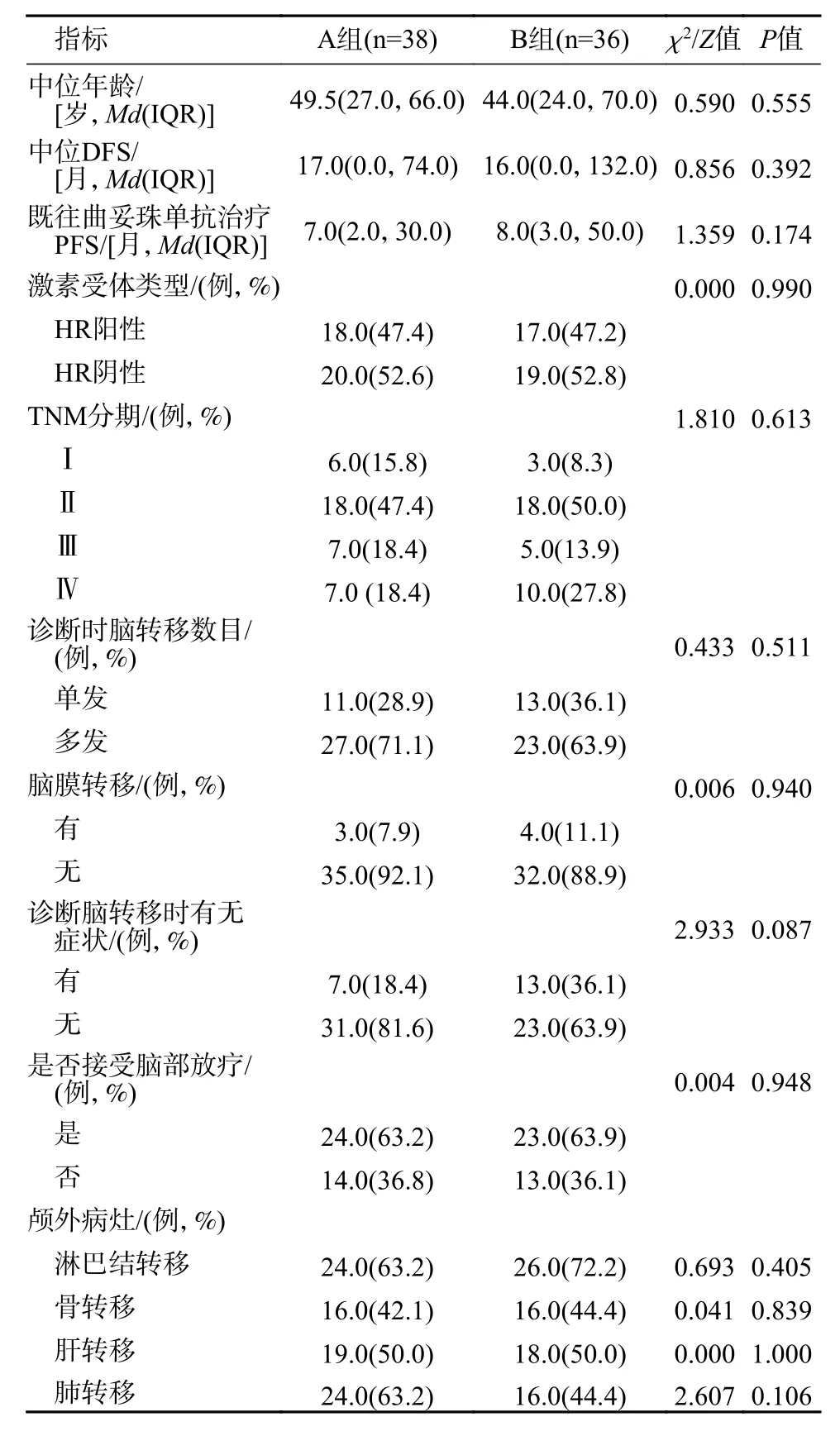
表1 乳腺癌脑转移患者基线信息Tab. 1 Baseline characteristics of breast cancer patients with brain metastases
截至2022 年4 月,A 组共38 例患者,其中25 例患者结束以曲妥珠单抗为主的方案治疗并观察到IC-PFS,25 例患者因为疾病进展或其他原因死亡;B 组共36 例患者,其中23 例患者结束以小分子TKI 为主的方案治疗并观察到IC-PFS,20 例患者因为疾病进展或其他原因死亡。
2 疗效及生存分析 曲妥珠单抗治疗脑转移患者的颅内病灶ORR 和CBR 分别为23.7%和63.2%,而TKI 组分别为41.7%和75.0%(表2)。对于既往接受曲妥珠单抗治疗有效、颅外病灶稳定的新发脑转移患者,继续曲妥珠单抗与换用TKI 治疗,两组中位颅内无进展生存期分别为9 个月和8 个月(P=0.400)(图1),两组中位总生存期分别为75个月和96 个月(P=0.140)(图2)。
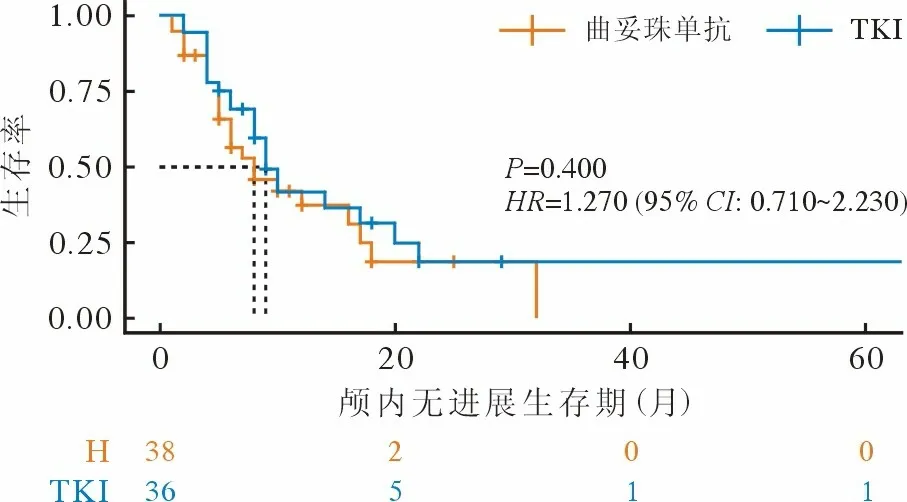
图1 两组颅内无进展生存曲线F ig.1 IC-PFS curves of the two groups
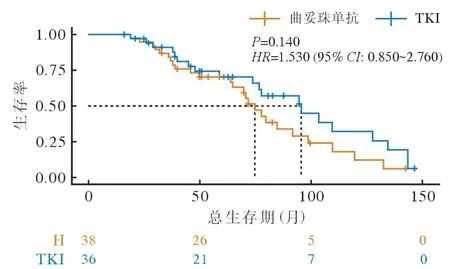
图2 两组总生存曲线F ig.2 OS curves of the two groups
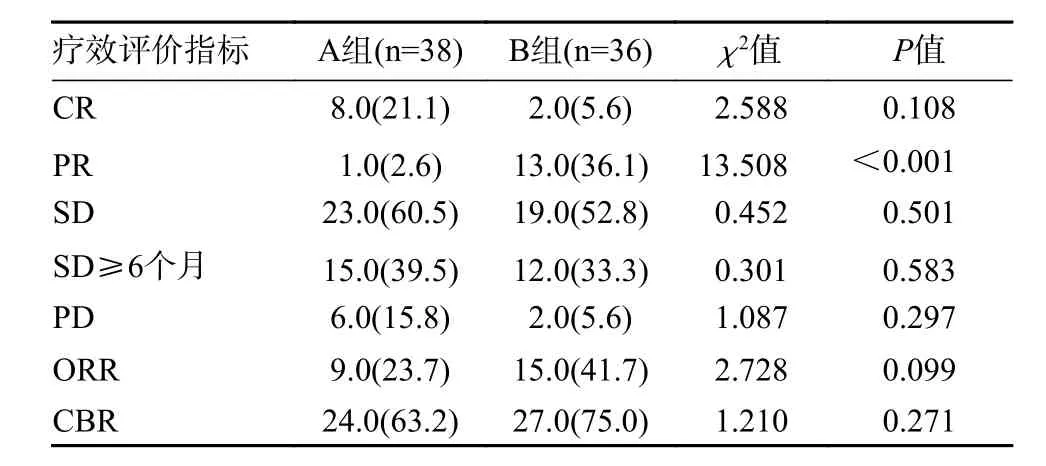
表2 两组患者颅内疗效比较(例,%)Tab. 2 Comparison of efficacy between the two groups (n, %)
3 HR 阳性和HR 阴性患者的生存分析 临床实践中知,HR 阳性可能与临床疗效和患者预后密切关联。进一步比较HR 阳性与HR 阴性患者的生存资料:接受TKI 治疗的新发脑转移患者中,相比HR 阴性患者,HR 阳性患者具有更长的IC-PFS(P=0.008)(图3)。接受曲妥珠单抗治疗的新发脑转移患者中,HR 阳性患者与HR 阴性患者的生存时间无统计学差异(P=0.241),但HR 阳性患者的ICPFS 比HR 阴性患者稍长(图4)。
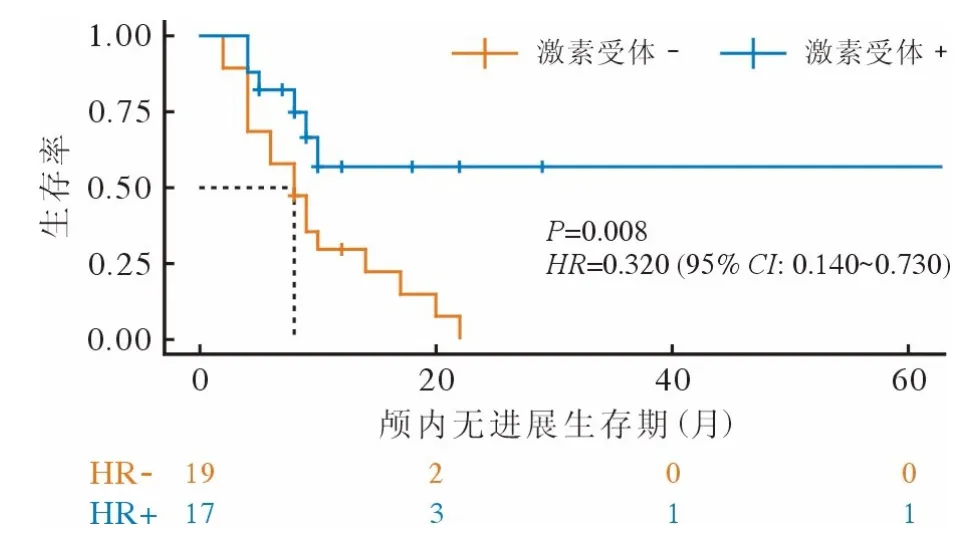
图3 TKI 治疗组激素受体阳性和激素受体阴性患者颅内无进展生存曲线Fig.3 IC-PFS curves of hormone receptor-positive and hormonereceptor-negative patients in the TKI therapy group
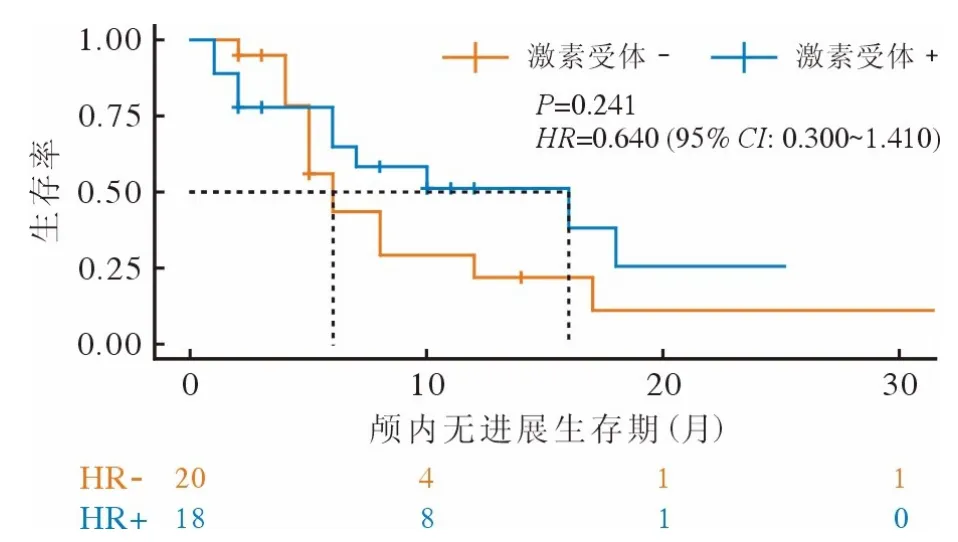
图4 曲妥珠单抗治疗组激素受体阳性和激素受体阴性患者颅内无进展生存曲线Fig.4 IC-PFS curves of hormone receptor-positive and hormonereceptor-negative patients in the trastuzumab group
4 安全性分析 两组患者均未发生急性脑水肿、认知功能障碍等严重不良反应,A 组最常见的不良反应为疲劳(28.9%),B 组最常见的不良反应为腹泻(75.0%)。A 组共有34.2%(13/38) 患者发生3 级以上不良反应,B 组共有41.7%(15/36)患者发生3 级以上不良反应。A、B 两组均未发生治疗相关死亡事件。见表3。
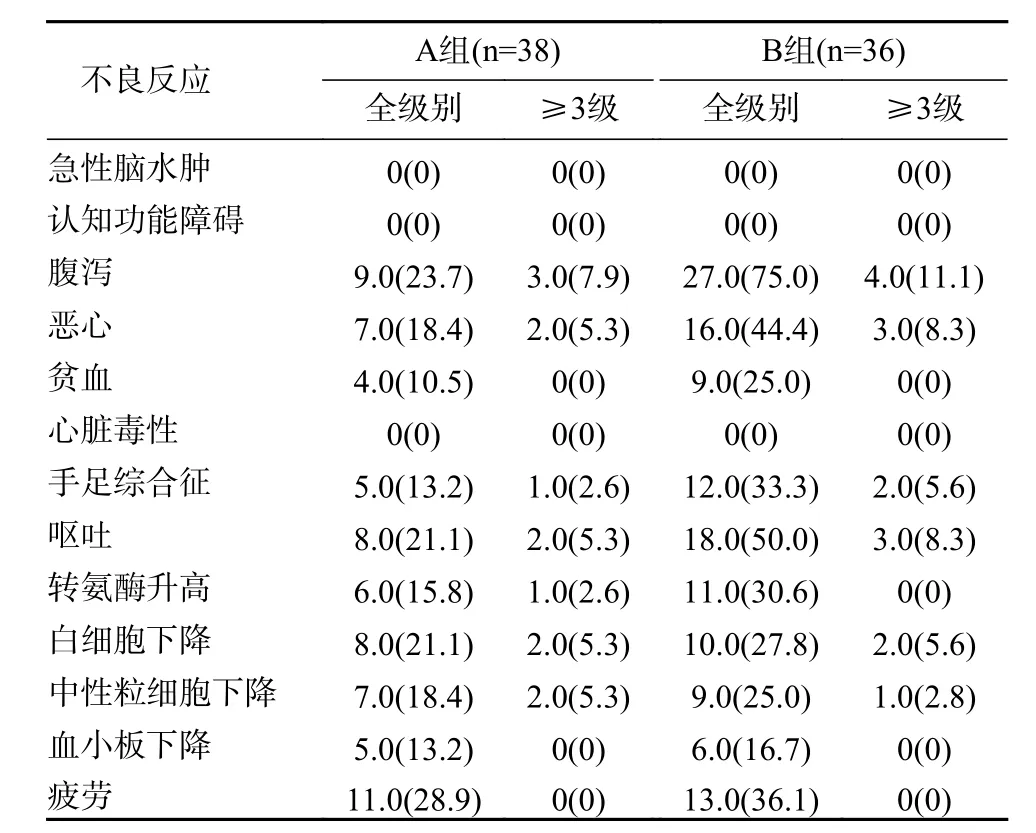
表3 两组治疗相关不良反应比较(例,%)Tab. 3 Comparison of treatment-related adverse reactions between the two groups (n, %)
讨 论
乳腺癌脑转移是目前威胁患者生命的主要因素,鉴于各新药临床试验的入组人群大多排除了乳腺癌脑转移患者,针对乳腺癌脑转移的治疗研究相对较少[19]。本研究是一项真实世界回顾性研究,主要入组人群包括接受曲妥珠单抗治疗有效、颅外病灶稳定的新发乳腺癌脑转移患者,拟比较该类患者继续曲妥珠单抗治疗与换用TKI 治疗的疗效和安全性,为脑转移患者提供更多治疗选择,以更好地改善HER2 阳性乳腺癌脑转移患者的生存。 既往研究显示,吡咯替尼联合卡培他滨治疗乳腺癌脑转移患者的CNS-ORR 为42.1% ~74.6%[15-16]。而 在 本 研 究 中,TKI 组 的ORR 和CBR 分别为41.7% 和75.0%,优于曲妥珠单抗治疗组,但低于既往已发表研究结果[20]。这可能与本研究治疗方案以TKI 类药物为主,对其联合用药未做限制有关,但本研究更能反映真实的临床信息。 研究表明,相较小分子TKI 类,大分子单克隆抗体类在透过血脑屏障方面不具有优势[21-22],但尚无前瞻性临床研究比较TKI 类药物与单克隆抗体类药物对脑转移病灶的疗效。一项比较曲妥珠单抗与拉帕替尼对新发脑转移患者疗效的回顾性研究显示,相比曲妥珠单抗治疗组,拉帕替尼治疗组的PFS 和OS 均未显示出生存获益(PFS:12.2 个月vs9.9 个月,P=0.09;OS:33.7 个月vs28.5 个月,P=0.28)[23]。现有指南对这一人群的治疗方案也无明确推荐,建议可考虑继续曲妥珠单抗靶向治疗,也可换用TKI 药物治疗。因此对于脑转移患者,仍需更多随机对照试验探索最佳治疗模式。 本研究发现,既往接受曲妥珠单抗治疗有效的患者换用TKI 药物,总生存更能表现出优势。CLEOPATRA 研究显示,抗HER2 靶向治疗可能延长患者的OS[24]。而小分子TKI 药物拉帕替尼联合卡培他滨的治疗方案已经在既往研究中证实对HER2 阳性晚期乳腺癌颅外病灶治疗有效,且LANSCAPE 研究首次证实抗HER2 的小分子TKI药物治疗HER2 阳性乳癌脑转移患者有效[14,25]。PHENIX 研究结果显示,脑转移患者吡咯替尼联合卡培他滨的PFS 可达6.9 个月,可以看到吡咯替尼治疗脑转移有一定效果[15]。最新的PERMEATE研究显示,吡咯替尼治疗乳腺癌脑转移患者PFS可达5.6 ~ 11.3 个月,与颅外病灶效果相当,似乎TKI 类药物对延长患者生存更具优势,筛选优势人群个体化治疗显得更加重要。 亚组分析显示,激素受体阳性的乳腺癌脑转移患者更能从TKI 的治疗中获益,而对于接受曲妥珠单抗治疗的患者,其激素受体状态似乎并不影响IC-PFS 时间。两组患者均未对患者接受内分泌治疗情况进行限定[26],因此TKI 治疗组具有更长的IC-PFS,而曲妥珠单抗组未显示出统计学差异,这可能与两组患者接受内分泌治疗情况不同有关。本研究对于筛选曲妥珠单抗或TKI 的最佳治疗人群借鉴意义较小,未来仍需开展更多前瞻性大样本量研究,探索适用脑转移患者的最优治疗模式。 本研究的安全性分析与既往已发表数据一致[16,24]。两组患者中均未出现急性脑水肿、认知功能障碍等严重不良反应,说明无论是曲妥珠单抗还是TKI 治疗的乳腺癌脑转移患者,总体安全性和耐受性尚可。 本研究仍然存在一定局限性,研究样本量较小,研究结果也存在一定的偏倚和混杂因素,未来仍需开展大型随机对照研究,更好地比较不同抗HER2药物对乳腺癌脑转移患者的疗效,选择最佳治疗人群,提高患者的生存期。
作者贡献陈佳欣:文章构思、数据收集分析、文章撰写等;张会强、周金妹、吴雪雪:数据收集分析;张少华、江泽飞:文章设计、撰写、修改等;王涛:文章构思、指导、撰写及修改工作。所有作者均审阅了手稿。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:amberchenjx@163.com。

