非梗阻性无精子症患者精浆蛋白质组学研究
轩 冉,薛丹丹,王春杨,鲍金凤,虞亚菲,段晋燕 解放军医学院,北京 0085;解放军总医院第一医学中心检验科,北京 0085;解放军总医院第一医学中心泌尿外科,北京 0085
男性不育中无精子症占5% ~ 10%,是男性不育患者十分严重的一种情况[1-2]。无精子症分为梗阻性无精子症(obstructive azoospermia,OA)和非梗阻性无精子症(non-obstructive azoospermia,NOA)两大类。OA 指睾丸内精子发生正常,但由于双侧睾丸网至射精管开口的任意部位生殖道梗阻,导致精子不能正常排出体外[3];NOA 指原发性睾丸功能衰竭或下丘脑/垂体功能异常等引起的生精功能障碍从而导致射出的精液中无精子,是无精子症中更严重的类型[4]。NOA 的病理生理学较复杂,遗传/先天性异常、泌尿生殖道感染、精索静脉曲张、创伤、内分泌失调等都可能与疾病发生发展相关[5]。目前,不明病因的NOA 临床鉴别诊断主要方法是睾丸活检,但侵入性手术可能导致NOA 患者更严重的性腺功能减退[5-6]。基于此,寻找鉴别NOA 病理亚型的非侵入性术前标志物具有重要临床意义。采用LC-MS/MS 进行蛋白质组学的高通量检测和分析,已广泛应用于疾病病理、发病机制及发生发展的新型生物标志物的鉴定[7-9]。本实验应用超高效液相色谱串联质谱技术,基于数据依赖采集(data-dependent acquisition,DDA)模式,比较NOA 不同亚型患者精浆差异表达蛋白,以期为NOA 不同亚型的病理生理提供分子生物学视角。
对象与方法
1 研究对象及 分组 收集2020 年10 月 - 2022年1 月于解放军总医院第一医学中心门诊行精液常规分析的非梗阻性无精子症患者精液,在精液常规分析检测后将样本分装,于-80℃冷冻备用。纳入标准:参照WHO《人类精液检查与处理实验室手册》第5 版标准,至少3 次精液常规分析中无精子,且睾丸活检证实为非梗阻性无精子症。排除标准:已知的获得性(如化疗、双侧隐睾和睾丸扭转等) 和遗传(核型畸变、Y 染色体AZF 缺失)等原因导致的非梗阻性无精子症。根据血清性激素[睾酮(testosterone,T)、卵泡刺激素(folliclestimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)] 水平将患者分为:(1)原发性性腺功能减退(primary hypogonadism,PH) 组,血清T 浓度低于正常值,且血清LH 和(或)FSH 浓度高于正常值;(2) 继发性性腺功能减退(secondary hypogonadism,SH)组,血清T 低于正常值,且血清LH 和(或)FSH 浓度正常或低下;(3)血清性激素水平正常组(NH 组)[10]。本研究通过解放军总医院医学伦理委员会审核批准(S2021-669-01)。
2 精液标本处理 取出冻存标本,3 000 r/min 离心10 min,留取上清(精浆)待用。采用NanoDrop微量分光光度计检测精浆蛋白浓度。5 µL 精浆与65 µL 金标水混合,95℃变性5 min;加入4 µL 1 mol/L 碳酸氢铵和8 µL 100 mmol/L 2-巯基乙醇,混匀后37℃孵育4 h;再加入9 µL 500 mmol/L 碘乙酰胺,室温避光40 min。取20 µL 上述溶液与60 µL 50 mmol/L 碳酸氢铵于新的EP 管进行酶切,以胰蛋白酶∶蛋白为1∶50 的比例加入胰酶后,37℃酶切12 ~ 16 h。过夜酶切后,加入9 µL 5%甲酸(formic acid,FA) 16 000 r/min 离心15 min;C18 膜经80 µL 100%甲醇活化及80 µL 0.1% FA平衡后,80 µL 样本经膜过滤3 次;加入80 µL 0.1% FA 800 × g 离心1 min 脱盐,此步骤重复3 次;用50%乙腈(acetonitrile,ACN)-0.1% FA-水混合液800 × g 离心1 min 洗脱样本,此步骤重复3 次;最后45℃下220 r/min 热干2 h 后收集样本。
3 LC-MS/MS 检测 0.1% FA 复溶后,各样品分别取350 ng 肽段上样。上样泵流动相由Loading pump A 液98% 水-2% ACN-0.05% FA 和Loading pump B、Loading pump C 液甲醇水-0.05% FA 构成,流速为2 µL/min。采用C18 色谱柱对样品进行分级,色谱柱以A 液100% 水-0.1% FA 平衡,以B 液20% 水-80% ACN-0.08% FA 洗脱,流速为0.6 µL/min,梯度:0 ~ 5 min,B 液0 ~ 10%;5 ~ 10 min,B 液10% ~ 12.5%;10 ~ 85 min,B 液12.5% ~ 27.5%;85 ~ 110 min,27.5% ~ 50%;110 ~115 min,维持B 液95%;115 ~ 120 min,95% ~ 5%。经色谱分离后的样品进样到Q-Exactive 质谱仪进行质谱测定,检测时长为120 min,检测方式为正离子,母离子扫描范围300 ~ 1400 m/z,一级分辨率为70000,AGC target 为3e6,一级Maximum IT 为60 ms。每次全扫描(full mass)为20 个循环计数(loop count),MS2 二级分辨率为17500,AGC target 为5e4,二 级Maximum IT 为80 ms,Isolation window 为3.0 m/z,Normalized CE/stepped NCE 为27 eV。
4 质谱结果分析 使用Proteome Discoverer 2.2.0软件将质谱原始raw 文件在Uniprot 蛋白数据库进行搜库计算分析,根据错误发现率(false discovery rate,FDR)<0.01 的标准对数据进行筛选。使用Perseus1.6.15 软件对搜库文件进行数据前处理,去除50%缺失值,将数据进行对数转换,之后做标准化处理。
5 生 物学 信息 处 理 筛 选 差异 蛋白 的 条 件 为:Student’st检 验P<0.05 且 差 异 倍 数>1.5 或<0.67 倍(|log2 fold change|>0.58)。使用SRING 11.0(https://string-db.org)对差异蛋白进行功能富集分析,包括GO 富集分析和Pathway 通路富集分析等,P<0.05 为显著富集的通路。
6 统计学分析 采用SPSS 26.0 对数据进行统计分析,呈正态分布的计量资料以x¯±s表示,多组间比较采用单因素方差分析。质谱原始数据去除50%缺失值后,剩余缺失值用中值以下高斯分布中的随机值代替。两组间差异蛋白质比较采用t检验,P<0.05 为差异有统计学意义;FDR 采用BH多重检验校正计算,以FDR<0.01 为过滤阈值。差异表达蛋白通路聚类分析采用Hyper geometry检验和BH 多重检验校正。
结 果
1 研究对象一般资料 共纳入患者21 例,年龄26 ~ 34 岁。按性激素水平(表1)将其分为原发性性腺功能减退组(12 例)、继发性性腺功能减退症(6 例)和性激素水平正常组(3 例)。由于非梗阻性无精子症患者多伴随性激素水平异常,故本研究中NOA 患者性激素水平正常组纳入例数较少。

表1 三组非梗阻性无精子症血清性激素水平Tab. 1 Sera sex hormone levels in three groups of NOA
2 差 异蛋 白 鉴 定 和筛 选 通 过Label-free 定 量蛋白质组学技术,三组患者精浆共鉴定出1144种蛋白质。与性激素水平正常组相比,原发性性腺功能减退组上调差异蛋白32 个、下调差异蛋白8 个,继发性性腺功能减退组上调差异蛋白14 个、下调差异蛋白99 个(表2,表3)。与继发性性腺功能减退组相比,原发性性腺功能减退组上调差异蛋白146 个、下调差异蛋白21 个(表4)。差异蛋白火山图中绿色代表下调蛋白,红色代表上调蛋白(图1)。

图1 差异表达蛋白火山图A:原发性性腺功能减退组和性激素水平正常组差异蛋白火山图;B:继发性性腺功能减退组和性激素水平正常组差异蛋白火山图;C:原发性性腺功能减退组和继发性性腺功能减退组差异蛋白火山图Fig.1 Volcano of DEPs A: primary hypogonadism group vsnormal sex hormone group; B: secondary hypogonadism group vsnormal sex hormone group;C: primary hypogonadism group vssecondary hypogonadism group
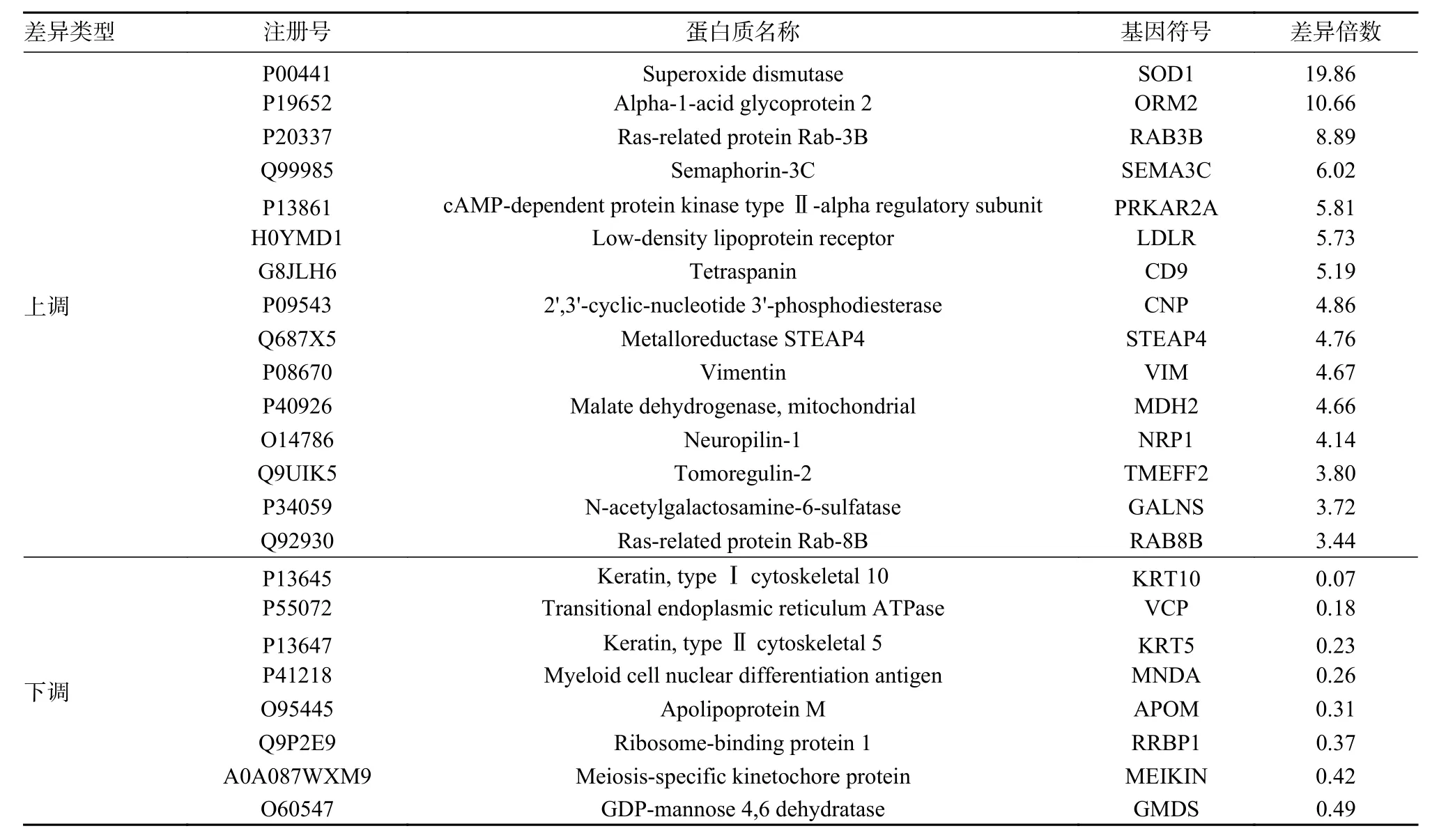
表2 原发性性腺功能减退组和性激素水平正常组主要差异蛋白Tab. 2 Details of the main DEPs in the primary hypogonadism group compared with normal sex hormone group

表3 继发性性腺功能减退组和性激素水平正常组主要差异蛋白Tab. 3 Details of the main DEPs in the secondary hypogonadism group compared with normal sex hormone group
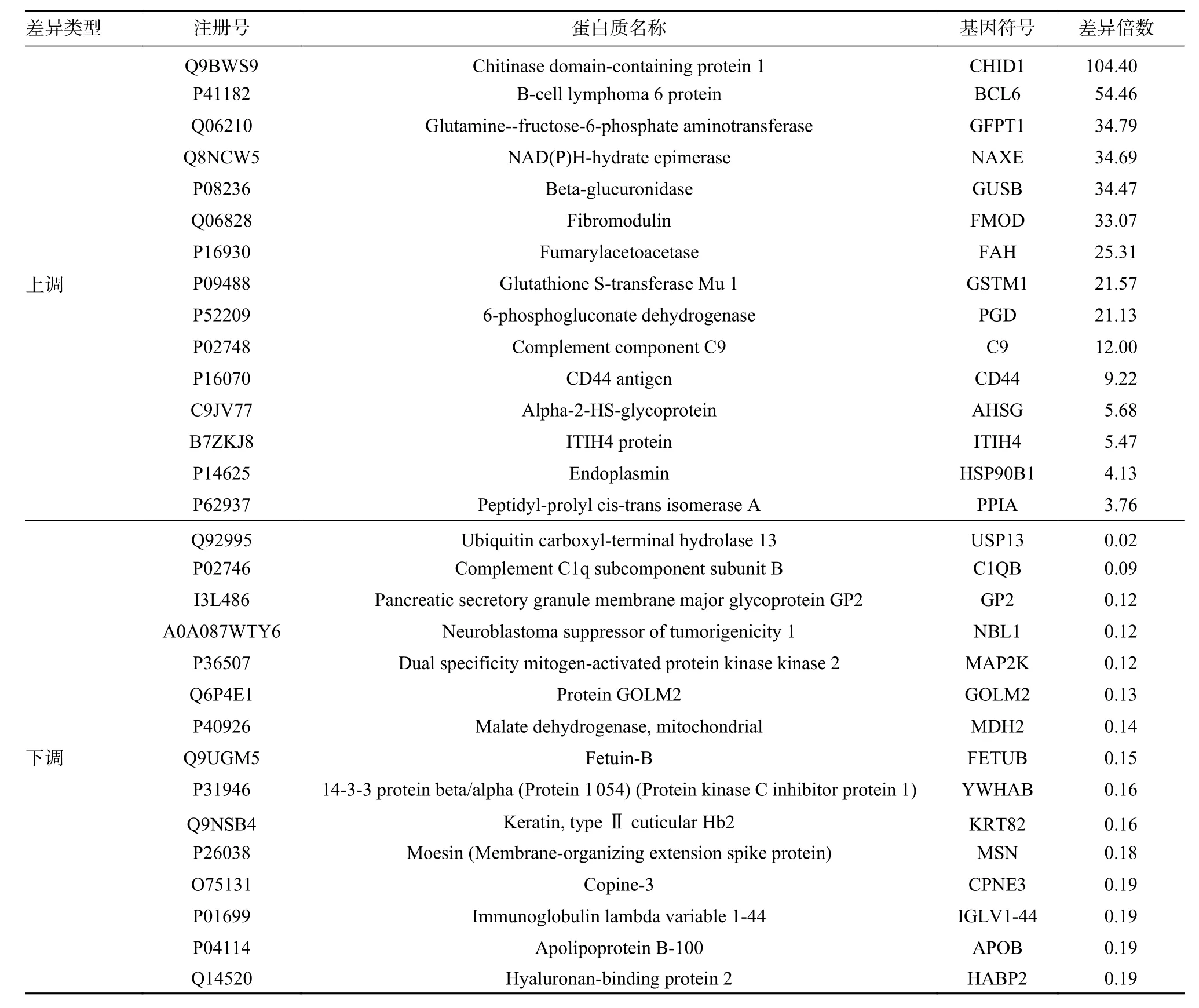
表4 原发性性性腺功能减退组和继发性性腺功能减退组主要差异蛋白Tab. 4 Details of the main DEPs in the primary hypogonadism group compared with secondary hypogonadism group
3 差异表达蛋白生物信息学分析 与性激素水平正常组相比,原发性性腺功能减退组的差异表达蛋白GO 富集分析中,主要参与的生物学过程包括嗜中性粒细胞脱颗粒、蛋白质运输和凋亡过程调节等,主要参与细胞组分包括胞外外泌体、质膜外区域、细胞囊泡和溶酶体等,主要参与的分子功能包括G 蛋白结合、蛋白质结构域特殊结合和肝素结合等(图2);在KEGG 通路分析中,差异表达蛋白主要富集于轴突导向和内质网中蛋白质加工(图3)。与性激素水平正常组相比,继发性性腺功能减退组的差异表达蛋白在GO 富集分析中,主要参加的生物学过程包括小分子化合物的代谢和分解、对外部及化学刺激的反应和胞外分泌调节,主要参与的细胞成分包括胞外外泌体和细胞囊泡,主要参与的分子功能包括酶催化活性和蛋白质结合(图4);在KEGG 通路分析中,差异表达蛋白主要富集于代谢途径(图5)。与继发性性腺功能减退组相比,原发性性腺功能减退组差异表达蛋白在GO 富集分中,主要参加的生物学过程包括细胞过程、代谢过程和对刺激及化学刺激反应,主要参加的细胞组分包括胞外区域和囊泡,主要参与的分子功能包括水解酶活性、酶催化活性和受体结合(图6);在KEGG 通路分析中,差异表达蛋白主要富集到溶酶体、糖降解、补体和凝血级联和阿米巴病(图7)。值得注意的是,在Tissue Expression 数据库中,继发性性腺功能减退组与性激素水平正常组间差异表达蛋白、原发性性腺功能减退组与继发性性腺功能减退组间的差异表达蛋白多富集于生殖系统、内分泌腺、男性内部生殖器官和男性生殖腺体等(图8)。
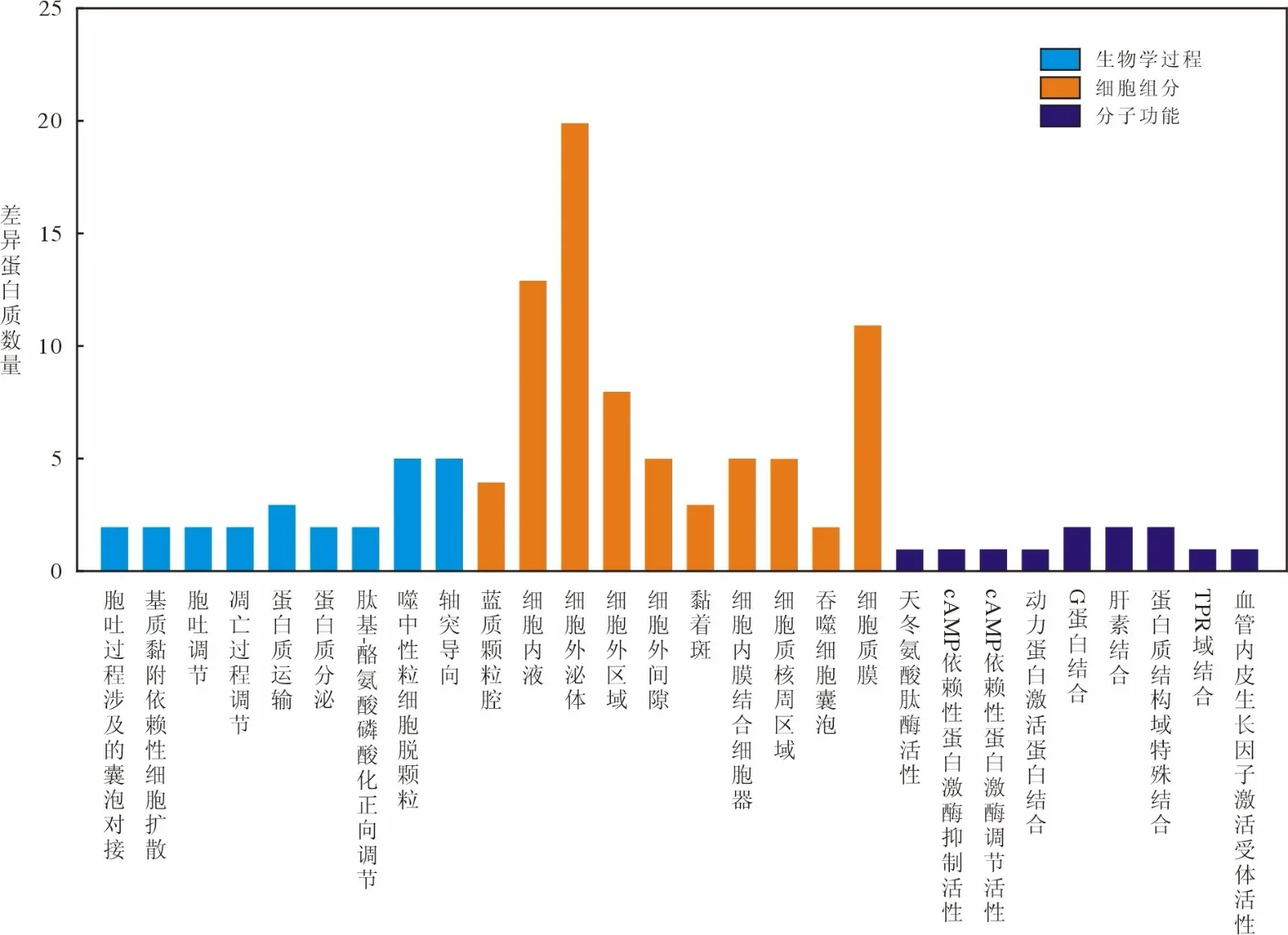
图2 原发性性腺功能减退组和性激素水平正常组差异蛋白GO 富集分析Fig.2 GO function analysis for DEPs of the primary hypogonadism group compared with the normal sex hormone group
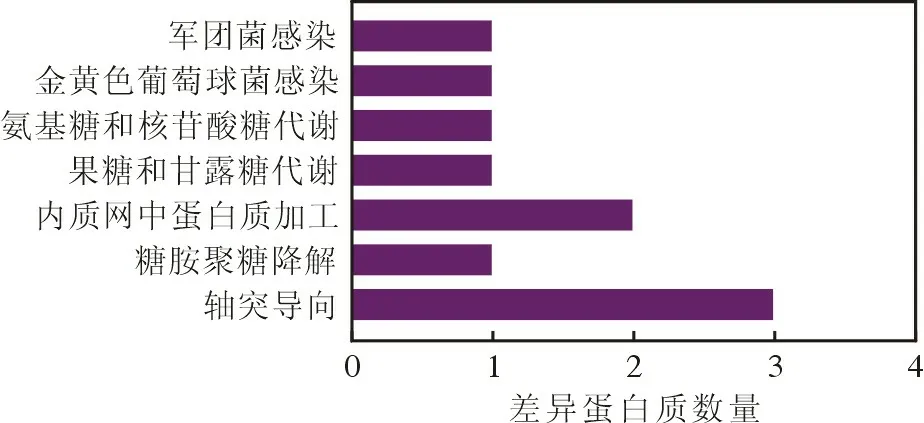
图3 原发性性腺功能减退组和性激素水平正常组差异蛋白KEGG通路Fig.3 KEGG pathway analysis for DEPs of primary hypogonadism group compared with normal sex hormone group

图4 继发性性腺功能减退组和性激素水平正常组差异蛋白GO 富集Fig.4 GO function analysis for DEPs of the secondary hypogonadism group compared with the normal sex hormone group

图5 继发性性腺功能减退组和性激素水平正常组差异蛋白KEGG通路Fig.5 KEGG pathway analysis for DEPs of the secondary hypogonadism group compared with the normal sex hormone group
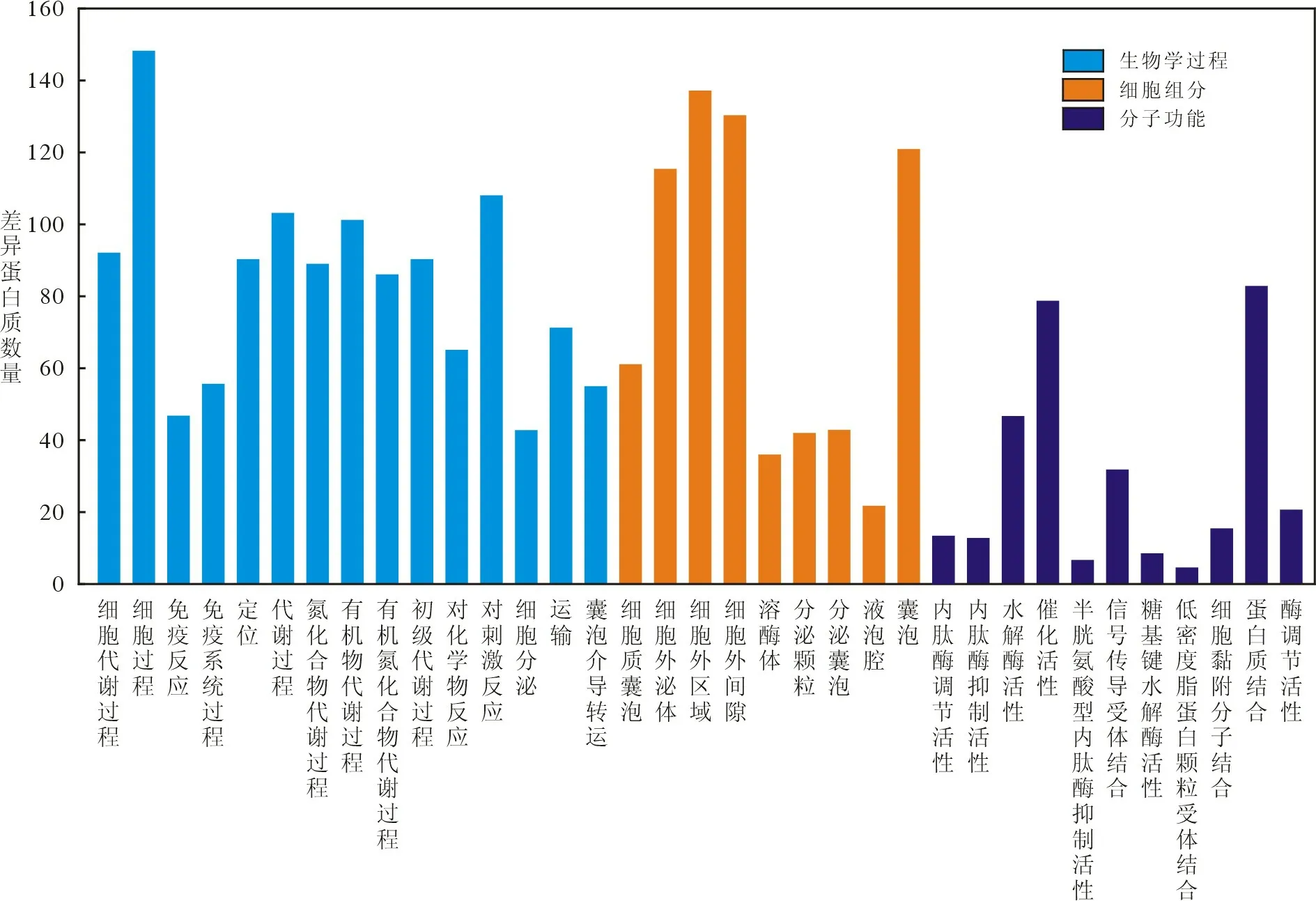
图6 原发性性腺功能减退组和继发性性腺功能减退组差异表达蛋白GO 富集Fig.6 GO function analysis for DEPs of the primary hypogonadism group compared with the secondary hypogonadism group
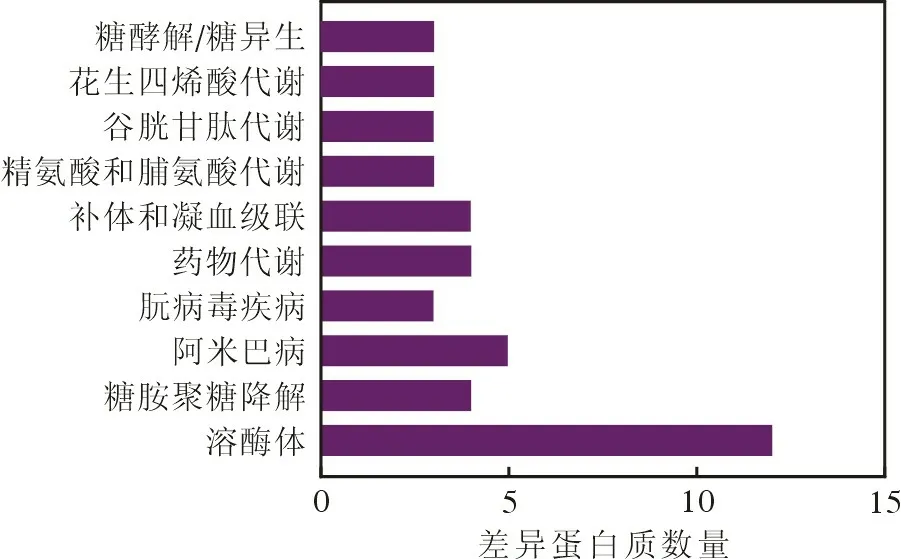
图7 原发性性腺功能减退组和继发性性腺功能减退组差异表达蛋白KEGG 通路Fig.7 KEGG pathway analysis for DEPs of the primary hypogonadism group compared with the secondary hypogonadism group

图8 差异表达蛋白Tissue Expression 富集B-C:继发性性腺功能减退组和性激素水平正常组;A-B:原发性性腺功能减退组和继发性性腺功能减退组。纵坐标为组间差异表达蛋白富集到该组织中的蛋白质数占总差异表达蛋白数的比例Fig.8 Tissue expression analysis for DEPs B-C: secondary hypogonadism group vsnormal sex hormone group; A-B: primary hypogonadism group vssecondary hypogonadism group. The ordinate is the ration of the number of DEPs enriched into the tissue to the total number of DEPs
4 蛋白质间相互作用(protein-protein interaction,PPI)分析 使用STRING 数据库进行PPI 分析。原发性性腺功能减退组与性激素水平正常组间差异表达蛋白的PPI 主要由STXBP2、SOD1、VCP、VIM、MDH2 和RAB8B 蛋白编码基因组成;继发性性腺功能减退组与性激素水平正常组间差异表达蛋白的PPI 主要由TPI1、PPIA、HSP90B1、ITIH4、AHSG、MDH2、CCT2、RPL18A、GNB2L1、C9 和CD44 蛋白编码基因组成;原发性性腺功能减退组与继发性性腺功能减退组间差异表达蛋白的PPI 主要由HSP90AA1、HSP90B1、CD44、ITIH4、APP、PPIA、CLU、APOM、AHSG、CTSD、TTR、LDHA 和C9 蛋白编码基因组成。结果表明,MDH2、PPIA、HSP90B1、ITIH4、AHSG、CD44 和C9 蛋白编码基因可能在非梗阻无精子症患者精子生成的调控网络中发挥重要作用(图9)。这些蛋白编码基因是首次被报道可能在非梗阻性无精子症患者精子生成调控网络中发挥作用,其中动物实验已证实MDH2 和HSP90B1 在精子发生调控起到重要作用。
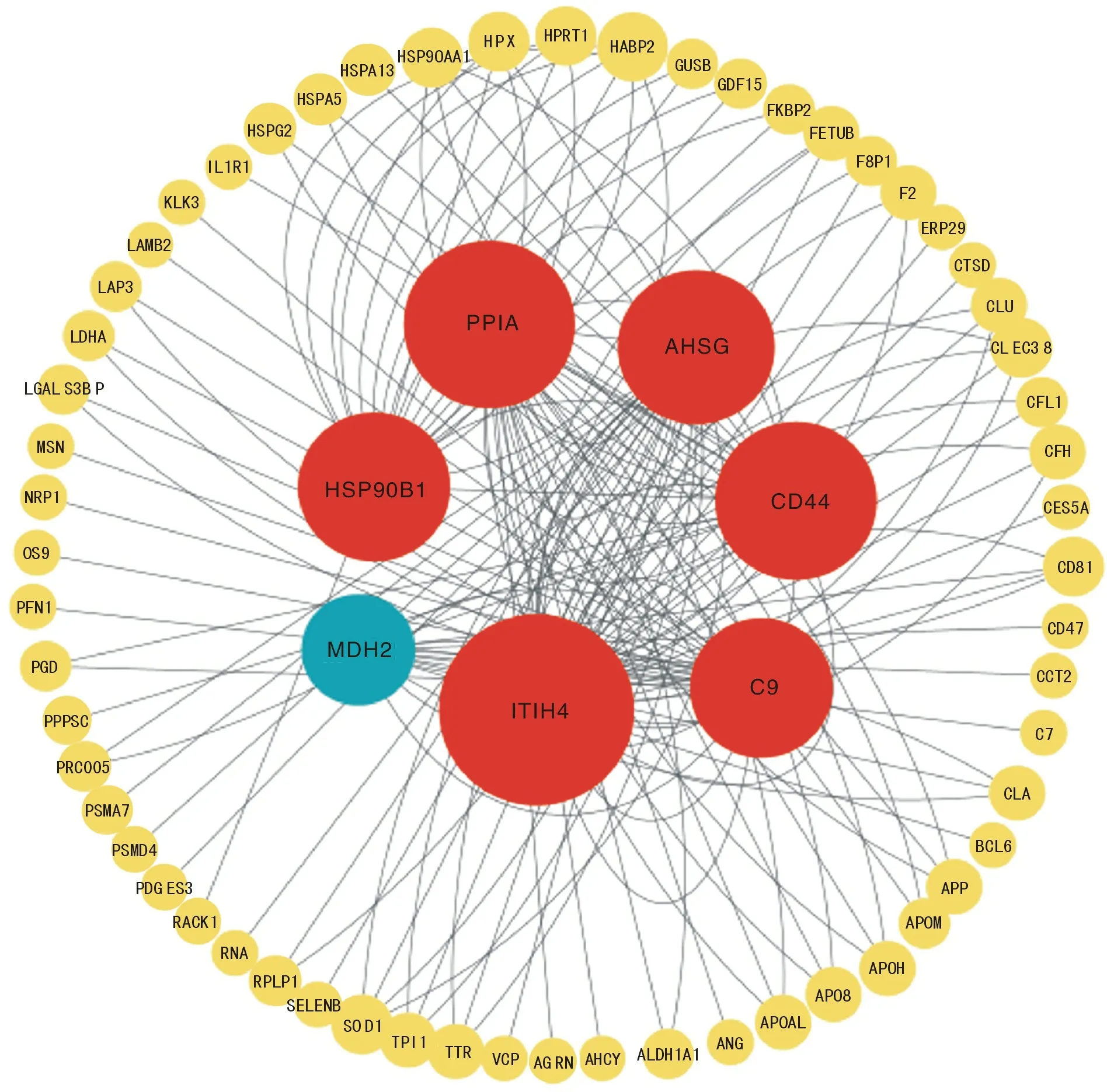
图9 差异表达蛋白间相互作用(PPI)橙色背景为上调蛋白(原发性性腺功能减退组>继发性性腺功能减退组);蓝色背景为下调蛋白(原发性性腺功能减退<继发性性腺功能减退组)Fig.9 Protein-protein interaction network of DEPs Orange background: up-regulated proteins (primary hypogonadism group > secondary hypogonadism group); Blue background:down-regulated proteins (primary hypogonadism group < secondary hypogonadism group)
讨 论
目前无非侵入性检测方法能够准确鉴别NOA亚型及预判患者睾丸中是否存在精子[11]。睾丸的主要功能包括精子产生和睾酮产生,睾丸疾病导致功能异常时为原发性性腺功能减退,而下丘脑或垂体疾病引起异常为继发性性腺功能减退[10,12]。睾丸精子发生受下丘脑-垂体-睾丸轴的调节,主要通过下丘脑分泌促性腺激素释放激素,作用于腺垂体的靶细胞,以分泌与合成LH 和FSH[13-14]。LH 作用于睾丸间质细胞,刺激睾丸合成分泌T,供精子生成需要;FSH 作用于睾丸精曲小管生精上皮的支持细胞,刺激性激素结合球蛋白的生成,刺激性激素结合球蛋白与T 结合使精曲小管内高T 状态,维持生精微环境,促进精子生成。目前国内外对NOA 的研究多集中于血清性激素联合评估睾丸功能,而蛋白质组学研究相对较少。研究发现,血清性激素升高或有所改变时生精功能受损[15];其中FSH 和抑制素B 水平分别与生精功能呈负相关和正相关,且联合检测较单项检测对睾丸生精功能的评估有更高的预测价值[1,4,16-17]。在蛋白组学研究方面,Yao 等[18]通过分析无精子症患者精浆外泌体蛋白组学,筛选出多种与男性不育相关的差异表达蛋白;还发现SLC5A12 和HIST1H2BA 在鉴别NOA 患者唯支持细胞综合征亚型时有100% 的敏感度和特异度。基于此,通过FSH、LH 和T 水平将NOA 患者进行分组,采用基于二级谱图质量更高的DDA 采集模式的质谱技术对精浆进行蛋白组学分析[19];初探NOA 相关的候选生物标志物,旨在分子水平为NOA 的发病机制和临床诊疗提供新视野。
本研究共发现1144 种蛋白质,分别有40 种、113 种和167 种蛋白质在性激素水平正常组与原发性性腺功能减退组间、性激素水平正常组与继发性性腺功能减退间、原发性性腺功能减退组与继发性性腺功能减退组间表达有显著差异。Tissue Expression 富集分析中,组间差异表达蛋白主要富集于生殖系统、男性内部生殖器官和男性生殖腺体等,说明这些差异蛋白可以作为筛选NOA 相关候选生物标志物的来源。PPI 分析表明,MDH2、PPIA、ITIH4、HSP90B1、AHSG、CD44 和C9 可能在NOA 患者精子生成调控网络中发挥重要作用。
MDH2 在三羧酸循环最后一步利用NAD+/NADH 作为辅因子催化苹果酸酯氧化为草酰乙酸。Muhammad Aslam 等[20]发现MDH2 减少会降低精子内部能量分布,从而影响精子生成、超活化和受精能力。本研究发现,与继发性性腺功能减退组相比,MDH2 在原发性性腺功能减退组低表达,进一步证实了MDH2 表达水平的降低会影响睾丸精子生成。此外,非梗阻无精子症患者MDH2 表达降低或可提示睾丸功能异常致NOA。
HSP90 是细胞中最丰富的蛋白质之一,在精子细胞中可调节激酶活性、调控减数分裂和精子成熟等过程[21]。目前发现HSP90 家族有4 个成员:HSP90α、HSP90β、GRP94、TRAP1。研究发现,缺乏HSP90α 亚型的雄性小鼠由于减数分裂阻滞导致不育;缺乏HSP90β 亚型的动物更容易产生圆头精子和顶体缺陷的精子;GRP94 和TRAP1 两种亚型对精子生成的具体调控机制尚不清楚[22]。2018年,有研究发现包括HSP90B1 在内的6 种热休克蛋白可能在NOA 发病机制中发挥作用[3]。HSP90B1定位于细胞内质网。本研究中在继发性性腺功能减退组低表达,我们推测其对精子生成的调控,可能是在滑面内质网通过调节脂质代谢影响性激素水平,从而在精子生成调控网络中发挥作用。
GO 分析表明,差异表达蛋白的主要功能包括小分子化合物的代谢和分解、胞外分泌、小分子生物合成、运输、对外部及化学刺激反应、酶活性、肽链内切酶调节活性和抑制活性、免疫反应等。这些结果提示,外部及化学刺激、小分子化合物合成分泌异常、酶调节异常等可能影响精原细胞分化、精母细胞减数分裂、精子细胞变态过程、类固醇加工、成熟和分泌,从而导致NOA。KEGG 富集分析中,差异表达蛋白主要富集于氨基酸代谢、溶酶体、糖降解、补体和凝血级联、系统性红斑狼疮、阿米巴病。这些结果表明,氨基酸代谢异常、溶酶体消化功能异常可能会引起下丘脑-垂体-性腺轴正负反馈调节异常,从而导致NOA;代谢途径异常、糖降解紊乱、补体和凝血级联紊乱可能会引起睾丸功能障碍从而导致NOA。其中,补体和凝血级联紊乱、糖代谢异常导致男性不育已有报道证实[11,23]。
总而言之,本实验采用基于DDA 的质谱技术,对NOA 患者精浆进行蛋白组学定性及相对定量分析,初步筛选出的差异表达蛋白在未来有望作为候选生物标志物。但它们确切的生物学功能和机制尚不清楚,因此进一步的实验研究对阐明它们在NOA 患者发病机制中所起到的作用至关重要。此外对差异表达蛋白的生物信息学分析,可在分子层面为NOA 患者发病机制研究及临床诊疗提供新的视野。本实验标本数较少,在接下来的研究中,将扩大样本量继续围绕本实验结果进行深入的验证与探索,以揭示导致NOA 的差异表达蛋白的潜在机制。
作者贡献轩冉:设计实验,实施研究,分析数据,撰写初稿;薛丹丹:采集样本,解释数据;王春杨:对文章的知识性内容作批判性审阅;鲍金凤:分析/解释数据;虞亚菲:调查研究,数据管理;段晋燕:实验设计指导,对文章的知识性内容作批判性审阅,获取研究经费和技术或材料支持。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:xuanxuanr2020@163.com。

