乳酸菌发酵对青稞β-葡聚糖加工特性及其耐缺氧和抗疲劳作用影响
姜敬维,李玟君,李建湘,宋青云,李玉蝶,汪海燕,李玮*
(1.陆军勤务学院,重庆 401331;2.湖北工业大学发酵工程教育部重点实验室,湖北 武汉 430068)
我国高原地区面积辽阔,约占土地面积1/6[1]。高原低氧环境会造成人体头痛、胸闷,甚至产生高原肺水肿等缺氧应激及疲劳应激反应[2]。相关研究表明,在高原缺氧环境下,官兵的运动能力和军事作业效能比平原地区下降20%~40%,显著影响高原部队的战斗力[3]。开发高原功能食品、预防或减轻高原反应、增强高原适应力并提高高原地区部队作战能力,对有效维护高原地区军民身体健康,提升我国高原地区经济竞争力具有积极的影响。
β-葡聚糖广泛存在于大麦和青稞等麦科作物中,在青稞胚芽中的含量尤其丰富[4-5]。目前针对青稞β-葡聚糖的研究主要集中在降血糖[6]、降血脂[7]、胆固醇调节机制[8-9]及应用等方面,青稞β-葡聚糖干预缺氧应激及疲劳应激的相关研究较少。本文以产生胞外多糖的乳酸菌—植物乳杆菌(Lactobacillus plantarum,LP)、保加利亚乳杆菌(Lactobacillus bulgaricus,LB)、鼠李糖乳杆菌(Lactobacillus rhamnosus,LR)分别对青稞进行发酵,研究乳酸菌对青稞中提取出的β-葡聚糖的加工特性的影响,通过动物实验建立抗氧化抗疲劳复合应激模型,研究不同乳酸菌发酵制备的青稞β-葡聚糖对小鼠抗缺氧疲劳功效的影响,为开发高原功能食品、服务高原地区军民提供参考。
1 材料与方法
1.1 主要试剂与设备
青稞粉(昆仑17 号):产自西藏自治区昌都市;昆明小鼠(雄性,SPF 级):华中科技大学动物实验中心,SCXK(鄂)2016-0009,体质量(20.4±2.2)g。植物乳杆菌、保加利亚乳杆菌、鼠李糖乳杆菌:湖北工业大学保藏;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(BC0175)、丙二醛(malondialdehyde,MDA)检测试剂盒(BC0025)、血尿素氮(blood urea nitrogen,BUN)检测试剂盒(BC1535)、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(BC0685)、乳酸(lactic acid,LA)检测试剂盒(BC2235):南京建成生物工程研究所;钠石灰:武汉鸿睿康试剂有限公司;葡萄糖标准品、耐高温α-淀粉酶(380 U/mg):阿拉丁试剂公司;其他试剂均为分析纯。
X3R 型高速冷冻离心机:美国Thermo Fisher Scientific 公司;DHR-1 流变仪:美国TA 仪器公司;1260 Infinity II 高效液相色谱仪:美国Agilent 科技有限公司。
1.2 方法
1.2.1 样品制备
参考陈瑜等[10]和谭翠[11]的方法,称取一定量青稞粉于500 mL 烧杯中,加入体积比为1∶2 蒸馏水,并在室温25 ℃下浸泡24 h。用纱布沥干水分后,置于蒸锅中常压下蒸煮20 min,并分装于250 mL 三角瓶中,冷却后分别接入植物乳杆菌(LP)、保加利亚乳杆菌(LB)和鼠李糖乳杆菌(LR),选择接种量、发酵温度、发酵时间为单因素,以β-葡聚糖的提取率为试验指标,进行L9(34)进行正交试验,具体因素与水平如表1 所示。以3 种乳酸菌最优工艺得到的纯化后青稞β-葡聚糖为样品(以LPG、LBG、LRG 表示)进行分析测试,以未发酵的青稞提取的β-葡聚糖做对照组(NFG)。
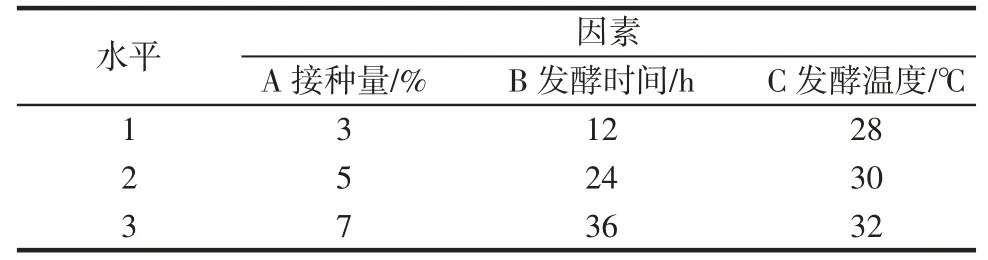
表1 因素与水平Table 1 Factors and levels
1.2.2 青稞β-葡聚糖的提取
参考谢昊宇等[12]和贾莹[13]的方法,青稞全粉加稀碱提取2 次,收集上清液(4 000 r/min 离心15 min),耐高温α-淀粉酶除淀粉,等电点法去除蛋白质(调节pH值至4.5,95 ℃水浴静置30 min,收集上清液,醇沉(真空减压浓缩,缓慢加入乙醇溶液使最终浓度为60%,4 ℃下静置20 h,离心收集沉淀,沉淀复溶,冷冻干燥得到青稞β-葡聚糖粗多糖。
1.2.3 青稞β-葡聚糖的纯化
取10 mg/mL 粗多糖溶液50 mL,缓慢加入27 g 硫酸铵,边加边搅拌后置于4 ℃条件下,静置10 h;4 000 r/min离心10 min,收集沉淀;将沉淀溶于20 mL 纯水中,加热溶解,冷却后,缓慢加入60 mL 无水乙醇,边加边搅拌,使各溶液体系中乙醇最终浓度达到75%,置于4 ℃冰箱静置10 h;重复离心3 次、收集沉淀、纯水溶解,加热溶解、冷却后,将溶液采用截留分子量为3 500 Da的有机膜进行处理,并按2 h/次的速率更换外层水溶液,直至样品溶液与0.5 mol/L BaCl2溶液滴加混合时,不产生任何沉淀;将样液于12 000 r/min 下高速离心20 min,去除溶液中可能存在的不溶性小颗粒,收集上清液,浓缩后进行冷冻干燥得青稞β-葡聚糖纯品。
1.2.4 分子量测定
配制浓度为1 mg/mL 的β-葡聚糖,过0.22 μm 水相膜待测,采用高效液相凝胶色谱联合折光示差和多角度光散射检测器测定其重均分子量(Mw)、数均分子量(Mn)、分子量分布系数(Mw/Mn)。色谱柱:OHpak SB-806 M HQ 和SB-805 HQ,8 mm×30 cm;流动相:0.1 mol/L NaCl 溶液,流速:0.5 mL/min,柱温:25 ℃;溶液的示差折光指数增量为0.138 mL/g;进样量:20 μL。
1.2.5 青稞β-葡聚糖的加工特性
青稞β-葡聚糖的溶解性、起泡能力、起泡稳定性、乳化稳定性和乳化性参考贾莹[13]的方法进行测定。
1.2.6 动物实验
将小鼠随机分为5 组,每组18 只并编号,供给实验食物及饮水。环境温度(25±2)℃,相对湿度(70±2)%。其中4 组每天固定时间以300 mg/(kg·d)的剂量将NFG、LPG、LBG、LRG 水溶液连续给药7 d,每天1 次,每次0.4 mL;另一组为对照组,给予等体积生理盐水,记为空白组(CK),每组数据取6 次平行均值。
1.2.6.1 耐缺氧实验
末次给药后1 h,每组取6 只小鼠进行常压密闭缺氧试验。常压密闭缺氧试验容器为40cm×40 cm×40 cm玻璃真空干燥器,内置竖隔板分成两室,底部放置钠石灰,每次放入2 只小鼠,分别进入一室,加盖密封。记录两只小鼠的放置时间,以及小鼠剧烈抽搐、呼吸停止时间。每次试验结束,更换钠石灰,记录小鼠的存活时间。
1.2.6.2 耐疲劳实验
末次给药后1 h,每组取6 只小鼠进行游泳(耐疲劳)试验。小鼠称重,记录体质量,将小鼠尾部固定体质量4%的铅片,置入65 cm×50 cm×40 cm 池中进行游泳实验,水温控制在(28±1)℃,水深30 cm,并记录每只小鼠的游泳时间,以头部沉没水中6 s 为试验终点,记录小鼠的存活时间。
1.2.6.3 指标检测
末次给药后1 h,将小鼠置入游泳箱内进行不负重游泳训练,时间为60 min,水温控制在(28±1)℃;游泳后30 min 进行眼球取血,按照试剂盒的使用说明测定小鼠体内LDH 和SOD 的活性以及MDA、LA 和BUN的含量。
将小鼠脱颈处死,取其肝脏,使用生理盐水进行清洗,并用滤纸除湿,按照试剂盒说明,测定肝脏内肝糖原含量。
1.3 数据处理
对所测得数据使用统计学方法分析,并采用Origin 2019 计算机统计软件处理,数据用平均值±标准差表示,采用t-检验进行显著性分析,显著性水平取0.05。
2 结果与分析
2.1 不同乳酸菌发酵对青稞β-葡聚糖提取率的影响
试验结果如表2 所示。

表2 LP、LB、LR 发酵提取β-葡聚糖正交试验结果Table 2 Experimental results of orthogonal extraction of β-glucan by LP,LB and LR fermentation
由表2 可知,植物乳杆菌(LP)提取青稞β-葡聚糖的最佳组合为A2B1C3,即接种量为5%,发酵时间为12 h,发酵温度为32 ℃,提取得到的β-葡聚糖含量为(5.07±0.19)%;保加利亚乳杆菌(LB)提取青稞β-葡聚糖的最佳工艺组合为A3B3C2,即接种量为7%,发酵时间为36 h,发酵温度为30 ℃,提取得到的β-葡聚糖含量为(5.14±0.22)%;鼠李糖乳杆菌(LR)提取青稞β-葡聚糖的最佳工艺组合为A3B2C1,即接种量为7%,发酵时间为24 h,发酵温度为28 ℃,提取得到的β-葡聚糖含量为(5.05±0.16)%。
2.2 不同乳酸菌发酵对青稞β-葡聚糖分子量分布的影响
采用高效液相凝胶色谱联合折光示差和多角度光散射检测器测定发酵前后β-葡聚糖粗提物的重均分子量(Mw)、数均分子量(Mn)和分子量分布系数(Mw/Mn),结果见表3。

表3 不同乳酸菌发酵提取β-葡聚糖的分子量参数Table 3 Molecular parameters of β-glucan extracted by different lactic acid bacterias
由表3 可知,LPG 和LBG 的Mw/Mn 均高于NFG,说明植物乳杆菌和保加利亚乳酸菌发酵能显著改善青稞β-葡聚糖的分子量分布。LRG 的Mw/Mn 最小,为1.00,说明鼠李糖乳杆菌制得的青稞β-葡聚糖中多糖均一性较高。
在发酵过程中,乳酸菌的酶解反应可能会促进天然青稞β-葡聚糖分子量的降解[9-10]。研究表明β-葡聚糖分子量的降低与微生物发酵关系密切。由于发酵过程中乳酸菌的酶解反应促使β-葡聚糖聚合物分子链断裂,从而导致样品分子量的降低[11-12]。
2.3 不同乳酸菌发酵对青稞β-葡聚糖加工特性的影响
天然多糖的起泡性能和乳化性能与多糖自身携带的亲水基团与疏水基团有关[13-17],其中良好的起泡性能和乳化性能可丰富食品加工体系的多样性[18]。β-葡聚糖的溶解性、起泡性和乳化性与其来源、分子量、结构、浓度等因素有关,是衡量其加工特性的重要指标[19-20]。青稞β-葡聚糖的溶解度、起泡性和乳化性等理化性质如图1 所示。
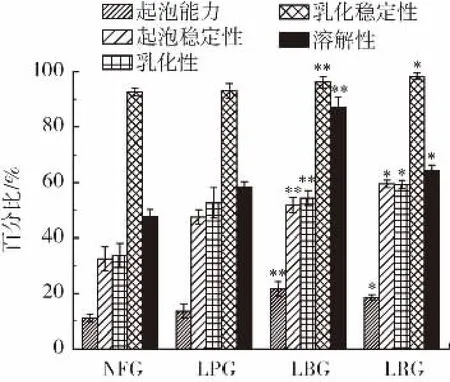
图1 乳酸菌发酵提取β-葡聚糖的加工特性参数Fig.1 The parameters of β -glucan extracted by lactic acid bacteria
如图1 所示,LPG、LBG、LRG 与NFG 相比均具有良好的溶解性、乳化性和起泡稳定性,LBG 的溶解性和起泡能力均高于LPG、LRG 和NFG,LRG 的起泡稳定性高于LPG、LBG 和NFG,LPG、LBG 和LRG 的乳化性均显著高于NFG,LPG、LBG 和LRG 的乳化稳定性与NFG 相比无显著差异。
2.4 发酵工艺对青稞β-葡聚糖耐缺氧和抗疲劳功效的影响
不同乳酸菌发酵提取β-葡聚糖对小鼠耐缺氧、抗疲劳功效的影响如图2 所示。

图2 乳酸菌发酵提取β-葡聚糖对小鼠缺氧存活时间和游泳存活时间的影响Fig.2 Effects of lactic acid bacteria fermentation extraction of βglucan on mouse survival time
由图2 可知,喂食β-葡聚糖组与CK 组相比,明显延长密闭缺氧小鼠的存活时间,证明β-葡聚糖具有耐缺氧的功效,其中LPG、LBG 和LRG 与NFG 相比,密闭缺氧存活时间延长了26.6%、42.3%和36.4%,延长效果均显著,说明乳酸菌发酵能显著提升β-葡聚糖小鼠耐缺氧的存活时间。喂食β-葡聚糖组与CK 组相比,明显延长游泳小鼠的存活时间,证明β-葡聚糖具有抗疲劳的功效,其中LPG、LBG 和LRG 与NFG 相比缺氧存活时间延长了22.6%、40.3%和42.4%,证明乳酸菌能显著提升β-葡聚糖的抗疲劳效果。
2.5 青稞β-葡聚糖对小鼠缺氧、疲劳应激生理指标的影响
小鼠抗疲劳能力与肝糖原含量直接相关,乳酸脱氢酶(LDH)水平的高低直接反映体内持续运动时的代谢能力,而SOD 有助于清除体内产生的自由基;LA、BUN、MDA 与运动产生的代谢废物有关[21-23]。不同乳酸菌发酵取得的β-葡聚糖对小鼠乳酸LDH、LA、肝糖原等指标的影响如表4 所示。
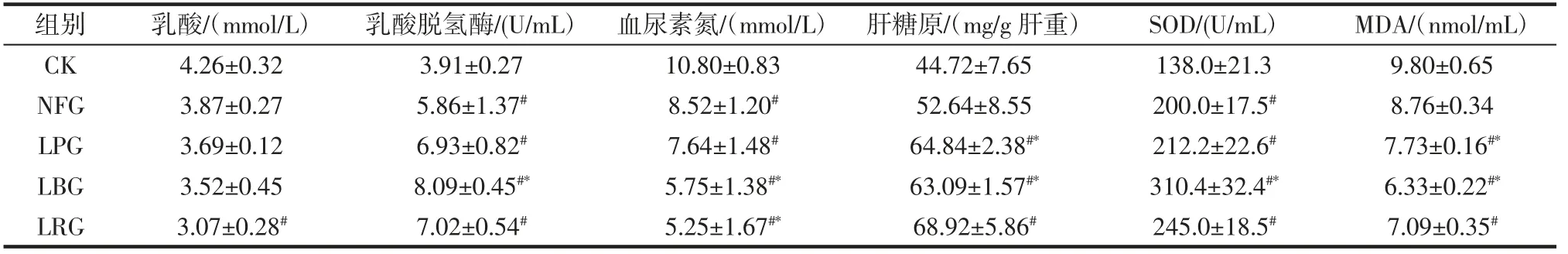
表4 乳酸菌发酵提取β-葡聚糖对小鼠生理指标的影响Table 4 Effects of β-glucan extracted by lactic acid bacteria fermentation on physiological indexes of mice
由表4 可知,LPG、LBG、LRG、NFG 与CK 相比,乳酸脱氢酶的含量明显提升,证明β-葡聚糖能提升小鼠体内LDH 的含量。其中LBG 组是CK、NFG 组的2.07 倍和1.38 倍,且高于LPG 和LRG 组16.74%和15.24%。LPG、LBG、LRG、NFG 与CK 相比,血尿素氮的含量明显降低,证明β-葡聚糖能降低小鼠体内BUN 的含量。LPG、LBG、LRG 和CK 相比,肝糖原的含量明显升高,其中LRG 组是CK、NFG 组的1.54 和1.31 倍,LRG 组LA 含量比CK 组降低38.76%。LPG、LBG、LRG、NFG与CK 相比,SOD 的含量明显提升,其中LBG 与CK、NFG 相比提高了124.93%和55.20%,LRG 与CK、NFG相比提高了77.54%和22.50%。LPG、LBG、LRG、NFG与CK 相比,MDA 的含量降低。证明β-葡聚糖能降低小鼠体内MDA 的含量,经乳酸菌发酵后得到的β-葡聚糖比未发酵得到的β-葡聚糖的MDA 含量要低。其中LBG 组最低。
3 结论
植物乳杆菌和保加利亚乳酸菌发酵能显著改善青稞β-葡聚糖的分子量分布鼠李糖乳杆菌制得的青稞β-葡聚糖中多糖均一性较高,保加利亚乳杆菌发酵后得到的β-葡聚糖起泡能力和溶解性都显著高于植物乳杆菌、鼠李糖乳杆菌及未发酵组,而鼠李糖乳杆菌发酵得到的β-葡聚糖起泡稳定性显著高于植物乳杆菌、保加利亚乳杆菌和未发酵组。
乳酸菌发酵能显著提升β-葡聚糖小鼠耐缺氧的存活时间和游泳存活时间,添加LBG 的鼠粮组的小鼠乳酸脱氢酶(LDH)含量均高于LPG 和LRG 组,添加LRG 的鼠粮组血尿素氮的含量远低于普通鼠粮组和空白组,添加LPG 的鼠粮组肝糖原的含量远高于普通鼠粮组和空白组,添加LBG 的鼠粮组能显著降低小鼠体内MDA、提升SOD。LRG 对小鼠血乳酸含量的影响比其他组降低更显著。
综上,3 种乳酸菌发酵后得到的青稞β-葡聚糖均能有效改善小鼠耐缺氧和抗疲劳的效果。这种改善效果可能与β-葡聚糖的分子量大小高度相关,植物乳杆菌、保加利亚乳杆菌和鼠李糖乳杆菌提升β-葡聚糖抗疲劳效果无显著性差异;植物乳杆菌和鼠李糖乳杆菌提升β-葡聚糖耐缺氧效果无显著性差异。

