糖尿病伴慢性牙周炎患者口腔菌群变化及其与龈沟液炎症因子的相关性研究
刘 芳,王 密,乔 柱,陈菁菁,赵 虎(保定市第一中心医院,河北保定 071000)
糖尿病人群牙周病发病率较高,约超过非糖尿病人群的三倍,且近年来呈上升趋势[1]。既往有研究发现牙周炎与糖尿病常互相影响、伴随发生,牙周炎不仅影响糖尿病患者的咀嚼功能,还可加重其机体代谢紊乱,增加并发症发生风险;而糖尿病患者对牙周炎的易感性增强,可加重炎症反应和骨吸收,二者互为疾病的高危因素和促进因素,严重影响患者的健康和生活质量[2-3]。炎症反应是糖尿病伴慢性牙周炎发生发展中的重要机制,龈沟液(gingival crevicular fluid,GCF)炎症因子水平与牙周炎症程度密切相关,并对该病的诊断治疗具有重要意义[4-5]。口腔菌群在慢性牙周炎发生发展中起重要作用,细菌在龈沟液中生长繁殖,可附着于牙周袋或牙齿表面构成以细菌为主体的微生态体系损害牙周组织,当宿主环境、pH 值等发生改变,其微生态平衡被打破,菌斑属性也随之发生变化[6],但其在糖尿病伴慢性牙周炎患者中的变化以及与龈沟液炎症因子的关系尚少有研究报道。鉴于此,本研究探讨口腔菌群在糖尿病伴慢性牙周炎患者中的变化,并分析其与龈沟液炎症因子水平的关系,旨在为临床治疗减轻糖尿病伴慢性牙周炎患者炎症反应提供新方向。
1 材料与方法
1.1 研究对象 选取保定市第一中心医院2022 年6~12 月收治的86 例糖尿病伴慢性牙周炎患者、88 例不伴糖尿病的慢性牙周炎患者分别作为A 组和B组,另于同期招募85例健康志愿者作为对照组。纳入标准:①A 组均符合糖尿病诊断标准[7],且糖尿病病情稳定,空腹血糖≤7.0mmol/L;②A,B两组均确诊为慢性牙周炎[8]且全口剩余牙齿≥16颗;③对照组均经全面体检确认健康;④均对本研究知情并签署同意书。排除标准:①侵袭性牙周炎或伴有牙髓病变者;②接受牙齿矫正、牙周洁治和抗生素治疗者;③近期使用抗菌漱口液者;④有免疫系统疾病、骨质疏松症等需持续使用抗炎和免疫抑制药物治疗者;⑤长期吸烟者;⑥孕期、哺乳期或围绝经期妇女。对照组男性50 例,女性35 例;年龄30~68(45.88±7.26)岁。A 组男性53 例,女性33 例;年龄33~69(46.17±8.03)岁;糖尿病病程2~10(8.43±1.47)年;慢性牙周炎病程5~23(12.58±2.17)个月;牙周炎严重程度[9]:轻度12例,中度47 例和重度27 例。B 组男性48 例,女性40 例;年龄30~68(46.29±7.88)岁;慢性牙周炎病程4~29(13.02±2.26)个月;牙周炎严重程度:轻度14 例,中度45 例和重度29 例。三组性别、年龄对比差异无统计学意义(χ2=0.912,t=0.064,P>0.05),A 组与B 组慢性牙周炎病程及程度对比差异无统计学意义(t=1.309,χ2=0.246,P>0.05)。
1.2 仪器与试剂 微生物DNA 提取试剂盒(天津科斯莫生物技术有限公司),PCR 仪[乐普(北京)医疗器械股份有限公司)],龈沟液炎症因子检测试剂盒(上海酶联生物科技有限公司)。
1.3 方法
1.3.1 口腔微生物属水平相对丰度检测:选择探诊深度不低于4mm 且有附着丧失的磨牙,刮去龈上菌斑后采用无菌Gracey 刮治器刮取牙周袋全部龈下菌斑,加入免疫组织化学磷酸盐缓冲液洗涤后取洗涤液于-80℃下保存备用;按照商品化微生物DNA 提取试剂盒说明书提取菌斑DNA;采用16S rDNA 高通量测序技术检测微生物属水平相对丰度,PCR 扩增目的片段引物:1 492R(5’-ACGGTTACCTTGTTACGACTT-3’)和27F(5’-AGAGTTTGATCCTGGCTCAG-3’),反应体系:10×PCR 缓冲液5μl,无菌去离子水50μl,dNTP 4μl,模板1μl,引物1492R 1μl,引物27F 1μl,Taq 酶0.5μl;反应程序:94℃5min,94℃45s,55 ℃40s,72 ℃90s 循环30 次,72 ℃10min。将获得的目的片段进行克隆后转化阳性的克隆子构建文库进行测序,分析菌群属水平的相对丰度,采用QIIME 软件分析菌群α 多样性,计算菌群Shahnon,Simpson,Chao1 多样性指数。
1.3.2 龈沟液炎症因子的检测:用滤纸条于颊侧近中、远中和舌侧近中、远中四个位点吸取龈沟液后将纸尖浸泡于200μl 磷酸盐缓冲液中30min,然后离心10min 取洗脱液,采用酶联免疫吸附法检测超敏C 反应蛋白(high sensitivity C-reactive protein,hs-CRP)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、白细胞介素-10(interleukin-10,IL-10)、白细胞介素-6(interleukin-6,IL-6)和白细胞介素-4(interleukin-4,IL-4)。
1.4 统计学分析 采用SPSS25.0 软件作为统计学工具,计量资料行正态性检验均符合正态分布,以均数±标准差(±s)描述,多样本计量资料比较采用单因素方差分析,两两比较采用Bonferroni法,需要调整检验标准α,α=α’/c,其中α’=0.05,c 为比较次数;计数资料以“率(%)”描述,采用χ2检验;采用Pearson 法分析糖尿病伴慢性牙周炎患者口腔菌群属水平的相对丰度与龈沟液炎症因子的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 三组口腔菌群属水平的相对丰度比较 见表1。三组乳杆菌属、双歧杆菌属、酵母菌属、肠球菌属、卟啉单胞菌属、韦荣球菌属、普氏菌属、奈瑟菌属、密螺旋体属水平相对丰度比较,差异均有统计学意义(均P<0.05),A 组乳杆菌属、双歧杆菌属、酵母菌属和肠球菌属水平相对丰度均低于B 组(t=8.220,15.774,8.217,9.362,均P=0.000)和对照组(t=29.680,35.305,32.720,37.617,均P=0.000),B 组均低于对照组(t=23.775,25.609,28.678,29.378,均P=0.000),差异具有统计学学意义。A 组卟啉单胞菌属、韦荣球菌属、普氏菌属、奈瑟菌属和密螺旋体属水平相对丰度均高于B 组(t=2.984,3.161,2.945,3.021,3.766,P=0.003,0.002,0.004,0.003,0.000)和对照组(t=23.179,14.742,12.199,10.780,26.805,均P=0.000),B 组均高于对照组(t=22.373,11.875,9.742,8.370,24.172,均P=0.000),差异具有统计学意义(均P=0.000)。
表1 三组口腔菌群属水平的相对丰度比较[±s(%)]

表1 三组口腔菌群属水平的相对丰度比较[±s(%)]
菌 属A 组(n=86)B 组(n=88)对照组(n=85)F 值P 值乳杆菌属3.52±0.614.38±0.768.50±1.43611.5110.000双歧杆菌属8.47±1.7613.54±2.4228.95±5.08846.5260.000酵母菌属1.44±0.271.83±0.354.96±0.96865.0540.000肠球菌属1.51±0.261.99±0.404.58±0.72944.5800.000卟啉单胞菌属20.28±3.4318.84±2.9210.53±1.82300.2210.000韦荣球菌属9.35±1.788.53±1.645.95±1.17111.4090.000普氏菌属27.29±5.4624.99±4.8318.73±3.4976.8540.000奈瑟菌属13.17±2.5212.10±2.149.71±1.5660.0780.000密螺旋体属12.68±2.2811.44±2.065.64±0.82356.3610.000其它2.35±0.432.42±0.462.45±0.491.0640.347
2.2 三组口腔菌群α 多样性分析 见表2。三组Simpson 指数、Chao1 指数比较差异均无统计学意义(F=1.044,2.789,均P>0.05),Shahnon 指数比较差异有统计学意义(F=6.537,P=0.002),A组和B 组Shahnon 指数均高于对照组(t=3.599,2.528,P=0.000,0.012)。
表2 三组口腔菌群属α 多样性分析(±s)

表2 三组口腔菌群属α 多样性分析(±s)
类别A 组(n=86)B 组(n=88)对照组(n=85)F 值P 值Shahnon 指数5.44±0.485.35±0.365.24±0.186.5370.002 Simpson 指数0.93±0.070.91±0.180.95±0.251.0440.354 Chao1 指数2 496.26±718.222 574.13±745.372 736.98±558.062.7890.063
2.3 三组龈沟液炎症因子水平比较 见表3。三组龈沟液hs-CRP,TNF-α,IL-10,IL-6 和IL-4 水平比较,差异具有统计学意义(均P<0.05)。A 组龈沟液IL-10 水平均低于B 组和对照组(t=4.657,11.559,均P=0.000),B 组均低于对照组(t=7.378,P=0.000)。A 组龈沟液hs-CRP,TNF-α,IL-6,IL-4 水平均高于B 组(t=17.065,27.033,5.863,3.461,P=0.000,0.000,0.000,0.001)和对照组(t=38.806,39.822,14.549,6.327,均P=0.000),B 组均高于对照组(t=26.347,10.909,9.081,2.949,P=0.000,0.000,0.000,0.004),差异具有统计学意义。
表3 三组龈沟液炎症因子水平比较(±s)
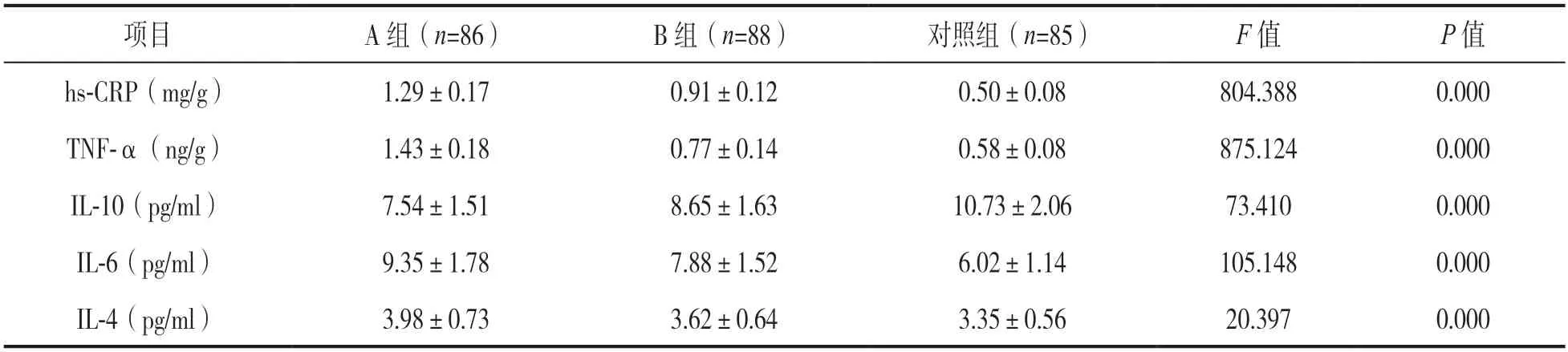
表3 三组龈沟液炎症因子水平比较(±s)
项目A 组(n=86)B 组(n=88)对照组(n=85)F 值P 值hs-CRP(mg/g)1.29±0.170.91±0.120.50±0.08804.3880.000 TNF-α(ng/g)1.43±0.180.77±0.140.58±0.08875.1240.000 IL-10(pg/ml)7.54±1.518.65±1.6310.73±2.0673.4100.000 IL-6(pg/ml)9.35±1.787.88±1.526.02±1.14105.1480.000 IL-4(pg/ml)3.98±0.733.62±0.643.35±0.5620.3970.000
2.4 A 组口腔菌群属水平的相对丰度与龈沟液炎症因子的相关性 见表4。A 组乳杆菌属、双歧杆菌属、酵母菌属和肠球菌属水平相对丰度与龈沟液IL-10 水平均呈正相关(均P<0.05),与龈沟液hs-CRP,TNF-α,IL-6 和IL-4 水平均呈负相关(均P<0.05);A 组卟啉单胞菌属、韦荣球菌属、普氏菌属、奈瑟菌属和密螺旋体属水平相对丰度与龈沟液IL-10 水平均呈负相关(均P<0.05),与龈沟液hs-CRP,TNF-α,IL-6 和IL-4 水平均呈正相关(均P<0.05)。
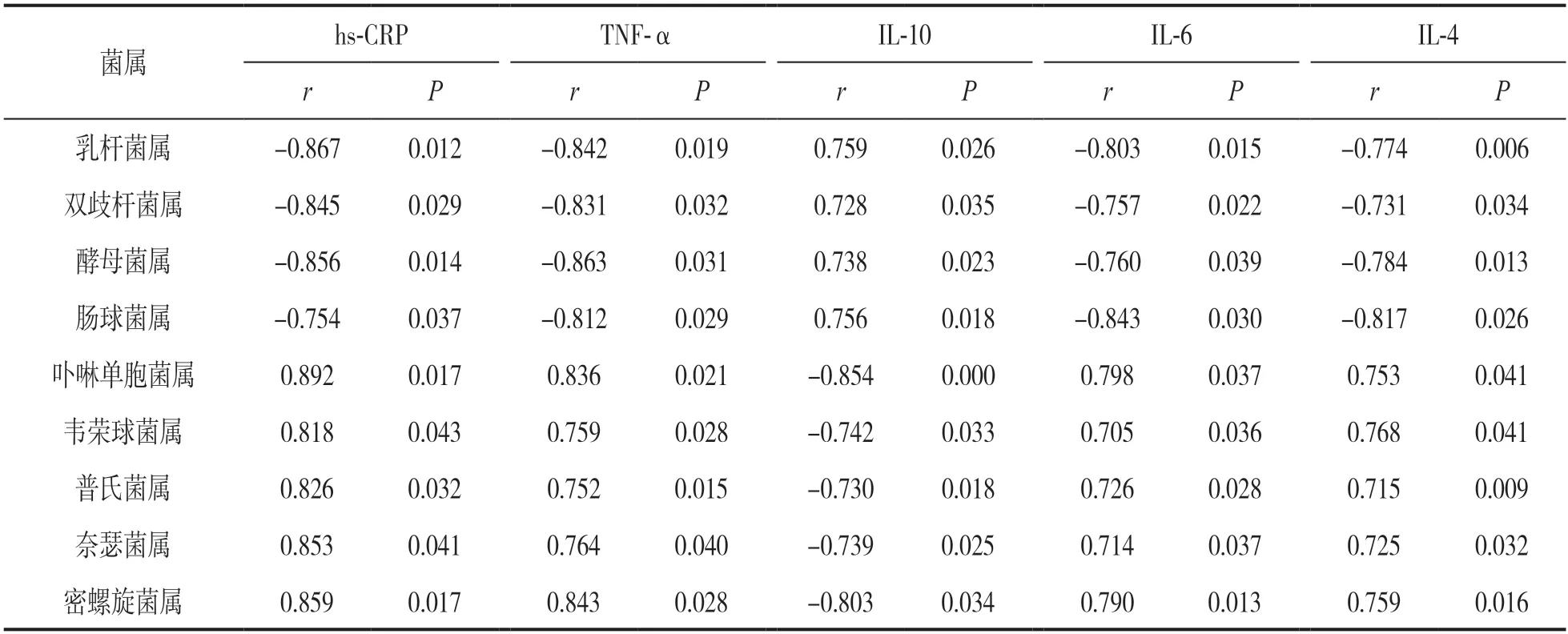
表4 A 组口腔菌群属水平的相对丰度与龈沟液炎症因子的相关性
3 讨论
近年来,糖尿病伴慢性牙周炎逐渐多发,越来越受临床关注。目前临床对于糖尿病伴慢性牙周炎患者常采取洁治、刮治、抗感染等治疗,虽能改善症状,但长期疗效不佳[10]。糖尿病与牙周炎在免疫、代谢紊乱方面联系密切,有研究指出,糖尿病和牙周炎共同作用使得患者口腔长期处于炎症状态,导致牙周组织发生病理改变,加重牙周组织损伤;另外糖尿病伴慢性牙周炎患者在糖脂代谢紊乱和炎症作用下会导致口腔菌群发生改变,致病菌大量繁殖产生毒性物质,加重牙周损害和疾病进展,对患者健康造成严重影响[11-12]。基于此,本研究尝试探讨糖尿病伴慢性牙周炎患者口腔菌群变化及其与龈沟液炎症因子的关系,以为临床治疗提供新思路。
本研究结果显示A 组乳杆菌属、双歧杆菌属、酵母菌属和肠球菌属水平相对丰度均低于B 组和对照组,B 组均低于对照组;A 组卟啉单胞菌属、韦荣球菌属、普氏菌属、奈瑟菌属和密螺旋体属水平相对丰度均高于B 组和对照组,B 组均高于对照组,提示口腔菌群失调参与糖尿病伴慢性牙周炎的发生发展过程。口腔微生物包含多种细菌、真菌和病毒等,是牙周炎发病的始动因子,微生物堆积在牙龈和牙齿结合面以及牙龈沟内,微生物之间相互作用影响牙菌斑微生物的性质、毒力以及在生物膜中的定植,导致口腔微生态改变,其中乳杆菌属、双歧杆菌属、酵母菌属和肠球菌属均是口腔有益菌,可维持口腔酸性环境,帮助抑制有害菌群的滋生,还能与有害菌群竞争牙斑生物膜位点,减少有害菌群的定植;而卟啉单胞菌属、韦荣球菌属、普氏菌属、奈瑟菌属和密螺旋体均属有害致病菌,可定植在牙菌斑中形成致病性生物膜,释放毒性产物,造成免疫紊乱,引起牙周组织破坏,是牙周炎的主要致病因素[13-14]。在正常人群中牙周菌斑量相对较低,多以共生菌为主,但当牙周菌斑堆积过多时刺激牙周组织引发慢性炎症,同时含有营养成分的龈沟液为牙周致病菌的繁殖提供良好的培养基,口腔微生态逐渐失衡,致病菌群成为优势菌群进一步加剧炎症反应,破坏牙周组织,导致牙周组织附着丧失、牙槽骨吸收。另外有研究发现[15],糖尿病中糖基化血红蛋白能够促进细菌生物膜形成,增加口腔卟啉单胞菌的致病潜力,并且糖尿病患者唾液中微生物代谢途径中ABC 转运蛋白通路遭到破坏,可能是糖尿病患者牙周病发生的重要机制。既往谢芬等[16]报道,2 型糖尿病并发牙周炎患者变黑普氏菌、中间普氏菌和牙龈卟啉单胞菌等病原菌水平均高于单纯牙周炎患者,这与本研究结果一致,证实了糖尿病伴慢性牙周炎患者口腔菌斑微生物的占比会发生改变,致病菌取代有益菌成为优势菌,造成口腔菌群失调,破坏牙周组织。另外,口腔菌群α 多样性分析结果显示,三组Simpson 指数、Chao1 指数无明显差异,A 组和B 组Shahnon 指数均高于对照组,提示糖尿病伴慢性牙周炎和单纯慢性牙周炎患者相较于健康人群口腔菌群多样性升高,可能由于糖尿病、牙周炎病理改变更有助于菌群在牙周附着和生长,导致菌群多样性增加。另外,研究结果显示A组和B 组Shahnon 指数相近,既往相关研究[17-18]也均报道糖尿病伴慢性牙周炎和单纯慢性牙周炎患者菌群多样性相似,菌群差异主要体现在相对丰度和代谢功能方面。但口腔菌群多种多样,目前建立的菌群数据库信息有限,菌群测序分析技术也有一定的局限性,可能部分低丰富度的菌群尚未检出,将来仍需进一步充分分析口腔菌群的多样性,深入了解糖尿病伴慢性牙周炎的口腔菌群变化情况。
本研究结果显示A 组龈沟液IL-10 水平均低于B 组和对照组,B 组均低于对照组;A 组龈沟液hs-CRP,TNF-α,IL-6 和IL-4 水平均高于B 组和对照组,B 组高于对照组,表明炎症反应是糖尿病伴慢性牙周炎发生的关键因素,炎症因子在其发病进程中起重要作用。慢性牙周炎患者龈沟液中可检测到多种炎症因子,其中hs-CRP 是反映机体炎症最常用的敏感指标;TNF-α 是多功能细胞因子,不但激活破骨细胞活性,同时抑制牙周膜纤维细胞碱性磷酸酶活性,进而损伤牙周组织,促进牙槽骨吸收[19];IL-4,IL-6 均是介导炎症反应的细胞因子,均具有促炎症反应作用,而IL-10 是一种调节免疫的抗炎因子,能够抑制多种炎症因子的表达,减轻炎症反应造成的病理损害[20]。糖尿病患者处于氧化应激激活、慢性微炎症状态,同时糖脂代谢紊乱削弱白细胞趋化防御功能,增加单核细胞高反应性,刺激单核细胞分泌大量的炎性细胞因子,放大细菌引起的炎性反应,促进牙周炎的发生发展。MIRANDA 等[21]研究发现糖尿病会促使慢性牙周炎患者促炎因子与抗炎因子比例转变,患者龈沟液TNF-α,IL-6和IL-4等促炎细胞因子水平显著升高,加重炎症负担;武玮等[22]通过降低CRP,TNF-α和IL-6 水平,升高IL-10 水平来治疗糖尿病伴慢性牙周炎患者,明显改善了牙周情况,以上研究均证实了炎症因子参与糖尿病伴慢性牙周炎的发生和发展,对该病的诊断和治疗具有重要意义。
本研究结果显示A 组乳杆菌属、双歧杆菌属、酵母菌属和肠球菌属水平相对丰度与龈沟液IL-10水平均呈正相关,与龈沟液hs-CRP,TNF-α,IL-6,IL-4 水平均呈负相关;A 组卟啉单胞菌属、韦荣球菌属、普氏菌属、奈瑟菌属和密螺旋体属水平相对丰度与龈沟液IL-10 水平均呈负相关,与龈沟液hs-CRP,TNF-α,IL-6 和IL-4 水平均呈正相关,说明糖尿病伴慢性牙周炎患者口腔菌群失调与龈沟液炎症因子水平有密切相关性,提示临床可通过改善口腔菌群平衡来减轻患者炎症反应。在糖尿病伴慢性牙周炎患者中口腔微生态紊乱,乳杆菌属、双歧杆菌属、酵母菌属和肠球菌属等有益菌相对丰度降低,其对致病菌黏附定植的阻碍作用也随之降低[23];而龈下卟啉单胞菌属、韦荣球菌属、普氏菌属、奈瑟菌属和密螺旋体属水平相对丰度增加,此类致病菌取代有益菌大量定植于牙周组织并释放丁酸盐、戊糖、抗坏血酸等代谢物,刺激牙周组织产生过敏反应,引发免疫应答;同时附着在牙周的致病菌可通过损伤的牙周内壁进入血液循环,导致牙周局部血管发生炎症,刺激牙周分泌更多的促炎因子释放到龈沟液中,加重牙周组织损害,促进牙周炎疾病进展[24-25]。
综上,糖尿病伴慢性牙周炎患者口腔致病菌占比升高而有益菌占比降低,龈沟液促炎症因子水平升高而抗炎症因子水平降低,较单纯慢性牙周炎患者改变更为显著,且糖尿病伴慢性牙周炎患者口腔菌群属水平相对丰度与龈沟液炎症因子水平均有密切相关性。因而,通过改善口腔菌群平衡,提高有益菌水平、降低致病菌水平可能有助于抑制促炎因子的释放,提高抗炎因子水平,进而减少糖尿病伴慢性牙周炎患者炎症反应。不足之处:仅对患者进行一次口腔菌群和龈沟液炎症因子检测,未持续监测;针对此类患者通过调节口腔菌群水平来减轻牙周炎炎症反应的效果如何尚未研究明确,需进一步进行临床试验明确,为临床干预提供更有力的支持。
- 现代检验医学杂志的其它文章
- 急性肺栓塞患者血清ADAM15和MMP-2表达水平及其与疾病严重程度的相关性研究
- 肺炎支原体感染诱发哮喘患儿血清中miR-424-5p和CX3CL1表达水平及与预后预测价值研究
- ALKBH5调控GEFT的m6A修饰对胆管癌转移及EMT的实验研究
- LncRNA NNT-AS1通过调控miR-582-5p/NCKAP1轴激活Hippo-YAP/TAZ信号通路促进膀胱癌细胞增殖、迁移、侵袭和干细胞干性影响
- 血浆外泌体miR-4306表达水平联合CT征象对单发非实性肺结节良恶性鉴别的价值研究
- 白细胞介素-1β基因(rs16944)单核苷酸多态性与骨髓增生异常综合征易感性及临床特征的相关性研究

