二维铜基金属有机框架材料作为锂硫电池正极材料的理论研究
*王思奇 于姜超 江国亮 吕正雪 苑文扬 刘洪梅 李小龙
(临沂大学 物理与电子工程学院 山东 276000)
锂硫电池具有非常高的理论比容量(1675mAh/g)和能量密度(2600Wh/kg),而且具有硫储量丰富、价格低廉、环境友好等优势。因此,锂硫电池是一种极具发展潜力的电化学储能装置[1]。但目前仍面临许多挑战,限制了其实际应用。例如正极中的单质硫电导率太低,且和锂化产物Li2S2/Li2S密度差异大,存在明显的体积膨胀。而中间产物多硫化锂可溶于有机电解液,并穿过隔膜扩散至负极,在锂电极表面发生自放电反应,形成穿梭效应,导致活性材料减少、电池容量损失和循环性能下降。
为了降低锂硫电池中的穿梭效应,提高电池性能,需要使用导电性良好、高比面积的多孔材料作为正极,有效地负载单质硫和中间产物多硫化锂[2]。为此,国内外学者们研究了大量正极材料,包括碳基材料(如石墨烯、碳纳米管、多孔碳等)、二维非金属材料(如黑磷、硼烯等)、金属氧化物、过渡金属二硫化物等。二维金属有机框架材料(MOF)具有超高的比表面积和多孔结构[3],有助于单质硫的负载并缓冲充电/放电过程中的体积膨胀。MOF中苯环上的离域电子可形成良好的平面共轭,使材料展现出优异的导电性。已有的理论研究预测一些二维导电的MOF适宜于作为锂硫电池正极材料,例如:Cu与六巯基苯的配位聚合物[4]、基于金属卟啉的MOF、过渡金属与六氨基苯(HAB)的复合物。
实验上可通过替换金属离子和有机配体调控二维MOF的结构和导电性质。通常认为金属离子是MOF吸附多硫化物的活性位点,但是MOF中的配位原子通常具有极性,也易于与多硫化锂结合。本文将探讨不同的有机配体对MOF负载多硫化物的影响。实验研究报道可利用铜盐与HAB、六羟基苯(HHB)、六巯基苯(BHT)合成二维MOF,其中Cu分别与-N-、-O-、-S-基团形成配位键,本文将探索三种MOF材料在锂硫电池正极材料方面的应用。
1.计算方法
本文的计算采用基于第一性原理的VASP软件,交换相关泛函采用广义密度近似的Perdew-Burke-Ernzerhof(PBE)方法,采用了投影缀加波方法处理电子与离子间的相互作用。利用Grimme(D2)方法描述体系内的范德瓦尔斯弱相互作用。采用截断能为500eV,k点网格为7×7×1。对于电子态密度的计算,使用了19×19×1k点网格。为了防止周期结构中相邻层间的相互作用,计算时含有真空层的z方向设为20Å。能量收敛的标准为10-5eV,每个原子上的受力均小于0.02eV/Å。计算时考虑了电子的自旋极化。
2.结果与讨论
图1展示了三种MOF薄膜的原胞结构,每个Cu原子与四个配位基团连接形成密网格结构。从侧视图中我们可以看出,Cu-HAB和Cu-HHB薄膜是非平面结构,这是因为Cu原子采用sp3杂化方式与N或O成键,四个N原子或O原子分别位于Cu的上下两侧,形成四面体配位结构。而Cu-BHT则表现为平面结构,Cu原子与四个S形成了平面正方形配位结构。Cu-N、Cu-O和Cu-S的键长分别为1.98Å、2.00Å和2.21Å。三种MOF的晶格常数分别为13.66Å(Cu-HAB)、13.46Å(Cu-HHB)和14.72Å(Cu-BHT)。
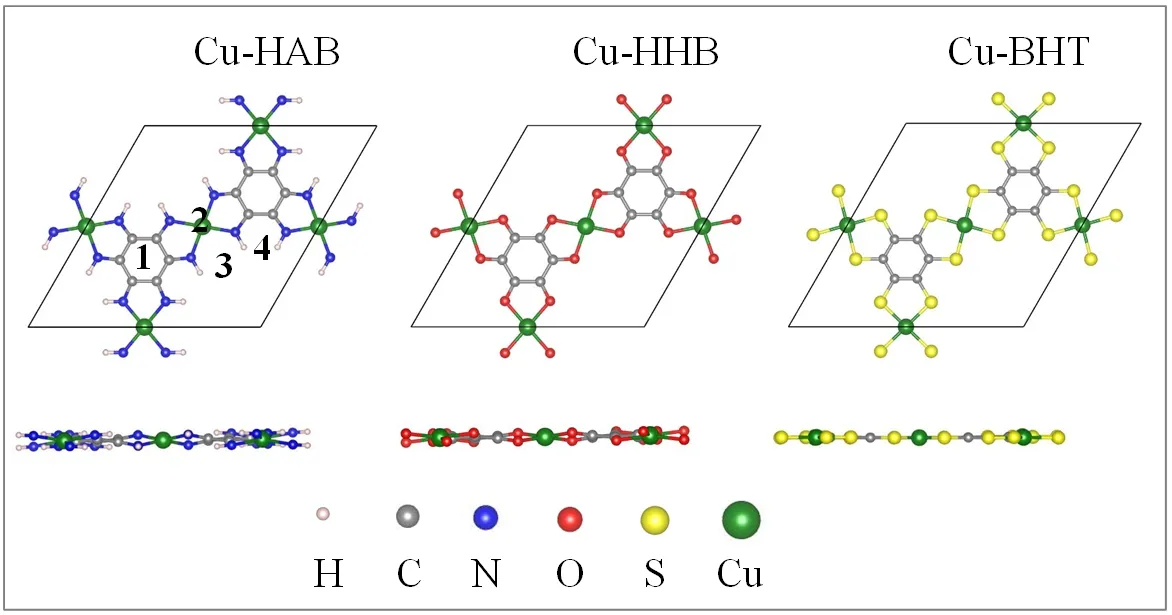
图1 二维Cu-HAB、Cu-HHB和Cu-BHT的几何结构
图2给出了二维Cu-HAB、Cu-HHB和Cu-BHT的电子态密度(DOS)。在费米能级处,三种MOF都具有较高的态密度峰,表明三种薄膜都是金属性,导电性良好,能够为电极表面的氧化还原反应提供稳定的电荷传输,适宜作为电极材料。其中Cu-BHT在费米能级处的峰最高,说明导电性质最好。这是由于Cu原子的d轨道与N、O和S的p轨道杂化,进一步与苯环上的π电子在平面内形成良好的共轭结构。

图2 二维Cu-HAB、Cu-HHB和Cu-BHT的电子态密度
锂硫电池的正极材料包裹单质硫,负极材料为金属锂。放电过程中,单质硫(S8)首先锂化形成一系列长链多硫化锂(Li2S8、Li2S6、Li2S4),进一步锂化为短链硫化物(Li2S2、Li2S)。我们首先以单层Cu-HAB薄膜作为吸附S8和Li2Sn(n=8、6、4、2、1)的锚定材料。为了得到S8和Li2Sn分子在Cu-HAB表面的最稳定吸附构型,我们设置了不同的初始吸附位置,如图1中的1、2、3和4所示,分别对应苯环上方、Cu原子上方、孔洞处或氨基的上方。图3描述了S8和Li2Sn分子在单层Cu-HAB薄膜上最稳定的吸附构型。S8分子易于吸附苯环上方,距离苯环平面约3.25Å。而Li2Sn分子表现出不同的特点,Li2S8、Li2S6、Li2S4、Li2S2吸附易于在氨基的上方,而Li2S分子易于吸附在Cu原子上方。Li2Sn分子与薄膜之间形成化学吸附,两个Li原子分别与氨基的N原子成键。这是由于N的电负性较强,易于与带正电的Li原子成键。Li2Sn分子与MOF之间最短的Li-N键分别为2.14Å、2.14Å、2.12Å、2.22Å和2.09Å。此外,Li2S中S原子与薄膜中Cu原子的距离为2.34Å。S原子中有孤对电子,表现出较弱的路易斯碱性,而Cu原子具有空的3d轨道,表现出较弱的路易斯酸性,S的孤对电子提供给Cu原子,形成路易斯酸和路易斯碱的结合。S-Cu作用与Li-N作用形成协同效应,加强了Li2S在Cu-HAB表面的吸附。

图3 S8和多硫化锂分子在Cu-HAB表面的稳定吸附结构
为了更准确地描述多硫化锂在Cu-HAB表面的结合,下面进一步分析结合能(Eb)。Eb=Etotal-EMOFES8/Li2Sn,其中,EMOF、ES8/Li2Sn和Etotal分别是MOF薄膜、S8或Li2Sn分子以及吸附体系的能量。S8分子吸附在薄膜上的结合能为-0.415eV,Li2S8、Li2S6和Li2S4分子与Cu-HAB薄膜的结合能分别是-1.294eV、-1.315eV和-1.520eV。锂硫电池中常用的电解质溶剂是1,3-二氧戊环(DOL)和1,2-二甲氧基乙烷(DME),经计算三种长链Li2Sn分子与DOL和DME的结合能在-0.831~-0.904eV范围内。因此它们与Cu-HAB的结合能高于与常用电解质溶剂的结合能,表明Cu-HAB薄膜能够有效地固定多硫化锂,抑制其穿梭效应,是适宜的正极材料。Li2S2和Li2S分子在Cu-HAB薄膜表面的吸附更强,结合能增加到-2.292eV和-2.224eV。
二维Cu-HAB吸附S8或Li2Sn分子后仍然保持金属性质,说明Cu-HAB薄膜适宜作为锂硫电池的正极材料负载多硫化锂,而且长链的多硫化锂分子在薄膜表面的吸附位点是氨基上方,多硫化锂中的Li与MOF中的N成键。如果MOF中的配位基团从N变为O或S,配位基团电负性的变化是否会对多硫化锂的负载造成影响?我们以Li2S6分子为代表,讨论Cu-HHB和Cu-THB对多硫化锂的吸附。
图4展示了Li2S6分子吸附在Cu-HHB和Cu-THB薄膜表面的构型。Li2S6分子易于吸附在Cu-HHB薄膜中铜原子的正上方,S-Cu最短距离为2.18Å。而Li原子与电负性更高的O成键,最短的Li-O键长为1.90Å,低于Li-N距离2.14Å。S-Cu与Li-O作用形成协同效应,导致Cu-HHB薄膜的结构扭曲。其中两个Cu-O配位键被拉长至2.79Å、3.10Å(吸附之前为2.00Å),说明Cu-O键断裂,吸附导致Cu-HHB薄膜结构被破坏,而且Li2S6被稳定地固定在电极表面,不利于后续锂化反应的进行。而在Cu-THB薄膜表面,Li2S6分子易于吸附在氨基的上方。Li-S键长为2.51Å,长于Li-N距离2.14Å,这是由于S的电负性低于N。Li2S6分子中S原子与Cu原子的最近距离为3.61Å,相互作用较弱。Cu-THB薄膜中Cu-S配位键长仅增加了0.01~0.03Å,变化幅度较小。

图4 Li2S6分子吸附在Cu-HHB和Cu-THB薄膜上的几何构型
Li2S6分子在三种MOF表面的结合能顺序为Cu-HHB(-2.068eV)>Cu-HAB(-1.315eV)>Cu-THB(-0.946eV)。长链Li2S6分子与Cu-THB薄膜的结合能与其在电解质溶剂中的结合能相近,其中DME为-0.904eV,DOL为-0.831eV,因此Cu-THB不能完全抑制多硫化锂分子溶解到电解质溶剂中。根据以上分析,在这三种二维MOF材料中,由于有机配体中的N、O、S具有不同的电负性,与多硫化锂的结合能力不同。电负性太强,形成的Li-O键导致MOF结构被破坏,而且多硫化锂分子被MOF表面固定住,不利于锂化反应的发生。电负性太弱,与多硫化锂的结合力较弱,不能抑制穿梭效应。因此,本文研究的三种MOF中,Cu-HAB薄膜是最有效的硫负载材料,Cu-HHB和Cu-THB薄膜不是适宜的锚定材料。
3.结论
本文利用第一性原理研究了二维Cu基MOF作为Li-S电池硫宿主材料,对比了MOF中配位原子的影响。结果表明三种MOF薄膜都具有金属性质,具有良好的导电性。单质硫在Cu-HAB表面的结合能为-0.415eV,Li2Sn分子与Cu-HAB得结合能在-1.294~-2.292eV范围内,说明Cu-HAB薄膜和Li2Sn间的吸附作用有效抑制了多硫化锂溶解到电解质溶剂中。Li2S6分子与Cu-HHB薄膜的结合太强,导致二维Cu-HHB薄膜结构被破坏,不利于锂化反应的进行;而Li2S6和二维Cu-THB薄膜的结合能较小,不能有效抑制穿梭效应。因此,在三种导电的二维MOF材料中,Cu-HAB薄膜是良好的电池硫宿主材料,而Cu-HHB和Cu-THB薄膜不适宜作为正极材料。因此,选择MOF作为锂硫电池正极材料时,不仅需要考虑金属离子作为活性位点,也需要考虑配位基团的电负性。本研究为高性能锂硫电池选择合适的电极材料提供新的思路。

