牛蒡果胶多糖/玉米醇溶蛋白复合颗粒稳定的 Pickering乳液构建及对姜黄素的递送功效
吴 彤,冯 进,黄午阳,汪 晶,李 莹,,陈小娥
(1.浙江海洋大学食品与药学学院,浙江 舟山 316022;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.南京林业大学化学工程学院,江苏 南京 210014)
Pickering乳液是固体颗粒稳定的乳液[1]。由于乳化剂颗粒以不可逆的形式吸附于油-水界面,因此与传统乳液相比,它的聚结和奥斯瓦尔德熟化抵抗性更强[2]。并且,界面颗粒形成的三维致密屏障可以将分散相与外界环境有效阻隔,提升包封材料的稳定性。近年来,Pickering乳液在食品领域中的应用受到了极大的关注,比如活性因子递送、氢化植物油替代、肉糜凝胶结构调控以及3D打印等[3-4]。与无机纳米颗粒相比,通过多糖、蛋白质等食物来源生物高分子组装形成的Pickering稳定剂、安全剂、生物相容性以及可降解性更加突出。
牛蒡是一种药食同源植物,有较高的营养价值,其药用和保健功能也备受关注。多糖是牛蒡中重要的活性物质,在食品和医药等领域有广阔的应用前景,提取后,发现牛蒡多糖具有高鼠李糖半乳糖醛酸I(rhamnogalacturonan I,RG-1)含量特征,有助于增强人体的免疫系统并改善代谢功能,具有降血脂、降血糖、抗癌、抗炎等生理功能,可作为防治肿瘤、冠心病、糖尿病、抗炎等的保健食品配料和天然药物,适合用作制备Pickering乳液,负载活性物质。而玉米醇溶蛋白作为玉米加工工业中的副产物,由9 个相邻且反方向平行的螺旋通过谷胱酰胺残基联接形成圆柱形结构,其中包含70%~80%的非极性氨基酸,常作为疏水内核用于核壳结构递送体系[5-6]。玉米醇溶蛋白廉价易得,可以有效降低Pickering构建的成本。由于其疏水性较强,玉米醇溶蛋白一般经过理化改性或者与其他亲水材料复合形成颗粒后作为Pickering乳化剂使用。Wang Dandi等[5]通过反溶剂法构建了玉米醇溶蛋白纳米颗粒用于稳定Pickering乳液。结果表明,碱性条件预处理玉米醇溶蛋白可以获得更好的良好胶体稳定性和再分散性,从而有效降低纳米颗粒的疏水性,提升其在油水界面的吸附能力[5]。在另一篇报道中,Dai Lei等[7]发现玉米醇溶蛋白和阿拉伯胶可以通过氢键和静电相互作用形成核-壳结构的纳米颗粒。与阿拉伯胶复合后,玉米醇溶蛋白纳米颗粒在水-油界面的三相角θo/w由原来的133.75°降低至88.95°,亲水/疏水性更加平衡。当油相体积分数(φ)高于0.5时,由于体系黏度的增加形成了乳液凝胶[7]。此外,关于玉米醇溶蛋白与壳聚糖[8]、黄原胶[9]和果胶[10]等多糖组装形成的Pickering稳定剂已有报道。但鲜见利用牛蒡多糖与玉米醇溶蛋白组成Pickering稳定剂的报道。
课题组前期实验中,通过纤维素酶/果胶酶从牛蒡中分离得到了富含RG-1结构域的果胶型多糖。与工业中广泛使用的同型半乳糖醛酸聚糖(homogalacturonan,HG)型果胶不同,RG-1型果胶的含有大量阿拉伯糖和半乳糖中性侧链,呈分枝状结构,其电荷密度较低,疏水性相对较强。有研究表明,RG-1型果胶可以更加有效的缓解肠道炎症状态[11]。
本研究选择牛蒡RG-1型果胶多糖与玉米醇溶蛋白组装形成的纳米颗粒作为Pickering乳化剂,首先系统研究了多糖质量浓度、溶液pH值、φ、离子强度等对Pickering乳液稳定性的影响;其次,使用高内相Pickering乳液作为姜黄素递送体系,研究了钙离子交联对体系流变学特性和姜黄素生物利用度的影响规律。这对拓展RG-I型果胶多糖与玉米醇溶蛋白形成的纳米颗粒Pickering乳液在食品递送体系中的应用具有积极意义。
1 材料与方法
1.1 材料与试剂
玉米蛋白、姜黄素 上海源叶生物科技有限公司;牛蒡购自徐州市丰县;玉米油 江苏省南京市苏果超市;无水乙醇、盐酸 南京化学试剂股份有限公司;胆酸钠、胰酶 阿拉丁试剂(上海)有限公司;其余试剂(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
BX-1F磁力搅拌器、全温振荡器 常州普天仪器制造有限公司;高速匀浆机、pH计 奥豪斯仪器(上海)有限公司;分析天平 梅特勒-托利多仪器(上海)有限公司;JEM-1230型透射电子显微镜(transmission electron microscope,TEM)日本电子株式会社;Zetasizer Nano ZS90纳米粒度仪、MasterSizer 2000激光粒度仪 英国马尔文仪器有限公司;Cnoptec-B302正置生物显微镜 重庆奥特光学仪器有限责任公司;UV-6300型紫外-可见分光光度计 上海美谱达仪器公司;H3-16KR台式高速冷冻离心机 湖南可成仪器设备有限公司;Discovery HR10混合流变仪 杭州汉泽仪器有限公司。
1.3 方法
1.3.1 牛蒡RG-1型果胶多糖的制备
取新鲜牛蒡粉,加入5 倍质量80%乙醇溶液,50 ℃搅拌2 h,离心去除上清液;再加入5 倍质量100%乙醇,50 ℃搅拌2 h,离心去除上清液,40 ℃条件下烘干。称取适量牛蒡粉,加入质量比20∶1的水分散均匀,调节pH值为6;加入0.6%低温α-淀粉酶45 ℃水浴加热40 min,调节pH值为4.5;在60 ℃水浴加热的情况下加入1%糖化酶反应40 min;然后在100 ℃水中灭酶5 min,冷置过夜再匀浆。将上述溶液冻干,将1 g冻干粉末分散到50 mL的醋酸钠缓冲液中(10 mmol/L,pH 4.8),加入50 mg纤维素酶,然后按照100 μL/200 mL的量加入多聚半乳糖醛酸内切酶。在300 r/min振荡条件下,50 ℃反应24 h,然后在100 ℃水中灭酶5 min。用氢氧化钠调至pH 6.5,浓缩后,在上清液中加入适当体积的脱蛋白溶剂(氯仿和正丁醇的体积比为4∶1),混合,分离去除有机溶剂层和变性蛋白层,重复1 次。在上清液中加入1 倍体积的乙醇,4 ℃醇沉过夜后,5000×g离心,沉淀用无水乙醇洗涤两次,继续溶解于水中,醇沉后得到牛蒡RG-1型果胶多糖。实验室自制RG-1型果胶多糖提取率为10.34%,其中HG型结构域占比为(16.48±0.23)%,RG-1型结构域占比为(73.46±1.09)%。
1.3.2 牛蒡RG-1型果胶多糖/玉米醇溶蛋白Pickering 稳定剂的制备
参考Zeng Tao等[10]的反溶剂法制备RG-1型果胶/玉米醇溶蛋白纳米颗粒。称取6.0 g玉米醇溶蛋白溶解于20 mL 80%乙醇溶液配制成质量浓度0.3 g/mL的溶液;配制质量浓度为0、2.0、4.0、6.0、8.0 mg/mL和10 mg/mL 的果胶多糖溶液。在快速搅拌状态下,将1.0 mL玉米醇溶蛋白乙醇溶液缓慢滴加于9.0 mL多糖溶液中,室温条件下持续搅拌2 h促进纳米颗粒的自组装。将体系中的乙醇旋转蒸发去除,并用蒸馏水将溶液总体积补足为10 mL,最终形成0.03 g/mL玉米醇溶蛋白溶液与质量浓度为0、1.8、3.6、5.4、7.2 mg/mL和9 mg/mL 的牛蒡果胶多糖水溶液混合。检测产品的水动力学直径(hydrodynamic diameter,DZ)、多分散系数(polydispersity index,PDI)和Zeta电位。
1.3.3 Pickering乳液特性测定
分别取1.3.2节中Pickering稳定剂(果胶多糖质量浓度为0~10 mg/mL)10 mL与2.5 mL玉米油混合,在12000 r/min条件下匀浆5 min形成Pickering乳液。使用电子显微镜观察油滴形貌特征、激光粒度仪检测尺寸D90变化。控制制备Pickering稳定剂时,果胶多糖质量浓度为10 mg/mL,使用1.0 mol/L HCl和NaOH溶液将稳定剂调至pH 2~8,随后分别加入2.5 mL玉米油,匀浆制备Pickering乳液,观察油滴形态和尺寸变化;在乳液中滴加高浓度的NaCl水溶液,使最终浓度达到40、80、120、160 mmol/L和200 mmol/L;观察油滴形态和尺寸变化。制备Pickering稳定剂时果胶多糖质量浓度为10 mg/mL、pH 3.0,加入不同体积的玉米油使得φ分别达到0.09、0.17、0.23、0.28、0.33、0.50、0.67和0.75,观察油滴形态和尺寸变化。
1.3.4 Pickering乳液动态界面张力测定
采用悬滴法测定牛蒡多糖与玉米蛋白溶液与正十四烷之间的动态界面张力。光学接触角记录了油水-界面的变化,并利用Young-Laplace方程计算了界面张力。对照使用蒸馏水。利用光学接触角仪在25 ℃研究油-水界面压力(π)。体积相(溶液)和油相分别置于试管和注射器中。实验前,分散剂和油被允许放置至少30 min达到25 ℃,并通过恒温器中的循环水持续保持整个系统的温度。然后将10 μL样品溶液滴入试管中,在针尖处放置3600 s以实现对样品的吸附。液滴的图像被连续地从相机的电荷耦合器件上拍摄并数字化。按式(1)计算π。
式中:γ0为纯油-水的界面张力/(mN/m);γ为油-溶液的界面张力/(mN/m)。
1.3.5 负载姜黄素高内相Pickering乳液的制备
将质量分数0.1%的姜黄素在90 ℃下充分溶解于玉米油中,并以此为油相制备φ为0.75的高内相乳液,并在持续搅拌条件下添加系列浓度(0、1、2、4、6 mmol/L)的钙离子进行交联。使用尼罗蓝标记乳液界面层(油相使用荷载姜黄素标记),分别在530 nm和425 nm激发波长下使用转盘式共聚焦激光显微镜观察样品荧光。
1.3.6 负载姜黄素高内相Pickering乳液的流变学特性测定
参考Yan Jun等[12]的方法并稍作修改。取少量乳液,在25 ℃、0.1~100 s-1剪切速率条件下,记录黏度的变化情况。将剪切速率调至0.1 s-1,维持15 min,随后将剪切速率调至10 s-1,维持10 min,再将剪切速率调整回0.1 s-1,维持10 min,记录整个过程中黏度的变化情况。在25 ℃条件下,控制扫描频率1.0 Hz,在0.1%~10%应变范围扫描弹性模量(G′)和黏性模量(G″),确定线性黏弹区。在25 ℃下,选择应变1%,在频率0.1~10 Hz范围内扫描G′和G″的变化情况。控制应变1%、频率1.0 Hz,将样品从5 ℃加热到90 ℃冷却回5 ℃,速率均为5 ℃/min,检测G′和G″的变化情况。进一步使用Power-Law模型(式(2))分析。
式中:τ为剪切应力/Pa;K为流体的稠度系数/(Pa/s);γ为剪切速率/s-1;n为流动指数/(Pa/s)。
1.3.7 高内相Pickering乳液中姜黄素的稳定性测定
将1.3.4节中制备的姜黄素乳液,在60 ℃条件下贮存7 d。姜黄素的提取和检测方法[13]如下:准确吸取1.0 mL乳液,乙醇破乳后加入20 mL乙酸乙酯溶液进行萃取,吸取上清液,测定其在425 nm波长处的吸光度。根据线性回归公式Y=0.1616X+0.0013(R2=0.9995),计算姜黄素浓度,其中,Y为425 nm波长处吸光度,X为乙酸乙酯中姜黄素浓度。采用溶解姜黄素的纯玉米油作为对照,用式(3)计算姜黄素的保留率。
1.3.8 姜黄素Pickering乳液的模拟消化研究
参考文献[14-15 ]的方法制备模拟胃液(simulated gastric fluid,SGF)和肠液(simulated intestinal fluid,SIF)并稍作修改。SGF配方:41.4 mL 0.5 mol/L氯化钾溶液、5.4 mL 0.5 mol/L磷酸二氢钾溶液、75 mL 1.0 mol/L碳酸氢钠溶液、70.8 mL 2 mol/L NaCl溶液以及2.4 mL 0.15 mol/L六水合氯化镁溶液。SIF配方:34 mL 5.0 mol/L氯化钾溶液、4.0 mL 0.5 mol/L 磷酸二氢钾溶液、212.5 mL 1.0 mol/ L碳酸氢钠溶液、48 mL 2.0 mol/ L NaCl溶液、5.5 mL 0.15 mol/ L 六水合氯化 镁溶液。
取8.0 mL SGF与5.0 μL 0.1 mol/L氯化钙溶液混合,加超纯水至10 mL,随后与10 mL溶解姜黄素的Pickering乳液充分混合,将体系调至p H 2.0,在37 ℃预热30 min。加入0.1 g胃蛋白酶(分散在1.0 mL蒸馏水中)启动胃消化,在37 ℃、120 r/min搅拌条件下反应60 min。
取10 mL模拟胃消化后的食糜与8.0 mL SIF混合,加入1.25 mL 160 mmol/L胆酸钠溶液与20.0 μL 0.1 mol/L氯化钙溶液,将溶液调至pH 6.8,37 ℃预热30 min。加入0.3 g胰酶(分散在1.0 mL蒸馏水中)启动消化,将体系调至pH 7.0,在37 ℃、120 r/min条件下反应2.0 h。反应过程中,连续检测体系pH值,通过滴定NaOH溶液将体系维持在7.0。消化结束后,检测食糜中姜黄素含量。将食糜在16000×g条件下离心分离上层胶束,并检测胶束层姜黄素浓度。
按照式(4)~(6)计算姜黄素生物转化率、生物可给率和生物利用度。
1.4 数据分析
2 结果与分析
2.1 牛蒡RG-1型果胶多糖质量浓度对Pickering乳液理化特征的影响
如图1所示,牛蒡RG-1型果胶多糖/玉米醇溶蛋白纳米颗粒稳定的Pickering乳液的乳化层高度与多糖质量浓度关系密切。当Pickering稳定剂中不含有多糖时,几乎没有乳化层形成,这可能是由于玉米醇溶蛋白纳米颗粒的疏水性过强,在乳化过程中,大量的颗粒分布在连续相中但不能有效湿润油水界面[16]。加入果胶多糖后,Pickering颗粒疏水性逐渐降低,对油水界面的稳定能力增强,乳液乳化层高度逐渐提升,同时油滴D90由果胶多糖质量浓度2.0 mg/mL时的750 μm左右降低至果胶多糖质量浓度10 mg/mL时的20 μm以下(图1a)。由图1c可知,在10 倍镜图像中,不含果胶多糖的乳液中油滴很少。随着果胶多糖质量浓度增加,视野中油滴数量增加,并且形态更加规则、均一。此外,果胶多糖质量浓度为0、2 mg/mL时,油滴D90远高于显微镜看到的油滴尺寸,这有可能与这两个样品中存在沉淀,未能滴加到载玻片上有关。因此,后续实验选择牛蒡果胶多糖质量浓度为10 mg/mL。

图1 不同牛蒡果胶多糖浓度下Pickering乳液的尺寸(a)、外观(b)和微观形貌(c)的变化规律Fig.1 Size (a),appearance (b) and micromorphology (c) of Pickering emulsions with different concentrations of burdock RG-1-type pectic polysaccharides
2.2 pH值对Pickering乳液理化特性的影响
首先研究了pH值对Pickering颗粒DZ、PDI和Zeta电位的影响规律。由图2a可知,溶液pH值由2升高到3时,果胶多糖/玉米醇溶蛋白Pickering颗粒DZ由183.3 nm增加到688.2 nm。在pH 2条件下,果胶多糖中糖醛酸羧基质子化现象比较明显,与玉米醇溶蛋白之间的静电相互作用有限。在pH 3条件下,果胶多糖通过静电引力有效包覆在玉米醇溶蛋白表面,因此Pickering颗粒的尺寸较大。然而,随着pH值进一步增加,Pickering颗粒DZ下降明显。推测此时玉米醇溶蛋白表面的游离氨基发生了去质子化效应,携带负电荷增加,因此玉米醇溶蛋白和果胶多糖之间的静电斥力增加,导致果胶多糖的吸附量降低。总体而言,在pH 2~8条件下,颗粒的PDI均维持在0.3以下,表明粒度的分布相对均一。由图2b可知,Pickering颗粒的Zeta电位绝对值先随着pH值的增加而增加,pH 4时达到最高值50.6,随后随着pH值的增加逐渐减少,这与颗粒表面果胶多糖吸附量减少有密切关联。结合图2c可知,不同pH值条件下颗粒的TEM图像与DZ变化趋势基本一致,pH 2.0时颗粒较小,主要呈圆形或者椭圆形的结构,pH 3时颗粒尺寸显著增加,呈边缘清晰的不规则结构,pH 5.0时颗粒尺寸显著减少,pH值继续增加至8.0时,Pickering颗粒轮廓更加模糊,DZ仅为238.32 nm,表明玉米醇溶蛋白表面的果胶多糖发生了严重的解吸附现象。

图2 pH值对Pickering乳化剂DZ和PDI(a)、Zeta电位(b)以及 TEM图像(c)的影响规律Fig.2 Effect of pH on the DZ,PDI (a),zeta potential (b),and TEM image (c) of RG-1-type pectin/zein emulsifiers
进一步研究了Pickering乳液外观、油滴尺寸和形态与Pickering乳化剂pH值的内在关联,如图3所示。由 图3b可知,乳化剂pH 2时,形成的Pickering乳液稳定性较差,pH 3~5时,Pickering乳液的乳化指数比较高,接近100%,然而pH值高于6时,乳化层高度仅占乳液总高度的1/3。根据前面研究,推测pH 2或者pH 6~8条件下,RG-1型果胶多糖未能充分包覆于玉米醇溶蛋白表面,因此颗粒的两亲性不佳,在油水界面的湿润能力差[16]。由 图3c可知,除了pH 6.0外,其他pH值条件下油滴的尺寸均较低,D90均在20 μm以下,而pH 6.0时乳液脂滴D90超过250 μm。这有可能是pH 6.0时,未能包覆在玉米醇溶蛋白表面的多糖引发了架桥絮凝。另外,pH 3~5条件下,电子显微镜视野中Pickering乳液脂滴较多且分布均一,pH 2.0以及6.0~8.0范围内油滴数量极少(图3a)。
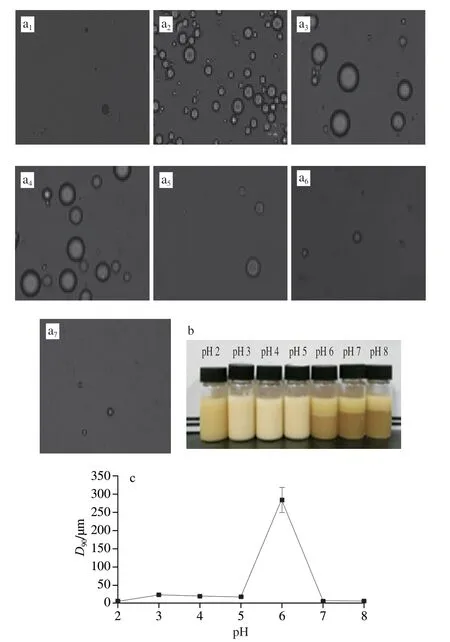
图3 Pickering稳定剂pH值对乳液的微观形貌(a)、外观(b)和 尺寸(c)的影响规律Fig.3 Influence of Pickering emulsifiers on the morphology (a),appearance (b),and dimension (c) of emulsions
2.3 离子强度对Pickering乳液理化性质的影响
由图4a可知,在40~200 mmol/L NaCl浓度范围内,离子强度对Pickering乳液外观的影响不大。但随着NaCl浓度的增加,油滴D90逐渐下降,NaCl浓度大于80 mmol/L后下降不明显,趋于稳定。由 图4b、c可知,增加离子浓度会影响乳液的尺寸,NaCl浓度较大的情况下,乳液的尺寸会变小,而乳液的电位在离子浓度为200 mmol/L时会较大;这可能是因为盐的静电屏蔽作用导致乳化剂颗粒携带电荷减少,使颗粒疏水相互作用提升,乳化层发生收缩[17-18]。从显微图像中可以看出(图4d),随着离子强度的增加,视野中颗粒密度逐渐降低且均一性变差,这有可能与高离子强度降低了颗粒的界面湿润能力有关。
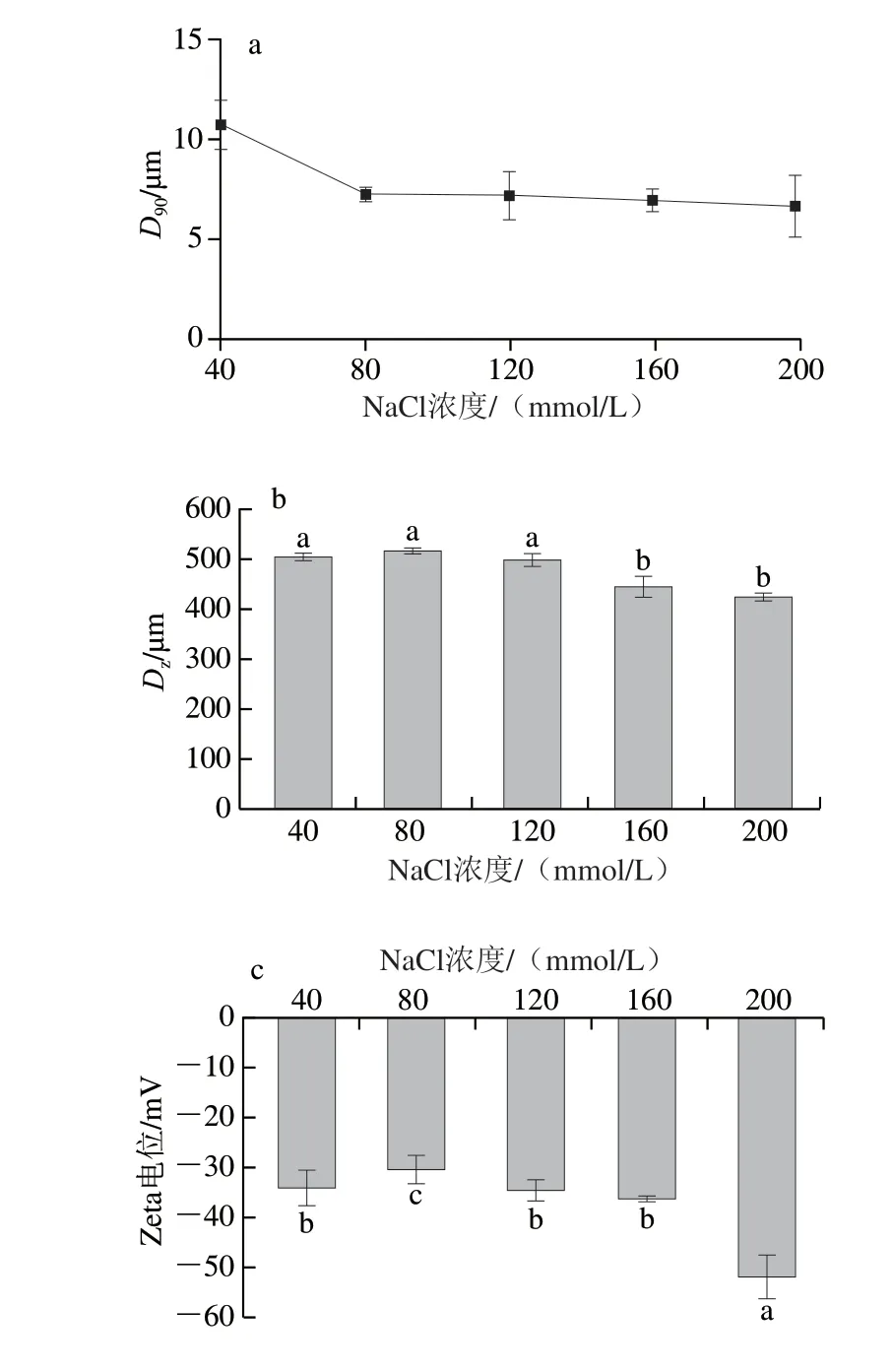

图4 离子强度对乳液的尺寸(a)、DZ(b)、Zeta电位(c)和 微观形貌(d)的影响规律Fig.4 Influence of ionic strength on the size (a),DZ (b),zeta potential (c) and micromorphology (d) of emulsions
2.4 φ对Pickering乳液理化特性的影响
由图5可知,果胶多糖质量浓度10 mg/mL、pH 3条件下,随着φ增加,Pickering乳液脂滴D90在15~30 μm范围内波动(图5c)。根据乳液外观,φ越高,乳液的黏稠程度越强(图5a),这与脂滴之间的距离缩小、产生了强大的范德华力等非共价相互作用有关[19]。当φ达到0.67和0.75时,贮藏乳液的玻璃瓶倒置后乳液不会滑落,凝胶状的Pickering乳液的形成也预示着絮凝的脂滴形成了致密的三维网状结构。随着φ增加,视野中油滴的密度不断提高(图5b)。

图5 φ对乳液的外观(a)、微观形貌(b)和尺寸(c)的影响规律Fig.5 Influences of φ on the appearance (a),micromorphology (b) and dimension (c) of emulsions
下标1~8.φ分别为0.09、0.17、0.23、0.28、0.33、0.50、0.67和0.75。
2.5 不同果胶多糖浓度对Pickering乳液动态界面张力的影响
由图6可知,玉米蛋白的添加改变了牛蒡多糖的表面性质,影响了其油-水界面行为。所有溶液的π会随时间逐渐延长,这与纳米颗粒吸附到油水界面上有关。水的界面张力为γ0=30.35 mN/m(30 min后),当牛蒡多糖的质量分数为0 mg/mL时,π最小。而随着牛蒡多糖质量浓度增加,π逐渐上升,吸附油-水界面的能力更强。

图6 不同果胶多糖质量浓度复合颗粒对动态界面张力的影响Fig.6 Effect of composite nanoparticles with different concentrations of RG-1-type pectic polysaccharide on dynamic interfacial tension
2.6 负载姜黄素的高内相Pickering乳液理化性质分析
根据前面的研究,选择φ为0.75的高内相Pickering乳液对姜黄素进行包载。由于果胶多糖可以在Ca2+作用下形成网格结构[20],因此选择使用0、1、2、4、6 mmol/L 的钙离子对Pickering乳化层进行交联,从而强化乳液稳定性。由图7a可知,负载姜黄素后,乳液油滴变为黄色,随着钙离子浓度的增加,外观变化不明显。由图7d可知,油滴D90会随着钙离子浓度增加而降低。图7b为2 mmol/L钙离子条件下高内相乳液的共聚焦激光扫描显微镜图像,从中可以清晰分辨乳液的油相和界面层,表明乳液结构比较稳定。光学显微镜观察结果显示(图7c),当钙离子浓度为1~4 mmol/L时,视野中油滴数量较多且分布均匀,当钙离子浓度达到6 mmol/L时,大量油滴结构发生了坍塌,证明乳液稳定性变差[21-22],这与钙离子的过度交联引发了凝胶收缩失水有关。
高内相乳液的界面组成对其流变行为起到十分关键的作用[4,23]。如图8a所示,不同钙离子浓度下,4 种乳液的表观黏度均随着剪切速率的增大逐渐减小,呈非牛顿流体特征。这与较高的剪切速率下,乳液的网格结构受到破坏,并且依照剪切方向发生了结构重组相关[24]。此外,拟合数据表明,当乳液中加入1 mmol/L Ca2+时,乳液黏度显著升高,继续增加Ca2+浓度,乳液黏度发生了一定幅度的下降。


图8 不同钙离子浓度下荷载姜黄素Pickering乳液的表观黏度-剪切速率曲线(a)、应变扫描曲线(b)、频率扫描曲线(c、d)以及温度扫描曲线(e、f)Fig.8 Apparent viscosity versus shear rate curves (a),strain sweep curves (b),frequency sweep curves (c,d) and temperature sweep curves (e,f) of curcuminloaded Pickering emulsions with different calcium ion concentrations
如图8b所示,研究的0.1%~10%应变范围内,G’和G”均未发生明显下降,说明4 种乳液的线性黏弹区范围较大,经过研究,选择1%的应变进行后续实验。在频率扫描实验中(图8c),随着频率的增加,G’和G”上升明显,其中G’均显著高于G”,表明是弹性主导乳液凝胶结构的形成,乳液呈典型的固态弹性特征。随着钙离子浓度的升高,姜黄素乳液的黏弹性先升高,在2 mmol/L时达到最大值,达到4 mmol/L时模量反而降低,这与过高的钙离子造成乳液结构的脱水坍塌有密切关系。另外,由图8d可知,4 种乳液的tanδ均小于1,并且随着扫描频率的增加而增加,说明G”的上升幅度相较于G’更大[25]。
由图8e可知,在控制应变1%、频率1.0 Hz条件下,随着温度上升而G’和G”显著下降,这可能与高温条件下,脂滴之间的相互作用和脂滴吸附层大分子之间的相互作用下降有关。由图8f可知,而当温度达到90 ℃并降温冷却后,乳液凝胶的黏度迅速上升,黏弹性增强,样品冷却到5 ℃时,G’达到了加热前G’的2~3 倍,这可能与加热-冷置的循环过程中促进了氢键及其他作用力的生成有关,表明加热-冷置可以用于强化高内相乳液凝胶结构[26]。
2.7 高内相Pickering乳液包封对姜黄素稳定性的影响
如图9所示,纯玉米油中姜黄素的降解较快,在第28天时几乎检测不到姜黄素。而使用Pickering乳液包封之后,姜黄素的稳定性显著提升,在实验终止时的保留率比纯玉米油姜黄素组高10%左右。加入钙离子交联后,乳液中姜黄素的稳定性进一步提升,其中2 mmol/L钙离子浓度下的提升效果最明显,这可能与钙离子交联会使得乳液结构强化,而减少了姜黄素中的泄露和环境中溶解氧、自由基向脂滴中扩散的现象有关[27]。
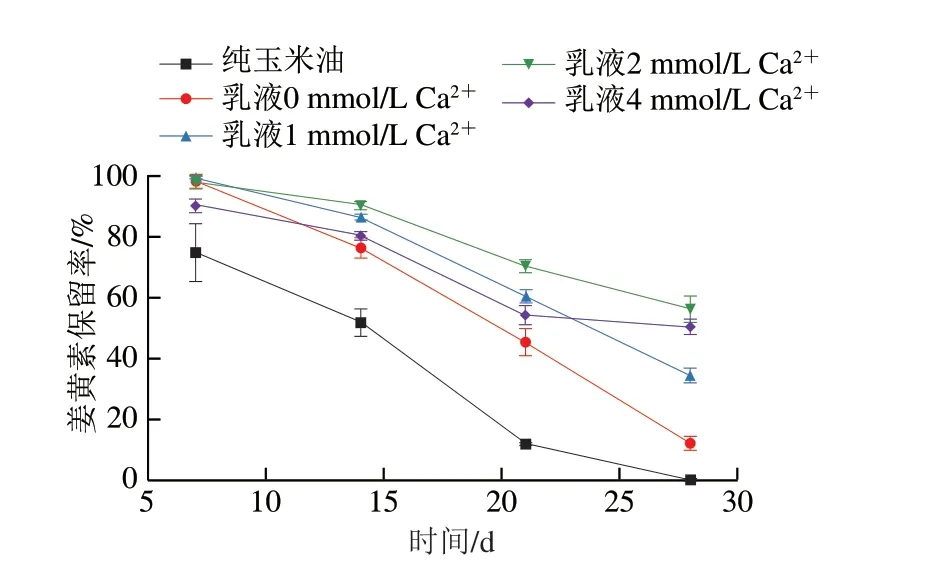
图9 玉米油和不同钙离子交联Pickering乳液中姜黄素稳定性变化Fig.9 Stability of curcumin dissolved in corn oil and stability of curcuminloaded Pickering emulsions in the presence of 0,1,2,or 4 mmol/L Ca2+
2.8 Pickering乳液中姜黄素的生物转化率、生物可给率与生物利用度
如图10a所示,模拟胃肠消化后的Pickering乳液离心后会分为3 层,从上到下分别是油脂层(主要是未消化油脂)、混合胶束层(油脂消化产物、胆汁盐以及溶解的姜黄素)和沉淀层(未消化样品、钙盐等)[28]。一般认为,在混合胶束层中溶解的姜黄素可以穿过小肠黏液屏障从而被肠上皮细胞吸收利用。由图10b可知,纯玉米油中姜黄素生物转化率低,仅为30%左右,这与纯玉米油对姜黄素的稳定性保护效果不佳有关;消化过程中,pH值的变化和自由基的渗透导致姜黄素大量降解;而在乳液中,姜黄素得到了更好的保护。在生物可给率方面,纯油脂在消化液中的分散性较差,导致姜黄素释放不完全,生物可给率很低,不到50%。然而,在乳液中姜黄素的分散性更好,并且消化产物如游离脂肪酸、2-酰甘油等可以与胆汁盐形成混合胶束,增强对姜黄素的载运能力[29]。加入了越多钙离子的乳液,其姜黄素的生物可给率较低。使用钙离子交联会降低包封姜黄素的生物可给率,这有可能与以下原因有关:钙离子的加入会强化乳液结构,导致消化变慢;钙离子也有可能与游离脂肪酸和胆汁盐螯合,生成沉淀,从而降低姜黄素在混合胶束层的增溶[30]。总体而言,不同体系中姜黄素生物利用度的顺序为:1 mmol/L钙离子交联乳液>2 mmol/L钙离子交联乳液>不含钙离子乳液>4 mmol/L钙离子交联乳液>玉米油。

图10 消化后样品图像(a)和姜黄素的生物转化率、生物可给率和生物利用度(b)Fig.10 Images of the samples after simulated digestion (a) and transformation,bioacessibility,and bioavailability of curcumin dissolved in corn oil and curcumin-loaded Pickering emulsions (b)
3 结论
以牛蒡RG-1型果胶多糖和玉米醇溶蛋白为原料,通过反溶剂法制备了Pickering乳液稳定剂。在稳定剂中果胶多糖质量浓度10 mg/mL、pH 3~5条件下获得的Pickering乳液乳化层较高且脂滴分布较为均一。随着NaCl浓度的增加,乳液的粒径大小降低,但稳定性保持良好。在φ0.17~0.75区间内均能形成稳定的乳液,且在φ0.67和φ0.75条件下形成乳液凝胶。进一步制备了荷载姜黄素的高内相乳液(φ0.75),结果表明,添加钙离子可以显著提升荷载乳液的黏弹性以及姜黄素的贮藏稳定性,其中低浓度钙离子(1、2 mmol/L)的效果会高于高浓度钙离子(4 mmol/L)。模拟消化实验发现,使用1、2 mmol/L钙离子交联高内相Pickering乳液可以显著提升姜黄素的生物利用度。本研究对于拓展可食性Pickering乳液在活性因子递送方面的应用具有积极意义。
- 食品科学的其它文章
- 包埋花色苷的海藻酸钙-乳清分离蛋白 复配凝胶的制备与表征
- 酪蛋白胶束与多元活性分子的相互作用及其复合物特性
- Effect of Soy Lecithin,Glucose Oxidase,and Transglutaminase on Dough Rheology and Quality Properties of Steamed Bread Enriched with Potato Pulp
- 不同葡萄糖当量值预消化大米膨化粉的理化性质和结构特性
- 热处理香榧种子油中美拉德产物的生成及其对两种总酚测定方法的影响
- 乳铁蛋白、表没食子儿茶素没食子酸酯、高甲酯果胶和β-环糊精四元复合物基高内相Pickering乳液的构建及表征

