不同倍性白姜花切花挥发性成分差异分析
张爱玲, 涂红艳, 肖望, 陆秋婵, 钟晓晴, 吕雨欣, 易新萍, 卢娜, 何灏城
不同倍性白姜花切花挥发性成分差异分析
张爱玲, 涂红艳, 肖望*, 陆秋婵, 钟晓晴, 吕雨欣, 易新萍, 卢娜, 何灏城
(广东第二师范学院生物与食品工程学院,广东高校应用生态工程技术开发中心,广州 510303)
为比较二倍体和四倍体白姜花()切花挥发性成分差异,采用顶空固相微萃取(HS-SPME)和气相色谱-质谱联用(GC-MS)技术测定了二倍体和四倍体白姜花切花初开期、盛开期和初衰期释放物质种类,通过峰面积归一法测定了各成分的相对含量,建立正交偏最小二乘判别分析(OPLS-DA)模型进行主成分分析和变量投影(VIP)分析。结果表明,白姜花切花挥发性成分包含63种萜烯类、40种苯丙素类和22种脂肪酸衍生物类物质;萜烯类物质相对含量大于其他两类,四倍体白姜花在初开和盛开期挥发物质总质量极显著大于二倍体。二倍体与四倍体挥发性成分的组间差距明显,两个倍性组内差距在正常范围内;挥发性成分约63.7%的代表性特征得到较好聚类;优势成分和劣势成分均是两个倍性白姜花差异的重要成分。在盛开期和初衰期,-罗勒烯是四倍体特有的且相对含量最大的优势成分,-罗勒烯是二倍体中相对含量最大且显著多于四倍体的优势成分;二倍体和四倍体共有的优势成分和贡献较大的物质是石竹烯、沉香醇、桉树脑、-金合欢烯和苯甲酸甲酯等。总体上,二倍体白姜花在四倍化过程中挥发性成分种类和总含量增加,相同倍性不同时期的挥发性成分种类和含量也存在差异,白姜花切花的挥发性成分以萜烯类为主。
白姜花;四倍体;挥发性成分;气相色谱-质谱联用;罗勒烯
植物花朵可以分泌低分子量挥发性次生代谢物,赋予花朵独特的香味,在植物的繁殖、观赏性方面发挥着重要的作用[1]。白姜花()为姜科(Zingiberaceae)姜花属多年生草本植物,分布于整个热带地区[2]。香气浓郁怡人是白姜花的显著特征之一,加之洁白的花色和飘逸的花形,使其成为南方地区流行的重要切花品种。此外,白姜花还是重要的药用植物,其花、根、茎含有多种活性成分,在我国南方地区是一种重要民间药物[3–4]。分析白姜花切花挥发性成分组成及在开放过程中的变化规律,将有助于解析白姜花挥发性成分合成的调控机理,为开发利用白姜花潜在的经济价值提供科学资料。
多倍体诱导是药用和观赏植物改良的有效策略。花卉的芳香物质不仅在不同开花时期呈现种类和释放量的差异,在其多倍化过程中也会产生较大的变化,不同倍性手参()的挥发性成分组成呈现显著差异[5–6],说明多倍化对挥发性成分的合成和表达产生了影响。与二倍体相比,四倍体植物不仅具有更大的体型和花型等特征,多倍化后重复基因表达剂量也增强了代谢活性,组织和器官中次生代谢物(比如挥发性成分)等浓度会得到提升,这些新产生的表型、次生代谢物质的含量变化等在农业上具有潜在的应用价值[7]。
课题组前期通过薄片培养结合秋水仙素诱导技术获得了白姜花四倍体植株,与二倍体植株相比,白姜花四倍体不仅植株高大,花器官变大,而且还散发出更为浓郁的花香[8]。本研究通过顶空固相微萃取(HS-SPME)和气相色谱-质谱联用(GC-MS)技术对白姜花二倍体和四倍体在初开期、盛开期和初衰期的挥发性成分种类进行鉴定,测定挥发性成分的含量,采用主成分分析法对花朵不同发育时期的主要挥发性成分进行分析,探讨白姜花在多倍化过程中挥发性成分组成和释放的规律变化。
1 材料和方法
1.1 材料
本研究于2019—2020年在广东第二师范学院和华南农业大学测试中心完成。白姜花()二倍体和四倍体采自广州市从化试验基地。将花枝保留大约45 cm剪下,插入水中带回实验室备用。选取初开期、盛开期和初衰期的小花用于挥发性成分含量的测定。初开期指花苞完全伸出苞叶、小花花瓣微展约30° (图1: A);盛开期指小花花瓣完全展开,花瓣呈约180° (图1: B);初衰期指小花花冠管向下弯曲,与花冠约成60°的夹角,花瓣开始失去张力出现皱褶(图1: C)。
用于成分分析的标准品癸酸乙酯购自Sigma公司;萃取头涂层材料为DVB/CARon PDMS即聚二甲基氧烷,购自Sigma公司;气相色谱仪型号色谱柱型号为安捷伦DB-5MS系列122-5532型(30 m; 0.25 mm×0.25m),用于气体分析,GC-MS 型号为安捷伦7890B,用于质谱分析。

图1 白姜花小花。A: 初开期; B: 盛开期; C: 初衰期。
1.2 挥发性成分的提取
采用顶空固相微萃取(HS-SPME)技术进行挥发性成分的提取。取白姜花二倍体和四倍体初开期、盛开期和初衰期的小花各5朵放入洁净的250 mL锥形瓶中,分别设置3个重复。在锥形瓶中加入5L 31.6 ng/L癸酸乙酯作为内标物,迅速用锡箔纸包住锥形瓶口,用封口膜密封。将萃取头在气相色谱进样口250 ℃温度下老化30 min (涂层厚度50/30m), 将老化后的萃取头透过锡箔纸伸进样品瓶内置于花朵上方约 2~3 cm处,顶空萃取30 min,随后将萃取头取出后插入气相色谱仪进样口,于250 ℃解吸3 min,对挥发性成分进行分析鉴定。
1.3 挥发性成分分析
采用气相色谱-质谱联用(GC-MS)技术进行挥发性成分分析。气相色谱条件:色谱柱用HP-5石英毛细管柱(30 m×0.25 mm×0.25m);载气为高纯氦气He, 分流比20׃1, 柱前压50 Pa, 流量2 mL/min;取样时间2 min;程序升温:柱起始温度40 ℃,保持2 min,以5 ℃/min的速度升至80 ℃,保持2 min,再以10 ℃/min的速度升至250 ℃,保持5 min。质谱条件:扫描质量范围50~550;扫描时间0.3 s,间隔0.2 s,电压1 kV。采集到的离子图用WILEY/ MAINLIB库进行分析,通过质谱和保留时间与对照品进行比较,按各峰的质谱裂片图与标准质谱库进行核对,根据人工图谱解析及标准质谱库进行挥发性成分鉴定,确认挥发性成分的种类。以癸酸乙酯为内标,采用内标法定量分析每种化合物含量[9], W=(A×N×M)/(A××)×109, 式中,W为化合物含量[ng/(g·h)],A为化合物峰面积,N为内标物的量(mol),M为化合物的摩尔质量(g/mol);A为内标物的峰面积,为样品取样量(g),为停留时间。根据各组分的峰面积按照归一化定量分析法计算化合物的相对含量。
1.4 数据处理
将归一化处理的各物质相对含量进行检验, 分析两个倍性白姜花花瓣不同时期释放的总物质含量差异的显著性和优势物质相对含量, 以<0.01表示差异显著;利用SIMCA软件进行主成分分析(principal component analysis, PCA);建立OPLS-DA模型(正交偏最小二乘判别分析, orthogonal signal correction and partial least squares-discriminant analysis),基于OPLS-DA模型预测VIP值(variable importance in projection, VIP),分析不同时期两个倍性白姜花花瓣挥发性成分的差异。
2 结果和分析
2.1 花挥发性成分的种类
采用GC-MS分析白姜花二倍体和四倍体在初开期、盛花期和初衰期的挥发性花香成分(图2),在初开期,二倍体和四倍体白姜花花香成分的总离子峰图较单一,表明在此时挥发性物质含量较少;在盛开期和初衰期,二倍体和四倍体白姜花花香成分总离子丰度高,表明此时挥发性成分比初开期多。
对白姜花花朵的挥发性成分可以分为萜烯类、苯基苯丙烷类和脂肪酸衍生物等3大类(图3)。从二倍体的初开期、盛开期和初衰期花朵中分别鉴定出39、68和44种挥发性化合物,四倍体中分别鉴定出43、74和41种。二倍体和四倍体初开期的挥发性成分种类较少,在盛开期挥发性成分种类增加, 随着花朵的衰老,挥发性物质种类减少。初开期萜烯类和脂肪类物质较多,盛开期和初衰期萜烯类和苯基苯丙烷类种类较多,脂肪酸类种类最少。
2.2 花挥发性成分含量的比较
二倍体和四倍体白姜花花的挥发性成分含量存在显著差异(表1)。四倍体在初开期和盛开期的挥发性成分总量极显著高于二倍体,主要是四倍体此时的萜烯类物质总量明显高于二倍体。相反,在初衰期,二倍体的挥发性成分总量[19.89 mg/(g·h)]极显著高于四倍体[17.25 mg/(g·h)],主要来自于苯丙素类化合物。
二倍体花初开期的挥发性成分总量较少,然后在盛开期和初衰期急剧增加(表1)。初开期的萜烯类、苯丙烷类和脂肪酸类相对含量分别为89.64%、3.31%和7.05%;从盛开期到初衰期挥发性成分的组成结构发生了变化,表现为萜类物质和脂肪酸类相对含量下降,苯丙素类化合物相对含量升高,脂肪酸类相对含量下降。四倍体不同开花期的挥发性成分含量与二倍体表现出相同的变化规律。
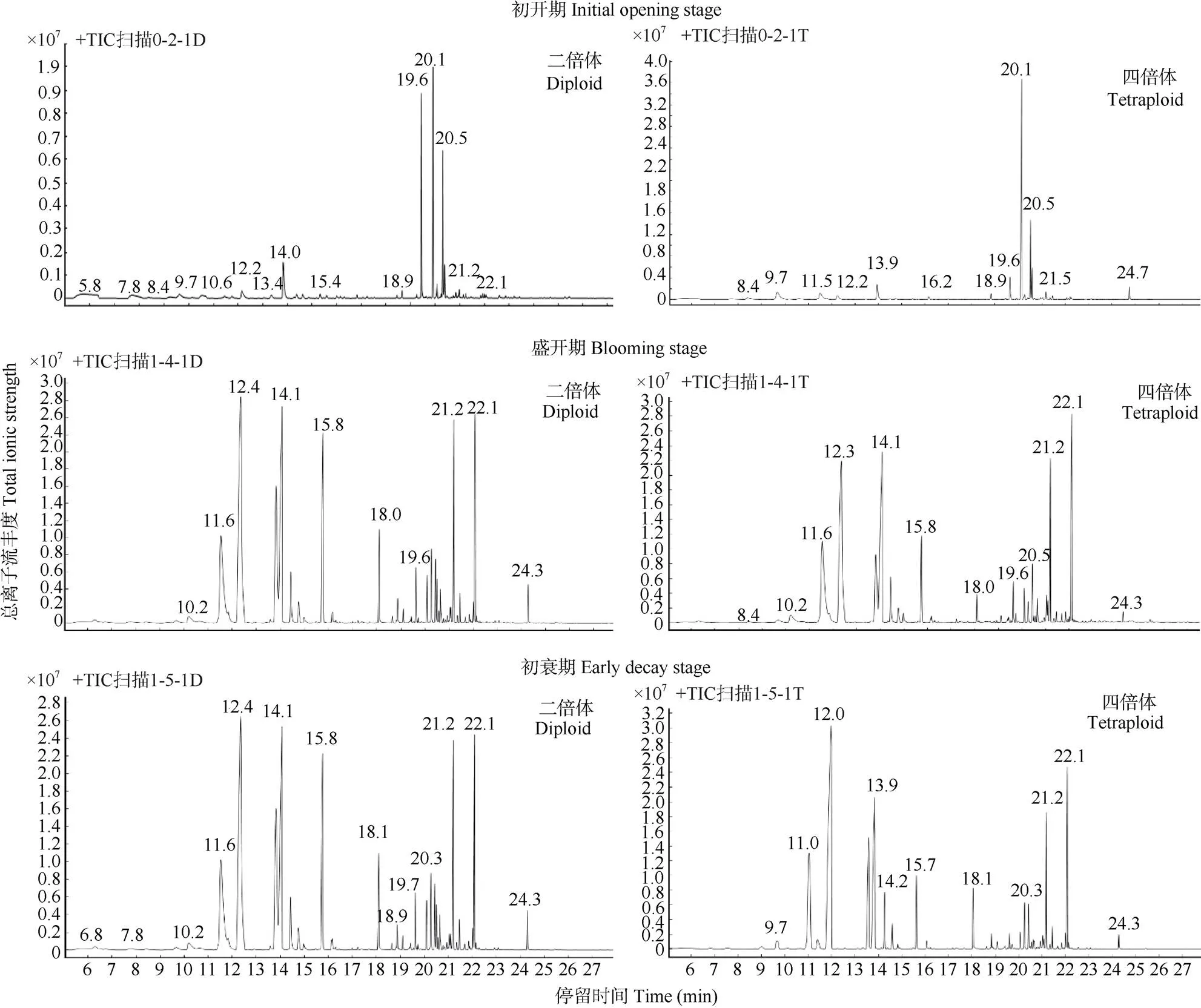
图2 白姜花花挥发性成分的总离子流图

图3 白姜花二倍体和四倍体花挥发性成分的种类和数量

表1 二倍体和四倍体白姜花花挥发性成分总量
**:<0.01
2.3 花挥发性成分的分析
在两个倍性白姜花3个时期检测到挥发性成分125种,其中萜烯类63种,苯基苯丙烷类40种,脂肪酸衍生物22种(表2仅列出30种优势成分)。二倍体共有96种挥发性成分,四倍体有102种,其中二倍体和四倍体共有的挥发性成分72种,二倍体特有的24种,四倍体特有的30种, 表明白姜花在多倍化过程中,挥发性成分的种类发生了改变。二倍体的24种特有挥发性成分在各时期的相对含量总和<1%,是构成挥发性成分的劣势成分;四倍体特有的30种挥发性成分中,初开期的-蒎烯和盛开期和初衰期的-罗勒烯相对含量高, 分别为7.02%、31.09%和36.58%,其他的相对含量很低。

续表(Continued)
-: 未检测到; tr: 痕量。
-: Not detected; tr: Trace.
2.3.1 主成分分析(PCA)
对两个倍性3个时期6个样品的所有挥发性成分进行主成分分析(图4: A), 结果表明样本聚集程度较好,趋于数轴中心点, 说明实验方法和仪器可靠稳定。同时,6个样品的挥发性化合物在组内较为聚集,同一时期样品聚集在相同的象限,如1~3和10~12分别为二倍体和四倍体初开期样品,7~9和16~18分别为二倍体和四倍体盛开期样品,两个倍性初衰期聚集在同一象限,3组的样品区分明显, 说明样品重复性良好;挥发性物质的差异体现在不同时期, 在相同时期,如二倍体和四倍体初开期,无论在挥发性成分种类还是含量方面都存在较大的相似性; 同样,两个倍性白姜花在盛开期和初衰期也存在同样趋势。PC1和PC2分别解释了39.2%和24.5%的方差, 挥发性物质约63.7%的代表性特征得到较好聚类。
对挥发性物质特征负载值的分析表明(图4: B),大多数优势挥发性成分在两个倍性盛开期和初衰期释放并聚在一起,而且倍性间的共有物质在这两个时期最多,初开期最少(表2)。
2.3.2 OPLS-DA分析
对于相关性较小的变量,OPLS-DA比PCA能更为精准筛选出组间挥发性成分的差异。分别计算二倍体和四倍体初开期、盛开期、初衰期挥发性成分预测参数(图5)。在初开期,二倍体vs四倍体的R2X (对X矩阵的解释率)、R2Y (对Y矩阵的解释率)分别为81.9%和9.46% (图5: A);在盛开期分别为88.8%和10.1% (图5: B);在初衰期分别为83.9%和15.1% (图5: C)。OPLS-DA得分表明二倍体与四倍体各组间差距明显, 2个倍性组内差距在正常范围内。
2.3.3 基于VIP的挥发性差异成分的韦恩分析
基于OPLS-DA分析结果,选取VIP≥1的差异挥发性成分进行韦恩分析,结果表明(图6),初开期,二倍体vs四倍体的差异挥发性成分有50种,其中二倍体特有17种,四倍体特有21种,共有12种; 盛开期,二倍体vs四倍体差异挥发性成分有73种, 其中二倍体特有13种,四倍体特有20种,共有39种;初衰期,二倍体vs四倍体差异挥发性成分有43种,其中二倍体特有8种,四倍体特有5种,共有30种。可见,2个倍性切花在3个时期的挥发性成分差异较明显。
韦恩分析结果表明(图6),优势成分和劣势成分均是两个倍性白姜花的重要差异成分。对两个倍性3个时期共有的相对含量>0.1%的挥发性成分(表2), 以及VIP值P≥1的差异挥发成分进一步分析,结果表明,-罗勒烯是四倍体白姜花相对含量最高的特有成分,在盛开期和初衰期其相对含量高达31.09%和36.02%。在二倍体中,相对含量最高的是-罗勒烯,在盛开期和初衰期显著高于四倍体。

图4 白姜花花挥发性成分的主成分分析。A: 样品分布,1~3: 二倍体初开期; 4~6: 二倍体盛开期; 7~9: 二倍体初衰期; 10~12: 四倍体初开期; 13~15:四倍体盛开期; 16~18: 四倍体初衰期; B: 挥发性物质特征负载值分布。1~30见表2,下同。
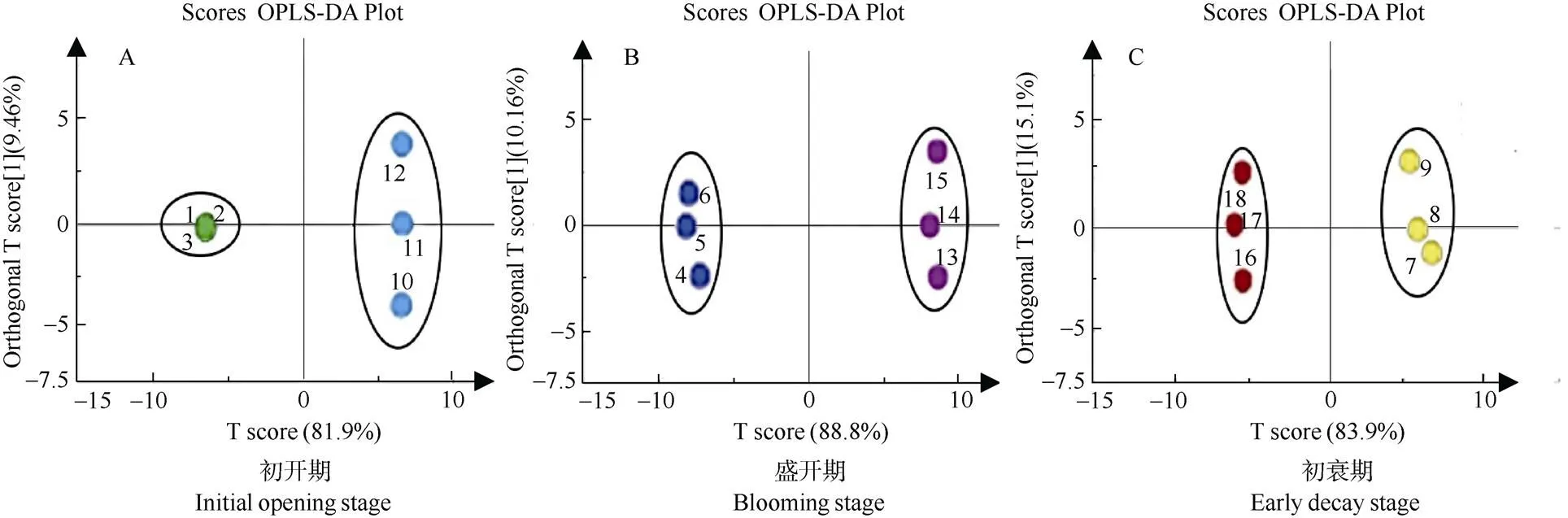
图5 二倍体vs四倍体样品的OPLA-DA得分
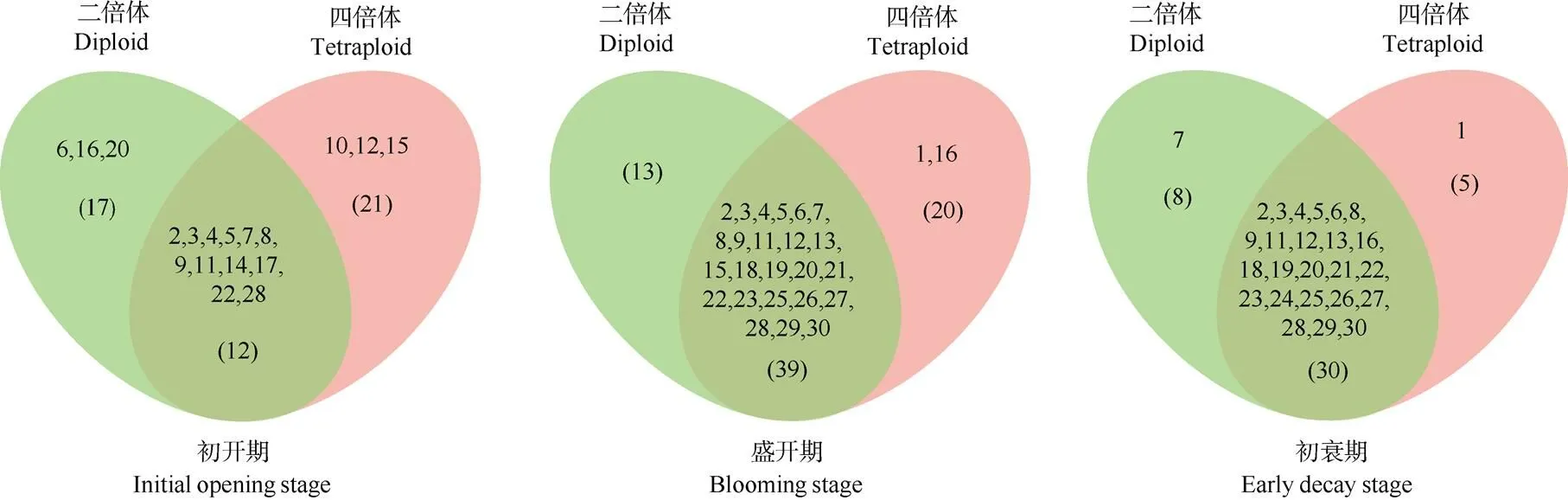
图6 二倍体和四倍体白姜花3个时期花差异挥发性成分韦恩分析。括号内数字表示化合物种类。
石竹烯在初开期含量很高,在盛开期、初衰期很低,且在同一时期两个倍性间没有显著差异。两个倍性初开期的-金合欢烯和沉香醇相对含量较高,但差异不显著,在盛开期、初衰期含量下降或不产生。苯基苯丙烷类物质中,苯甲酸甲酯和苯甲酸乙酯是两个倍性主要的优势挥发性成分,苯甲酸乙酯随着花的发育相对含量开始下降;吲哚只在初衰期检测到,在其他两个时期在两个倍性之间差异不显著。
3 结论和讨论
花色、花香、花型和瓶插寿命等品质性状决定了观赏花卉的商品价值,是花卉市场活力的主要推动力量。自然界中具有浓郁香气的花卉大多数形体较小,如桂花()、含笑()、紫丁香()、水仙()等,白姜花是少有的花型较大且香气浓郁的具有观赏价值的花卉,明确白姜花花挥发性物质释放规律对于培育香型切花品种和开发潜在香料价值具有重要的意义。
目前,作为工业香料的重要来源,一些著名的芳香型花卉的花香味谱不断得到解析,如桂花[10]、百合()[11]、梅花()[12]、鸢尾()[13]、山茶属()[14]等,如萜烯类、醇类和酯类是鸢尾花的主要花香成分[13],在一些梅花杂交品种中,苯基苯丙烷类占挥发性成分总含量可达95%以上[11]。研究表明,花朵释放的挥发性有机化合物按生物合成来源大致可分为4类:萜类化合物、苯基丙烷类化合物、脂肪酸衍生物和含氮/硫化合物[15]。本研究检测了二倍体和四倍体白姜花在3个花发育时期的挥发性成分,125种化合物大致可分为萜烯类化合物、苯基丙烷类化合物和脂肪酸衍生物。虽然两个倍性含有各自特有的挥发性成分,但是大部分为劣势成分,相对含量>0.1%的优势挥发性成分并不多。-罗勒烯、沉香醇、-金合欢烯是二倍体的优势香气成分,而前人[16]的研究表明, 沉香醇、1,8-桉油醇(桉树脑)、3,7-二甲基1,3,7-辛三烯(-罗勒烯)、乙酸月桂酯、苯甲酸甲酯为白姜花的特征香气成分,这可能与挥发性成分的释放极易受到环境因素的影响,以及标准质谱库不断完善有关。尽管挥发性成分不同,但大多数挥发性成分的生物合成途径在植物界都是保守的[17–18]。虽然本研究中白姜花不同时期释放的挥发性成分和含量有所变化,但与前人[15]研究相比,主要的花香成分基本上保持稳定。
主成分分析表明,二倍体和四倍体在相同的花发育阶段,其释放的挥发性成分较为接近;而两个倍性在不同发育期的挥发性成分差异较大;OPLS- DA模型也较好地支持两个倍性在3个时期的挥发性成分差异。二倍体和四倍体在初开期挥发性成分释放量少,共同的优势物质如石竹烯、-金合欢烯,随发育进程释放量急剧下降。在盛开期和初衰期,两个倍性的挥发性成分则呈现出一定的差异。-罗勒烯(31.09%)是四倍体中最主要的挥发性成分,而在二倍体中-罗勒烯是最主要的挥发性成分,这与前人[16]的研究结果不同。罗勒烯是植物天然存在的一种有机挥发性小分子,-罗勒烯和-罗勒烯是两种不同的构型,罗勒烯可以提高植物的耐胁迫能力[19–21],这为探究白姜花的耐胁迫能力提供了参考。虽然白姜花的二倍体和四倍体的主要挥发性成分组成相似,但由于挥发性成分的总量和各成分相对含量不同,因此对嗅觉器官的刺激或者激活作用不同,因而产生了不同感觉的香气特征。相比二倍体,白姜花四倍体的花香表现更为浓郁[8]。与盛开期相比,二倍体和四倍体在初衰期释放的挥发性成分总量进一步增加,挥发性成分的组成也发生了变化,如苯甲酸-2-甲基丁基酯和吲哚仅在初衰期检测到,这可能导致白姜花香气在初衰期变得浓烈沉闷。此外, 李慧[22]报道薰衣草()中-反式罗勒烯含量最高,李琳[23]报道水仙的主要挥发性成分为罗勒烯与反式罗勒烯,钱晓慧等[24]、陆安霞等[25]报道腊梅()开放过程中释放以花果香气为主的-罗勒烯,这为白姜花的花香香型的界定和花香物质利用提供参考。
在本研究中,二倍体诱变为四倍体后,挥发性成分总量显著增加,这部分解释了四倍体白姜花香味增强的原因[8]。植物多倍化后从分子到表型等不同尺度表现多重效应,一些植物多倍化后出现了气味模式的变化[5–6],这可能是促进挥发性成分进化的一个重要驱动因素[26]。
综上,白姜花二倍体诱导为四倍体后,切花释放的挥发性物质总量显著增加,两者均表现在初开期释放总量较少,盛开期和初衰期释放量较多;在不同开放时期,挥发性物质种类以萜烯类为主,其次是苯基苯丙烷类和脂肪酸衍生物,罗勒烯是白姜花中相对含量最高的优势花香物质,并以不同构型存在于两种倍性白姜花中。
[1] DE VEGA C, HERRERA C M, DÖTTERL S. Floral volatiles play a key role in specialized ant pollination [J]. Perspect Plant Ecol Evol Syst, 2014, 16(1): 32–42. doi: 10.1016/j.ppees.2013.11.002.
[2] Lim T K. Edible Medicinal and Non Medicinal Plants, Volume 8 Flowers [M]. Dordrecht: Springer, 2014: 847–856. doi: 10.1007/978- 94-017-8748-2.
[3] YUE Y C, YU R C, FAN Y P. Characterization of two monoterpene synthases involved in floral scent formation in[J]. Planta, 2014, 240(4): 745–762. doi: 10.1007/s00425-014-2127-x.
[4] JI B B, HU X, HUANG J Q, et al. Review on chemical constituents ofJ. Koenig and their biological and pharmacological activities [J]. J Zhongkai Univ Agric Eng, 2018, 31(3): 64–71. [姬兵兵, 胡秀, 黄嘉琦, 等. 白姜花化学成分及其生物和药理活性研究进展 [J]. 仲恺农业工程学院学报, 2018, 31(3): 64–71. doi: 10.3969/j.issn.1674-5663.2018.03.011.]
[5] Gross K, Schiestl F P. Are tetraploids more successful? Floral signals, reproductive success and floral isolation in mixed-ploidy populations of a terrestrial orchid [J]. Ann Bot, 2015, 115(2): 263–273. doi: 10.1093/aob/mcu244.
[6] JERsáková J, Castro S, Sonk N, et al. Absence of pollinator- mediated premating barriers in mixed-ploidy populations ofs.l. (Orchidaceae) [J]. Evol Ecol, 2010, 24(5): 1199– 1218. doi: 10.1007/s10682-010-9356-7.
[7] LAVANIA U C. Genomic and ploidy manipulation for enhanced production of phyto-pharmaceuticals [J]. Plant Genet Resour, 2005, 3(2): 170–177. doi: 10.1079/PGR200576.
[8] TU H Y, Zhang A L, Xiao W, et alInduction and identification of tetraploidthrough thin cell layer culture [J]. Plant Cell Tiss Organ Cult, 2018, 135(3): 395–406. doi: 10.1007/s 11240-018-1472-z.
[9] ZHAO Y Q, PAN H T, ZHANG Q X, et al. Studies on the volatile constituents from cultivars of[J]. J Trop Subtrop Bot, 2010, 18(3): 310–315. [赵印泉, 潘会堂, 张启翔, 等. 不同类型梅花品种挥发性成分的研究[J]. 热带亚热带植物学报, 2010, 18(3): 310–315. doi: 10.3969/j.issn.1005-3395.2010.03.017.]
[10] ZOU J J, CAI X, ZENG X L, et al. Changes of aroma-active com- pounds in different cultivars ofduring flowering [J]. Acta Hort Sin, 2017, 44(8): 1517–1534. [邹晶晶, 蔡璇, 曾祥玲, 等. 桂花不同品种开花过程中香气活性物质的变化 [J]. 园艺学报, 2017, 44(8): 1517–1534. doi: 10.16420/j.issn.0513-353x.2017-0050.]
[11] DU F, WANG T, FAN J M, et al. Volatile composition and classi- fication offlower aroma types and identification, polymer- phisms, and alternative splicing of their monoterpene synthase genes [J]. Hort Res, 2019, 6: 110. doi: 10.1038/s41438-019-0192-9.
[12] Zhang T X, Bao F, Yang Y J, et al. A comparative analysis of floral scent compounds in intraspecific cultivars ofwith different corolla colours [J]. Molecules, 2019, 25(1): 145. doi: 10.3390/ molecules25010145.
[13] YUAN Y, SUN Y, ZHAO Y C, et al. Identification of floral scent profiles in bearded irises [J]. Molecules, 2019, 24(9): 1773. doi: 10. 3390/molecules24091773.
[14] FAN Z Q, LI J Y, LI X L, et al. Composition analysis of floral scent within genusuncovers substantial interspecific variations [J]. Sci Hort, 2019, 250: 207–213. doi: 10.1016/j.scienta.2019.02.050.
[15] MUHLEMANN J K, KLEMPIEN A, DUDAREVA N. Floral volatiles: From biosynthesis to function [J]. Plant Cell Environ, 2014, 37(8): 1936–1949. doi: 10.1111/pce.12314.
[16] LI R H, FAN Y P. Changes in floral aroma constituents inkoenig during different blooming stages [J]. Plant Physiol Commun, 2007, 43(1): 176–180. [李瑞红, 范燕萍. 白姜花不同开花时期的香味组分及其变化 [J]. 植物生理学通讯, 2007, 43(1): 176–180.]
[17] ASAKAWA Y, LUDWICZUK A, NAGASHIMA F. Phytochemical and biological studies of bryophytes [J]. Phytochemistry, 2013, 91: 52–80. doi: 10.1016/j.phytochem.2012.04.012.
[18] CHEN F, LUDWICZUK A, WEI G, et al. Terpenoid secondary meta- bolites in bryophytes: Chemical diversity, biosynthesis and biological functions [J]. Crit Rev Plant Sci, 2018, 37(2/3): 210–231. doi: 10.1080/ 07352689.2018.1482397.
[19] TIAN Z H, LUO Q Y, ZUO Z J. The role of ocimene inresisting high temperature [J]. Plant Physiol J, 2020, 56(3): 547–555. [田正凤, 罗青云, 左照江. 罗勒烯在香樟抗高温胁迫中的作用 [J]. 植物生理学报, 2020, 56(3): 547–555. doi: 10.13592/j.cnki. ppj.2019.0248.]
[20] GUI Q. Preliminary study on the mechanism of ocimene promoting plant insect resistance [D]. Changsha: Hunan Agricultural University, 2017. [桂茜. 罗勒烯促进植物抗虫分子机制的初步研究 [D]. 长沙: 湖南农业大学, 2017.]
[21] XIAO M. Insight into the molecular basis of ocimene-primed plant defense [D]. Changsha: Hunan Agricultural University, 2019. [肖牧. 罗勒烯诱导植物防御反应的分子机制研究 [D]. 长沙: 湖南农业大学, 2019. doi: 10.27136/d.cnki.ghunu.2019.000424.]
[22] LI H. Molecular mechanism of the terpenoids metabolism regulation of lavender and the influence on the flower-visiting insects [D]. Beijing: Beijing Forestry University, 2019. [李慧. 薰衣草萜类代谢调控分子机制及对访花昆虫影响 [D]. 北京: 北京林业大学, 2019. doi: 10. 26949/d.cnki.gblyu.2019.000647.]
[23] LI L. Analysis of genes related to the terpenoids synthesis pathway in‘Yunxiang’ based on Transcriptome data [D]. Fuzhou: Fujian Agriculture and Forestry University, 2019. [李琳. 基于转录组分析‘云香’水仙萜类合成途径基因的研究 [D]. 福州: 福建农林大学, 2019.]
[24] QIAN X H, CHEN L Q, LI B, et al. Analysis of aromatic components from different genotypes ofin Yunnan Province [J]. SW China J Agric Sci, 2021, 34(4): 834–841. [钱晓慧, 陈龙清, 李彪, 等. 云南地区不同基因型蜡梅花香气成分分析 [J]. 西南农业学报, 2021, 34(4): 834–841. doi: 10.16213/j.cnki.scjas.2021.4.022.]
[25] LU A X, ZHOU X R, YE Y L, et al. Changes of sensory characteristic and volatiles of harvested flowers ofduring spreading process [J]. Acta Hort Sin, 2020, 47(1): 73–84. [陆安霞, 周心如, 叶玉龙, 等. 蜡梅花离体摊放过程中香气感官评价和挥发性物质分析 [J]. 园艺学报, 2020, 47(1): 73–84. doi: 10.16420/j.issn. 0513-353x.20190-0233.]
[26] MADLUNG A, WENDEL J F. Genetic and epigenetic aspects of polyploid evolution in plants [J]. Cytogenet Genome Res, 2013, 140 (2/3/4): 270–285. doi: 10.1159/000351430.
Volatile Components in Cut Flowers of Diploid and Tetraploid
ZHANG Ailing, TU Hongyan, XIAO Wang*, LU Qiuchan, ZHONG Xiaoqing, LÜ Yuxin, YI Xinping, LU Na, HE Haocheng
(College of biology and food engineering, Development Center of Applied Ecology and Ecological Engineering in Guangdong Universities, Guangdong University of Education, Guangzhou 510303, China)
In order to compare the difference of volatile components in cut flowers of diploid and tetraploid, the types of volatile components released from cut flowers were determined by headspace solid phase microextraction (HS-SPME) and gas chromatography-mass spectrometry (GC-MS) at initial opening, blooming and early decay stages. The relative content of each component was determined by the peak area normalization method, and the orthogonal partial least quadratic discriminant analysis (OPLS-DA) model was established for principal component analysis and variable importance projection (VIP) analysis. The results showed that there were 63 terpenoids, 40 phenylpropanoids, and 22 fatty acid derivatives identified from the cut flowers. The relative content of terpenoids was higher than that of the other components. The total volatile mass of tetraploid flowers was significantly higher than those of diploids at initial opening and blooming stages. The difference of volatile components between diploid and tetraploid groups was obvious, and the difference within the two ploid groups was within the normal range. About 63.7% representative characteristics of volatile compounds were clustered. The variance analysis of the volatile compounds showed that the dominant and minor compounds contributed to the difference between the diploid and tetraploid. During blooming and early decaying stages,-ocimene was the dominant component of tetraploid with the highest relative content, while-ocimene was the dominant component with the highest relative content in diploid and significantly more than that in tetraploid. The common dominant components and contributions of diploid and tetraploid were caryophyllene, linalool, cineole,-farnesene, and methyl benzenecarboxylate. Therefore, the types and total contents of volatile components increased with quadrupling process, and the types and contents of volatile components at different periods of the same ploidy were also different. The main volatile components ofwere terpenes.
; Tetraploid; Volatile compounds; GC-MS; Ocimene
10.11926/jtsb.4629
2022-02-28
2022-08-24
广东省创新强校工程基础研究重点项目及应用研究重点项目(2018KZDXM049);广州市科技计划项目(201804010413, 202102080244);广东第二师范学院大学生创新创业训练计划(202114278106, 202214278097);广东省大学生攀登计划项目(pdjh2022b0383)资助
This work was supported by the Project for Basic and Application Research of Guangdong Provincial Innovation School (Grant No. 2018KZDXM049), the Program for Science and Technology Planning of Guangzhou (Grant No. 201804010413, 202102080244), the Project for Innovation and Entrepreneurship of Guangdong University of Education (Grant No. 202114278106, 202214278097), and the Climbing Program for College Students in Guangdong (Grant No. pdjh2022b0383).
张爱玲(1977年生),女,副教授,主要从事动植物分子遗传学研究和教学工作。E-mail: zhangailing@gdei.edu.cn
通讯作者 Corresponding author.E-mail: xiaowang@gdei.edu.cn

