AFP IL-6 FT3水平与人工肝支持急性肝衰竭患者预后的关系及意义
李彩霞, 孟文勤, 郝颖楠, 张勇刚
(1.内蒙古自治区人民医院重症医学科, 内蒙古 呼和浩特 010020 2.内蒙古自治区肿瘤医院腹部外科B区, 内蒙古 呼和浩特 010020)
急性肝衰竭(Acute liver failure,ALF)是以肝细胞大量死亡导致的快速严重肝损伤、凝血功能障碍和肝性脑病为特征的综合征,与高循环水平的内源性有害分子从器官内逃逸到体循环有关[1,2]。肝脏作为重要器官,功能障碍逐渐导致多器官功能障碍综合症,死亡率高[3]。ALF可由多种原因引起,如病毒感染(乙型或丙型肝炎或其他)、酒精成瘾和药物滥用等,肝脏免疫微环境功能障碍被认为是导致ALF的主要原因。目前,治疗ALF的方法主要是肝移植或人工肝支持系统(artificial liver support system,ALSS)。虽然肝移植被认为是治疗急性肝衰竭最有效的措施,但因为各种原因目前无法得到广泛应用。ALSS治疗目前被证明是除肝移植外可降低ALF患者死亡率的有效治疗策略。ALSS治疗可缓解持续性损伤,修复肝组织,为肝移植等治疗提供了宝贵的时间。然而,并非所有的ALF患者都能从ALSS治疗中获益,部分患者甚至对ALSS无反应。因此,探索与人工肝支持急性肝衰竭患者预后的预测指标具有重要意义。虽然多项研究显示[4],AFP、IL-6、IL-8、TNF-α及TF3等细胞因子被证明在ALSS治疗ALF中具有预测价值,但目前仍未有成熟的系统性标准来评估预测人工肝治疗ALF的效果。本文对103例ALF患者ALSS治疗后血清AFP、FT3、IL-6的水平变化进行了检测对比,以探讨其在ALSS治疗ALF中的临床意义。
1 资料与方法
1.1一般资料:对我院2019年3月至2021年3月采取人工肝支持治疗的103例急性肝衰竭患者进行回顾性研究,根据其治疗后随访90d内的生存结局分为死亡组35例、生存组68例。纳入标准:①患者年龄19~75岁;②重急性肝衰竭患者临床诊断和纳入标准参考《肝衰竭诊治指南(2018年版)》[5],患者因各种诱因导致急性肝损伤、肝功能衰竭,临床表现为患者的黄疸病情逐渐的加重、可出现凝血功能障碍、血清总胆红素(TBIL)超过正常上限值10倍或每日升高超过17.1μmoL/L,需要实施人工肝进行替代治疗;③患者愿意在我院接受人工肝支持治疗;④课题研究开头报告符合医学伦理委员会规定,并获得患者家属的知情同意。排除标准:①癌症、白血病患者;②心脏瓣膜疾病、心肌炎、心脏起搏器植入患者;③HIV感染患者;④因病情恶化转院治疗;⑤伴有免疫系统疾病、甲状腺功能疾病。
1.2AFP、FT3、IL-6检测方法:留取患者第2天空腹血标本,2000r/min低温离心10min,取上清液置于-80℃冰箱保存。采用ELISA法检测AFP、IL-6水平:预先准备蒸馏水将浓缩清洗液按1∶10的比例稀释混匀后备用。将检测用的试剂和样品在正常室温下充分混匀,将标准品和待测样品按顺序分别加入加入标准品孔和样品孔,每孔100μL。混匀后用封版膜封板,37℃反应1h,然后取出微孔板,小心揭除封版膜,将孔内液体弃去,加入配好的洗涤液,静置30s后弃去,反复洗涤5次。洗涤结束后,除空白孔外,均加入50μL酶标记物,然后按顺序加入50μL底物I和50μL底物Ⅱ,混匀后室温下避光反应15min。反应结束后每孔加入50uL终止液。终止反应后15min内在450nm波长下读取各孔的吸光度值,根据标准曲线,计算AFP、IL-6水平。采用化学发光免疫法检测FT3:每孔加入500μL待测样品,600r/min震荡2h,弃去液体后拍干进行吸附,每孔加入625μL的25%丙酮,震荡5min,弃去液体后拍干进行除杂;再用875μL醋酸钠洗涤3次,弃去液体拍干;每孔加入250μL的0.1moL/L NaOH,震荡15min进行洗涤;加入100μL 1moL/L Tris(pH7.8),25μL酰化剂,震荡5min进行酰化。将处理好的待测样品转移至反应杯中,使用全自动检测分析仪(郑州安图生物工程股份有限公司)检测FT3含量。试剂盒购于Biolegend公司,严格按照说明书实验步骤进行检测。
1.3人工肝支持治疗方法:治疗全程严密监测患者生命体征,首次治疗留置股静脉单针双腔导管,并在ALSS治疗前肝素化管路,以80~150mL/min的速率置换血浆,肝素维持量5mg/h,出血风险高的患者采用无肝素滤过。每次维持同型新鲜冰冻血浆2600~3500mL的置换量,治疗时间2~3h/次,3~5d/次,治疗次数≥2次/周。常规使用地塞米松5mg于治疗前,同时,分别于术前、中、后注射10mL葡萄糖酸钙,治疗过程中实时监测凝血功能,根据检查结果调节肝素用量,治疗结束时输注鱼精蛋白(1/2体内肝素量)。当患者恶心、呕吐及肝性脑病的临床症状、肝功能相关指标及凝血功能指标均改善(TBIL<140umoL/L、INR<1.6h或48h内凝血酶原活动度>40%)后,停止人工肝支持治疗。
1.4实验室指标检测方法:分别留取ALSS治疗前、后的空腹血标本,2000r/min低温离心10min,取上清液置于-80℃冰箱保存。采用全自动血细胞分析仪检测白细胞(WBC)、血小板(PLT)等检测指标;采用全自动生化分析仪检测:血清白蛋白(ALB)、总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、血肌酐(Scr)、尿素氮(BUN);采用全自动止血/血栓分析仪检测凝血酶原时间(PT)、凝血酶原活动度(PTA)、国际标准化比值(INR)。终末期肝病模型评分(MELD评分)=9.6×ln[肌酐(mg/dL)]+3.8×ln[TBIL(mg/dL)]+11.2×ln(INR)+6.4×病因(病因:胆汁性或酒精性0,其他1)。肝功能分级评分(CTP)=肝性脑病(1-3)+腹水(1-3)+TBIL(1-3)+PT(1-3)+白蛋白(1-3),A级5~6分,B级7~9分,C级≥10分,见表1。

表1 MELD评分标准
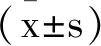
2 结 果
2.1死亡组和生存组的血清AFP、FT3、IL-6比较:经统计学对比分析,死亡组患者的血清AFP、IL-6显著高于生存组,血清FT3显著低于生存组,差异均有统计学意义(P<0.05);见表2。

表2 死亡组和生存组的血清AFP FT3 IL-6比较
2.2死亡组和生存组基础资料比较:死亡组患者和生存组患者的年龄、BMI、性别、合并疾病、乙肝病史等进行比较,两组差异无统计学意义(P>0.05);见表3。

表3 死亡组和生存组的基础资料比较
2.3死亡组和生存组的实验室资料、并发症情况分析:死亡组和生存组的实验室资料、并发症情况分析详见表3,死亡组患者的TBIL、PT、INR、肝性脑病合并比例、CTP评分、MELD评分均高于生存组,死亡组患者的PLT、PTA测定值均低于生存组,差异有统计学意义(P<0.05);见表4。

表4 死亡组和生存组的实验室资料并发症情况分析
2.4影响急性肝衰竭人工肝治疗患者预后结局多因素分析:以患者预后结局作为因变量(生存=0、死亡=1),本研以单因素分析具有统计学差异的TBIL、PT、INR、是否合并肝性脑病(0=否、1=是)、CTP评分、MELD评分、PLT、PTA、AFP、FT3、IL-6测定值为自变量建立Logistic回归模型,结果显示:AFP、TBIL、PT、CTP评分、MELD评分、INR增高、合并肝性脑病将会增大急性肝衰竭人工肝治疗患者治疗后90d死亡的风险(P<0.05);患者的PTA保持较好水平是急性肝衰竭人工肝治疗患者预后良好的保护性因素(P<0.05);见表5。

表5 Logistic回归模型分析结果
2.5血清AFP、FT3、IL-6预测急性肝衰竭人工肝治疗患者预后结局ROC曲线分析:以临床确诊患者是否发生肝衰竭作为金标准,以患者的血清AFP、IL-6、FT3测定值分别绘制ROC曲线,结果显示其预测急性肝衰竭人工肝治疗患者90d死亡的截断值分别为:113.2μg/L、28.61 pg/mL、3.20 pmoL/L,ROC曲线下面积AUC值分别为0.811、0.733、0.864,灵敏度分别为:68.49%、65.39%、73.86%,特异度分别为:82.56%、63.50%、81.07%;见图1。

图1 为血清AFP、IL-6、FT3预测急性肝衰竭人工肝治疗患者预后结局ROC曲线
3 讨 论
急性肝衰竭导致大量内源性毒素及炎症介质持续释放和堆积,又反过来通过各种途径加重肝损害,形成恶性循环,其发病凶险,预后较差。目前,ALSS已被证实是一种具有良好临床治疗效果的体外装置,在过去的几十年中,各种ALSS已被广泛应用[6]。ALSS利用其独特的生物膜和对化学物质的吸附作用,可通过物理手段去除患者体内的有害物质,并且补充多种凝血因子、白蛋白和调理素等体内所需物质,从而使肝细胞再生以促进肝脏功能恢复,并且增加了肝移植的机会[7]。因此准确评估ALSS治疗ALF患者的预后,能有效合理利用稀缺肝源,制定个性化治疗方案,以提高ALF生存率。
IL-6作为一种炎症因子,主要来源于活化的单核细胞,在诱导干扰素产生、促进肾上腺皮质激素分泌和提高多种免疫细胞活性等机制中发挥重要作用[4]。研究显示,IL-6升高会导致大量的炎性细胞聚集在肝细胞周围,加速了肝细胞的死亡,与肝细胞坏死程度密切相关[5]。FT3由甲状腺产生,不仅可以有效反映人体的甲状腺功能状态[8],还可以反映肝功能损伤的情况。在肝肾组织中表达的脱碘酶,参与甲状腺激素合成、释放。肝功能损伤导致脱碘酶活性降低,使FT3分泌减少。此外,FT3的合成与甲状腺结合球蛋白分泌密切相关,而甲状腺结合球蛋白由肝脏合成。因而肝衰竭导致肝功能异常,促使甲状腺结合球蛋白分解加速,FT3水平下降。AFP在健康成人的体内较为少见,仅在胚胎时期及病理状态下产生。近年来研究表明[9],AFP对许多细胞类型有调节作用,在ALF中AFP升高反映了炎症和坏死。
本研究对死亡组和生存组患者的实验室资料、并发症情况进行了对比分析,发现死亡组患者的TBIL、PT、INR、肝性脑病合并率、CTP评分、MELD评分均显著高于生存组,而PLT、PTA测定值均显著低于生存组(P<0.05),表明ALSS能够明显改善ALF患者的黄疸、凝血异常和肝性脑病等临床症状,提示ALSS治疗ALF有效,能够有效滤出体内有害物质,恢复肝脏功能和促进肝细胞再生,为患者行肝移植争取时间。
本研究还结合Logistic回归分析,对影响急性肝衰竭人工肝治疗患者预后结局的多因素进行探索。结果显示,AFP、TBIL、PT、CTP评分、MELD评分、INR增高、合并肝性脑病将会增大急性肝衰竭人工肝治疗患者治疗后90d死亡的风险(P<0.05),患者的PTA保持较好水平是急性肝衰竭人工肝治疗患者预后良好的保护性因素(P<0.05)。表明AFP、TBIL、PT、CTP评分、MELD评分、INR增高、合并肝性脑病、PTA为ALF短期预后的独立危险因素。提示入院伴有AFP、TBIL、PT、CTP评分、MELD评分、INR高,PTA时间延长,以及合并肝性脑病的ALF患者ALSS治疗预后较差。众所周知,AFP、TBIL、PT、CTP评分、MELD评分、INR和PTA,均是提示肝功能异常的重要指标。肝功能指标的异常升高,肝细胞可能仍然在坏死,进一步损伤肝功能,即使在接受ALSS治疗后,严重的肝脏损伤也难以挽回,导致ALF预后不良。
在我们的研究中,急性肝衰竭人工肝治疗后预后不良患者早期的AFP、IL-6水平明显增高、FT3降低。为进一步明确AFP、IL-6、FT3在ALSS治疗ALF患者中的临床价值。我们以患者的血清AFP、IL-6、FT3测定值分别绘制ROC曲线,AFP、IL-6、FT3的AUC值均>0.5,表明AFP、IL-6、FT3均可以预测ALF的预后和ALSS的疗效,其中FT3的AUC值最高(0.864),且灵敏度和特异度也相对较高,预测价值较好。IL-6升高可能提示肝细胞坏死严重,肝脏的自我修复和再生能力差。ALF患者经ALSS治疗后,肝衰竭的情况未得到有效的改善,肝细胞坏死现象持续存在,致使肝脏合成、解毒以及生物转化等功能障碍未恢复。一方面使内毒素堆积进一步加重,加强刺激单核巨噬细胞,导致IL-6水平升高。另一方面,持续诱导脱碘酶活性降低、甲状腺结合球蛋白分解加速,导致FT3水平降低。肝细胞大量坏死可引发免疫细胞攻击肝脏,抑制FT3的分泌,形成恶性循环。同时,AFP升高充分反映了ALF的炎症和坏死可能加重。因此,AFP、IL-6、FT3可作为判断ALF预后及人工肝支持疗效的重要指标,具有临床指导意义。
综上所述,急性肝衰竭人工肝治疗预后不良患者早期的AFP、IL-6、FT3水平对患者治疗结局有一定的预测价值,血清AFP增高、FT3降低会增大患者不良预后结局的风险。

