中国国家药包材标准体系的沿革与启示
王丹丹,金宏,蔡荣,蔡弘,陈蕾
(1.浙江省食品药品检验研究院,浙江省药品接触材料质量控制研究重点实验室,杭州 310052;2.浙江省药品审评中心,杭州 310000;3.上海市食品药品包装材料测试所,上海 201203;4.中国医药包装协会,北京 100803;5.国家药典委员会,北京 100061)
直接接触药品的包装材料和容器通常简称药包材。作为药品重要组成部分之一,药包材的质量、安全性、使用性能以及与药品之间的相容性对药品质量具有十分重要的影响[1-4]。此外,有些制剂本身依赖药包材存在,例如气雾剂、预灌充制剂等所用药包材,其功能性和保护性贯穿药品整个生命周期,包装密闭系统参与和完成药物的传递,离开了药包材药品就无法质量均一、有效递送到患者体内[5]。
国家药包材标准是推进药包材产业高质量发展的重要保障。原国家食品药品监督管理局颁布的《直接接触药品的包装材料和容器管理办法》(局令第13号)[6]规定:“国家药包材标准,指国家确保为保证药包材质量,确保药包材的质量可控而制定的质量指标、检验方法等技术要求”。早在医药产业《国家药品安全“十二五”规划》中,已将提高药品质量标准作为一项重要任务,并首次将新型药包材开发的关键技术列入其中[7]。国家药包材标准与医药产业、监管需求一脉相承,三者有着相互促进的旋转门效应。随着国内外医药工业水平的提高,我国医药产业迅猛发展,在医药产业发展的不同时期、不同的药包材监管模式下,我国国家药包材标准经历了从无到有、从零散到系统、从本土特色到与国际接轨的历程。
根据我国药包材监管的脉络,我国国家药包材标准的建设历程大致可分为三个阶段。笔者在本文通过分析我国国家药包材标准沿革,进一步深入理解药包材标准对保障药品安全有效可及的重要意义,以期对正在推进的国家药包材标准体系构建提供帮助。
1 医药行业起步阶段,管理逐步走向法制化规范化的早期药包材标准
新中国成立后,药包材生产随着医药行业的逐渐复苏而开始起步。早期药包材品种较少,基本上都是在小工厂、小作坊用极其简单和原始的方法生产[8]。当时药包材管理理念模糊,没有药包材标准体系,不同药包材品种分别归不同行业部门管理,例如“抗生素橡胶瓶塞(标准号HG3327-1979)”属于化工行业标准,“玻璃药瓶(GB2638-1981)”归原国家医药管理总局和原轻工业部管辖,还有部分药包材标准既可用于药品又可用于其他产品包装,相关行政部门未制定质量标准,由生产方自行制定、使用方选择使用。
早期药包材标准体系的形成和政府监管密不可分。我国药包材监管始于原国家医药管理局1980年制定、次年7月全国正式实施的《药品包装管理办法》(试行)[9],对药包材生产企业实施生产许可管理。此后,药包材管理开始走向法制化。1984年9月,全国人大委员会审议通过第一部《中华人民共和国药品管理法》,改变了过去药品无法可依的状况,将药品生产、经营活动和国家对药品的监督管理纳入了法制化轨道,其中第七条要求药品生产企业生产符合药用要求的药包材,第三十六条规定药包材必须适合药品质量的要求,符合药品的要求。1992年4月,原国家医药管理局发布局第10号令《药品包装用材料、容器生产管理办法(试行)》,明确对直接接触药品的包装材料和容器实施生产许可管理,颁发药品包装用材料、容器生产许可,药品包装用材料、容器必须按法定标准组织生产[10-11]。药包材采用许可证管理后,部分规模较大的药包材生产及原料源头企业,例如华强科技股份有限公司(生产卤化丁基橡胶塞)、杭州塑料工业有限公司(生产PVC及复合硬片)、中国石化集团北京燕山石油化工有限公司(生产聚丙烯B205粒料)等,陆续引进国外先进生产工艺、先进原材料,逐步替代落后产品,推广先进药包材的使用,这些药包材经国内外药厂验证成功并广泛应用。
20世纪八十和九十年代,药包材行业管理不像药品标准一样采取单独管理,而是有多种形式[11],主要采用国标(GB)、医药标准(YY),格式按照《标准化工作导则—第1部分:标准化文件的结构和起草规则》(GB1.1)制定。除了GB和YY标准,1987年,原国家医药管理局批准发布并实施的中华人民共和国专业标准,收载了药品铝塑泡罩包装标准(ZBC 08003-87);1996年,中华人民共和国卫生部《药品标准》收载了滴眼剂用塑料容器检查法、输血输液用收录容器检查法2个药包材标准。常见的GB、YY药包材标准[12]见表1,其中大部分标准后来经过提高转化成为目前广为熟知的《国家药包材标准》[7](简称YBB标准)。

表1 常见的GB、YY等药包材标准汇总
综上所述,从新中国成立到20世纪90年代,我国药包材品种较少,所执行的药包材标准主要为GB和YY标准,数量虽较少,但也覆盖了塑料、玻璃、橡胶、金属四大包材材质,基本适应当时医药行业的发展需要。在当时的医药工业技术和行业发展水平下,药包材标准中设置的项目,注重药包材配合性等适用性能和阻隔性能的控制,重点保障药包材对药品的保护功能。
2 医药行业迅速发展阶段,行政注册审批制度下的YBB标准
1998年,国家药品监督管理局组建成立,包材进入药品生产监管体系,采取生产、使用全链条管理。2000年10月1日,国家药品监督管理局颁布实施《药品包装用材料、容器管理办法》(暂行)(21号令)[13],其中第六条到第九条规定,药包材国家标准或行业标准由国家药品监督管理局组织制订和修订,未制定国家标准、行业标准的药包材,由申请产品注册企业制订企业标准,药包材标准由药品监督管理部门监督实施,药包材需经药品管理部门注册并获得《药包材注册证书》后生产、销售、经营和使用。2001年2月28日颁布的《中华人民共和国药品管理法》(主席令第45号)[14]进一步明确了药包材的监管。其中第五十二条规定:直接接触药品的包装材料和容器,必须符合药用要求,符合保障人体健康、安全的标准,并由药品监督管理部门审批,药品生产企业不得使用未经批准的直接接触药品的包装材料和容器。在药包材注册行政审批的大背景下,鉴于药包材标准覆盖品种和范围不全,监管部门有必要制定系统完整的国家药包材质量标准,以规范药包材生产、销售和使用,助力政府部门依标检验、依法查处,提升药包材整体质量水平。
国家药品监督管理局统领药包材标准的制修订工作,明确标准制修订工作目标和任务,要求各药品包装材料容器标准项目承担单位,按科学严谨的态度做好药包材标准的制修订工作,促进药包材发展,提高药包材质量,使药包材达到国际先进水平。国家药品监督管理局按年度、品种逐步推进、落实药包材标准制修订工作,例如2000年国家药品监督管理局注册司发布通知(药管注[2000]217号)[15],要求各药包材标准项目承担单位,借鉴国际标准组织(International Organizationg for Standardization,ISO)相关药包材标准,制修订药包材标准共计30项,其中新制定药包材标准21项,修订药包材标准9项。2000年度药包材制修订工作为2002年颁布的YBB标准奠定了稳固基础,部分GB和YY标准替代为YBB标准品种(表1)。 此外,2000年制定的《药用包装材料容器装药实验方法》正是《药品包装材料与药物相容性实验指导原则(试行)》(YBB00142002-2015)的雏形,其体现的药品和药包材相容性理念在当时非常超前,并影响至今。
国家食品药品监督管理局《直接接触药品的包装材料和容器管理办法(局令第13号)》(2004年7月20日)的颁布[6],进一步明确了药包材标准管理体系。局13号令要求,我国对药包材实施产品注册管理和监督管理相结合的制度。申请注册的药包材产品,必须提供所申报产品的注册质量标准,以满足产品注册要求,并由国家食品药品监督管理局组织注册审评会进行审评,经国家食品药品监督管理局批准注册后颁发药包材注册证。局13号令第二、五至八条规定,药包材必须符合药包材国家标准,药包材国家标准由国家食品药品监督管理局组织国家药典委员会制修订,并由原国家食品药品监督管理局颁布实施。
为满足医药行业迅猛发展的需求,适应药包材行政注册审批制度的实施,满足政府监管的需要,2002—2006年,原国家食品药品监督管理局陆续颁布国家YBB标准6册。YBB标准涵盖药包材品种较为齐全[16],包含药包材标准139个,涉及产品标准88个、方法标准47个、通则3个以及指导原则1个。涉及的材料种类有塑料(聚乙烯PE、聚丙烯PP、聚酯PET、聚氯乙烯PVC等),橡胶(卤化丁基胶塞、聚异戊二烯和硅橡胶),玻璃(低硼硅、中性硼硅、高硼硅和钠钙玻璃),金属(铝等)等。方法标准涵盖鉴别实验、阻隔性能、物理机械性能、生物实验等,其中还包括用于药包材洁净厂房进行洁净室检测所用的检测方法标准1个。3个通则分别是复合膜/袋、共挤输液用膜/袋、铝塑封口垫片的通则。在格式上,YBB标准采用药品标准的编制格式。在标准项目的设置上,按照安全性、有效性、功能性等要求,对药包材关键质量属性进行设置,主要有鉴别、使用性能、物理性能、化学性能、挥发性物质测定、微生物限度、异常毒性、生物安全性能等。
受原国家食品药品监督管理局药品注册司委托,从2009年开始,由中国食品药品检定研究院作为牵头单位,组织全国药包材检验检测机构对6册YBB标准进行整理、勘误和汇编。修订后的YBB标准[7]包含现行有效的标准文本130个,汇编为一册,分为7个部分,由国家药典委员会审定发布。
在药包材行政注册审评审批制度下,YBB标准作为国家强制性标准,为药包材行业技术人员的工作参考提供了便利,在行业内得到了广泛应用。药包材行业在国家政策和国家标准的引导促进下快速发展,药包材生产管理更加规范,药包材生产质量意识逐步加强,药包材总体质量水平显著提高。在医药工业和行业发展的带动下,药包材生产企业和药包材品种快速增加,涌现了一批新型药包材产品,满足了部分高端药品和特殊药品包装的需要,加快了药包材行业与国际接轨的步伐。
《中华人民共和国药典》处于国家药品标准核心地位,YBB标准虽然由国家药典委员会审定,但一直未载入《中华人民共和国药典》[17]。随着对药包材和药品相互影响作用理解的深入,药品研发和监管部门越来越意识到国家药包材标准的重要性。《中华人民共和国药典》2015年版首次新增“药包材通用技术要求指导原则”和“药用玻璃材料和容器指导原则”,《中华人民共和国药典》2020年版又新增药包材测定法16个,为国家药包材标准进入《中华人民共和国药典》做了铺垫,为后续新的国家药包材标准体系的构建奠定了基础。
3 医药行业高质量发展阶段,关联审评审批制度下的全新国家药包材标准体系
随着我国医药行业的蓬勃发展,新的包装材料、包装形式和给药方式不断推出,药包材已从满足保护药品的基本需要,迈入了高质量发展的新阶段。为响应国家简政放权、放管结合、优化服务的要求[18],国家颁布并实施了《国务院关于改革药品医疗器械审评审批制度的意见》(国发[2015]44号)[19]文件,明确要求简化药品审批程序,明确责任主体,加快药品上市审批。我国借鉴美国、加拿大、欧盟、日本等国家对药包材实行药品主控文档(drug master file,DMF)管理的经验,将药包材单独审评审批改为药品与药包材关联审批审批,即药包材实行平台登记备案管理。在国家方针政策的指引下,国家药品监督管理局发布一系列政策法规,将药品关联审批审批管理制度逐步推上正轨。关联审批审批制度不仅简化了审批审批环节,给制剂企业更多的选择权,不再唯“证”选材,切实有效支持药品和包装企业研发和创新。
在药品关联审批制度下,YBB标准逐渐显现出弊端,主要表现在:①YBB标准重点规定药包材产品应达到的要求,无法充分体现药包材应以制剂为核心的理念;②YBB标准基本是“一品一标准”的模式,无法覆盖制剂所需药包材的品规;③YBB标准没有充分体现药品全链条风险管理的理念。鉴于YBB标准与新形势下医药行业发展和监管需求不相适应,借鉴国内外药包材及相关领域标准体系发展趋势,基于保障药品安全有效的风险管理理念和全过程管理理念,重新构建国家药包材标准体系成为当务之急。
依据职责划分,国家药典委员会组织相关单位和专家对国家药包材标准体系进行了重新构架,新构建的国家药包材标准体系在形式和理念上均有较大调整[17,20-21]。形式上,新的国家药包材标准不以“一品一标准”模式收载,而是以通用技术要求的形式收载。药包材通用技术要求主要分为“主体框架”和“支撑体系”两大块[19],见图1。在理念上,一是新的国家药包材标准体系构建中全面关注药包材的安全性、保护性、功能性和相容性,即药包材的“四性”,多维度、全方位拟定标准内容,保证药包材符合药用要求。二是新的国家药包材标准体系构建中引入质量源于设计(QbD)理念,药包材的质量是设计和生产出来的,不是检验出来的,不过分强调标准和检验的作用。三是新构建的国家药包材标准体系,践行“放管服”理念,落实“政府主导、企业主体、社会参与”工作机制,边制定边宣传,充分发挥产、学、检、研、审评、监管各层面技术优势,带动全行业关注药包材标准的不断完善,助力药品安全有效。
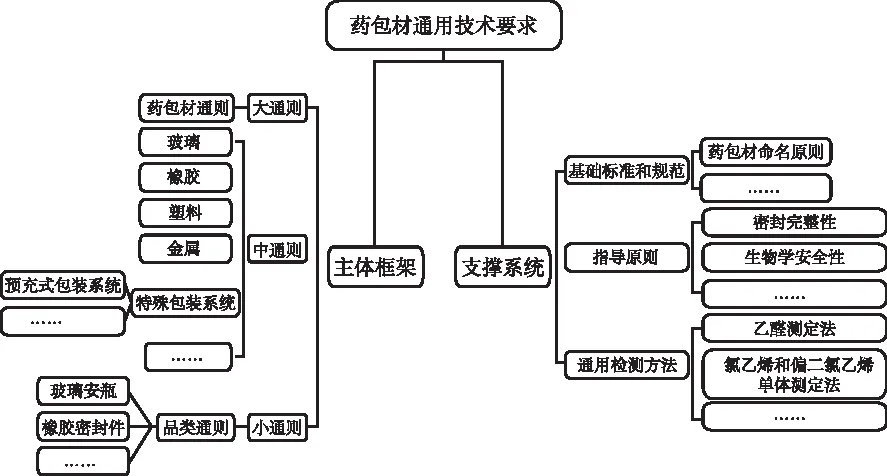
图1 新的药包材标准体系通用技术要求
根据《中华人民共和国药典》(2025年版)编制大纲要求,新的药包材标准体系相关标准拟收载于《中华人民共和国药典》2025年版。目前已有部分标准草案在国家药典委员会官方网站上公示,广泛征求业内相关单位意见[22-30],包括药品包装用橡胶密封件3个通则和8个配套通用检查方法、药品包装用玻璃容器6通则和12个配套通用检测方法、药品包装用塑料容器及组件5个通则及9个配套通用检查方法、预灌封注射器4个通则和13个配套通用检测方法、药品包装系统密封性研究指导原则、药包材检验规则指导原则、药包材生物学评价与实验选择指导原则的标准草案。接下来,陆续还有其他标准,例如金属通则及相关配套检测方法,以及其他通用技术要求,制修订完成后公示草案征求意见。标准制修订各承担单位根据行业内提出的修订意见,将进一步全面深入开展验证工作,完善标准草案,确保最终的药包材通用技术要求科学、先进、实用、规范,达到或基本达到国际先进水平,助力我国药包材质量控制和药品安全保障水平明显提升。
正在推进的新的国家药包材标准体系,作为药包材行业高质量发展的重要保障[31],适应了行业发展和监管的需要,兼顾了我国药包材生产的实际状况,在药包材监管理念、质量控制要求、检测技术应用、工艺过程控制、产品研发指导等方面不断加强,进一步强化了标准对药包材质量控制的导向作用。
4 总结
我国国家药包材标准体系的沿革是药包材行业发展和监管演变的缩影。笔者通过分析我国医药产业发展不同时期、不同药包材监管模式下国家药包材标准的沿革,认为随着医药行业的不断进步,国家药包材标准经历了切合医药产业发展和药包材监管模式的需求,形式逐步统一、内涵不断提升、理念持续升华。从演变过程可以发现,正在构建的新的国家药包材标准体系,不管从结构体系、内容内涵,还是建设理念上都有从量到质的蜕变。
4.1国家药包材标准体系结构上从萌芽到系统的变化 国家药包材标准从早期的数量较少的GB和YY标准,主要为少量的药包材的品种和测定法标准,到初步形成完整体系的YBB标准,包括了药包材标准139个,涵盖品种、测定法和指导原则,再到正在构建的国家药包材标准,以通用技术要求形式体现,包括不同材质药包材通则等构成的主题框架和测定法等构成的支撑体系,国家药包材标准经历了管理从分散到集中,标准数量从少到多,表现形式从“一品一标”到通用技术要求,标准体系从初期萌芽到发展壮大的一步步变化历程。新构建的国家药包材标准体系注重顶层设计,注重与相关法规、技术文件的衔接和互补,从设计源头上确保药包材标准体系的严谨性和系统性。
4.2国家药包材标准体系内涵上从点到面的变化 国家药包材标准内容内涵和医药工业技术设备、医药产业发展水平紧密相连,早期我国医药行业生产设备较国外落后,生产水平精准度不高,药包材标准项目设置上注重保护性能的考察,特别是包装组件配合性、包装系统密封性需满足要求,保证药品的安全有效和可及。随着医药产业的快速发展,药包材生产设备逐步更新换代,部分国外生产设备的引入提升了药包材产品质量和技术水平,药包材满足保护药品的功能之外,与药品的相容性和安全性指标越来越引起业内的关注和重视,所以在YBB标准里,相容性指导原则首次出现在国家药包材标准里,另外化学、生物等安全性项目指标也纳入YBB质量标准中。随着新包装、新给药途径的涌现,药包材逐步出现在高端药品和特殊药品的包装,以满足人们对高质量健康生活的追求,国家药包材标准的制定,应全面关注药包材对药品安全有效稳定可及的作用。新构建的国家药包材标准体系,从药包材的安全性、保护性、功能性和相容性,即药包材的“四性”出发考虑,多维度、全方位拟定标准内容,保证药包材符合药用要求。
4.3国家药包材标准体系建设理念向科学性、开放性的转变 不同发展时期,国家药包材标准建设的理念随着对科学监管认识的提升不断发生变化。设计理念上随着对药包材和药品相互影响作用的深入了解,新的国家药包材标准体系构建中引入QbD和全过程全生命周期风险管理的理念。强调药包材的质量是设计和生产出来的,不是检验出来的,不再过分强调标准和检验的作用。围绕保障药品全生命周期安全有效,保安全守底线,促发展追高线,注重药包材风险管理和控制。从标准体系形成机制上,新构建的国家药包材标准体系,是在对原有国家药包材标准的执行情况开展行业内调研和分析,了解新形势下监管部门及行业对国家药包材标准体系的需求后,借鉴国际经验,践行创新、协调、绿色、开放、共享发展理念,政府主导、企业主体、社会参与,边制定边宣传,充分发挥产、学、检、研、审评、监管各层面技术优势,带动全行业关注药包材标准的不断完善,助力药品安全有效。
总之,我国国家药包材标准体系一直紧跟医药行业发展和监管需求,不断提升内涵,持续升华理念。药包材标准体系只有紧跟新形势变化,不断自我提升完善,才能切实提升药包材质量,保障药品的安全有效可及。新形势下,医药包装行业迈入高质量发展新阶段,国家药包材标准是推进药包材产业高质量发展的重要保障。在国家药典委员会的组织统筹安排下,切合医药产业发展和监管需要,借鉴国内外药包材及相关领域标准体系发展趋势,基于保障药品安全有效的风险管理理念和全过程管理理念,加快推进构建符合我国发展实际和国际通行要求的国家药包材标准体系,是当前一项重要任务。随着国家药包材标准体系的快速推进,团体标准、企业标准、研究指导原则等其他药包材标准,也将作为国家药包材标准体系的互补,共同推动药包材行业开启新征程。标准变革促进技术创新,技术带动标准进步,其共生效应必将激活药包材行业发展动力,推动医药产业高质量可持续蓬勃发展。

