化痰通络汤对脑缺血/再灌注损伤大鼠肠道菌群的影响
曾鑫冰 唐三 谢若曦 贺骊文 邓常清 杨筱倩 黄小平
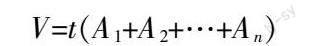
〔摘要〕 目的 從肠道菌群探讨化痰通络汤抗脑缺血/再灌注(ischemia/reperfusion, I/R)损伤的作用机制。方法 将30只SPF级雄性大鼠随机分为假手术组、模型组及化痰通络汤高剂量组(28.66 g/kg)、化痰通络汤中剂量组(14.33 g/kg)、化痰通络汤低剂量组(7.16 g/kg)、阳性对照组(依达拉奉4 g/kg+丁酸梭菌5.0×108 cfu/mL),每组5只。采用大鼠局灶性脑I/R模型,给药组在造模前2 h灌胃给药,缺血2 h后进行再灌注,于再灌注后24 h后取脑组织和新鲜结肠粪便,氯化三苯四氮唑(triphenyl tetrazolium chloride, TTC)染色法测定脑梗死体积,16S rRNA测序检测结肠内容物肠道菌群变化。结果 TTC染色显示,脑I/R后大鼠出现脑梗死灶,与模型组比较,化痰通络汤高、中、低剂量组均能显著减轻脑梗死体积,减少梗死率,且效应具有剂量依赖性(P<0.05,P<0.01)。Alpha和Beta多样性分析显示,与假手术组比较,模型组大鼠肠道菌群发生显著变化(P<0.05),与模型组比较,化痰通络汤中、高剂量组能提高大鼠肠道菌群丰富度和多样性,并能正向调节脑I/R损伤大鼠肠道菌群和优势菌种(P<0.05)。结论 化痰通络汤可能通过改善肠道菌群失调、调节肠道微生物种类和数量发挥对损伤大鼠的脑保护作用。
〔关键词〕 脑缺血;再灌注损伤;脑梗死;化痰通络汤;肠道菌群;16S rRNA
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.004
〔Abstract〕 Objective To discuss the mechanism of action of Huatan Tongluo Decoction (HTTLD) on gut microbiota in rats with cerebral ischemia-reperfusion (I/R) injury. Methods The total of 30 SPF-grade male rats were randomly divided into sham-operated group, model group, positive control group (Edaravone 4 g/kg+Clostridium butyricum 5.0×108 cfu/mL), high- (28.66 g/kg), medium- (14.33 g/kg) and low-dose (7.16 g/kg) HTTLD groups, with 5 rats in each group. The focal cerebral I/R rat model was established. The medication groups were given intragastric administration 2 h before modeling, and reperfusion was performed 2 h after ischemia. The brain tissue and fresh colon feces were taken 24 h after reperfusion. Then the cerebral infarction volume was measured by triphenyl tetrazolium chloride (TTC) staining and the changes in the gut microbiota of colonic contents were determined by 16S rRNA sequencing. Results TTC staining showed that cerebral infarction appeared in rats after cerebral I/R. Compared with model group, the cerebral infarction volume and the infarction rate in high-, medium- and low-dose HTTLD groups were significantly lower, and the effects were dose-dependent (P<0.05, P<0.01). Alpha and Beta diversity analysis showed that compared with sham operation group, the changes in the gut microbiota of rats in model group were significant (P<0.05). Compared with model group, HTTLD enriched and diversified the gut microbiota in medium- and high-dose HTTLD groups, and positively regulated the gut microbiota and dominant bacteria in rats with cerebral I/R injury (P<0.05). Conclusion The protective effects of HTTLD on rats with I/R injury may be achieved by improving the dysbiosis of gut microbiota and regulating the species and quantity of gut microorganisms.
〔Keywords〕 cerebral ischemia; reperfusion injury; cerebral infarction; Huatan Tongluo Decoction; gut microbiota; 16S rRNA
中医学认为中风多因脾胃损伤,脾失健运,内生浊痰,久郁化火,痰热互结,瘀滞脉络,上蒙清窍或痰瘀互结,痹阻脑络而发病。痰瘀互阻是缺血性脑卒中的重要病因病机,治宜痰瘀同治。因此,缺血性脑卒中急性期发展迅速,痰浊血瘀较为突出,应当采用化痰通络之法治疗。
化痰通络汤在中医经典名方半夏白术天麻汤的基础上加减而成。主要由半夏、天麻、茯苓、白术、胆南星、天竺黄、香附、丹参、酒大黄组成。半夏、天麻为君药,半夏可和胃降逆,使气顺则痰消,为治痰之要药;天麻祛风止痛。茯苓、白术二者为臣药,茯苓健脾利湿,白术健脾燥湿,相配可使脾旺健运、湿去痰消。胆南星有清热化痰、熄风定惊之功效;天竺黄清热豁痰、凉心定惊;香附乃气病之主药,治血者必先行气,治痰必理气,气顺瘀自化,血行痰自消;丹参活血化瘀;大黄有攻积滞、清湿热、泻火、凉血、祛瘀、解毒等功效,以上均为佐药。全方共奏熄风化痰、活血通络之功效,切中中风病“痰、瘀”的病机。半夏白术天麻汤出自《医学心悟·眩晕》,主治湿痰壅遏的头眩眼花等症。半夏白术天麻汤之化痰通络汤载于2017年版中华中医药学会颁布的《中风病(脑梗死)中医诊疗方案》[1]及《中医内科学》[2]规划教材中,具有化痰通络熄风之功,对治疗脑梗死风痰阻络证具有良好的疗效。方中药物配伍得当,可用于缺血性中风急性期和恢复期的治疗。
脑和肠在生理、病理上密切联系,“脑病肠治”理论指导中风治疗是中医整体观念和“上病下治”治则的重要体现。课题组前期研究表明,化痰通络汤能减少脑缺血/再灌注(ischemia/reperfusion, I/R)大鼠脑组织和胃肠道黏膜损伤,减轻神经功能缺损症状,提高胃肠道动力、改善肠道屏障功能、减少肠道细菌代谢产物和毒物的释放,从而发挥对脑缺血再灌注后“肠-脑”轴损伤的保护作用[3]。刘东坡[4]研究显示,化痰通络汤治疗脑梗死伴颈动脉粥样硬化临床疗效显著,能够明显降低动脉粥样硬化斑块总积分与斑块面积,并显著降低斑块不稳定标志物基质金属蛋白酶9,升高基质金属蛋白酶抑制剂-1,改善患者临床症状,从而发挥脑保护的作用。姚欣艳等[5]总结了20余年的临床经验,采用化痰通络汤治疗缺血性脑卒中效果显著,研究显示化痰通络汤对大脑中动脉阻塞(middle cerebral artery obstruction, MCAO)大鼠的脑保护作用可能是通过抗炎症反应来实现的。大量研究表明,组成化痰通络汤中的药物法半夏、大黄、白术、丹参等具有改善胃肠道功能、抑制肠道菌群移位、减少炎性因子释放等作用[6-9]。王海侨等[10]观察到化痰通络汤能够有效改善痰瘀痹阻型急性脑梗死患者脑血管血流动力学指标,从而改善患者脑部循环,减少神经组织的损伤。
推测化痰通络汤对脑I/R大鼠“肠-脑”轴的干预作用,可能是通过调节脑缺血后肠道菌群来实现的。因此,本研究以脑I/R损伤大鼠模型,研究化痰通络汤对脑I/R后大鼠肠道菌群的影响,从而揭示化痰通络汤“脑病肠治”的科学内涵,并为其临床应用提供科学依据。
1 材料
1.1 动物
雄性健康SD大鼠,SPF级,体质量220~250 g,购自湖南斯莱克景达实验动物有限公司,动物合格证号:SCXK(湘)2019-0004,饲养于湖南中医药大学SPF级动物实验中心,室温22~26 ℃,湿度50%~65%,实验前适应性喂养3~5 d,给药前禁食12 h,自由饮水。实验单位使用许可证号:SYXK(湘)2019-0009。符合湖南中医药大学动物伦理委员会实验伦理学要求,伦理审批号:LL2019100902。
1.2 药物
化痰通络汤组方药材法半夏20 g、天竺黄10 g(亳州市沪谯药业有限公司,批号分别为1905160252、1904030462);茯苓20 g、天麻20 g、白术15 g、丹参30 g(湖南中医药大学第一附属医院,批号分别是PR19070801、YP19070502、CK19061604、HY19052201);胆南星10 g(四川百胜药业有限公司,批号:180906),香附10 g、大黄15 g(湖南三湘中药饮片有限公司,批号分别为2019050401、2018102901),均购自湖南中医药大学第一附属医院门诊药房,由湖南中医药大学左亚杰教授鉴定为正品,符合《中华人民共和国药典》规范[11]。依达拉奉注射液(福建天泉药业股份有限公司,批号:1910142)。
1.3 试剂
强化梭酸培养基、氧气指示剂均购自青岛高科技工业园海博生物技术有限公司(批号分别为20200619、20200703);氯化三苯四氮唑(triphenyl tetrazolium chloride, TTC)购自美国Sigma公司(批号:T8877-10G);丁酸梭菌(北京北纳创联生物技術研究院,批号:BNCC337239)。
1.4 仪器
日本三菱MGC厌氧培养罐(北京缘生化科技有限公司,型号:C-32);麦氏比浊管(美国Pro-Lab诊断公司,型号:2350);生物安全柜(苏州安泰空气技术有限公司,型号:BSC-1300 II A2);比浊仪(英国Grant仪器有限公司,型号:DEN-1);二氧化碳培养箱(赛默飞世尔科技有限公司,型号:3111);超净工作台(苏州安泰空气技术有限公司,型号:SW-CJ-1FD);Illumina Miseq 测序仪(美国Illumina公司,型号:PE300)。
2 方法
2.1 化痰通络汤的制备
同前期实验,设定化高剂量痰通络汤、中剂量化痰通络汤、低剂量化痰通络汤(28.66、14.33、7.16 g/kg),并制备成水提物[3]。将上述中药饮片以8倍量水浸泡30 min,加热至沸腾并保持微沸30 min,然后过滤取药液;残渣再加6倍量水,加热至沸腾并保持微沸30 min,过滤取药液。合并2次药液,采用旋转蒸发器浓缩至所需生药质量浓度为2.28 g/mL,作为高剂量灌胃浓度;中剂量在高剂量浓度基础上稀释为1.14 g/mL,低剂量在中剂量基础上再稀释为0.57 g/mL。置于4 ℃冰箱内保存备用。
2.2 液体培养基和种子液制备[12]
首先,称取强化梭酸培养基38.0 g,加入蒸馏水800 mL,加热混匀,再加水定容至1 L并平均分装至3个锥形瓶,灭菌30 min(121 ℃,0.1 MPa),冷却后备用。然后,取适量丁酸梭菌接种于上述培养基中,于CO2培养箱中厌氧培养24~48 h,采用麦氏比浊法测定菌液浊度计算浓度,待菌液浓度达到5.0×108 cfu/mL,以用于实验。
2.3 大鼠MCAO再灌注模型制作
依据前期方法[13]制作MCAO局灶性脑缺血模型。大鼠于颈前正中位置备皮、消毒,切开3 cm左右,钝性分离右側颈总动脉(common carotid arteries,CCA)、颈内动脉(internal carotid artery, ICA)、颈外动脉(external carotid artery, ECA),用手术线分别结扎ECA的远心端并于结扎点近侧凝断ECA及其分支,对ICA远心端进行结扎,动脉夹夹闭ICA远心端与CCA,用尼龙线线栓从ECA经CCA与ICA分叉部插入ICA,松开ICA上的动脉夹,将线栓插入ICA颅内段,插入长度为(18±2) mm,到达大脑中动脉环,扎住ICA内的线栓防止出血和线栓移动。阻断2 h后,拔出线栓进行再灌注24 h。再灌注2 h后,采用改良的神经功能缺损评分方法进行评分,1~3分表示造膜成功[14]。假手术组仅将CCA、ECA、ICA游离出来,不阻断血流,其他操作同模型组。
2.4 动物分组与给药
将30只大鼠随机分成假手术组、模型组、化痰通络汤高剂量组、化痰通络汤中剂量组﹑化痰通络汤低剂量组(28.66、14.33、7.16 g/kg)、阳性对照组[12](依达拉奉4 g/kg+丁酸梭菌5.0×108 cfu/mL),每组5只。各给药组于造模前2 h开始灌胃给药,每次给药间隔12 h。假手术组与模型组予等量生理盐水灌胃,同时腹腔注射等量生理盐水。化痰通络汤各剂量组灌胃不同剂量化痰通络汤药液,同时腹腔注射生理盐水。阳性药物组予丁酸梭菌液(5.0×108 cfu/mL)灌胃,0.7 mL/次,每日2次[12];同时腹腔注射依达拉奉(4 mg/kg)[15],每日1次。各组大鼠术后继续同前给药。
2.5 TTC法测定脑梗死率
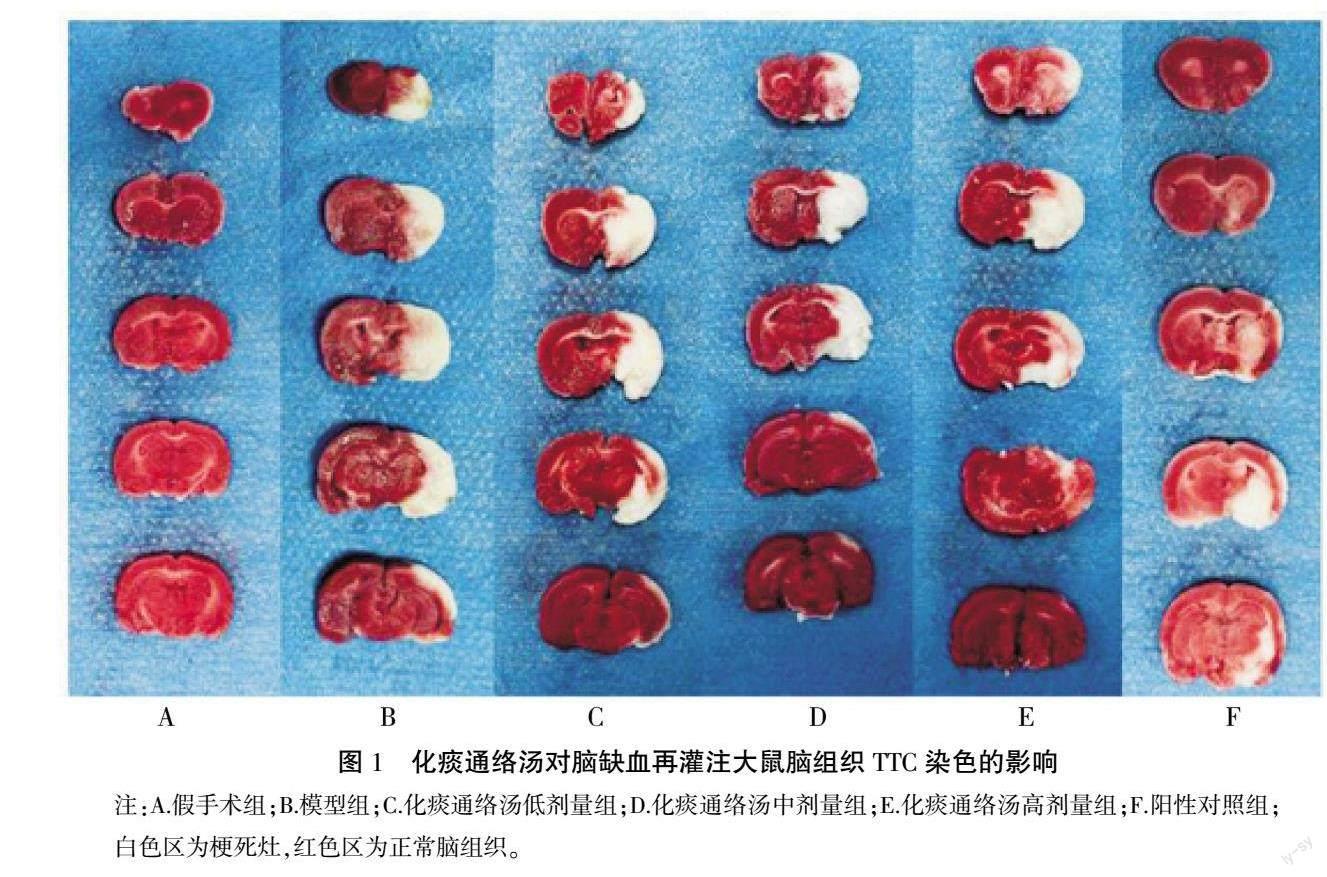
于缺血 2 h 再灌注 24 h 后,戊巴比妥钠麻醉大鼠,断头取脑,去除脑干和小脑,将鼠脑于-20 ℃冰箱中速冻约15 min后,置入脑切片槽,作2 mm厚的连续冠状切片。将切片立即置于2% TTC中,避光37 ℃染色30 min,然后用4%多聚甲醛固定24 h,拍照。正常脑组织染色为红色,梗死灶为白色。用Image-pro plus 5.1图像分析软件测量各脑片脑梗死面积[3]。
V=t(A1+A2+…+An)
脑梗死率=梗死区体积/正常侧大脑半球体积×100%
其中,t为切片厚度,A为梗死面积,n为脑片数。
2.6 肠内容物DNA抽提和PCR扩增
缺血2 h再灌注24 h后,麻醉大鼠取结肠内容物置于冻存管,液氮速冻,-80 ℃冰箱保存备用。根据DNA抽提说明书进行大鼠结肠内容物微生物群落总DNA抽提,使用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16SrRNA基因V3~V4可变区进行PCR扩增,每个样本重复3次[16]。
2.7 Illumina Miseq测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用DNA凝胶回收纯化试剂盒进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用荧光定量仪对回收产物进行检测定量。建库后,进行测序(上海美吉生物医药科技有限公司)。
2.8 统计学分析
使用fastp软件(https://github.com/OpenGene/fastp,v 0.20.0)对原始测序序列进行质量控制,使用FLASH软件(http://www.cbcb.umd.edu/software/flash,version 1.2.7)进行拼接,对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v 138),设置比对阈值为70%。
本实验数据均用“x±s”表示,多组样本间采用Kruskal-Wallis H检验。以P<0.05表示差异具有统计学意义。
3 结果
3.1 化痰通络汤对缺血再灌注后脑梗死体积的影响
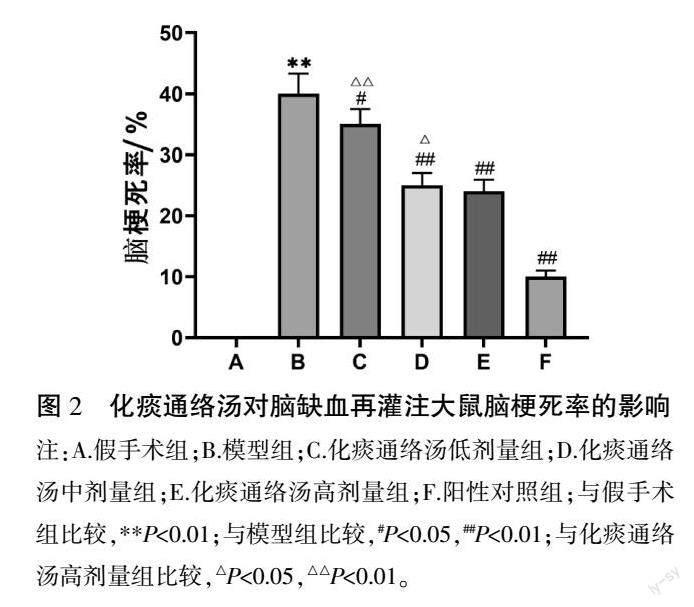
假手术组无梗死灶形成,脑梗死率为0。与假手术组比较,模型组出现明显梗死灶,脑梗死率显著升高(P<0.01)。与模型组比较,各药物组梗死体积均明显减少,脑梗死率显著下降(P<0.05,P<0.01)。化痰通络汤高剂量组降低脑梗死率的作用显著优于化痰通络汤中剂量组、化痰通络汤低剂量组(P<0.05,P<0.01)。详见图1—2。
3.2 各组大鼠肠道菌群物种注释与评估
6组共收集30个结肠内容物样品(每组5个样品)全部建库合格,共获得951 766 816个原始碱基数目,经过滤严格处理得到1 581 008条高质量优化序列数目,序列平均长度为424 bp,序列长度分布在401~440 bp内,以97%相似度聚类,共获得864个OUT,归属于13个门、196个属。
物种分布均勻Pan/Core物种分析用于描述随着样本量增加物种总量和核心物种量变化的情况。Pan物种,即泛物种,是所有样本包含的物种总和,用于观测随着样本数目增加,总物种数目的增加情况。Pan物种分析结果可解释样本包含的物种总和,说明本次测序样本量足够。详见图3a。Core物种,即核心物种,是所有样本共有物种数目,用于观测随着样本数目增加,共有物种数目的减少情况。Core物种分析结果发现各组总数目增加,共有物种减少的趋势趋于平坦,表明各组样本量满足评估物种丰度和核心物种数的要求。详见图3b。Shannon曲线主要用来评价菌群多样性,Shannon值越大说明样品的物种多样性越高,本研究各组曲线趋于平坦,表明各组样本微生物多样性满足测序要求。详见图3c。Anosim用来检验组间的差异是否显著大于组内差异,如图所示,证实6组之间的组间差异是显著大于组内差异的(P<0.01),表明分组有意义。详见图3d。
3.3 Alpha多样性分析
Alpha多样性分析反映微生物群落的丰富度和多样性。常用的Alpha多样性指数包括Sobs指数、Shannon指数、Simpson指数、Ace指数、Chao指数等。如表1所示,与假手术组比较,模型组Sobs指数、Ace指数、Chao指数、Shannon指数降低(P<0.05),Simpson指数增高(P<0.05)。说明脑I/R后,大鼠肠道菌群的多样性和丰富度均显著下降。与模型组比较,化痰通络汤中、高剂量组、阳性对照组Sobs指数、Ace指数和Chao指数增高(P<0.05),说明化痰通络汤、丁酸梭菌+依达拉奉有助于提升脑I/R后大鼠肠道菌群的丰富度。同时,化痰通络汤中、高剂量组Simpson指数降低、Shannon指数增高(P<0.05),说明中、高剂量化痰通络汤也可以提升脑I/R大鼠肠道菌群的多样性。阳性对照组与模型组比较,Simpson指数降低、Shannon指数增高,但差异无统计学意义(P>0.05)。化痰通络汤低剂量组虽然上述各指标的变化趋势与化痰通络汤中、高剂量组一致,但差异无统计学意义(P>0.05)。各给药组之间比较,化痰通络汤高剂量组与化痰通络汤低剂量组、阳性对照组相比,Sobs指数、Shannon指数、Simpson指数、Chao指数显著升高(P<0.05),说明高剂量的化痰通络汤对改善脑I/R后大鼠肠道菌群的丰富度和多样性的效果最好。详见表1。
3.4 Beta多样性分析
主成分分析(principal component analysis, PCA),通过分析不同样本菌落组成可以反映样本间的差异和距离,样本物种组成越相似,反映在PCA图中的距离越近。主成分1(principal component, PC1)贡献度为80.11%,主成分2(principal component, PC2)贡献度为13.69%,二者贡献度之和为93.8%,故二者能全面地反映群落组成信息。基于PCA分析结果,将不同分组样本在PC1轴上作箱线图。不同分组样本的中位值较近,表明样本物种组成较相近。模型组与假手术组距离较远,而假手术组与化痰通络汤中、高剂量组距离非常接近,说明MACO大鼠肠道菌群组成发生改变,而化痰通络汤中、高剂量具有不同程度调节脑I/R大鼠肠道菌群组成的作用。详见图4。
3.5 物种分布
大鼠肠道菌群优势菌群主要是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)3大菌门。在门水平上结果见图5。各组大鼠肠道菌群在门水平不同的群落丰度有显著性差异,与假手术组比较,模型组拟杆菌门、放线杆菌门(Actinobacteriota)、脱硫弧菌门(Desulfobacterota)丰度显著降低(P<0.05,P<0.01);与模型组比较,化痰通络汤高剂量组拟杆菌门群落、脱硫菌门群落丰度升高(P<0.05),化痰通络汤中剂量组放线杆菌门群落、脱硫菌门群落丰度升高(P<0.05),且化痰通络汤高剂量组拟杆菌门群落丰度升高显著优于化痰通络汤低、中剂量组和阳性对照组(P<0.05)。详见表2。
在属水平上的分布,各组大鼠肠道菌群优势菌属构成如图6所示。各组大鼠肠道菌群在属水平的优势物种主要有14种,以群落相对丰度>0.023为筛选条件[7],其中在志贺菌属(Escherichia-shigella)、双歧杆菌属(Bifidobacterium)、norank_f_Muribaculaceae、杜氏杆菌属(Dubosiella)、拟普雷沃菌属(Alloprevotella)、红蝽菌属_UCG-002(Coriobacteriaceae_UCG-
002)、普雷沃菌属(Prevotella)群落丰度具有显著性差异(P<0.05,P<0.01)。详见图6。与假手术组比较,模型组双歧杆菌属、norank_f_Muribaculaceae、杜氏杆菌属、红蝽菌属_UCG-002群落相对丰度显著降低(P<0.05,P<0.01),表明脑缺血再灌注后大鼠上述肠道菌群在属水平发生明显变化;与模型组比较,化痰通络汤中剂量组双歧杆菌属(Bifidobacterium)、norank_f_Muribaculaceae、杜氏杆菌属(Dubosiella)、红蝽菌属_UCG-002(Coriobacteriaceae_UCG-002)、普雷沃菌属(Prevotella)群落相对丰度显著升高(P<0.05,P<0.01),化痰通络汤高剂量组norank_f_Muribaculaceae、拟普雷沃菌属(Alloprevotella)、红蝽菌属_UCG-002(Coriobacteriaceae_UCG-002)、普雷沃菌属(Prevotella)群落丰度具有显著升高(P<0.05),阳性对照组norank_f_Muribaculaceae、杜氏杆菌属(Dubosiella)、红蝽菌属_UCG-002(Coriobacteriaceae_UCG-002)群落丰度显著升高(P<0.05),而化痰通络汤低剂量组肠道菌群各菌落间相对丰度比较,差异无统计学差异(P>0.05)。化痰通络汤不同剂量组间比较,化痰通络汤中剂量组双歧杆菌属(Bifidobacterium)群落丰度显著高于化痰通络汤高剂量组(P<0.05),杜氏杆菌属(Dubosiella)、红蝽菌属_UCG-002显著高于低剂量组(P<0.05);化痰通络汤高剂量组norank_f_Muribaculaceae显著高于化痰通络汤低剂量组(P<0.05)。说明不同剂量的化痰通络汤能调节不同的优势菌群,增加益生菌的丰度。详见表3。
3.6 LEfSe多级物种差异判别分析
LEfSe分析根据分类学组成对样本按照不同的分组条件进行线性判别分析(linear discriminant analysis, LDA),运用LDA估计这些差异物种对组间区别的影响大小。LDA值大于设定值的物种(morestrict设为4,指只有物种在多组中都存在差異),才能被认为是组间具有统计学差异的标记物。本研究发现,假手术组肠道菌群的优势物种为梭菌纲(Clostridia)、放线杆菌门、放线菌纲(Actinobacteria)、双歧杆菌属(Bifidobacterium)、双歧杆菌科(Bifidobacteriaceae)、双歧杆菌目(Bifidobacteriales)、毛螺菌目(Lachnospirales)、毛螺菌科(Lachnospiraceae)、消化链球菌目(Peptostreptococcales-Tissierellales)、红蝽菌目(Coriobacteriales)、红蝽菌纲(Coriobacteriia)、Eggerthellaceae、Adlercreutzia;化痰通络汤中剂量组优势物种为丹毒丝科(Erysipelotrichaceae)、丹毒丝目(Erysipelotrichales)、杜氏杆菌属;化痰通络汤高剂量组优势物种为拟杆菌纲(Bacteroidia)、拟杆菌门(Bacteroidota)、拟杆菌目瘤胃球菌科(Ruminococcaceae)。化痰通络汤低剂量组和阳性对照组组间物种差异不明显(LDA值<3.5)。详见图7。
4 讨论
肠道菌群与脑卒中[17]、心脑血管疾病[18]、孤独症[19]、阿尔茨海默病[20]等疾病密切相关,对肠道菌群的研究已成为许多脑部疾病防控的新方向。“肠-脑”是中枢神经系统(central nervous system, CNS)与胃肠道功能相互作用的双向调节轴,由CNS、自主神经系统、下丘脑-垂体-肾上腺轴、肠神经系统等组成一个神经-内分泌网络[21]。近年研究发现,肠道菌群可通过“肠-脑”轴与大脑实现相互影响,肠道菌群和“肠-脑”轴不仅能分别对胃肠道发挥调节作用,他们也通过神经-免疫-内分泌网络相互作用,协同发挥调节作用,称为“菌群-肠-脑”轴[22]。肠道菌群作为“菌群-肠-脑”轴的核心,是脑、肠相互调控的重要媒介,可直接作用于大脑影响CNS功能。肠道菌群还可通过影响高血压、糖尿病、肥胖、高脂血症等危险因素,进而影响卒中的发病[23]。BENAKIS等[24]证明肠道菌群被抑制后显著降低脑梗死体积,其作用机制依赖于调节性T细胞增加和IL-17阳性γδT细胞的降低,揭示了“肠-脑”轴及脑缺血与肠道菌群的相关性,为脑缺血的治疗提供了新的思路。
本研究结果显示,脑I/R后,大鼠出现脑梗死病灶,化痰通络汤高剂量组、化痰通络汤中剂量组、化痰通络汤低剂量组可以减少脑梗死体积,效应具有剂量依赖性。表明化痰通络汤可以减轻脑I/R后脑组织的损伤。
人体肠道菌群主要由厚壁菌门、拟杆菌门、变形菌门、放线菌门、梭杆菌门、疣微菌门、螺旋体菌门等组成,其中厚壁菌门和拟杆菌门占整个肠道菌群的80%以上,厚壁菌门与拟杆菌门之比是反映肠道菌群失调的重要指标[25]。正常情况下,肠道菌群与机体是互利共生的稳态关系,但当正常肠道菌群的组成发生改变时,就会引起机体生理功能改变甚至导致病变,反之,机体的某些病变也会引发肠道菌群的变化[26-28]。研究发现,肠道菌群失调会对脑缺血模型小鼠转归产生不良影响[29]。脑卒中后肠道微生物群的组成改变,胃肠道蠕动减弱导致有害代谢产物的局部积累,炎症反应亢进,均能引起肠道通透性增加,影响肠道屏障功能,最终造成肠道黏膜受损,增加了消化道溃疡、出血的发生率[30]。HOULDEN等[31]观察到,缺血性脑损伤可在72 h内引起小鼠盲肠肠道菌群失调,随着梗死范围的扩大,消化道球菌科细菌数量增多,拟杆菌门中的普雷沃菌科细菌数目减少。
本研究Alpha多样性分析显示,与假手术组相比,模型组大鼠肠道菌群的丰富度和多样性显著下降,表明脑I/R后,存在肠道菌群的失调。化痰通络汤低、中、高剂量组均能提升脑I/R后大鼠肠道菌群的丰富度和多样性,以化痰通络汤高剂量组效果最为显著。Beta多样性分析显示,模型组大鼠肠道菌群组成结构与假手术组距离较远,而化痰通络汤中、高剂量组与假手术组距离接近,表明脑I/R可以影响正常小鼠肠道菌群的组成和结构,化痰通络汤能使之趋向正常。
研究表明,“菌群-肠-脑”轴对微生物及代谢产物的调控能够有效改善和预防神经精神疾病,肠道菌群代谢产物短链脂肪酸直接或间接对阿尔茨海默病、帕金森病以及孤独症等神经系统疾病发挥作用[32]。拟杆菌类、双歧杆菌类、消化链球菌类、梭菌类、瘤胃球菌类细菌可以代谢产生短链脂肪酸(主要包括乙酸、丙酸、丁酸),肠道内游离的短链脂肪酸可以通过单羧酸转运蛋白穿过血脑屏障[33],进入大脑调节神经元、神经胶质细胞的功能[34-35]。研究表明,小鼠补充丁酸可以促进脑内海马神经的再生,短链脂肪酸水平与中风严重程度和预后恢复水平呈负相关;norank_f_Muribaculaceae、杜氏杆菌属于拟杆菌门,拟杆菌是整个肠道的重要菌群之一;颤螺旋菌与健康呈正相关,在炎症疾病中丰度降低;普雷沃菌可能在多发性硬化症患者中有潜在的治疗作用,发挥“益生菌”的作用;丹毒丝菌也可产生短链脂肪酸,参与肠道物质和能量的代谢[36-37]。
本研究结果表明,在门水平上,与假手术组相比,模型组拟杆菌门、放线杆菌门(Actinobacteriota)、脱硫弧菌门(Desulfobacterota)丰度显著降低(P<0.05,P<0.01)。化痰通络汤高、中剂量组能不同程度升高拟杆菌门、放线杆菌门及脱硫菌门群落丰度,表明化痰通络汤可以调节缺血性脑卒中后的肠道菌群失调,促进优势菌群的恢复。在属水平上,主要的优势物种有14种,其中7种具有显著性差异。化痰通络汤中剂量组能显著升高肠道双歧杆菌属(Bifidobacterium)、norank_f_Muribaculaceae、杜氏杆菌属(Dubosiella)、红蝽菌属_UCG-002(Coriobacteriaceae_
UCG-002)、普雷沃菌属(Prevotella)群落相对丰度,化痰通络汤高剂量组能显著升高norank_f_Muribaculaceae、拟普雷沃菌属(Alloprevotella)、红蝽菌属_
UCG-002(Coriobacteriaceae_UCG-002)、普雷沃菌属(Prevotella)群落丰度。且化痰通络汤中剂量组升高双歧杆菌属(Bifidobacterium)属群落丰度的效应显著优于化痰通络汤高剂量组(P<0.05),升高杜氏杆菌属(Dubosiella)、红蝽菌属_UCG-002的效应显著优于化痰通络汤低剂量组(P<0.05);化痰通络汤高剂量组升高norank_f_Muribaculaceae的效应显著优于化痰通络汤低剂量组(P<0.05)。说明化痰通络汤能调节脑I/R肠道的优势菌群,且不同剂量调节的优势菌群不同。
LEfSe分析结果显示,化痰通络汤高剂量组优势菌种为拟杆菌纲、拟杆菌门、拟杆菌目、鼠杆菌科、norank_f_Muribaculaceae、普雷沃菌科、颤螺旋菌目、颤螺旋菌科、普雷沃菌属、瘤胃球菌科,化痰通络汤中剂量组优势菌为丹毒丝科、丹毒丝目、杜氏杆菌属,说明中、高剂量的化痰通络汤可能通过上调大鼠脑I/R后肠道产短链脂肪酸类和减轻炎性反应的菌种含量、调整肠道菌群的结构,从而改善代谢途径、减少炎症因子的释放,对缺血脑组织产生保护作用。
综上所述,脑缺血再灌注后,大鼠出现脑组织损伤,同时肠道菌群的种类和丰度发生显著改变。化痰通络汤能通过调整和改善大鼠肠道菌群的组成结构,恢复大鼠“菌群-肠-脑”轴的平衡,减轻脑组织缺血性损伤。其机制可能与恢复肠道菌群的多样性和丰度,调节肠道益生菌有关,但由于肠道微生物菌群的复杂性,脑-肠相互作用的具体机制尚不清楚,尚待进一步研究。
参考文献
[1] 北京中医药大学东直门医院, 天津中医药大学第一附属医院, 福建中医药大学附属康复医院. 中风病(脑梗死)中医诊疗方案(2017年版)[S]. 北京:国家中医药管理局, 2017: 2-3.
[2] 张伯礼, 吴勉华. 中医内科学[M]. 4版. 北京: 中国中医药出版社, 2017: 110-120.
[3] 唐 三, 杨筱倩, 朱秋燕, 等. 化痰通络汤对脑缺血/再灌注大鼠“肠-脑”轴的干预作用[J]. 中国实验方剂学杂志, 2021, 27(18): 32-41.
[4] 劉东坡. 化痰通络汤对脑梗死患者颈动脉粥样硬化斑块、血脂及不稳定标志物MMP-9、TIMP-1水平的影响[J]. 中医学报, 2017, 32(12): 2472-2476.
[5] 姚欣艳, 王迎春, 高晓峰, 等. 化痰通络汤对MCAO大鼠脑保护作用及HMGB 1-TLR4-NF-κB信号通路的影响[J]. 中国中医急症, 2017, 26(9): 1536-1540.
[6] LI C Q, HE L C, JIN J Q. Atractylenolide I and atractylenolide III inhibit Lipopolysaccharide-induced TNF-alpha and NO production in macrophages[J]. Phytotherapy Research, 2007, 21(4): 347-353.
[7] 王郁金, 周永学, 苏衍进. 半夏泻心汤治疗胃肠疾病临床应用[J]. 吉林中医药, 2014, 34(2): 132-133.
[8] 周晓亮. 复方丹参制剂对心血管和胃肠道药理作用的临床分析[J]. 中国医药指南, 2011, 9(29): 343-344.
[9] 李建志, 王晓源, 王亚贤. 8种中草药抗菌作用实验研究[J]. 中医药信息, 2015, 32(1): 32-34.
[10] 王海侨, 黄 涛, 彭烈标. 化痰通络汤影响痰瘀痹阻型急性脑梗死患者脑血管血流动力学指标的研究[J]. 中国医药科学, 2016, 6(3): 79-81, 91.
[11] 国家药典委员会. 中华人民共和国药典: 2020年版[M]. 北京: 中国医药科技出版社, 2020: 22-179.
[12] SUN J, WANG F, LING Z, et al. Clostridium butyricum attenuates cerebral ischemia/reperfusion injury in diabetic mice via modulation of gut microbiota[J]. Brain Research, 2016, 1642: 180-188.
[13] 朱秋燕, 曾鑫冰, 杨筱倩, 等. 益气活血开窍组分中药对脑缺血后白质保护的网络药理学研究及药效学验证[J]. 湖南中医药大学学报, 2022, 42(6): 941-949.
[14] CHEN J, SANBERG P R, LI Y, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke, 2001, 32(11): 2682-2688.
[15] 杨筱倩, 丁 煌, 刘晓丹, 等. 冰片配伍黄芪甲苷和三七总皂苷促进脑缺血再灌注后神经修复作用的研究[J]. 中华中医药杂志, 2019, 34(12): 5854-5859.
[16] 嚴宝飞, 袁 鹏, 刘圣金, 等. 黄芩汤对非酒精性脂肪肝大鼠肠道菌群的影响[J]. 中草药, 2022, 53(1): 162-175.
[17] CHIDAMBARAM S B, RATHIPRIYA A G, MAHALAKSHMI A M, et al. The influence of gut dysbiosis in the pathogenesis and management of ischemic stroke[J]. Cells, 2022, 11(7): 1239.
[18] DRAPKINA O M, ASHNIEV G A, ZLOBOVSKAYA O A, et al. Diversities in the gut microbial patterns in patients with atherosclerotic cardiovascular diseases and certain heart failure phenotypes[J]. Biomedicines, 2022, 10(11): 2762.
[19] NIRMALKAR K, QURESHI F, KANG D W, et al. Shotgun metagenomics study suggests alteration in sulfur metabolism and oxidative stress in children with autism and improvement after microbiota transfer therapy[J]. International Journal of Molecular Sciences, 2022, 23(21): 13481.
[20] SHABBIR U, ARSHAD M S, SAMEEN A, et al. Crosstalk between gut and brain in alzheimer's disease: The role of gut microbiota modulation strategies[J]. Nutrients, 2021, 13(2): 690.
[21] STERLING K G, DODD G K, ALHAMDI S, et al. Mucosal immunity and the gut-microbiota-brain-axis in neuroimmune disease[J]. International Journal of Molecular Sciences, 2022, 23(21): 13328.
[22] BENAKIS C, LIESZ A. The gut-brain axis in ischemic stroke: Its relevance in pathology and as a therapeutic target[J]. Neurological Research and Practice, 2022, 4(1): 57.
[23] 王 雪, 朱路文, 李宏玉, 等.肠道菌群与脑卒中相关性的研究进展[J]. 中国医药导报, 2022, 19(13): 42-46.
[24] BENAKIS C, BREA D, CABALLERO S, et al. Commensal microbiota affects ischemic stroke outcome by regulating intestinal γδ T cells[J]. Nature Medicine, 2016, 22(5): 516-523.
[25] ZHANG Y J, LI S, GAN R Y, et al. Impacts of gut bacteria on human health and diseases[J]. International Journal of Molecular Sciences, 2015, 16(4): 7493-7519.
[26] LEI L, JI M H, YANG J J, et al. Gut microbiota-mediated metabolic restructuring aggravates emotional deficits after anesthesia/surgery in rats with preoperative stress[J]. Frontiers in Immunology, 2022, 13: 819289.
[27] CHANPONG A, BORRELLI O, THAPAR N. Recent advances in understanding the roles of the enteric nervous system[J]. Faculty Reviews, 2022, 11: 7.
[28] ROTH W, MOHAMADZADEH M. Vitamin B12 and gut-brain homeostasis in the pathophysiology of ischemic stroke[J]. EBioMedicine, 2021, 73: 103676.
[29] WINEK K, ENGEL O, KODUAH P, et al. Depletion of cultivatable gut microbiota by broad-spectrum antibiotic pretreatment worsens outcome after murine stroke[J]. Stroke, 2016, 47(5): 1354-1363.
[30] YARANDI S S, PETERSON D A, TREISMAN G J, et al. Modulatory effects of gut microbiota on the central nervous system: How gut could play a role in neuropsychiatric health and diseases[J]. Journal of Neurogastroenterology and Motility, 2016, 22(2): 201-212.
[31] HOULDEN A, GOLDRICK M, BROUGH, et al. Brain injury induces specific changes in the caecal microbiota of mice via altered autonomic activity and mucoprotein production[J]. Brain, Behavior, and Immunity, 2016, 57: 10-20.
[32] GUZZETTA K E, CRYAN J F, O'LEARY O F. Microbiota-gut-brain axis regulation of adult hippocampal neurogenesis[J]. Brain Plasticity, 2022, 8(1): 97-119.
[33] YIN Y J, GUO Q P, ZHOU X H, et al. Role of brain-gut-muscle axis in human health and energy homeostasis[J]. Frontiers in Nutrition, 2022, 9: 947033.
[34] SADLER R, CRAMER J V, HEINDL S, et al. Short-chain fatty acids improve poststroke recovery via immunological mechanisms[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2020, 40(5): 1162-1173.
[35] TRAN S M S, MOHAJERI M H. The role of gut bacterial metabolites in brain development, aging and disease[J]. Nutrients, 2021, 13(3): 732.
[36] LEE J, D'AIGLE J, ATADJA L, et al. Gut microbiota-derived short-chain fatty acids promote poststroke recovery in aged mice[J]. Circulation Research, 2020, 127(4): 453-465.
[37] TAN C H, WU Q H, WANG H D, et al. Dysbiosis of gut microbiota and short-chain fatty acids in acute ischemic stroke and the subsequent risk for poor functional outcomes[J]. JPEN Journal of Parenteral and Enteral Nutrition, 2021, 45(3): 518-529.

