一种面向不平衡数据的心脏病风险预测可解释性框架
周展 刘彬 郑立瑞 谭建聪 邹北骥 彭清华 肖晓霞


〔摘要〕 目的 研究疾病预测模型存在的类别不平衡性与不可解释性难题。方法 结合极限梯度提升(eXtreme gradient boosting, XGBoost)、混合采样和Shapley加法解释(shapley additive exPlanations, SHAP)分析,提出一种面向不平衡数据的心脏病风险预测可解释性框架ICRPI。结果 该框架下的风险预测模型平衡准确度为0.942 50,AUC为0.986 03,模型可视化分析获得高龄、高体质量指数(body mass index, BMI)值、患有糖尿病等9个心脏病危险因素,并得出高龄的糖尿病患者、高BMI值且诊断为糖尿病或临界糖尿病患者、高BMI值且缺乏体力活动群体为患心脏病高危群体,临界糖尿病人群参与体力活动可降低患心脏病风险。结论 ICRPI框架适用于真实临床不平衡数据分析,且能明确给出致病風险因素及其相关性,可有效提高临床诊断准确率的同时为医生提供致病因素分析,智能辅助医生临床诊疗。
〔关键词〕 数据类别不平衡;心脏病风险预测;XGBoost;SHAP;可解释性
〔中图分类号〕R2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.019
〔Abstract〕 Objective To solve the problems caused by imbalanced data and interpretability of disease prediction models. Methods ICRPI, the framework for predicting heart disease risk factors with interpretability by imbalanced data was proposed by combining eXtreme Gradient Boosting(XGBoost), mixed sampling, and Shapley Additive exPlanations(SHAP). Results The balance accuracy of the risk prediction model within this framework was 0.942 50, and the AUC was 0.986 03. Nine heart disease factors such as older age, high body mass index (BMI) value, and diabetes were obtained by model visualization analysis. The older diabetic patients, the diabetes or borderline diabetes with high BMI value, the patients with high BMI and lacking physical activities are high-risk groups for heart disease; while for the borderline diabetes, physical activity can reduce the risk of heart disease. Conclusion The ICRPI framework can analyze real clinical imbalance data, and can clearly show the pathogenic factors and their correlations. It can effectively improve the accuracy of clinical diagnosis, provide pathogenic factor analysis for doctors, and intelligently assist doctors in clinical practice.
〔Keywords〕 imbalanced data; predicting heart disease risk factors; XGBoost; SHAP; interpretability
心血管疾病(cardiovascular disease, CVD)是心脏病和血管疾病的一个类别,包括冠心病、脑血管病、先天性心脏病、心力衰竭等。根据《中国心血管健康与疾病报告2021》推算我国现心血管患病人数为3.3亿,2019年农村和城市CVD死亡人数分别占总死亡人数的46.74%和44.26%,且死亡率仍处于持续上升趋势[1]。目前,CVD临床诊断多采用临床血管造影术和影像诊断,该方式对医院资源配置要求较高,检查费用昂贵且对人体有一定创伤[2]。CVD治疗费用高昂,2019年中国心脑血管疾病患者的住院总费用为3 133.66亿元,且其负担持续加重,特别是在农村地区[1]。因此,早预防、早发现和早治疗是减轻患者负担的关键。
CVD往往是多种危险因素协同作用的结果,通过疾病风险评估可了解患病风险,做到早预防和早治疗,但这要求医生具有较高专业水平。基于大数据建立机器学习模型并分析患病危险因素可辅助医生诊断决策,提高诊断准确率,缓解医疗资源不均衡问题。同时,也可从海量临床数据中发现疾病诊疗新知识,丰富临床诊断知识。朱宵彤等[2]提出了基于一维卷积的CVD预测模型,在尔湾加州大学两个数据集上的独立实验准确率分别93.36%和94.48%。李瑞等[3]基于心脑一体化CT血管成像预测主要心血管不良事件,采用多因素逻辑回归(logistic regression, LR)分析其危险因素,显示多因素综合的心脑血管系统的影像评估模型预测结果最佳。然而这些研究都是基于类别平衡的数据集,而真实临床数据多为类别不均衡数据,基于这种数据构建的机器学习模型性能较差,且大多机器学习和深度学习模型都缺乏可解释性,无法直接给出模型基于哪些因素进行预测,这将无法满足医疗领域要求模型可解释的需求。目前,CVD风险预测模型对类别不均衡和模型可解释性的问题关注较少,本文提出基于类别不平衡数据集的ICRPI心血管疾病风险预测模型,该模型融合SMOTEENN采样、极限梯度提升(eXtreme gradient boosting, XGBoost)等模型和SHAP可解释性分析,可获得较高风险预测准确率的同时获得影响CVD的危险因素,为构建智能诊疗模型打下基础。
1 相关工作
1.1 基于结构化数据的分类算法
LR的本质是对数几率(log odds)的线性模型,由于线性模型由特征权重的线性加权组成,可通过特征权重来解释特征对输出的贡献程度,LR则可通过特征改变带来的对数几率的变化来解释模型,因此LR具有内置可解释性。MCRAE等[4]通过LR的可解释性,建立基于多变量指数测定系统的“心脏病计分卡”,分析CVD的危险因素,疾病预测心脏健康和心力衰竭的AUC分别为0.840 3和0.941 2。决策树(decision tree, DT)是通过树形结构形象地模拟出决策过程,从根节点到叶子节点的路径代表一条决策路径,只要将DT可视化即可了解模型决策全过程,因此DT是内置可解释性模型。但为提高模型准确性所建立的DT,往往因层数较深使人类无法真正理解。BLANCO-JUSTICIA等[5]通过微聚合结合浅层DT进行机器学习模型解释。这些具有内置可解释性的分类算法,虽具有较好的模型可解释性,但受模型本身的限制使其预测准确性不高。随机森林(random forest, RF)是由BREIMAN等[6]提出的基于Bagging的集成学习方法,而XGBoost是基于Boosting的集成学习算法[7]。相较于其他机器学习模型,不少学者发现集成学习模型预测能力更强[8-11]。但集成学习模型作为“黑盒模型”,在可解释方面存在不足。深度学习模型在图像和自然语言处理领域不仅预测性能高,还能避免大量特征工程工作,但在结构化数据任务中的表现却不如集成树模型。为提升神经网络模型在结构化数据中的性能,许多学者研究如何实现模拟树结构的神经网络架构[12-13]。TabNet是Google发布的针对结构化数据的神经网络模型[14]。与之前学者研究的模型相比,该模型不仅预测性能更好,且可提供模型输出的可视化解释。刘玉航[15]在研究中医哮喘辨证分型中提出基于定向正则化的TabNet模型,其辨证模型在多评价指标中占优。尽管基于结构化数据的深度学习模型在近年来取得了较大的进展,但这些模型不论在准确性、性能还是可解释性方面仍然有待改进。从整体上来看,在结构化数据领域分类模型中集成树模型仍然处于优势地位[16]。
1.2 SHAP可解释性分析
尽管集成树模型在预测能力上取得巨大成功,但缺乏可解释性的模型仍难以在业界应用,尤其在医疗领域中。集成树模型的解释方法常用有两种,第一种方法是将模型转化为可解释的模型,用可解释性模型替代“黑盒模型”进行模型解释。SAGI等[17]通过将任意决策森林模型转为可解释性DT进行模型解释,使其预测能力近似XGBoost模型且具有可解释性。这种方法虽然可解释模型,但在预测能力方面仍不足原生模型。第二种方法是使用模型无关的方法,该方法通过关注模型的输入和输出行为而不是模型的内部结构来解释模型。传统的模型无关解释方法是输出置换特征重要性,這种方法能输出对模型影响较大的特征并直观地反映特征的重要程度,但无法提供具体特征与预测输出的关系,在可解释力度上仍有不足。该问题的替代方案是使用Shapley值替代置换特征值,Shapley值不仅能表示特征重要度还能显示特征如何影响模型输出,例如在二分类任务中,通过输出某特征的Shapley值即可表示该特征对模型输出结果值(正类或负类)的贡献度。与传统的特征重要性方法相比,Shapley值更具有数学上的有效性,它是唯一满足效益性、对称性、虚拟性和可加性的归因方法[18]。但计算Shapley值的时间复杂度较高,使其难以应用于真实领域。SHAP是Shapley值的另一种估计方法,该方法极大地提升了计算速度,实现了工业化应用[19]。为计算特征x的SHAP值,假设set代表特征x与其他特征的所有可能的组合,F代表所有特征的个数,模型在包含特征x的特征组合下的预测结果表示为Predictset(x),模型在不包含特征x的特征组合下的预测结果表示为Predictset/feature(x),特征x的SHAP值计算公式如(1)所示。
SHAP概要图是将输出重要特征和特征效应相结合的全局可解释性方法,通过SHAP概要图可直观了解每个重要特征对模型类别输出的影响程度,但它无法展示不同特征值下模型输出结果的变化趋势。SHAP依赖图可展示单个特征取不同值时SHAP值的变化趋势,也是一种全局可解释性方法。这两种全局解释方法中,概要图显示重要特征对模型输出的关系,依赖图则从某个重要特征入手进一步展示该特征不同取值时对模型预测的影响。SHAP可解释性分析属于模型无关可解释方法,相较于传统方法的优势在于具有灵活性且不影响模型的预测能力。
1.3 不平衡分类的数据采样方法
在医疗领域,由于疾病的发病率不同,使得收集到的数据往往存在类别不平衡的问题。传统机器学习方法和深度学习方法在数据类别均衡时能取得较好成绩,相反往往性能极差,特别在类别极度不均衡时。面对类别极度不平衡的数据,通常使用数据采样的方法来解决。主流的采样方法有欠采样、过采样和混合采样,目的都是通过改变数据量使不同类别的样本量达到平衡。欠采样是减少多数类的样本量确保样本量均衡的方法,随机欠采样通过随机丢弃部分多数类样本使样本量达到平衡,是经典的欠采样方法。过采样与欠采样相反,是通过数学模型或方法合成的方式增加少数类样本量使不同类别的样本量均衡。最为经典的过采样方法是CHAWLA等[20]提出的SMOTE算法,该方法增加了数据量使数据达到均衡,同时提高了数据质量,在诸多领域得到认可。由于过采样能增加样本量则更多应用于小样本数据集,但样本合成的方式容易造成过拟合。混合采样是将欠采样和过采样相结合使不同类别样本量达到平衡的方法,BATISTA等[21]提出的SMOTETomek和SMOTEENN算法是较为经典的混合采样方法。混合采样可弥补欠采样导致的样本量减少,同时能优化过采样导致的样本重叠问题,能在不改变数据量的条件下均衡数据集。
2 对象和方法
2.1 研究对象及数据规范
本文采用kaggle网站2020年的Personal Key Indicators of Heart Disease数据集(https://www.kaggle.com/datasets/kamilpytlak/personal-key-indicators-of-heart-disease),其数据总量为319 795,包括167 805名女性和151 990名男性,分类标签为是否患有心脏病,包括27 373名心脏病患者和292 422名非心脏病患者,共有17个特征。通过样本量分析,该数据集具有数据量大且数据类别不平衡的特点。
本文采用的数据集的数据规范化包括:分类标签数值化处理(心脏病患者标记为“1”,非心脏病患者标记为“0”)、特征数值化处理(文本特征值数值化)以及范围特征取均值(如:年龄范围为55~59,则取57),规范化结果如表1所示。
2.2 ICRPI框架
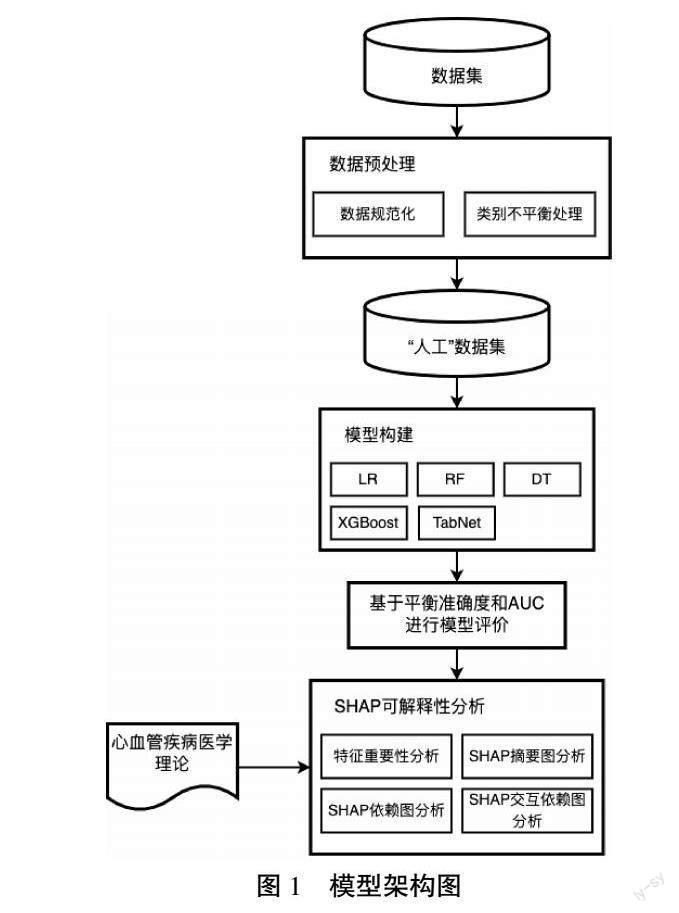
本文首先进行数据规范化,将规范后数据集进行类别平衡处理,得到多个“人工”数据集,对各“人工”数据集分别构建模型并得到疾病预测结果,选择最优预测模型并根据心血管医学理论为基准进行SHAP分析,具体模型架构如图1所示。
ICRPI框架执行步骤:(1)使用规范化后数据集S(样本量为n),由特征集与分类标签组成;(2)对数据集S分别进行随机欠采样、SMOTE过采样、SMOTETomek和SMOTEENN混合采样,得到采样后“人工”数据集;(3)对“人工”数据集分别构建LR、RF、XGBoost、TabNet模型,并采用平衡准确度、精度、召回率、F1和AUC进行模型结果评价,对比模型评价结果,得到预测性能最佳模型M;(4)通过SHAP获取影响模型M输出的重要特征;(5)使用SHAP概要图导出重要特征与心脏病患病的相关关系;(6)使用SHAP依赖图导出top5重要特征的单变量依赖图;(7)对单变量依赖图进行分析,并导出无法直接反映线性关系的重要特征的交互依赖图;(8)结合相关临床研究结果与实际情况对步骤(6)和步骤(7)中导出的图进行可解释性分析。
3 实验结果与可解释性分析
3.1 实验结果分析与对比
本文以TabNet、RF、DT、LR和XGBoost模型为基础构建心脏病风险预测模型,采用平衡准确度、AUC、F1、精度和召回率作为模型评价指标,分别对类别不平衡的原始数据集和采样后的数据集构建模型,结果如表2所示。从表2可知,所有在原始数据集上构建的模型效果都不好。经分别使用随机采样、SMOTE采样、SMOTETomek采样和SMOTEENN采样后,所建立的模型具有更好的学习能力,其中XGBoost+SMOTEENN模型的效果最好,其平衡准确度为0.942 5,比RF+SMOTEENN模型稍好,比XGBoos高出0.41还多,比TabNet模型高出0.175,说明XGBoost+SMOTEENN模型在數据集上效果最佳。
3.2 可解释性分析
由于在采样后建立的XGBoost+SMOTEENN模型的预测结果整体要优于其他机器学习模型,因此本文选择该模型做临床诊断可解释性分析。XGBoost是“黑盒模型”,无法通过模型内置性质获得模型解释,但模型都依赖特征进行预测,可通过分析特征取值与模型预测结果的关系了解模型决策的依据。不同特征对于模型决策的重要程度不同,模型决策结果往往仅受少数重要特征影响,因此,本研究重点分析对模型输出结果影响大的少数重要特征,而不是均摊地解释所有特征。本研究通过SHAP值分析训练模型的重要特征信息,模型中特征的SHAP值降序排序结果如图2所示,展示了从17个特征中筛选出的排名top 9的重要特征,通过对比不同特征的SHAP值可知,这些重要特征是对模型输出影响较大的特征。
为进一步明确重要特征对模型输出结果正/负关系,本文使用SHAP摘要图进行分析。如图3所示,SHAP摘要图显示了模型中的重要特征及对模型预测的影响关系。
SHAP单变量依赖图可分析单个特征与SHAP值之间的线性关系,图4是对输出结果有影响的排名top5的重要特征的单变量依赖图。图4(a)显示SHAP值随年龄增加,中老年人患心脏病风险更高;图4(b)显示参与体力活动的成年人比缺乏体力活动的成年人SHAP值更低,表明缺乏锻炼是导致心脏病的危险因素;图4(c)显示患有糖尿病和临界糖尿病的成年人有更多患心脏病的风险;图4(d)表明整体健康水平越高患心脏病风险越低;图4(e)中“BMI”与SHAP值不是简单线性关系,说明该特征可能与其他特征交互影响预测结果,无法通过单变量分析特征与模型的预测关系,需要引入双变量突出组合特征效应的交互依赖图做进一步分析。
本文分析“BMI”分别与“体力活动”“糖尿病”的组合特征关系,如图5所示。图5(a)中显示当“BMI”取值大于35时,红色点靠下居多,蓝色点靠上居多,表明“BMI”较高且缺乏体力活动的成年人有更高患病风险。因此,将“BMI”与“糖尿病”组合起来分析,如图5(b)所示,“BMI”取值大于30时,红色点靠右上居多,表明“BMI”较高的糖尿病患者或临界糖尿病患者有更高的患心脏病风险。
从“糖尿病”单变量依赖图可知糖尿病与临界糖尿病患者是患心脏病的高危人群,构建“糖尿病”与“体力活动”及“年龄范围”的交互依赖图进一步分析患病因素,如图6所示。图6(a)显示“糖尿病”取值为2时,蓝色区域靠上,说明临界糖尿病且缺乏体力活动的成年人有更高的患心脏病风险。图6(b)中显示“糖尿病”取值为3时,红色区域靠上,表明糖尿病患者随年龄的增长患心脏病风险提高。
4 讨论
本文结合XGBoost和SMOTEENN算法提出了ICRPI框架,该框架预测的平衡准确度超过94%,AUC值超过98%,且能提取与患病风险关系紧密的重要特征及其与患病风险的关系。通过本研究的实验得出传统机器学习模型、集成学习和TabNet对类别不平衡的数据分类效果不好,混合采样后的集成学习模型分类效果最佳。
为解释模型,本文使用SHAP进行可解释性分析。通过SHAP值排序获得年龄、高BMI值、糖尿病、缺乏体力活动等9个模型重要特征,有大量研究表明肥胖、糖尿病、缺乏锻炼等是导致心血管疾病的危险因素[22-24],这说明通过SHAP值筛选出的重要特征符合医学临床真实情况。为获得重要特征与模型输出的关系,本文使用了基于SHAP值的单变量依赖图和交互依赖图,通过单变量依赖图得出“年龄范围”“糖尿病”“体力活动”和“整体健康水平”这些特征与心脏病诊断结果存在线性关系。然而,单变量依赖图无法直接得出“BMI”与输出结果的线性关系。为分析“BMI”与其他特征的交互关系,需要了解在医学临床中哪些特征与“BMI”具有相关性。由于肥胖和缺乏锻炼是心脏病的危险因素[22],而肥胖可体现在较高的“BMI”值上,缺乏锻炼可体现在缺乏一定的体力活动上,于是分析“BMI”与“体力活动”共同作用于心脏病患病风险。ECKEL等[25]提出BMI和糖尿病体现了心脏代谢风险,是引发心脏病的危险指标,因此,将“BMI”与“糖尿病”组合起来分析。从“BMI”交互依赖图的分析得出高BMI值是心脏病危险指标,主要体现在高BMI值且缺乏体力活动与高BMI值的糖尿病患者或临界糖尿病人群中,分析结果与临床实际情况相符合。2型糖尿病防治指南指出,2型糖尿病患病时长大于等于10年或合并年龄大于50岁等为心血管风险高危因素,早期生活方式干预(如加强运动)可有效减少2型糖尿病的发生或延缓并发症的发展[26]。本文构建“糖尿病”与“体力活动”及“年龄范围”的交互依赖图分析得出高龄糖尿病患者及缺乏锻炼的临界糖尿病人群具有较高心脏病患病风险,该结果与2型糖尿病防治指南观点一致。
综上所述,本研究表明ICRPI框架可以面向真实的临床类别不平衡数据构建合适的具有较高预测性能的分类模型,且能客观地给出致病因素分析,可辅助医生提高心血管疾病风险预测准确率,降低心脏病诊疗费用并减少人体的创伤。该框架目前仅可解释特征与预测結果的相关性,不能解释特征与预测结果的因果关系,但这一框架为构建面向真实临床的高准确率、可解释性的风险预测模型提供一种有效途径,满足临床智能诊疗系统需求。
参考文献
[1] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2021概要[J]. 中国循环杂志, 2022, 37(6): 553-578.
[2] 朱宵彤, 庞春颖, 朱 涵. 基于深度学习的心血管疾病预测模型[J]. 计算机应用, 2021, 41(S2): 346-350.
[3] 李 瑞, 刘墨麒, 黎佳璐, 等. 心脑血管系统的影像评估对主要心血管不良事件的预测作用[J]. 中国脑血管病杂志, 2022, 19(3): 154-160.
[4] MCRAE M P, BOZKURT B, BALLANTYNE C M, et al. Cardiac ScoreCard: A diagnostic multivariate index assay system for predicting a spectrum of cardiovascular disease[J]. Expert Systems With Applications, 2016, 54: 136-147.
[5] BLANCO-JUSTICIA A, DOMINGO-FERRER J, MARTíNEZ S, et al. Machine learning explainability via microaggregation and shallow decision trees[J]. Knowledge-Based Systems, 2020, 194: 105532.
[6] BREIMAN L. Random forests[J]. Machine learning, 2001, 45: 5-32.
[7] CHEN T Q, GUESTRIN C. XGBoost: A scalable tree boosting system[C]//Proceedings of the 22nd ACM SIGKDD International Conference on Knowledge Discovery and Data Mining.New York: ACM, 2016: 785-794.
[8] 陈 苗, 陈 青, 尹晓清. 随机森林的集成分类算法对心胸外科ICU患者谵妄风险的预测分析[J]. 中国胸心血管外科临床杂志, 2022, 29(7): 886-891.
[9] 郑晓燕. 基于机器学习的心血管疾病预测系统研究[D]. 北京: 北京交通大学, 2018.
[10] 于大海. 基于BP神经网络和随机森林算法的冠状动脉狭窄风险识别模型研究[D]. 太原: 山西医科大学, 2019.
[11] 彭佳丽, 刘春容, 李 旭, 等. 采用XGBoost和随机森林探索中国西部女性乳腺癌危险因素[J]. 现代预防医学, 2020, 47(1): 1-4.
[12] KONTSCHIEDER P, FITERAU M, CRIMINISI A, et al. Deep neural decision forests[C]//2015 IEEE International Conference on Computer Vision (ICCV). Santiago, Chile. IEEE, 2016: 1467-1475.
[13] YANG Y, MORILLO I G, HOSPEDALES T M. "Deep neural decision trees"[EB/OL]. 2018. DOI: 10.48550/arXiv.1806.06988.
[14] ARIK S ?, PFISTER T. TabNet: Attentive interpretable tabular learning[J]. Proceedings of the AAAI Conference on Artificial Intelligence, 2021, 35(8): 6679-6687.
[15] 刘玉航. 基于机器学习的中医哮喘辨证分型研究与应用[D]. 青岛: 青岛科技大学, 2022.
[16] SHWARTZ-ZIV R, ARMON A. Tabular data: Deep learning is not all you need[J]. Information Fusion, 2022, 81: 84-90.
[17] SAGI O, ROKACH L. Approximating XGBoost with an interpretable decision tree[J]. Information Sciences, 2021, 572: 522-542.
[18] MOLNAR C. Interpretable machine learning:A guide for making black box models explainable[M]. Fletcher, NC, USA: LULU, Feb. 2019: 295-296.
[19] LUNDBERG S M, LEE S I. A unified approach to interpreting model predictions[C]//In Proceedings of the Advances in Neural Information Processing Systems, Long Beach, CA, USA, 4-9 December, 2017: 4765-4774.
[20] CHAWLA N V, BOWYER K W, HALL L O, et al. SMOTE: Synthetic minority over-sampling technique[J]. Journal of Artificial Intelligence Research, 2002, 16: 321-357.
[21] BATISTA G E A P A, PRATI R C, MONARD M C. A study of the behavior of several methods for balancing machine learning training data[J]. ACM SIGKDD Explorations Newsletter, 2004, 6(1): 20-29.
[22] LI X, WU C Q, LU J P, et al. Cardiovascular risk factors in China: A nationwide population-based cohort study[J]. The Lancet Public Health, 2020, 5(12): e672-e681.
[23] 何 源, 馬少宁, 王海宏, 等. 宁夏回族自治区心血管疾病高危人群筛查与相关危险因素研究[J]. 现代预防医学, 2022, 49(1): 21-26, 31.
[24] 刘 览, 刘华章, 冯颖青, 等. 广州市35~75岁社区居民心血管病主要危险因素聚集情况分析[J]. 现代预防医学, 2020, 47(4): 635-639, 647.
[25] ECKEL R H, KAHN R, ROBERTSON R M, et al. Preventing cardiovascular disease and diabetes: A call to action from the American Diabetes Association and the American Heart Association[J]. Circulation, 2006, 113(25): 2943-2946.
[26] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 国际内分泌代谢杂志, 2021, 41(5): 482-548.

