萸芪糖浆调节Th1/Th2平衡改善免疫性重症肌无力大鼠免疫功能的研究
喻雄华 辜转荣 程铁兵 向栋 喻轶
〔摘要〕 目的 觀察萸芪糖浆对重症肌无力大鼠Th1/Th2平衡的调节及改善重症肌无力大鼠免疫应答的影响。方法 取70只大鼠采用乙酰胆碱受体前体蛋白(acetylcholine receptor precursor protein, AchR)多点注射造模,筛选50只自身免疫性重症肌无力大鼠模型,随机分为模型组、泼尼松组、萸芪糖浆低剂量组、萸芪糖浆中剂量组、萸芪糖浆高剂量组,每组10只,另外设置空白组10只。造模完成后,分别给予萸芪糖浆31.84、15.92、7.96 g·(kg·d)-1灌胃,泼尼松组给予泼尼松5.4 g·(kg·d)-1灌胃,空白组、模型组给予同体积生理盐水灌胃。30 d后取材,比较各组大鼠体质量、胸腺指数、脾脏指数;疲劳试验及Lennon 14评分评估各组大鼠肌无力症状;ELISA法检测血清AchR、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)及白细胞介素-10(interleukin-10, IL-10)炎性细胞因子水平;流式细胞仪检测T细胞中CD4+/CD8+比值。结果 与空白组比较,模型组Lennon 14评分,血清AchR、TNF-α均升高(P<0.01),体质量、脾脏指数、胸腺指数、IL-10及T细胞中CD4+/CD8+比例均降低(P<0.01);与模型组比较,各组的脾脏指数、胸腺指数均显著升高(P<0.01),萸芪糖浆中剂量组和萸芪糖浆高剂量组Lennon 14评分,血清AchR、TNF-α均降低(P<0.01),体质量、IL-10及T细胞中CD4+/CD8+比例均升高(P<0.01);与泼尼松组比较,萸芪糖浆低剂量组体质量、脾脏指数、胸腺指数显著降低(P<0.05,P<0.01),萸芪糖浆中剂量组Lennon 14评分显著下降(P<0.05),萸芪糖浆中、高剂量组TNF-α降低(P<0.01),脾脏指数、胸腺指数、IL-10、T细胞中CD4+/CD8+比值均升高(P<0.01);与萸芪糖浆低剂量组比较,萸芪糖浆中、高剂量组脾脏指数、胸腺指数、IL-10、T细胞中CD4+/CD8+比值显著升高(P<0.05,P<0.01),Lennon 14评分、TNF-α降低(P<0.05,P<0.01)。结论 萸芪糖浆能有效治疗重症肌无力大鼠肌无力症状,其机制可能与维持Th1/Th2平衡相关。
〔关键词〕 重症肌无力;Th1/Th2平衡;萸芪糖浆;炎症因子;大鼠
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.06.001
〔Abstract〕 Objective To observe Yuqi Syrup's regulation on Th1/Th2 balance and and its effects on the improvement of the immune response in myasthenia gravis rats. Methods A total of 70 rats were modeled by multi-point injections of acetylcholine receptor precursor protein (AchR) and 50 of them (modeled rats with autoimmune myasthenia gravis) were screened and randomly divided into model group, prednisone group, low-dose, medium-dose and high-dose Yuqi Syrup groups, with 10 rats in each group. And another 10 rats were set up as the blank group. After modeling, the rats were given Yuqi Syrup at a dose of 31.84, 15.92, 7.96 g·(kg·d)-1 by gavage respectively. The prednisone group were given prednisone at a dose of 5.4 g·(kg·d)-1 by gavage, while blank group and model group were given the same volume of saline by gavage. After 30 d, the rats' body mass, thymus index, and spleen index of each group were compared, and the fatigue testing and Lennon 14 score were adopted to evaluate the rats' myasthenic symptoms. The levels of serum AchR, tumor necrosis factor-α (TNF-α), and interleukin-10 (IL-10) inflammatory cytokines were determined by ELISA. The flow cytometry was used to examine the CD4+/CD8+ ratio in T cells. Results Compared with blank group, the Lennon 14 score, serum AchR, and TNF-α levels in model group increased (P<0.01), while the body mass, spleen index, thymus index, IL-10, and CD4+/CD8+ ratio of T cells decreased (P<0.01). Compared with model group, the spleen index and thymus index increased significantly in all groups (P<0.01), and the Lennon 14 score, the serum AchR and TNF-α decreased in medium- and high-dose Yuqi Syrup groups (P<0.01), while the body mass, IL-10 and CD4+/CD8+ ratio in T cells increased (P<0.01). Compared with prednisone group, the body mass, spleen index and thymus index decreased significantly in low-dose Yuqi Syrup group (P<0.05, P<0.01), the Lennon 14 score decreased significantly in medium-dose Yuqi Syrup group (P<0.05), and TNF-α decreased in medium- and high-dose Yuqi Syrup groups (P<0.01), while the spleen index, thymus index, IL-10, and CD4+/CD8+ ratio of T cells increased (P<0.01). Compared with low-dose Yuqi Syrup group, the spleen index, thymus index, IL-10, and CD4+/CD8+ ratio of T cells had increased significantly (P<0.05, P<0.01), while the Lennon 14 score and TNF-α decreased (P<0.05, P<0.01) in medium- and high-dose Yuqi Syrup groups. Conclusion Yuqi Syrup can effectively treat the myasthenic symptoms in rats, and its mechanism may be related to maintaining the Th1/Th2 balance.
〔Keywords〕 myasthenia gravis; Th1/Th2 balance; Yuqi Syrup; inflammatory factors; rats
重症肌无力(myasthenia gravis, MG)是肌肉神经接头传递障碍导致肌肉收缩无力的常见自身免疫性疾病;2/3患者患病后病情恶化,致延髓、颈部、四肢和呼吸肌无力,最终死亡[1]。我国MG发病率约为0.68/10万,70~74岁高发,在国家人口老龄化趋势下,MG的发病及治疗已越来越受关注[2]。目前,临床疗法包括胆碱酯酶抑制剂、免疫抑制剂、胸腺切除术等,泼尼松是临床常用治疗MG的药物,但长期服用会有明显的毒副作用[3]。因此,迫切需要寻找安全有效的治疗药物。
近年来,中医药在MG的治疗中广泛应用,其临床疗效已经得到公认[4-5]。中医学认为,MG属于“痿证”范畴。《素问·痿论》曰:“脾主身之肌肉。”即脾气健运,则肌肉丰盈有所养;如脾有病,则肌肉萎缩不用。《素问·太阴阳明论》亦曰:“脾病……筋骨肌肉皆无气以生,故不用焉。”故脾失运化是MG的基本病机[6]。萸芪糖浆是仙桃市中医医院院内制剂,该制剂由黄芪、山茱萸、制首乌、白芍等12味中药组成,具有健脾益气、调节免疫功能作用。前期实验已证明,萸芪糖浆具有调节厌食幼龄大鼠下丘脑、血浆和胃窦黏膜β-Ep含量的作用,且可修复受损胃黏膜,并改善大鼠体质[7]。辅助性T细胞(helper-T cell, Th)具有辅助B细胞分化作用,是MG发病的重要机制之一。MG患者血清Th1/Th2细胞因子水平与病情严重程度呈正相关[8]。Th1细胞因子在重组人乙酰胆碱(human acetylcholine receptor, H-AChR)诱导HLA-DQ8转基因小鼠所建立的MG模型的发病机制中可能发挥重要作用[9]。故本研究建立自身免疫性重症肌无力(experimental autoimmune myasthenia gravis, EAMG)大鼠模型,给予萸芪糖浆干预,评估Th1/Th2细胞因子水平,明确其防治MG的作用及机制。
1 材料与方法
1.1 实验动物
SPF级SD大鼠80只,体质量180~220 g,购自三峡大学实验动物中心,合格证号:SCXK(鄂)2020-0018。饲养于湖北中医药大学实验动物中心屏障环境下,饲养环境许可证号:SYXK(鄂)2017-0067。饲养环境:室温21~22 ℃,环境湿度50%~55%,光照时间为12 h(8:00~20:00),所有SD大鼠自由摄食,饮水。适宜性喂养1周后,开始实验。实验由湖北中医药大学实验动物伦理委员会审批同意,批号为:HUCMS202111002。
1.2 实验仪器
电子天平(瑞士METTLER TOLEDO公司,型号:AX205);高速冷凍离心机(日本日立公司,型号:CR21GH);数显恒温水浴锅(苏州赛普生物科技股份有限公司,型号:HH-4);漩涡混合仪(上海沪西分析仪器厂有限公司,型号:WH-3);酶标仪(美国Thermo公司,型号:MK3);电热恒温干燥箱(上海齐欣科学仪器有限公司,型号:DHG-9053A);高速电动匀浆器(江苏恒丰科技有限公司,型号:FSH-Ⅱ);流式细胞仪(美国BD公司,型号:FACSCalibur)。
1.3 实验试剂
AChRα1多肽(北京博奥森生物技术有限公司,批号:bs-20199P);结核分枝杆菌H3干粉(上海晶诺生物科技有限公司,批号:GOMY0019);弗氏完全佐剂(美国Sigma公司,批号:F5881);大鼠白细胞介素-10(interleukin-10, IL-10)ELISA检测试剂盒(上海江莱生物科技有限公司,批号:JL13427);大鼠肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)ELISA检测试剂盒(上海江莱生物科技有限公司,批号:JL13202)。醋酸泼尼松片(仁和堂药业有限公司,批号:20210615,5 mg×100片/瓶);萸芪糖浆(仙桃市中医医院内部制剂,鄂药制字Z20180625,批号:202111027,200 mL/瓶)。
1.4 造模、分组及给药方法
大鼠适应性喂养1周后,70只SD大鼠采用免疫注射法,建立EAMG大鼠模型[10-11]。将大鼠来源的AchRα亚基、弗氏完全佐剂、PBS充分混匀后制成200 μL的乳剂,选取双后肢足垫(2点)、大鼠尾基部(1点),脊柱背两侧(2点),共计5个位点作为免疫原注射位点,每个位点注射免疫乳剂40 μL。首次免疫后的30 d和45 d分别进行免疫乳剂(40 μL)第2次和第3次加强免疫,大鼠注射乳剂配制、注射剂量、注射位点均同于首次免疫。如果免疫过程中,注射部位出现脓肿、溃疡或皮炎,给予外用抗炎消毒处理。造模完成后,根据Lennon 14评分>1分筛选50只EAMG模型大鼠[12],数字随机法分为模型组、泼尼松组、萸芪糖浆低剂量组、萸芪糖浆中剂量组、萸芪糖浆高剂量组,每组10只,另设空白组10只。泼尼松组给予泼尼松水溶液灌胃[5.4 g·(kg·d)-1],萸芪糖浆低、中、高剂量组分别以7.96、15.92、31.84 g·(kg·d)-1灌胃治疗,给药剂量按照大鼠与成人临床等效体表换算公式计算[13],空白组给予等量生理盐水。各组大鼠均根据10 mL·kg-1给药体积灌胃,每日1次,隔日称重调整剂量,连续30 d。
1.5 取材方法
末次给药后,禁食禁水24 h,各组大鼠进行肌无力评估后,2%戊巴比妥钠(3.5 mg·kg-1)腹腔注射麻醉。心脏取血,室温静置30 min,2000×g,离心10 min,取上清液,分装,-80 ℃保存备用。大鼠取血后,颈椎脱臼处死,75%乙醇浸泡5 min后,取脾脏组织。无菌操作,加入T淋巴细胞分离液,通过50 μm尼龙网,注射器活塞轻轻研磨脾脏,将脾脏细胞的分离液立即转移到离心管中,离心前再覆盖上大约1000 μL的1640培养基。800×g离心30 min,离心结束后,细胞液分为3层,取中间层(淋巴细胞),加入1640培养基,250×g,离心20 min,去上清液,备用。
1.6 指标检测方法
1.6.1 免疫器官指数的测定 各组大鼠收取血液后处死,分别取出脾脏和胸腺,使用滤纸去除剩余血液,将其置于无菌平皿中分别称重并记录,分别按照以下公式计算脾脏和胸腺指数。
脾脏指数=脾脏质量(mg)/大鼠质量(g);胸腺指数=胸腺质量(mg)/大鼠质量(g)。
1.6.2 肌无力症状评估 疲劳实验:抓住大鼠尾部,倒悬大鼠,让其前爪反复抓握鼠笼金属细杆,持续时间30 s,然后将其放置在实验平台上,观察其有无肌无力症状。评估方法参照Lennon 14分级法将症状分级评分,总分4分,分数与肌无力严重程度呈正比[12]。
采用Lennon 14评分标准对EAMG大鼠模型隔日进行双盲法评分观察大鼠震额、背姿势、叫声、活动性、肌力和疲劳程度等,对轻度肌无力大鼠在评估前进行疲劳试验。
1.6.3 血清AchR、TNF-α、IL-10炎性细胞因子水平检测 检测前将实验用试剂盒及血清样品置于室温,取200 μL血清,采用TNF-α、IL-10细胞因子ELISA试剂盒,检测各组大鼠血清AchR、TNF-α、IL-10细胞炎性因子的表达,操作过程严格按照试剂盒操作步骤完成。
1.6.4 流式细胞仪检测T细胞群CD4+/CD8+ 取1 mL T细胞悬浮液,分别加入荧光标记的细胞表面抗体CD8-APC、CD4-FITC,采用流式细胞仪检测CD4+T细胞(代表Th1)与CD8+T细胞(代表Th2)比例,计算CD4+/CD8+比值代表Th1/Th2比值。
1.7 统计学方法
数据采用SPSS 20.0软件分析。若数据符合正态分布,运用单因素方差分析;若数据不符合正态分布,用非参数检验分析;结果采用“x±s”表示,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠一般情况及体质量比较
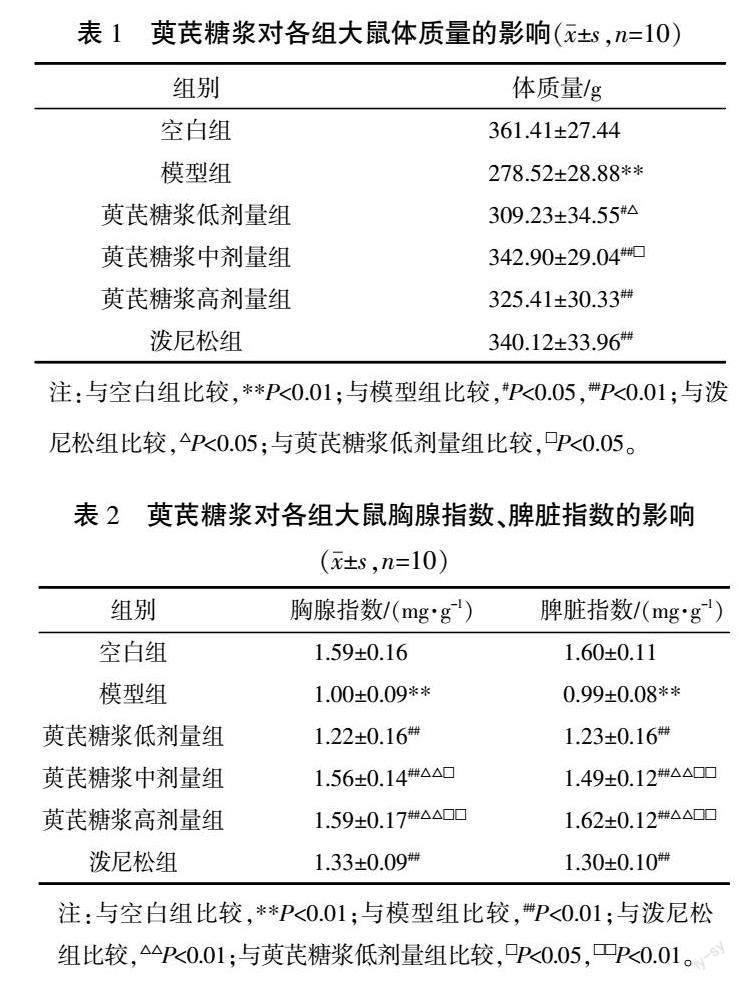
空白组大鼠皮毛光滑,饮食状态良好,二便正常,活动灵活,眼睛有神;模型组大鼠皮毛色微黄,饮食和饮水量欠佳,体质量变轻,对外界刺激减弱;泼尼松组、萸芪糖浆低剂量组、萸芪糖浆高剂量组大鼠的皮毛比模型组更有光泽,饮食和活动均尚可,体质量无明显波动,二便正常。与空白组比较,模型组体质量显著降低(P<0.01);与模型组比较,萸芪糖浆高、中、低剂量组及泼尼松组体质量均显著上升(P<0.05,P<0.01);与泼尼松组比较,萸芪糖浆低剂量组体质量降低(P<0.05);与萸芪糖浆低剂量组比较,萸芪糖浆中剂量组体质量显著升高(P<0.05)。详见表1。
2.2 各组大鼠胸腺指数、脾脏指数比较
与空白组比较,模型组胸腺指数、脾脏指数显著降低(P<0.01);与模型组比较,萸芪糖浆高、中、低剂量组及泼尼松组胸腺指数、脾脏指数均显著升高(P<0.01);与泼尼松组比较,萸芪糖浆高、中剂量组胸腺指数、脾脏指数显著上升(P<0.01);与萸芪糖浆低剂量组比较,萸芪糖浆中、高剂量组的胸腺指数、脾脏指数显著升高(P<0.05,P<0.01)。详见表2。
2.3 各组大鼠Lennon 14评分比较
与空白组比较,模型组大鼠Lennon 14评分显著增强(P<0.01);与模型组比较,萸芪糖浆高、中、低剂量组及泼尼松组Lennon 14评分均显著下降(P<0.05,P<0.01);与泼尼松组比较,萸芪糖浆中剂量组Lennon 14评分显著下降(P<0.05);与萸芪糖浆低剂量组比较,萸芪糖浆中、高剂量组Lennon 14评分显著降低(P<0.05,P<0.01)。详见表3。
2.4 各组大鼠血清AchR、TNF-α、IL-10炎性细胞因子比较
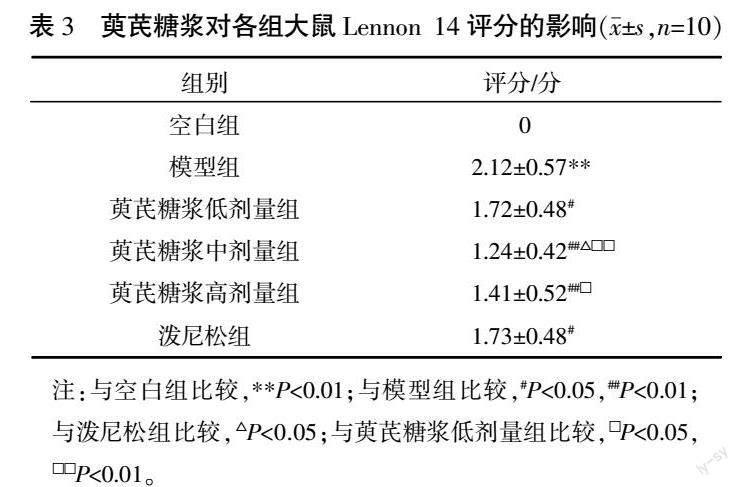
与空白组比较,模型组血清AchR、TNF-α水平均显著升高(P<0.01),IL-10水平显著降低(P<0.01);与模型组比较,萸芪糖浆高、中、低剂量组及泼尼松组血清AchR、TNF-α水平均显著降低(P<0.01),而IL-10水平显著升高(P<0.01);与泼尼松组比较,萸芪糖浆中、高剂量组的TNF-α水平显著降低(P<0.01),而萸芪糖浆中、高剂量组的IL-10水平显著上升(P<0.01);与萸芪糖浆低剂量组比较,萸芪糖浆中剂量组TNF-α水平显著降低(P<0.01),而IL-10水平显著升高(P<0.01)。详见表4。
2.5 各组大鼠T细胞中Th1/Th2比例比较
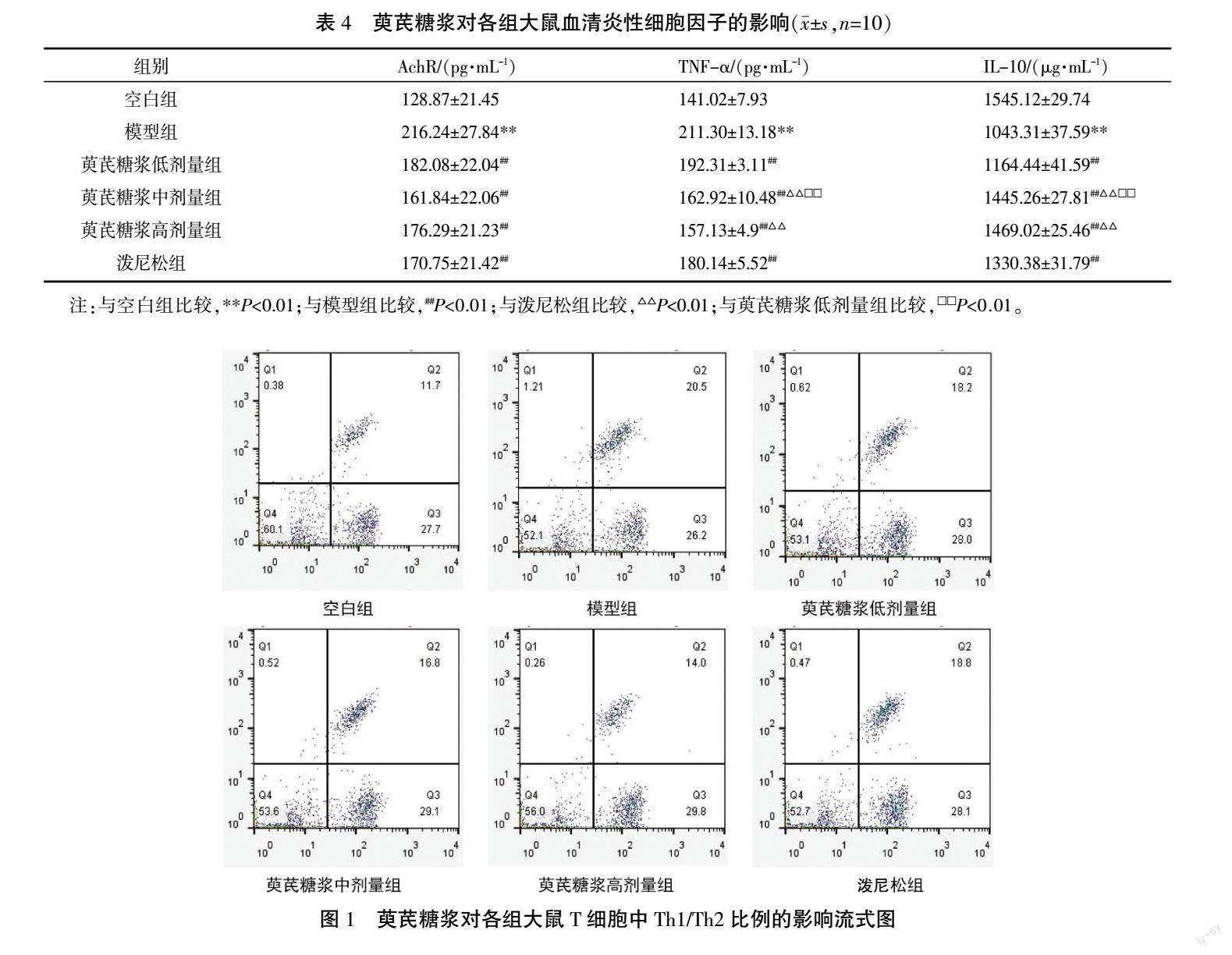
与空白组比较,模型组CD4+T细胞、CD4+/CD8+比值顯著降低,CD8+T细胞显著升高(P<0.01);与模型组比较,萸芪糖浆高、中剂量组及泼尼松组CD4+T细胞均显著升高(P<0.01),萸芪糖浆高、中剂量组CD8+T细胞均显著降低(P<0.01),萸芪糖浆高、中、低剂量组及泼尼松组CD4+/CD8+比值显著升高(P<0.05,P<0.01);与泼尼松组比较,萸芪糖浆高剂量组CD4+T细胞显著上升(P<0.01),萸芪糖浆高、中、低剂量组CD8+T细胞显著降低(P<0.01),萸芪糖浆高、中剂量组CD4+/CD8+比值显著上升(P<0.01);与萸芪糖浆低剂量组比较,萸芪糖浆中剂量组CD4+T细胞显著上升(P<0.01)、CD8+T细胞显著降低(P<0.05)、CD4+/CD8+比值显著升高(P<0.01),而萸芪糖浆高剂量组的CD4+T细胞显著上升(P<0.01)、CD8+T细胞显著降低(P<0.01)、CD4+/CD8+比值显著上升(P<0.05)。详见图1、表5。
3 讨论
MG属中医学“痿证”范畴,“痿”即四肢、官窍痿废,功能失常,早在《素问·痿论》中已提出了“治痿独取阳明”的治疗原则[14],因此,MG应从阳明论治。现阶段而言,中医理论已经明确“阳明”应该包括脾、胃阳明经脉[15],脾弱则肉虚,脾是后天养护之根本,故医家均紧紧围绕脾胃,以补脾、益脾、健脾为基本进行立法论治MG。如范永升运用“治中焦如衡,非平不安”理论,结合补中气、畅气机之法,治疗MG[16];又如况时祥基于补中益气汤化载的补脾强力复方治疗MG[17-18]。本研究药物萸芪糖浆为仙桃市中医医院院内制剂,由黄芪、山茱萸、制首乌、白芍等12味中药组成,具有健脾益气、调节免疫功能的作用[7]。该方黄芪、山茱萸为君药,共奏补气血、养肌肉、强筋骨之效;山药、制首乌、枸杞子、白芍、生地黄、玉竹为臣药,有益气养阴之功;佐以人参、当归,辅助气长血行;甘草为使,调和诸药。根据长期的临床实践,发现治疗脾胃气虚、营养不良,疗效显著。因此,无论从理论方面,还是组方配伍和临床疗效方面,该药健脾益气、调节免疫功能,具有治疗MG的功效。
本研究采用稳定可靠的MG动物模型,由AChR免疫大鼠,诱导EAMG,构建MG大鼠模型,该法广泛用于探索人类MG的免疫病理机制和治疗。如补脾强力复方通过调控HPTT轴及其相关因子,改善EAMG大鼠自身免疫平衡[19];芪参地黄颗粒能降低EAMG大鼠CD19和CD27蛋白、BAFF、CXCL13和CXCR5 mRNA的表达,减少B细胞的分化增殖,抑制B细胞产生AChR-Ab,减少对乙酰胆碱受体的破坏,使EAMG大鼠体质量增加,临床症状得到改善[20]。因泼尼松能抗炎、免疫抑制、改善神经肌肉传导,在MG的治疗中发挥了重要的作用[21]。因此,本研究中选用泼尼松作为阳性对照,考察萸芪糖浆对EAMG大鼠的治疗效果。本研究结果显示,成功复制EAMG大鼠模型后,给予萸芪糖浆干预能明显改善模型大鼠肌无力症状,疗效优于泼尼松组。
MG是一种抗体介导的疾病,其免疫发病机制由T细胞驱动,CD4+T细胞与B细胞发生复杂的联动作用。其免疫学过程始于机体免疫耐受遭到可能为感染性抗原的不明因素破坏,即感染性抗原触发AChR的“分子模仿”,使AChR同时具备识别自身抗原的能力[22]。抗原提呈细胞将AChR提交给CD4+T细胞,导致白细胞介素和肿瘤坏死因子等促炎细胞因子上调[23]。CD4+T细胞分化出的Th1、Th2、Th17、T滤泡辅助细胞和调节性T细胞等Th细胞亚群,均被证明参与MG和EAMG的发病[24-25]。Th分泌不同细胞因子,从而导致人体免疫方向的倾斜,其中Th1分泌IFN-γ、IL-2、TNF-α等细胞因子,主要介导细胞免疫应答,调节细胞毒性T细胞分化和参与迟发型超敏反应;Th2分泌IL-4、IL-10、IL-13等细胞因子,主要介导体液免疫,促进B细胞增殖、分化和产生抗体。Th1/Th2在体内处于动态平衡,使人体免疫系统处于平衡状态。当Th1/Th2失衡时,导致人体发生细胞免疫或者体液免疫。本研究结果显示,萸芪糖浆干预模型大鼠后,血清AchR、TNF-α水平降低,IL-10水平升高,CD4+T细胞升高、CD8+T细胞降低,从而CD4+/CD8+比值升高,提示萸芪糖浆对MG大鼠Th1/Th2平衡具有一定的调节作用。
综上所述,本实验结果明确萸芪糖浆健脾益气、调节免疫功能,对EAMG大鼠Th1/Th2免疫平衡及肌无力症状具有一定改善作用。本研究为萸芪糖浆临床应用推广提供有力的实验基础,为中医药治疗MG提供新方法。有关萸芪糖浆调节Th1/Th2免疫平衡的上游因子,后续研究中有待进一步明确。
参考文献
[1] CHEN J S, TIAN D C, ZHANG C, et al. Incidence, mortality, and economic burden of myasthenia gravis in China: A nationwide population-based study[J]. The Lancet Regional Health Western Pacific, 2020, 5: 100063.
[2] NARAYANASWAMI P, SANDERS D B, WOLFE G, et al. International consensus guidance for management of myasthenia gravis: 2020 update[J]. Neurology, 2021, 96(3): 114-122.
[3] 常 婷, 李柱一. 中国重症肌无力研究进展近十年回顾与展望[J]. 中国神经免疫学和神经病学杂志, 2022, 29(5): 349-355.
[4] 彭思揚, 李少红, 田煜坤, 等. 中医药治疗重症肌无力随机对照试验结局指标选用现状研究[J]. 中国全科医学, 2023(11): 1340-1347.
[5] 晏显妮, 江其龙, 赵利娜, 等. 中医药治疗眼肌型重症肌无力临床随机对照试验的Meta分析[J]. 广州中医药大学学报, 2022, 39(6): 1433-1440.
[6] 宋 健, 曾进浩, 刘友章, 等. 国医大师邓铁涛从脾论治重症肌无力临床经验[J]. 陕西中医, 2022, 43(12): 1774-1777.
[7] 喻雄华, 喻 轶. 萸芪糖浆改善厌食大鼠营养吸收的实验研究[J]. 中国现代药物应用, 2021, 15(16): 235-238.
[8] 赵庆珠, 吴多池, 黎灵萍. 重症肌无力患者C3、C4、Th1/Th2水平与MG-ADL评分的关系及预测眼肌型向全身型转变的效能[J]. 中国医师杂志, 2022, 24(6): 911-915.
[9] 吴晓蓉, 熊英琼, 胡裕翔, 等. Th1/Th2细胞因子在眼肌型重症肌无力转基因小鼠模型中的作用机制[J]. 中国医学科学院学报, 2019, 41(1): 37-42.
[10] 徐 鹏. 基于T细胞介导免疫自身耐受探讨健脾益气补髓方治疗EAMG机制的研究[D]. 长春: 长春中医药大学, 2019.
[11] LI N, WANG G, YAO X H, et al. Adenosine receptor expression in a rat model of experimental autoimmune myasthenia gravis[J]. Cellular Immunology, 2014, 290(2): 217-225.
[12] LENNON V A, LINDSTROM J M, SEYBOLD M E. Experimental autoimmune myasthenia: A model of myasthenia gravis in rats and Guinea pigs[J]. The Journal of Experimental Medicine, 1975, 141(6): 1365-1375.
[13] 陳 奇. 中药药理研究方法学[M]. 2版. 北京: 人民卫生出版社, 2006: 1261-1263.
[14] 熊为锋, 贺 娟. “治痿独取阳明”涵义解析及临床应用[J]. 现代中医临床, 2021, 28(6): 72-76.
[15] 韩 行, 张 林. 从“阳明系统”论五体痿的病位及病机[J]. 湖南中医药大学学报, 2021, 41(8): 1235-1238.
[16] 张 芹, 杨科朋, 张 毅, 等. 范永升运用“治中焦如衡,非平不安”治疗重症肌无力经验[J]. 浙江中医杂志, 2022, 57(9): 642-643.
[17] 王 静, 周双秀, 况时祥. 补脾强力复方对重症肌无力胸腺切除术前后干预的临床研究[J]. 时珍国医国药, 2016, 27(2): 383-385.
[18] 刘建辉, 杨 娅, 况时祥, 等. 补脾强力复方治疗重症肌无力患者的疗效及其对血清细胞因子的影响[J]. 医学信息, 2019, 32(16): 73-75.
[19] 王 强, 况时祥, 李若照, 等. 基于HPTT轴探讨补脾强力复方调节EAMG大鼠免疫系统平衡的机制[J]. 天津医药, 2022, 50(10): 1031-1036.
[20] 蒋 荔, 徐 鹏, 吕志国, 等. 芪参地黄颗粒对实验性自身免疫性重症肌无力大鼠B细胞介导的免疫机制研究[J]. 现代生物医学进展, 2022, 22(3): 432-436.
[21] 陈 渊, 张 鹏. 重症肌无力外科治疗京津冀专家共识[J]. 天津医药, 2020, 48(4): 327-332.
[22] ROJAS M, RESTREPO-JIM?NEZ P, MONSALVE D M, et al. Molecular mimicry and autoimmunity[J]. Journal of Autoimmunity, 2018, 95: 100-123.
[23] GILHUS N E, TZARTOS S, EVOLI A, et al. Myasthenia gravis[J]. Nature Reviews Disease Primers, 2019, 5(1): 30.
[24] ALAHGHOLI-HAJIBEHZAD M, DURMU H, AYSAL F, et al. The effect of interleukin (IL)-21 and CD4+ CD25+ T cells on cytokine production of CD4+ responder T cells in patients with myasthenia gravis[J]. Clinical and Experimental Immunology, 2017, 190(2): 201-207.
[25] EBI M, DURMUS H, AYSAL F, et al. CD4+T cells of myasthenia gravis patients are characterized by increased IL-21, IL-4, and IL-17A productions and higher presence of PD-1 and ICOS[J]. Frontiers in Immunology, 2020, 11: 809.

