CD133在胃肠道间质瘤中的表达及临床意义
赵应涛,侯能易,余 松,刘裔莎,熊海波,王 越,曹钦兴,谢 伟,旦真甲,庞明辉,
( 1.西南医科大学附属医院胃肠外科,四川 泸州 646000; 2.四川省医学科学院·四川省人民医院 a.老年综合外科 b.病理科,四川 成都 610072;3.成都大学附属医院普外科,四川 成都 610081;4.电子科技大学医学院,四川 成都 611731)
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是一种性质较复杂且具有恶性潜能罕见的肿瘤,源于消化道间叶组织,可以发生在消化道的任何部位,约占胃肠道肿瘤发病率的2%左右[1],GIST的发病率为1~2/10万。约15%~50%的GIST患者会发生转移[2]。目前研究表明肿瘤中肿瘤干细胞标志物CD133的高表达是疾病进展的预后标志[3,4],CD133可通过促进肿瘤代谢、增殖、迁移、神经分化,以及抑制细胞凋亡,从而促进肿瘤的进展[5~7]。CD133阳性细胞在脑癌、前列腺癌、结肠癌、肺癌、肝细胞癌和卵巢癌中均检测出高表达[8,9]。近年研究发现CD133同样在胃肠道间质瘤中也有较高的阳性表达[10,11],这或可成为评估胃肠道间质瘤生物学行为的重要指标。本研究采用免疫组化的方法检测CD133在GST组织中的表达情况,并分析其与临床病理特征的关系,探讨CD133在胃肠道间质瘤诊治中的意义。
1 资料与方法
1.1 一般资料收集2018年1月至2021年12月经四川省人民医院诊治的346例GIST患者的临床病理资料。纳入标准:所有患者行根治手术,术后病理诊断为胃肠道间质瘤;未行新辅助治疗等;病理组织为我院病理科石蜡切片。排除标准:病理信息缺失者。根据病理的大小、位置及核分裂象,分为极低危76例、低危109例、中危68例、高危93例。分级标准参照原发胃肠间质瘤危险度分级(中国共识2017修改版)[12]。
1.2 方法石蜡包埋组织连续切片(厚5 μm);二甲苯及梯度酒精中脱蜡至水;柠檬酸盐缓冲液(0.01 MpH6.0)对抗原进行修复处理;放入3%双氧水阻断内源性过氧化物酶;PBS清洗后加入山羊血清封闭;一抗孵育(CD133多克隆抗体,1∶100(浓度),18470-1-AP);4 ℃过夜。PBS清洗后加入二抗(山羊抗兔工作液1∶100(浓)GB23303),37℃ 30min;PBS清洗后加入DAB显色试剂显色;苏木素复染细胞核;脱水处理,中性树胶封片。
1.3 结果判读对免疫组化处理好切片进行图像采集,每张切片先于显微摄像系统100倍下观察全部组织,再分别采集3张不同区域400倍下显微图像。使用Halo数据分析系统计算每张图像阳性面积占比(%DAB positive tissue)。再计算出3个视野下图像的阳性面积占比的平均值,由此得出每例样本中CD133的平均表达量。
1.4 随访通过电话、邮件、门诊以及患者微信群等方式进行随访,随访时间截至2022年12月。从疾病首次确诊时间至当前随访、肿瘤复发或死亡的时间定义为无病生存时间(DFS)。
1.5 统计学方法应用SPSS 26.0统计学软件进行数据分析。不符合正态分布的计量资料以四分位数表示,采用非参数Mann-whitneyU检验,多样本采用Kruskal-WallisH检验,组间比较采用Bonf-feroni检验。Kaplan-Meier生存曲线、Cox回归进行生存分析;组间生存分析采用Log-rank检验或Breslow检验。P<0.05为差异有统计学意义。
2 结果
2.1 GIST切片中CD133的表达情况CD133主要在细胞膜表达,可少量表达于细胞质,染色呈现黄色或棕黄色,细胞核为蓝色。见图1。

图1 CD133在胃肠道间质瘤中的表达情况(免疫组化染色,×400) a:胃;b:小肠;c:结肠;d:直肠;e:腹腔
2.2 CD133在GIST不同临床病理特征下的表达比较不同肿瘤直径、危险分度、肿瘤部位的患者CD133表达量比较,差异有统计学意义(P<0.05);年龄、性别、核分裂象、是否有远处转移以及Ki-67与CD133的表达量比较,差异无统计学意义(P>0.05)。见表1。

表1 不同临床病理特征GIST患者CD133的表达比较
2.3 CD133表达情况与胃肠道间质瘤患者生存的关系本研究随访时间为9~59个月,中位随访时间38个月。利用X-tile软件计算出CD133表达量最佳截取值,以CD133平均阳性占比面积为7.45为界,≤7.45为低表达,>7.45为高表达。Kaplan-Meier生存曲线分析发现GIST肿瘤位置、肿瘤直径、核分裂象、危险分度、肿瘤是否转移、KI-67的表达与生存预后之间存在相关性(P<0.05),而CD133表达量的高低与GIST患者预后无关(P=0.717)。见图2。进一步性Cox多因素回归分析,提示GIST肿瘤位置、Ki-67>5%以及CD133表达量是影响患者预后的独立危险因素。见表2。
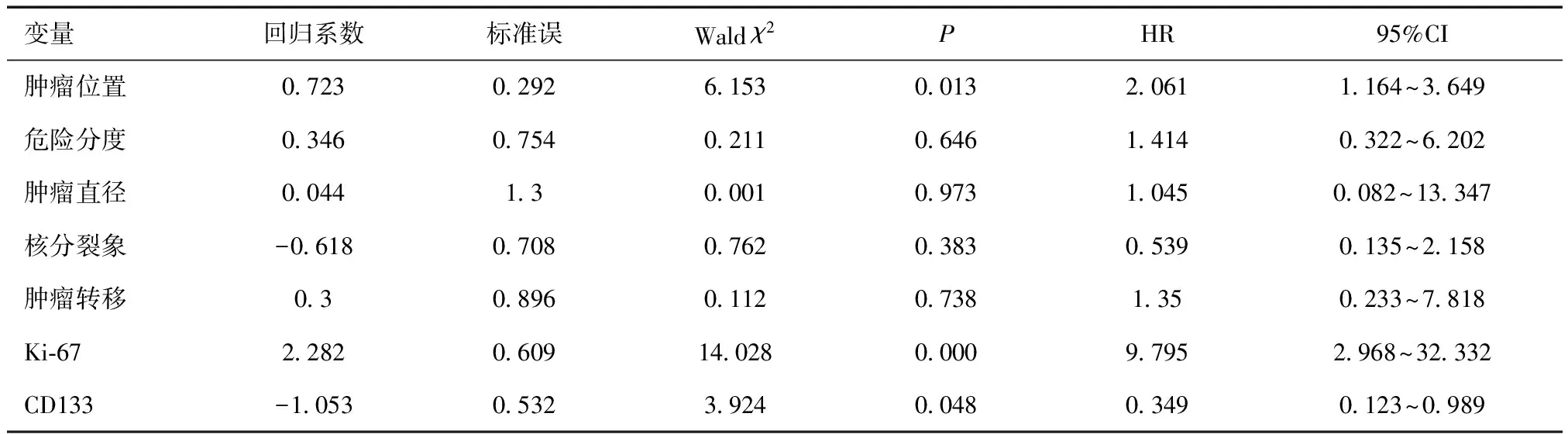
表2 GIST患者总生存率的COX多因素分析
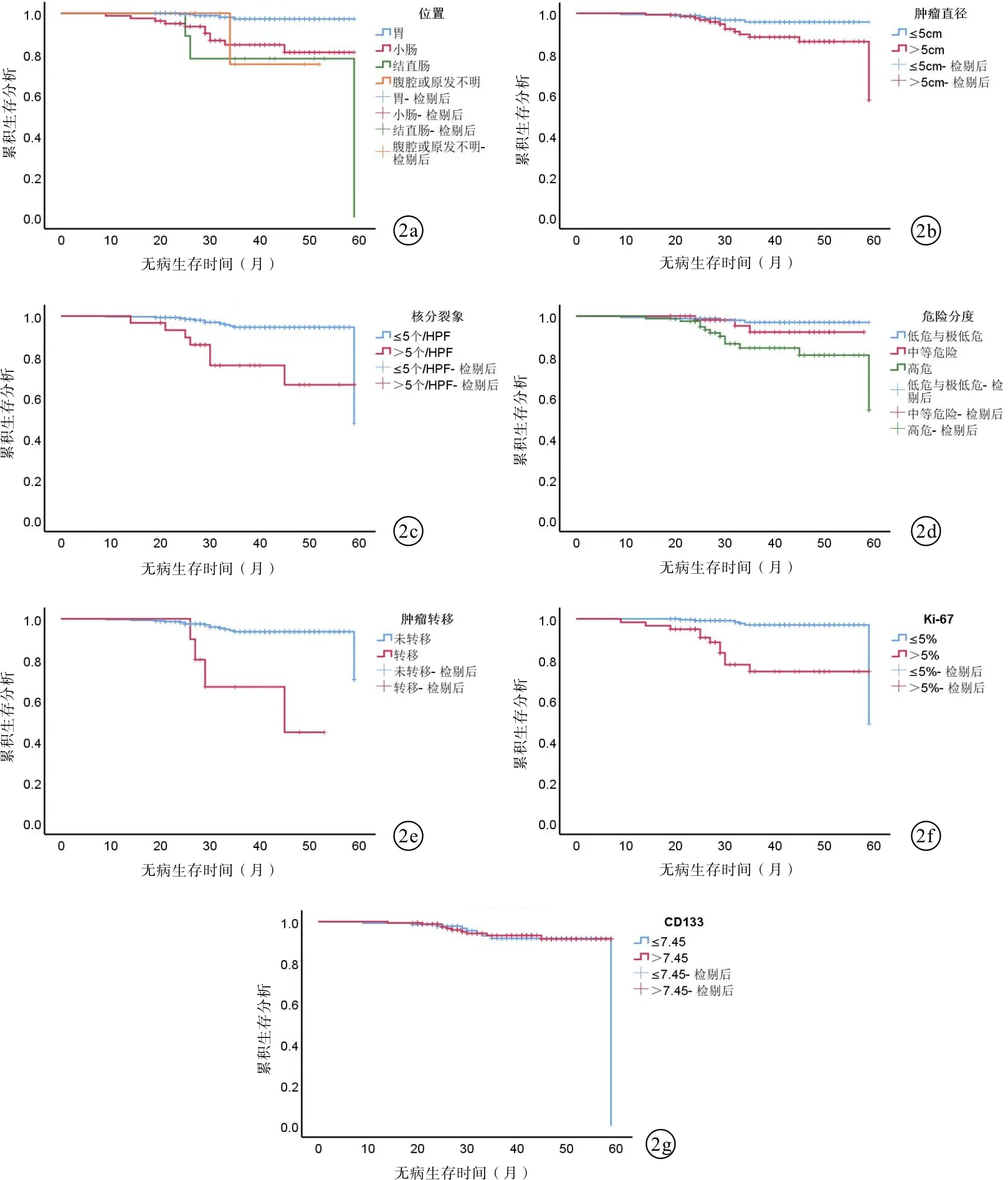
图2 GIST患者生存分析 a:肿瘤位置;b:肿瘤直径;c:核分裂象;d:危险分度;e:肿瘤转移;f:Ki-67 g:CD133
3 讨论
虽然靶向药物彻底改变了GIST的治疗,但由于GIST的性质较复杂且具有恶性潜能,随着时间的推移,大多数患者在靶向治疗期间经历疾病进展或获得性耐药性[9]。目前对于复发、转移以及耐药患者的治疗不容乐观,当前用于评价GIST复发风险的各项指标也在3年后失去评价意义[10],同时对于GIST的转移原因研究较少,对于GIST肿瘤干细胞及其生物标志物研究有限。因此更深入研究肿瘤干细胞及干细胞标记物,可能对于治疗耐药、肿瘤转移、临床治疗及患者的预后判断有着重要意义。
CD133是一种跨膜糖蛋白,大量研究表明,CD133阳性细胞在脑癌、前列腺癌等多种癌中均有高表达[7]。本研究发现不同危险分度GIST中CD133表达具有显著差异,危险度越高其表达也高。当前研究表明肿瘤中CD133的高表达是疾病进展的预后标志。CD133激活PI3K-Akt通路,促进肿瘤代谢、增殖;上调CD133阳性细胞中FLIP的表达,抑制细胞凋亡;CD133阳性细胞具有强有力的移植、增殖、迁移和神经分化;CD133可通过激活Wnt信号通路,增加VEGF-A和IL-8的表达,促进血管生成[11]。肿瘤微环境、p53、表观遗传因子等多种因子参与CD133的表达[13~15],通过上述方式,CD133在卵巢癌、结直肠癌、胃癌、肝癌等肿瘤的分化、进展以及耐药方面具有促进作用[16~21]。本研究发现GIST肿瘤直径越大、核分裂象越高,CD133表达量越高,这提示CD133或许在GIST的生长及分裂增殖中具有重要作用。Ki-67是一种存在于细胞核中的蛋白,可作为反应肿瘤细胞增殖程度的指标,有研究表明Ki-67是GIST预后不良的因素之一[22]。本研究结果发现CD133的表达与Ki-67的高低无关,但生存分析发现Ki-67是GIST预后的独立危险因素。
GIST患者中c-KIT突变约占80%,PDGFRA突变约占10%,还有10%为野生型GIST。大多数c-KIT突变发生在第11外显子(90%)或第9外显子(8%);PDGFRA突变最常见于第12、14和18外显子,第18外显子中的D842V突变频率最高(62.6%)[23]。有研究表明CD133甲基化程度与GIST原发部位及KIT突变相关,KIT突变胃GIST表现为更低的甲基化程度与更高的CD133蛋白表达富集,且CD133超甲基化多见于PDGFRA突变胃GIST[13]。
综上,非胃GIST、Ki-67>5%以及CD133高表达是影响患者预后的独立危险因素,可作为胃肠道间质瘤预后评估指标;CD133在非胃GIST、肿瘤直径>5cmGIST、核分裂象>5个/HPF、Ki-67>5%、高危患者以及转移性GIST中高表达;CD133甲基化程度高多见于KIT突变的胃GIST。研究因大部分中高危患者术后进行伊马替尼辅助治疗,导致终点事件发生较少,同时观察随访事件较短,为了进一步了解CD133与胃肠道间质瘤之间的关系,需增加病例数量以及延长随访时间,同时缺乏术后基因检测结果,CD133与GIST突变类型之间的联系有待进一步研究。

