原发性肝癌术后复发再次肝切除的疗效分析
范祺,倪彦彬,高杰,朱继业,李照
北京大学人民医院 肝胆外科,北京 100044
原发性肝癌(简称肝癌)是我国常见的恶性肿瘤,致死率高居所有恶性肿瘤的第二位。手术切除是主要的根治性方法,但术后5 年内的肿瘤复发率仍高达70%,成为制约远期疗效的关键因素[1]。目前针对肝癌术后复发患者的治疗尚无明确的共识,常用的治疗方式包括再次肝切除术、挽救性肝移植等,其中以再次肝切除术最为普遍,然而再次肝切除术的明确疗效及适应证等目前研究尚不充分。本研究拟通过回顾性收集本中心肝癌术后复发行再次肝切除术患者的临床病理资料,评估再次肝切除术的疗效和生存预后的影响因素。
1 资料和方法
1.1 一般资料
回顾性选取2008 年1 月至2019 年6 月在北京大学人民医院肝胆外科因初次肝切除术后肝癌复发而再次行肝切除术的复发性肝癌患者50 例(再次肝切除组,n=50),其中男42例,女8例。选取同期接受射频消融治疗的复发性肝癌患者(消融组,n=48)及基线特征相近的初次行肝切除术的原发性肝癌患者(初次肝切除组,n=50),作为对照。随访截止日期为2022年5月。以上患者均在手术前签署知情同意书,研究方案经北京大学人民医院伦理委员会审批同意(批号:2022PHB092-001)。
纳入标准:(1)术前临床或病理诊断为肝细胞癌;(2)在我中心行初次根治性肝切除术;根治性切除定义为术中切缘距肿瘤边界≥1 cm,术后1 个月影像学检查未发现肿瘤病灶;(3)术后1个月以上影像学发现复发。其中初次肝切除组符合第1条标准,再次肝切除组和消融组符合3条标准。
排除标准:(1)CNLC分期为Ⅲb期及以上;(2)因非肿瘤原因死亡者;(3)肝癌复发后行挽救性肝移植患者。
1.2 手术方法
患者取仰卧位,取右肋下缘切口或腹腔镜方式入腹,分离粘连,探查周围腹腔脏器,结合术前影像学资料明确肿瘤大小及位置。间断使用改良Pringle技术进行第一肝门阻断,以1 cm以上切缘完整切除肿瘤。对于血管和胆管的处理方法如下:<0.2 cm的小血管和胆管应采用电凝或超声凝固进行封闭,较大的血管和胆管应夹闭或缝合,使用氩气刀喷凝断面止血。术后留置腹腔引流管1~2根。
1.3 随访方式
采用门诊、电话及电子病历等方式进行随访,均为有效随访病例。患者治疗后每3~6个月复查肿瘤标志物、上腹部增强CT或MRI等影像学检查监测复发,随访指标为无瘤生存时间及总体生存时间。无瘤生存时间定义为再次肝切除术后至确诊肝癌再次复发转移的时间,总生存时间定义为再次肝切除术后至患者因肝癌死亡或随访截止的时间。
1.4 统计学分析
使用SPSS 24.0(IBM SPSS)进行全部数据的统计及分析。计量资料以()表示,组间比较采用方差分析;计数资料以例(%)表示,组间比较采用χ2检验。生存时间采用Kaplan-Meier法进行统计。预后影响因素采用Log-rank检验进行单因素分析,并采用Cox风险回归模型进行多因素分析,相对风险比(hazard ratio,HR)描述组间生存资料的差异情况。P<0.05认为差异有统计学意义。
2 结果
2.1 患者临床和病理特点
根据纳入标准和排除标准,笔者通过查阅病历及电话随访等途径收集该队列中所有患者的临床和病理资料,获得的临床数据包括:年龄、性别、术前AFP、术前是否合并HBV感染、术前是否合并肝硬化、复发时间、Child-Pugh分级、肿瘤数量、肿瘤最大径、有无卫星灶、微血管侵犯、分化程度、术后复发及生存情况。比较再次肝切除组、消融组和初次肝切除组的基线资料,结果发现再次肝切除组与消融组和初次肝切除组的基线特征差异均无统计学意义(P>0.05),见表1。
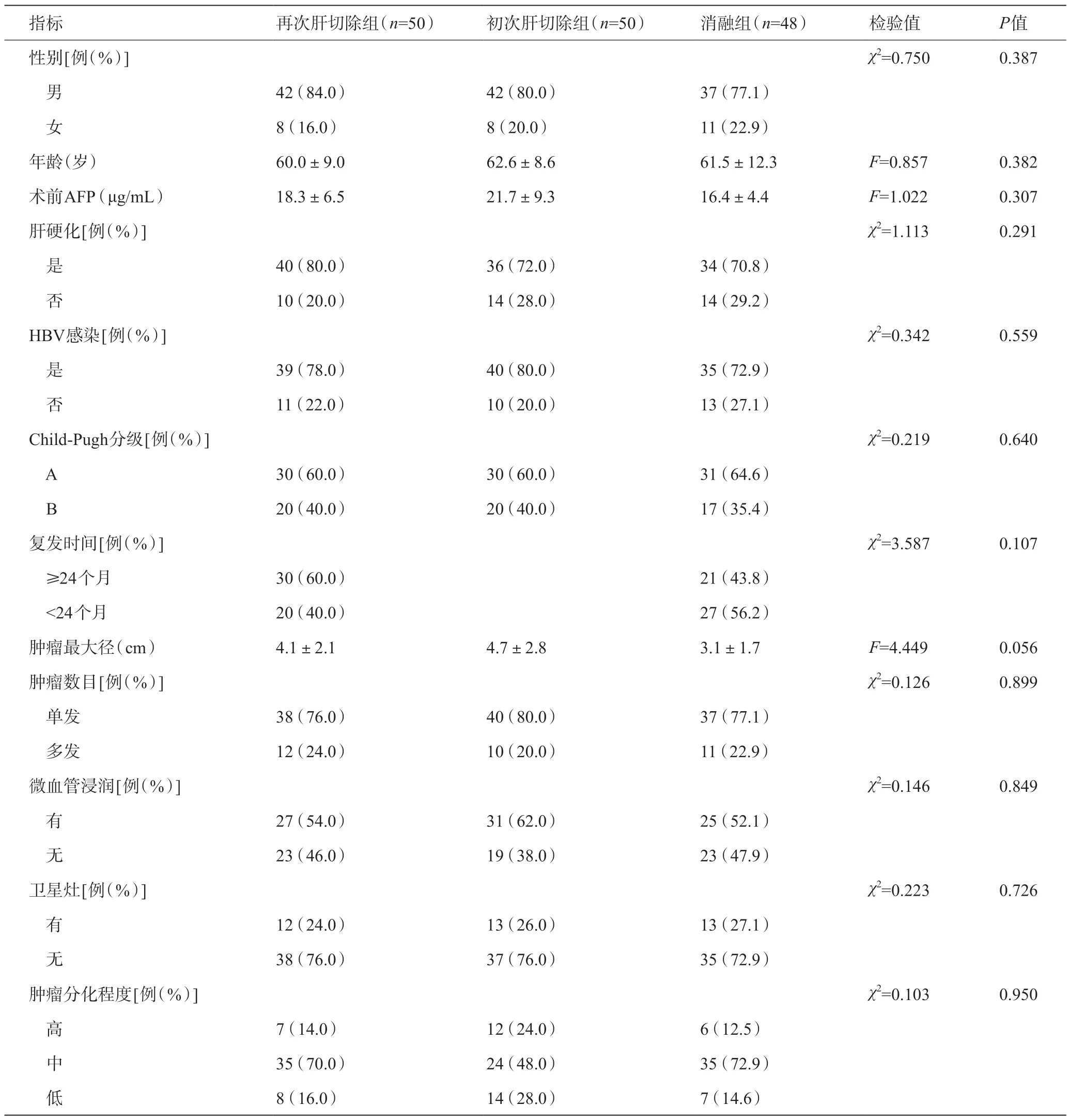
表1 再次肝切除组、初次切除组与消融组肝癌患者的基线特征比较
2.2 再次肝切除组、初次肝切除组与消融组的生存预后
与初次肝切除组比较,再次肝切除组无瘤生存时间(18.5个月vs24.1个月,χ2=0.111,P=0.560)差异无统计学意义,见图1。但与消融组比较,再次肝切除组的无瘤生存时间(18.5 个月vs14.2 个月,χ2=4.403,P=0.040)及总体生存时间(25.8 个月vs21.2个月,χ2=4.487,P=0.032)均更优,见图2~3。
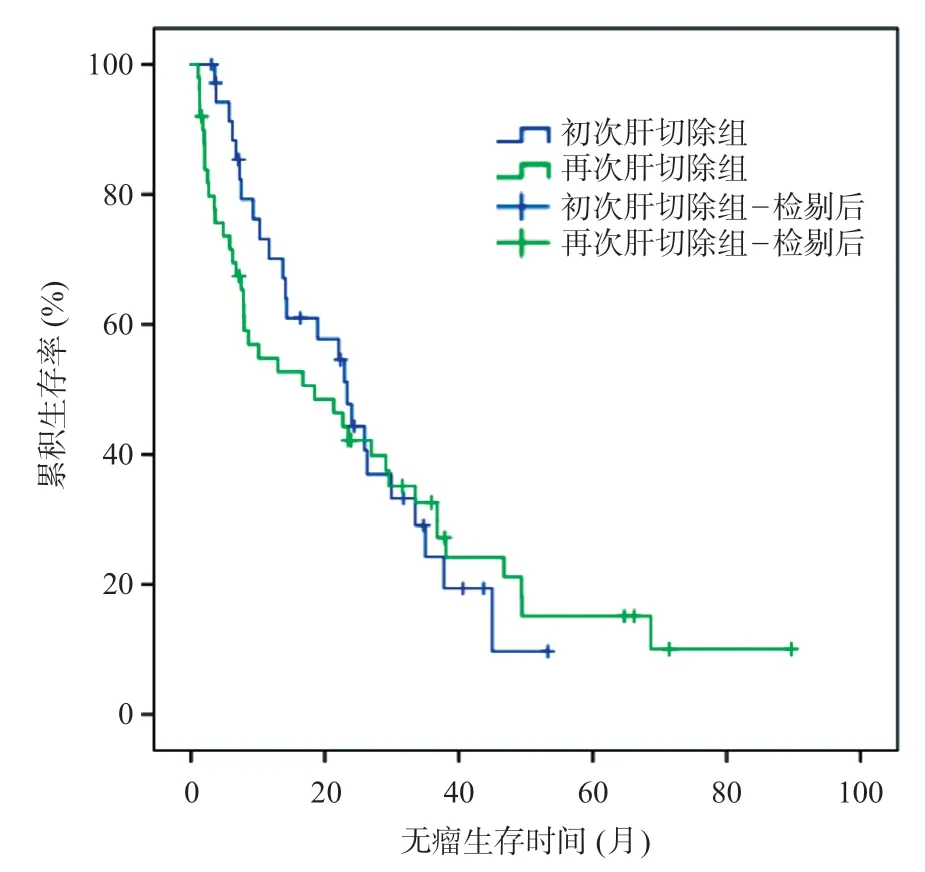
图1 初次肝切除组与再次肝切除组术后无瘤生存曲线
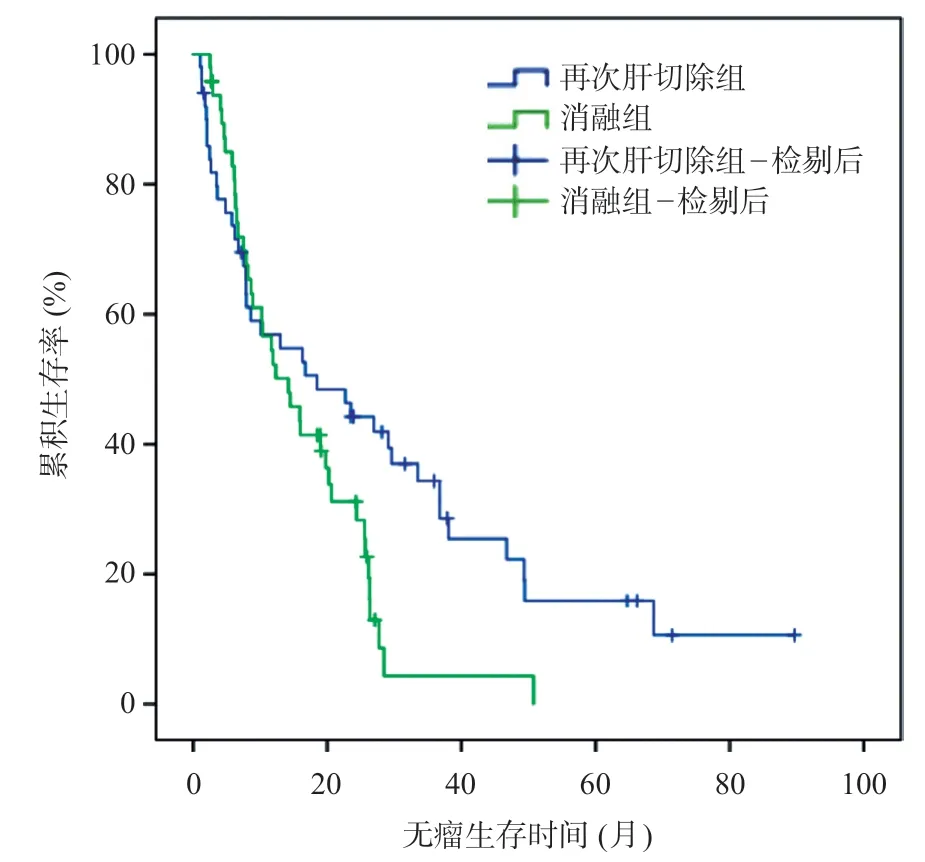
图2 再次肝切除组与消融组的术后无瘤生存曲线
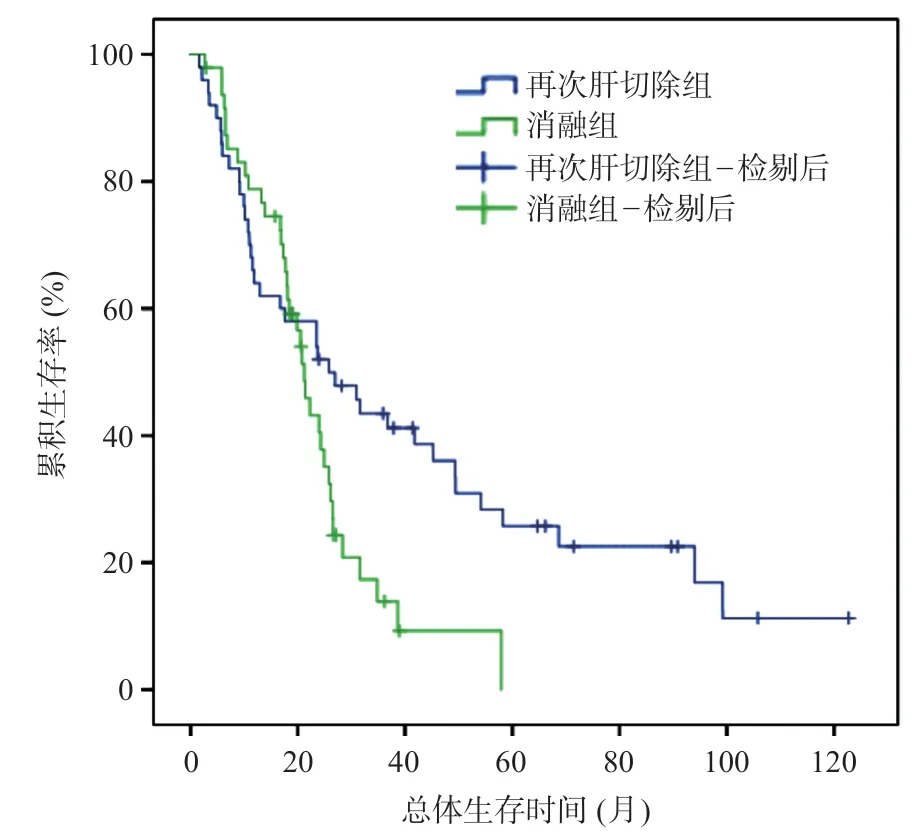
图3 再次肝切除组与消融组的术后总体生存曲线
2.3 再次肝切除组术后肝癌患者生存状态的影响因素
单因素分析结果显示肿瘤复发时间(P=0.021)、有无卫星灶(P=0.022)、微血管侵犯(P=0.033)及肿瘤分化程度(P=0.039)是再次肝切除组无瘤生存时间的影响因素,而Child-Pugh分级(P=0.030)、肿瘤复发时间(P=0.032)、微血管侵犯(P=0.021)是再次肝切除组总体生存时间的影响因素,见表2。Cox多因素分析显示,在肝癌术后复发再次肝切除患者中肿瘤复发时间(P=0.012)、微血管侵犯(P=0.046)及卫星灶(P=0.050)是无瘤生存时间的独立危险因素;Child-Pugh分级(P=0.015)和肿瘤复发时间(P=0.015)是总体生存时间的独立危险因素,见表3。
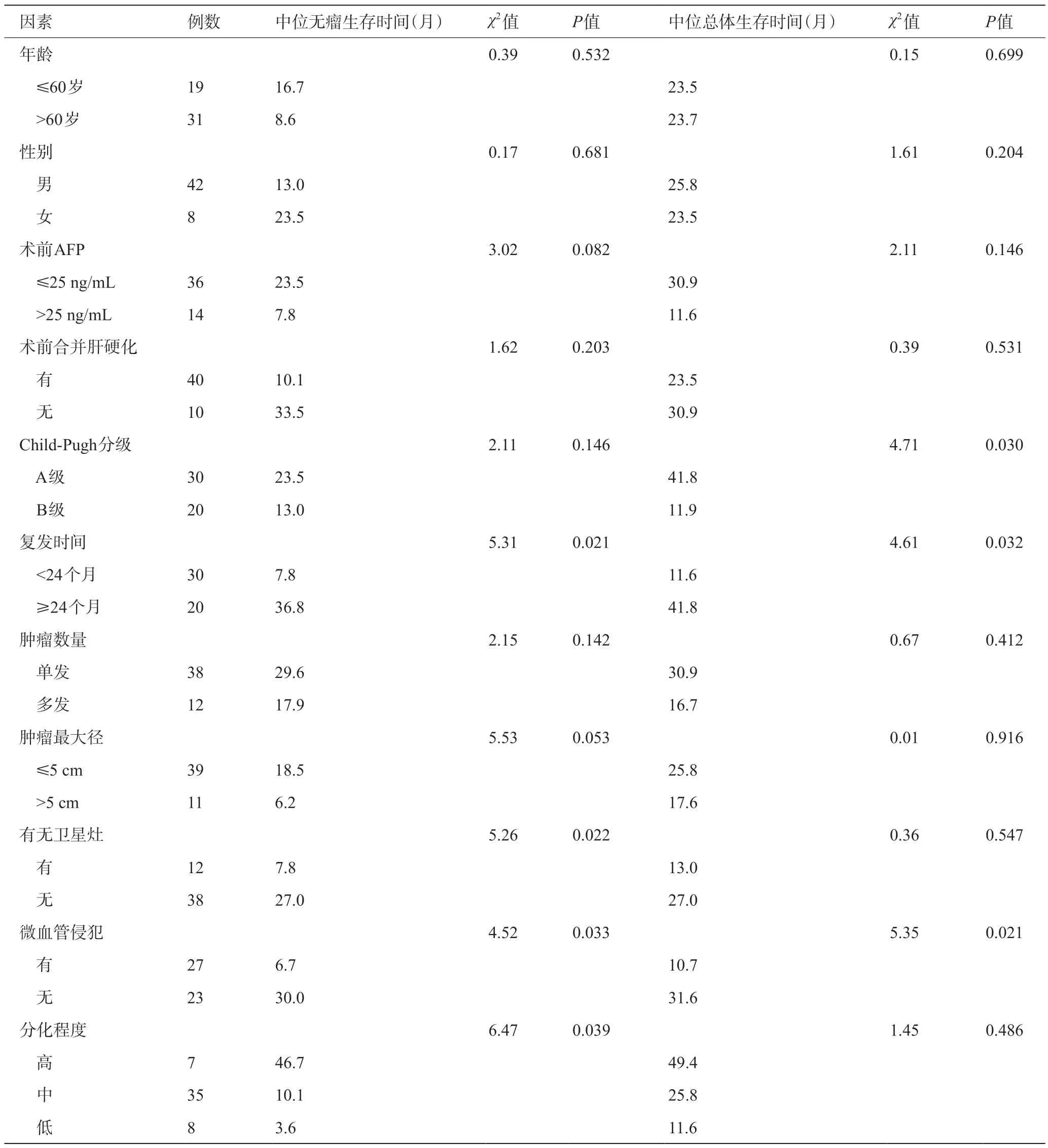
表2 再次肝切除组术后患者生存预后的单因素分析
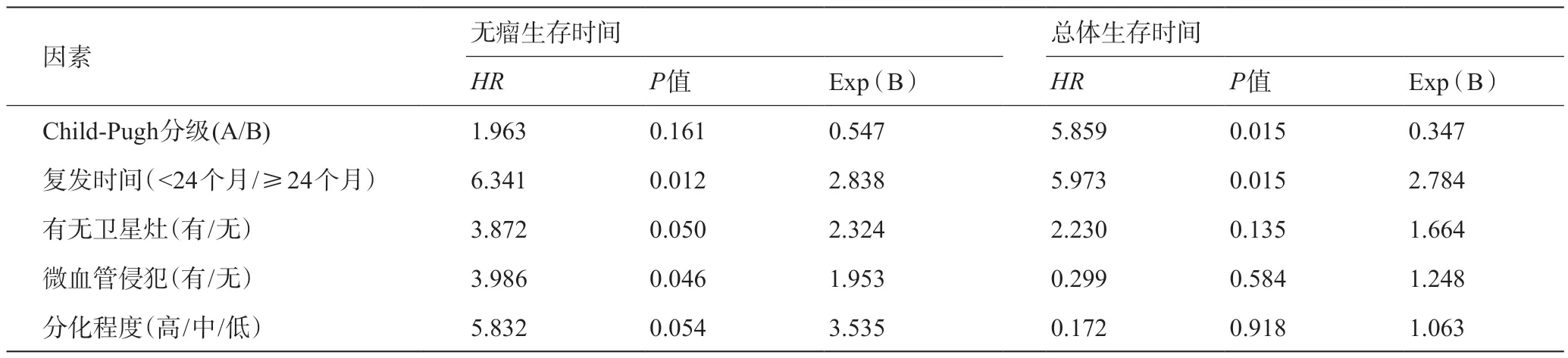
表3 再次肝切除组术后生存预后的多因素分析
3 讨论
肝癌根治性肝切除术后5 年肿瘤复发率高,影响肝癌预后。肝癌复发后的常见治疗策略包括肝切除术、挽救性肝移植等根治性手段和TACE、系统治疗等非根治性手段。再次行肝切除术是临床上最常用的复发性肝癌的根治性治疗手段,并得到一些专家共识的推荐[2]。目前再次肝切除术手术指征的把握主要沿用初次肝切除术的标准,即Chlid-Pugh分级A~B级;PS 0~2分;肿瘤单发或多发数目≤3个,单个肿瘤最大径≤3 cm;无影像学可见的血管癌栓及肝外转移。然而考虑到复发性肝癌患者肿瘤的恶性程度可能更高,肝脏储备功能相对更差等因素,再次肝切除的远期疗效如何,以及如何筛选手术获益更大的人群,仍存在争议。
既往已有研究表明,再次肝切除术与初次肝切除术的患者群体相比,肿瘤复发情况不存在显著差异[3]。本研究基于单中心的肝癌患者数据,纳入了再次肝切除与初次肝切除两组患者,首先对行二次手术的患者前后两次手术的术后无瘤生存期进行Logrank检验并绘制生存曲线,再对初次肝切除和再次肝切除两组患者的术后无瘤生存期加以比较,差异均无统计学意义(P>0.05)。这表明再次肝切除的有效性与安全性和初次肝切除相当,可以作为改善复发性肝癌预后的有效手段。
与肝切除术相比,射频消融具有手术创伤小、术后恢复快等优点,但肿瘤根治效果一直存在争议。尽管研究证实对于肿瘤最大径≤2 cm的原发肝癌患者接受射频消融与肝切除术的预后无明显差异,但复发性肝癌本身的基因异质性决定了其术后复发的风险更高,因此需要更加切实地实现肿瘤根治,但射频消融的疗效存疑。本研究纳入同期临床特征相近的肝癌术后复发行射频消融术的患者,结果发现再次肝切除组的无瘤生存时间及总体生存时间均优于射频消融组,更加证实了肝切除作为复发性肝癌的首选根治措施。
为了探究肝癌复发患者再次肝切除术后生存状况的影响因素,本研究纳入了可能影响肿瘤复发和患者预后的相关因素进行单因素和多因素分析,发现复发时间、微血管侵犯、有无卫星灶及肿瘤分化程度是影响无瘤生存时间的独立危险因素,而经过Cox多因素回归验证后发现以前三者的影响显著。影响总体生存时间的临床病理特征则为Child-Pugh分级、复发时间及有无微血管浸润,经Cox多因素回归验证后证实以前两者的影响显著。即复发时间≥24个月、不存在微血管侵犯和卫星灶者接受再次肝切除术后,无瘤生存时间更长;而Child-Pugh A级及复发时间≥24个月者总体生存时间更长。
目前公认的肝癌复发的发生机制有两种,即与原发灶分子特征相近的单中心起源型和与原发灶分子特征相差较大的多中心起源型,亦可称为“复发”与“新发”。单中心起源者复发肿瘤的分子克隆分型与原发灶更为接近,一般认为是原发灶的微转移灶进展所致;而多中心起源者往往发生于病毒性肝炎、肝硬化等土壤中,重新积累新的致癌突变进而导致新发肿瘤出现[4-5]。一般认为多中心起源型复发肝癌的预后相对较好,且更适合接受再次切除或射频消融等根治性治疗方式[6]。然而明确复发肝癌模式的方法往往基于组织学检测,需获取初次、再次肝切除术两次肝癌组织学样本进行分子克隆检测。这一方法价格相对昂贵,样本获取及保存难度大,临床实际应用较少。既往文献证明肝癌复发模式与复发时间存在明显的相关性,早期复发(<24个月)多为单克隆起源,晚期复发(≥24个月)多为多克隆起源[7-8]。本研究沿用这一结论,并发现复发时间是肝癌复发患者再次肝切除术后总体生存时间和无瘤生存时间的独立危险因素,早期复发者再次肝切除后更易复发,生存期更短,与既往的研究结果一致[9-10]。
除复发时间外,微血管侵犯及对再次肝切除术后疗效的影响亦不容忽视。一般认为单克隆起源者发生肝内转移最重要的病理基础即是肝脏特殊的富血管结构,癌细胞侵犯微血管导致微转移的发生。在本研究中相比微血管侵犯者,无微血管侵犯者的无瘤生存时间及总体生存时间均有所提高(30.0个月vs6.7个月,31.6个月vs10.7个月)。这一结论在Shimada等[11]和Lee等[12]的研究中有相似发现。
综上所述,采用再次肝切除切除治疗复发性肝癌是积极、主动的治疗方法,选择合适的病例会得到良好的效果。然而复发性肝癌再次切除与初次肝切除一样,仍然受到患者的全身状况以及肿瘤的临床病理特征等条件的限制。因此,为了达到最好的治疗效果,应严格掌握手术的适应证。本研究基于单中心的回顾性研究数据,发现肿瘤晚期复发(≥24个月)、不合并微血管侵犯及卫星灶、Child-Pugh A级的患者在接受再次肝切除术后能够收获更好的疗效,这为再次肝切除术手术适应证的把握提供了新的证据。然而被既往研究证实影响再次肝切除术后疗效的AFP水平及肿瘤数目等因素则在本研究中差异未体现出统计学意义。考虑到本文是基于单中心数据的回顾性研究,存在一定的选择偏倚。未来仍需大规摸、多中心的临床试验加以验证。此外,我们亦需关注肝癌复发的分子机制,探索基于临床及分子特征的分型,筛选出最适宜手术切除的复发肝癌患者,实现治疗的精准化、个体化。