3’-羟基紫檀芪抑制胰腺导管腺癌细胞生长的作用及其机制研究
徐黎明,莫佳杰,胡慧巧,方道全,戴以勒,茅叶繁,黄文铅,蒋磊,张启瑜
温州医科大学附属第一医院,浙江 温州 325000,1.肝胆外科,2.中心实验室,3.结直肠外科
胰腺癌是消化系统常见的恶性肿瘤之一,其中起源于胰腺导管上皮的胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)占90%左右。基于当代人不良的生活方式,如高脂饮食、酗酒等,预计在未来PDAC的发病率仍会不断增加[1]。在过去的时间里,人们已经尝试了许多方法来治疗PDAC,如手术、靶向治疗、化疗、放疗以及姑息治疗等[2]。但经统计,患者术后5年生存率仍只有10%左右[1]。其主要原因是大多数PDAC患者在确诊时肿瘤已经发生转移,因此不得不优先考虑采取化疗的治疗方案。然而单一的治疗方式却非常容易使PDAC产生耐药[3],这也就导致了PDAC的难治性。总体来说,目前对于PDAC的治疗结果是不尽人意的,需要寻求新的治疗方法。
3’-羟基紫檀芪(3’-Hydroxypterostilbene,3’-HPT)是苦马豆和紫檀木心的活性成分之一。有研究表明,在结肠癌细胞中,3’-HPT可通过诱导凋亡和自噬,从而有效抑制人结肠癌细胞的生长[4]。机制上,3’-HPT可以通过抑制PI3K/Akt/mTOR信号通路中的p70S6K和p38MAPK信号通路,进而激活ERK1/2,JNK1/2信号通路,从而产生抑制肿瘤生长的效应[4]。此外,也有研究表明3’-HPT能够抑制部分蒽类致癌物引起的小鼠皮肤癌变[5]。以上结果均表明3’-HPT在癌症的治疗方面具有值得探索的前景。
本研究用3’-HPT处理PDAC细胞,探究其在体内外发挥的抗肿瘤作用并探讨其可能的作用机制,为后续在临床上应用3’-HPT治疗PDAC提供实验基础。
1 材料和方法
1.1 实验细胞
PDAC细胞系PANC-1、PaTu8988t购自中国科学院典型培养物保藏委员会细胞库。所有细胞均使用添加了10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的DMEM培养基培养,并按照美国组织培养收藏中心(ATCC)的建议,置于37 ℃、含5% CO2的细胞培养箱中培养。
1.2 主要试剂
3’-羟基紫檀芪(MCE公司,美国);CCK-8试剂(同仁化学研究所,日本);流式细胞凋亡试剂盒、结晶紫染色液、SDS-PAGE预制胶(碧云天生物技术有限公司,中国);蛋白酶磷酸酶抑制剂、蛋白裂解液(北京索莱宝科技有限公司,中国);BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒(Abcam公司,英国);兔抗人AKT抗体、磷酸化AKT抗体、E-cadherin抗体、N-cadherin抗体、Snail抗体(Cell Signaling Technology公司,美国);兔抗人Cleaved Caspase 3抗体、鼠抗人Bcl-2抗体(江苏亲科生物研究中心有限公司,中国);兔抗人GAPDH抗体(武汉三鹰生物技术有限公司,中国);兔抗人Ki-67抗体(武汉塞维尔生物科技有限公司,中国);山羊抗兔荧光二抗-594(Southernbiotech公司,美国)。
1.3 实验方法
1.3.1 细胞活力测定(CCK-8法)消化细胞,将细胞悬液稀释至合适浓度(5×104个/mL),混匀后加至96孔板中,每孔100 μL悬液,每组至少3个复孔,放入37 ℃、含5% CO2的细胞培养箱孵育过夜。采用不同浓度的3’-HPT(1.25、2.5、5.0、10.0、20.0、40.0、80.0 μmol/L)分别对96孔板进行药物处理24 h和48 h后,每孔加入CCK-8试剂(此步骤需避光)。将96孔板置于细胞培养箱中孵育3 h后,用酶标仪测量450 nm处的吸光度(OD值),记录并计算细胞抑制率。根据CCK-8实验结果,确定在后续实验中采用2.5 μmol/L与5.0 μmol/L两个浓度的3’-HPT进行进一步研究。
1.3.2 细胞平板克隆实验 消化细胞,以800个/mL的密度铺入6孔板中,摇匀后放入37 ℃细胞培养箱孵育。待细胞贴壁后,分别加入不同浓度的3’-HPT(2.5 μmol/L、5.0 μmol/L)处理,24 h后换液,随后放入37 ℃细胞培养箱,一周左右换一次液。待细胞长出肉眼可见的集落后用4%多聚甲醛固定、0.1%结晶紫染液染色,而后用PBS缓冲液清洗至液体不变紫。最后将6孔板倒扣晾干,拍照并计数集落个数。
1.3.3 细胞迁移实验 在24孔板底部加入800 μL含20%胎牛血清的DMEM完全培养基,放入小室。收集细胞并计数,将细胞悬液用无血清DMEM培养基稀释至5×104个/mL,混匀后以200 μL分别加入每个小室中,置于培养箱过夜。细胞经3’-HPT处理24 h后用4%多聚甲醛固定,0.1%结晶紫染液染色,PBS缓冲液清洗。最后用尖头棉签拭干小室,拍照记录成功迁移的细胞,计算个数。
1.3.4 细胞凋亡率测定 轻柔收集3’-HPT处理后24 h的PDAC细胞至流式管中,用PBS缓冲液清洗细胞2次。最后一次离心完成后弃去上清,加入500 μL 1×Binding Buffer重悬细胞,然后在避光条件下加入PI(10 μL)与FITC(5 μL)染液并轻柔混匀。避光孵育10 min,用流式细胞仪检测药物处理后肿瘤细胞的早期凋亡率与晚期凋亡率;用FlowJo 10软件处理并统计细胞凋亡率。
1.3.5 细胞免疫荧光实验 将细胞爬片提前洗涤、高压灭菌,放入6孔板;收集细胞并铺板;待细胞贴壁后,加入不同浓度的3’-HPT处理24 h;4%多聚甲醛固定、0.3% Triton X-100破膜、5% BSA封闭;封闭完成后,加入一抗于4 ℃冰箱孵育过夜;在暗室内加入相应的二抗,室温下避光孵育1 h;将含DAPI的抗荧光淬灭剂滴入载玻片中央而后封片;正置荧光显微镜下观察并拍照。
1.3.6 Western blotting实验 收集3’-HPT处理24 h后的PDAC细胞,加入蛋白裂解液(含蛋白酶和磷酸酶抑制剂)裂解细胞,超声破碎提取蛋白。冰上静置10 min,以12 000 r/min、4 ℃离心30 min,取上清液于新的EP管中并做好标记。BCA法测定蛋白浓度,加入5×Loading Buffer并在100 ℃金属浴上变性5 min得到样品。样品经145 V、10% SDS-PAGE预制胶电泳45 min,300 mA恒流湿转30~90 min至PVDF膜上。而后用快速封闭液封闭,分别经指定一抗与相应二抗孵育后,加入ECL化学发光液显影并拍照。
1.3.7 裸鼠皮下移植瘤实验 雄性BALB/c裸鼠(4周龄)购自北京维通利华实验动物有限公司(本研究中的动物实验经温州医科大学动物实验伦理委员会批准)。裸鼠适应饲养1周后,将等量的PANC-1细胞(5×106个)重悬浮于100 μL PBS缓冲液中,然后加入等体积Matrigel基质胶吹匀,于裸鼠右腹部皮下注射接种。约2周后肿瘤成型,将所有裸鼠随机分为对照组和给药组,每组6只。给药组以10 mg·kg-1·d-1的标准(体质量取该组所有裸鼠的平均值)腹腔注射3’-HPT给药,剂量为100 μL;对照组则腹腔注射等体积生理盐水。给药治疗18 d后,处死所有裸鼠,取出肿瘤称重并拍照。
1.3.8 免疫组化分析 将新鲜动物组织切成小块,4%多聚甲醛固定、乙醇逐级脱水、二甲苯透明、浸蜡、包埋、切片,而后进行烘片、脱腊、水化。组织切片经抗原修复后加入内源性过氧化物酶封闭液,于室温下避光封闭30 min,PBS缓冲液漂洗3次后在封闭用山羊血清工作液中孵育10 min。封闭结束后用指定一抗在4 ℃冰箱中孵育(兔抗人Ki-67、Snail、Bcl-2)过夜,而后用相应二抗室温孵育30 min,最后滴加适量辣根过氧化物酶标记工作液,于37 ℃培养箱孵育30 min。经DAB显色、苏木精复染、组织脱水、组织透明后封片。显微镜下观察标本,拍照,按照评分方法评分并记录结果。免疫组化评分方法的计算是将强度得分(阴性=0、弱=1、中等=2或强=3)加上阳性染色细胞的百分比得分(<5%=0,>5%至≤25%=1,>25%至≤50%=2,>50%至≤75%=3,>75%=4)。
1.4 统计学分析
使用Graphpad Prism 8.0 对数据进行统计与分析。所有实验数据均重复3 次以上,数据以()表示,两组比较采用Studentt检验;三组比较采用方差分析,两两比较采用LSD检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3’-HPT抑制PDAC细胞的增殖与集落形成能力
为研究3’-HPT(图1A)对PDAC细胞的作用,我们用不同浓度3’-HPT对PDAC细胞PANC-1 和PaTu8988t处理24 h和48 h后,药物对癌细胞的抑制作用均呈浓度依赖性,浓度达到40 μmol/L以上后趋于稳定(图1B)。计算得出3’-HPT对PANC-1细胞的IC50浓度为4.97 μmol/L,对PaTu8988t细胞的IC50浓度为4.75 μmol/L。我们在后续对3’-HPT的研究中选用2.5 μmol/L与5.0 μmol/L两种浓度进行实验。集落形成实验结果提示3’-HPT明显抑制了PDAC细胞的集落形成能力(图1C)。细胞免疫荧光实验进一步表明,3’-HPT处理后,胰腺导管癌细胞Ki-67指标的平均荧光强度降低,提示3’-HPT抑制PDAC细胞的增殖能力(图1D)。
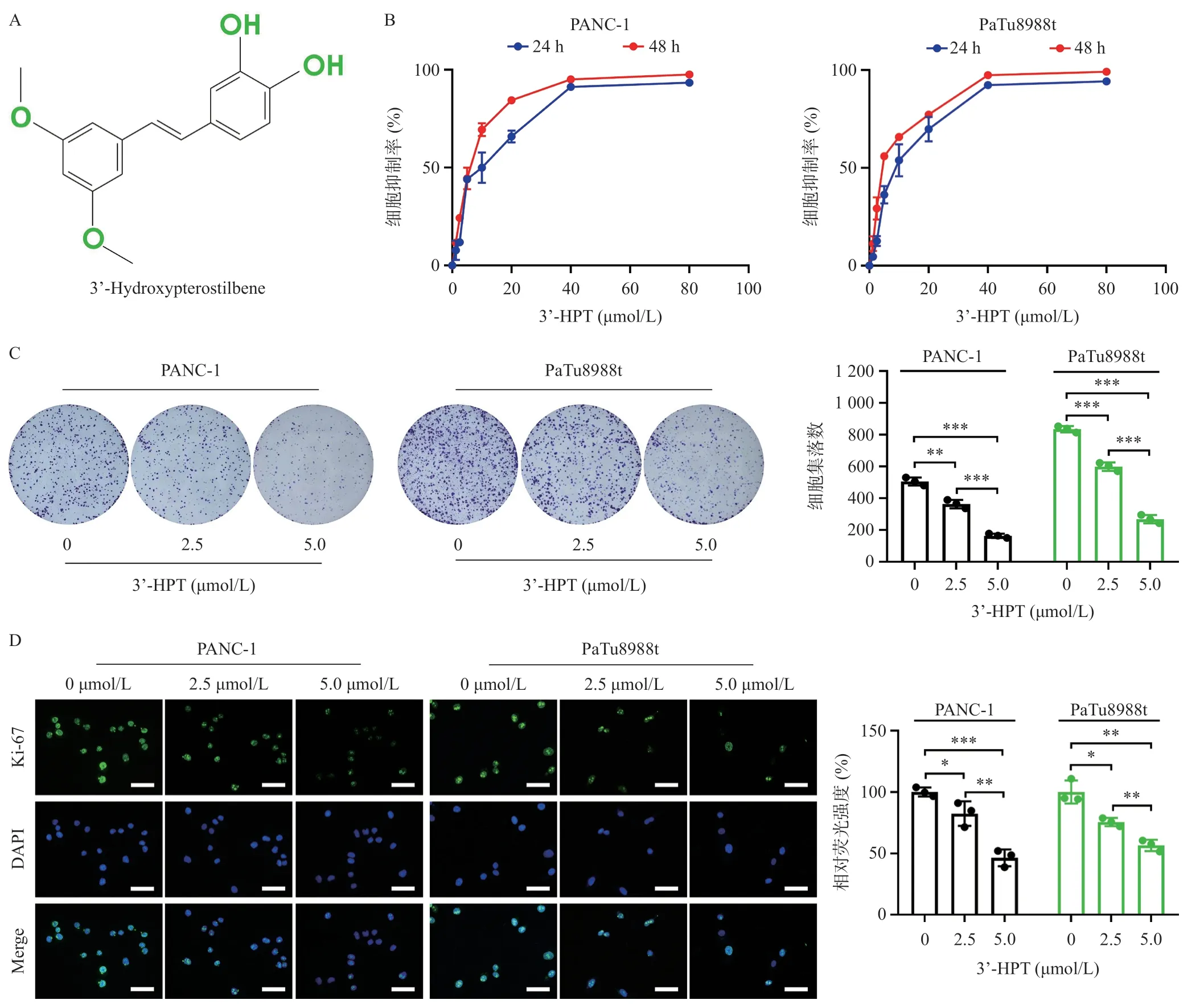
图1 3’-HPT抑制PDAC细胞的增殖与集落形成能力
2.2 3’-HPT抑制PDAC细胞的迁移能力
迁移实验结果提示,用不同浓度的3’-HPT处理PANC-1和PaTu8988t细胞后,两者的迁移能力较对照组均有所下降(图2A);Western blotting结果显示,经3’-HPT处理之后,PDAC细胞中E-cadherin的表达水平升高,N-cadherin与Snail的表达降低(图2B)。免疫荧光实验显示,药物处理后细胞中Snail表达量降低(图2C)。证实3’-HPT抑制胰PDAC细胞的迁移能力。
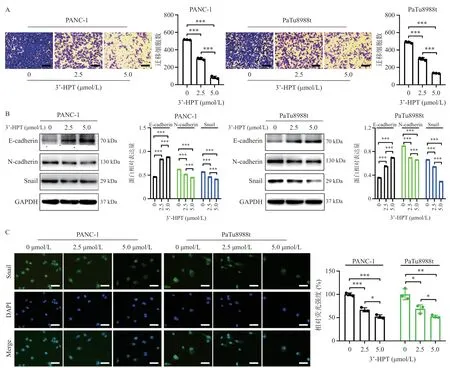
图2 3’-HPT抑制PDAC细胞的迁移能力
2.3 3’-HPT促进PDAC细胞凋亡
为探究3’-HPT是否经凋亡途径对PDAC细胞产生作用,我们在3’-HPT处理两种PDAC细胞后,用流式细胞仪检测活细胞凋亡率。结果显示3’-HPT处理过后PDAC细胞的凋亡率(早期凋亡率与晚期凋亡率之和)明显增加(图3A、3B)。Western blotting与细胞免疫荧光实验结果显示,经3’-HPT处理后,PANC-1 和PaTu8988t细胞中Bcl-2 表达水平降低,Cleaved Caspase 3表达水平升高(图3C、3D)。这些结果均表明,3’-HPT促进PDAC细胞凋亡。

图3 3’-HPT促进PDAC细胞凋亡
2.4 3’-HPT抑制胰腺导管癌细胞异种移植裸鼠模型中的肿瘤生长
从体外实验中我们得出结论:3’-HPT能够通过抑制增殖、集落形成、迁移能力以及促进凋亡来抑制PDAC细胞的生长。由此,我们建立PANC-1细胞的异种移植裸鼠模型为求从体内实验进一步验证。在PANC-1细胞接种2周之后,裸鼠分别接受对照组试剂或3’-HPT(10 mg/kg)处理,给药18 d内两组裸鼠体质量无统计学差异(图4A),从第10天开始,3’-HPT组肿瘤体积逐渐缩小(图4B),差异有统计学意义;给药18 d后3’-HPT组肿瘤组织明显小于对照组(图4C),肿瘤质量也低于对照组(图4D),显示出3’-HPT对胰腺导管癌细胞具有显著肿瘤抑制效应。3’-HPT组肿瘤组织中反映肿瘤增殖能力、迁移能力和肿瘤凋亡的Ki-67、Snail和Bcl-2水平均低于对照组(图4E)。以上体内实验结果均表明,3’-HPT在小鼠体内发挥抑制肿瘤细胞生长的作用。
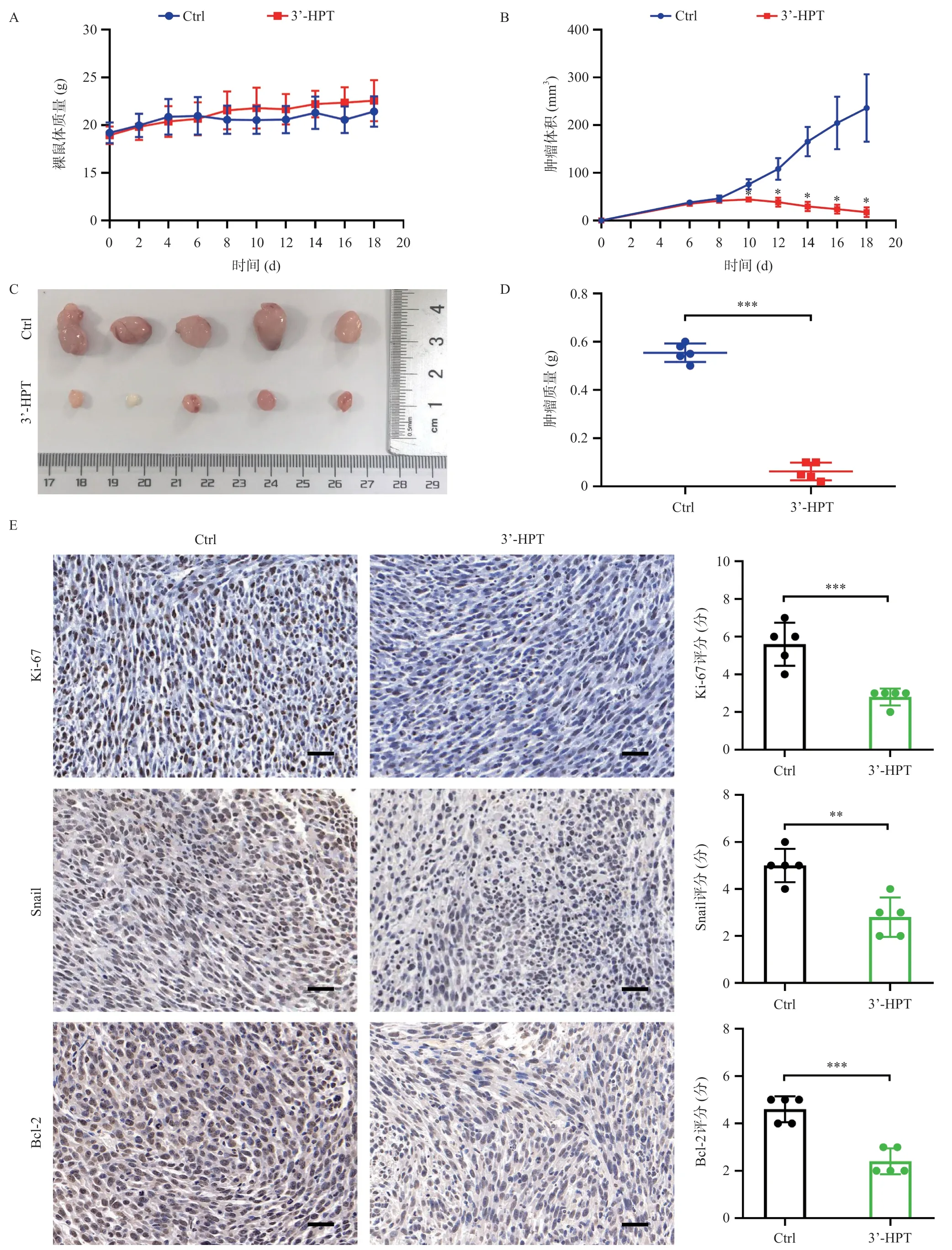
图4 3’-HPT抑制胰腺导管癌细胞异种移植裸鼠模型中的肿瘤生长
3 讨论
胰腺癌是最致命的恶性肿瘤之一,素有“癌中之王”的称号,其特点是诊断晚、易转移、治愈率低且预后差,患者术后五年生存率仅有10%[6]。且在胰腺癌的所有种类中,起源于腺管上皮的胰腺导管腺(PDAC)占90%左右。PDAC的发病率每年以0.5%~1.0%的速度增长,预计到2030年将成为提高美国癌症相关死亡率的第二大原因[7]。大多数癌症患者在晚期表现出非特异性症状,且疾病不适合手术治疗,而目前尚无有效的癌症筛查手段[8]。PDAC的治疗方式包括手术、靶向治疗、化疗、放疗和姑息治疗[9]。但PDAC对大多数疗法都有耐药性,治愈率低、预后差[10-11]。因此,新药的应用可能成为治疗PDAC的一种可行策略。
3’-HPT作为一种天然的紫檀芪类似物,是苦马豆和紫檀木心的活性成分之一。有报道称3’-HPT可以通过下调COX-2和STAT3抑制炎症,也能通过调节PV1 来防止肠道血管屏障破坏,从而有效预防小鼠发生结肠炎[12]。3’-HPT通过抑制PCNA、Cyclin B1和CDK1的表达来抑制DMBA/TPA诱导的小鼠皮肤肿瘤的发生发展[5]。此外,3’-HPT还通过抑制IL-6/STAT3信号通路抑制小鼠结肠炎相关肿瘤的发生[13]。据报道,3’-HPT在分子水平上显著下调PI3K/AKT及丝裂原激活蛋白激酶(MAPK)信号,并且通过诱导细胞凋亡与自噬来抑制结肠癌细胞的生长[4]。最近有研究表明3’-HPT可以通过调节肠道菌群治疗炎症性肠病以及改善非酒精性脂肪性肝病[14-15]。以上结论表明,3’-HPT可在许多疾病中发挥治疗作用。我们的研究首次发现,3’-HPT能够抑制PDAC细胞的生长。CCK-8结果显示3’-HPT可以抑制PDAC细胞生长,具有浓度依赖性与一定程度的时间依赖性。3’-HPT处理可以减少肿瘤细胞的集落数目,这表明3’-HPT能够抑制PDAC细胞的集落形成能力。药物处理后穿过Transwell小室的细胞数减少,且肿瘤细胞内E-cadherin蛋白表达升高,N-cadherin、Snail蛋白表达降低,表明3’-HPT可降低肿瘤细胞的迁移能力。肿瘤细胞经3’-HPT处理24 h后流式细胞仪测得活细胞凋亡率增加,并且细胞内Bcl-2表达降低、Cleaved Caspase 3表达升高,表明3’-HPT促进细胞发生凋亡。细胞免疫荧光实验进一步研究肿瘤细胞Ki-67、Snail和Bcl-2的表达变化,与上述表型实验结果一致。此外,3’-HPT还能显著抑制裸鼠体内PDAC移植瘤的生长。本研究目前仅证明3’-HPT在PDAC中通过抑制细胞增殖、迁移以及促进凋亡来发挥抗肿瘤作用,下一步我们将进行一系列实验来进一步探究3’-HPT抑制PDAC生长的更多机制。综上所述,本研究表明3’-HPT能够抑制体内外PDAC细胞生长,并抑制细胞迁移、促进凋亡。本研究为今后在临床上应用3’-HPT治疗PDAC提供了实验基础。