某污染场地地下水中溶解性有机质组成特征及其自然衰减指示作用
赵萌,姜永海,贾永锋,廉新颖,尚长健,臧永歌,冯帆,3*
1.环境基准与风险评估国家重点实验室,中国环境科学研究院
2.国家环境保护地下水污染模拟与控制重点实验室, 中国环境科学研究院
3.北京师范大学水科学研究院
监测自然衰减(monitored natural attenuation,MNA)是一种利用污染场地天然存在的修复能力来降低污染物浓度,减小污染物总量的地下水污染修复方法,生物降解作用是其中的重要机制[1-2]。应用监测自然衰减技术的场地要制定一系列的监测计划以掌握场地污染羽状态、降解进程和自然衰减能力等,然而目前自然衰减效果的主要评价方法如污染物浓度分析法、水文地球化学指标方法、稳定同位素分析方法和微宇宙实验方法等,均不能快捷高效地识别出已发生的生物降解作用及其微生物活跃程度[3]。
溶解性有机质(DOM)是地下水环境中普遍存在的有机化合物的复杂混合体,它作为碳循环中的重要有机组成成分,在一定程度上反映地下水中有机污染物的来源、形态及微生物代谢能力[4],并且与水化学特征[5-7]及与以生物作用为主的自然衰减过程相关[8-9]。人类活动如垃圾填埋场渗滤液下渗、再生水补给、农业灌溉等均会增加地下水中的DOM 浓度,DOM 中类蛋白等小分子物质可以充当电子供体及微生物的能量来源,从而提高微生物活性,增加微生物代谢能力;DOM 中类腐殖质物质中具有氧化-还原活性的醌类化合物可以促进微生物参与的降解有机物的过程[10-11]。因此,研究地下水中DOM 的结构组成等特征,对阐明有机污染物在地下水中的降解转化过程具有非常重要的意义。
目前针对DOM 结构组成和理化特征研究中,现代光谱技术已得到广泛应用。荧光光谱技术(EEM)可以直观地反映DOM 的荧光信息,应用荧光区域体积积分法(FRI)可以确定DOM 的结构和组成并对其进行半定量分析;红外光谱法(FTIR)可用于确定有机物分子的官能团结构;荧光技术可用于监测水生生态系统中的石化污染物,如对石油残留物浓度进行估算[12],Podgorski 等[13]证明了光学组合技术在评估地下水中石油衍生溶解有机物的自然衰减方面具有一定效用。
笔者将污染羽中的生物降解作用及其微生物活跃程度与DOM 表征相结合,以山东省某污染场地地下水为研究对象,通过分析DOM 组成及结构的空间变化规律,研究DOM 对地下水中有机污染自然衰减进程的指示能力,以期为地下水有机污染自然衰减的识别提供依据。
1 研究区与研究方法
1.1 研究区
研究场地为山东省某退役农药厂生产区,该厂已停产近9年,在产期间主要生产各类农药和氯碱产品,现生产区所有建筑已拆除。该场地位于山前冲积平原,其地形平坦,地表完整。区域气候属于暖温带半湿润季风型大陆性气候,全年平均气温为12.6~13.1 ℃,多年平均降水量为630~654 mm。
场地调查结果显示,研究区域地层可划分为杂填土(0~1.8 m)、粉质黏土(1.8~6.8 m,10.6~14.2 m)、粉土(6.8~10.6 m)和泥质胶结碎石层(14.2 m 以下)。该场地浅层地下水为孔隙水,属于Na-Ca-Cl型,其流向为东北至西南。由于前期调查中发现原备料仓库附近存在污染,故而于该备料仓库与厂房处沿地下水流场方向设置4 个地下水监测井(图1)。
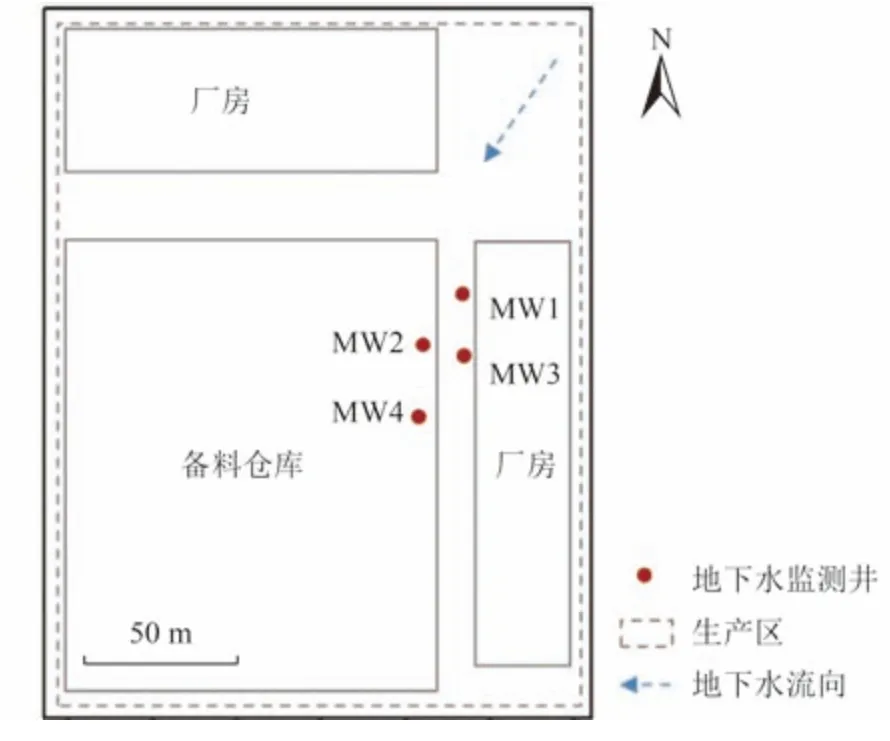
图1 地下水流向及地下水监测井分布Fig.1 Groundwater flow direction and locations of the groundwater wells
1.2 样品采集与分析
1.2.1 地下水样品采集与处理
于2021年10 月采集地下水样品。现场使用便携式多参数测定仪进行水样的常规物理化学指标测试,包括pH、溶解氧(DO)浓度、溶解性总固体(TDS)和氧化还原电位(ORP)。水样经0.45 µm 的玻璃纤维滤膜过滤后置于4 ℃保存,待测。采用离子色谱仪(ICS 2000)测定水质常规离子Na+、Ca2+、K+、Mg2+、Cl-、和浓度;使用总有机碳分析仪测定地下水样品中总有机碳(TOC)浓度;使用EDTA 容量法测定总硬度;使用高锰酸盐法测定耗氧量。依据HJ 639—2012《水质 挥发性有机物的测定 吹扫捕集/气相色谱-质谱法》和HJ 894—2017《水质 可萃取性石油烃(C10~C40)的测定 气相色谱法》的要求采集、测定VOCs 和石油烃(C10~C40)浓度。
采用荧光分光光度计(F-7000)进行DOM 荧光测试,扫描间隔激发波长(Ex)=5 nm,发射波长(Em)=5 nm;三维荧光光谱测试设定Ex 为200~450 nm,Em 为250~600 nm,扫描速度2 400 nm/min;同步荧光光谱测试设定扫描波长为200~450 nm,波长差(Δλ) 为60 nm,扫描速度为240 nm/min。采用傅里叶红外变换光谱仪(Tensor Ⅱ)进行水样有机分子官能团的测试,以透射模式测试,光谱范围为400~4 000 cm-1,扫描次数为16,分辨率为4 cm-1。
采用常用荧光特征参数荧光指数(FI)、生物指数(BIX)、腐殖化指数(HIX)和新鲜度指数(β∶α)分析DOM 的来源及特征。FI 为Ex=370 nm 时,Em 分别在450 和500 nm 处的荧光强度比值。BIX 为Ex=310 nm 时,Em 分别在380 和430 nm 处的荧光强度比值。HIX 为Ex=255 nm 时,Em 分别在434~480与300~346 nm 区域处的积分比值。β∶α为Ex=310 nm 时,Em=380 nm 的荧光强度与Em 在420~435 nm 区间最大荧光强度的比值。
依据HJ/T 164—2004《地下水环境监测技术规范》在采样阶段和实验室分析阶段均采取了相应的质量保证和控制措施,测试误差保证在10%以内,合格率为100%。
1.2.2 DNA 提取与宏基因组测序
在现场使用真空泵及0.22 µm 无菌滤膜将4 L地下水样品进行抽滤,所得滤膜立刻于-80 ℃冷冻保存。使用FastDNA®Spin Kit for Soil 试剂盒(MP Biomedicals,美国) 提取总基因组DNA,使用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′) 和806R(5′-GGACTACHVGGGTWTCTAAT-3′) 对16S rRNA 基因V3~V4 可变区进行PCR 扩增。分别用TBS-380 和NanoDrop2000 测定提取DNA 的浓度和纯度,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。通过非接触式超声波破碎仪(Covaris M220)将DNA 剪切成约400 bp 片段。而后采用NEXTFLEX™ Rapid DNA-Seq Kit 进行PE 文库构建。宏基因组测序采用Illumina 公司的NovaSeq 6000 测序平台进行。
使用Faslp软件(http://opengene.org/fastp/,version 0.20.0)对原始测序序列进行质控,使用Megahit 软件(http://www.I3-bionfo.com/products/megahit/,version 1.1.2)对原始测序序列进行测序数据组装。使用MetaGene(http://metagene.cb.k.u-tokyo.ac.jp/)对拼接结果进行ORF 预测,选择核酸长度≥100 bp 的基因,并将其翻译为氨基酸序列。将所有样品预测出来的基因序列,用CD-HIT 软件(http://www.bioin formatics.org/cd-hit/,version 4.6.1)进行聚类,每个类取最长的基因作为代表序列,构建非冗余基因集。使用Diamond 软件(https://github.com/bbuchfink/dia mond,version 0.8.35)将非冗余基因集序列与 eggNOG数据库(http://eggnog.embl.de/,version 4.5)进行比对(比对类型:BLASTP)。以上数据使用美吉生物云在线平台(www.majorbio.com)进行分析。
1.3 数据处理与分析
根据Chen 等[14]提出的FRI 法,将溶解性有机物的荧光区域分成5 个部分:1)区域Ⅰ,Ex 为200~250 nm、Em 为280~330 nm 的酪氨酸类蛋白区;2)区域Ⅱ,Ex 为200~250 nm、Em 为330~380 nm 的色氨酸类蛋白区;3)区域Ⅲ,Ex 为200~250 nm、Em 为380~550 nm 的类富里酸区;4)区域Ⅳ,Ex 为250~450 nm、Em 为280~380 nm 的溶解性微生物代谢副产物区;5)区域Ⅴ,Ex 为250~450 nm、Em 为380~550 nm 的类腐殖质区。荧光区域体积积分按各区域的有效数据采用离散积分公式进行积分计算,公式如下:
式中: Φi为区域i的荧光体积积分,a.u.·nm2,i为1~5;ΔλEx为激发波长间隔,nm;ΔλEm为发射波长间隔,nm;I(λEmλEx)为荧光强度,a.u.。
分区荧光体积积分占比(Pi)为区域i积分体积占总积分体积之比,计算公式如下:
采用Matlab2020b 软件进行三维荧光光谱图的绘制,运用Excel、Origin2021 软件分析处理数据并绘制相关图件。
2 结果与分析
2.1 场地有机污染分布特征
该污染场地4 个地下水监测井常规水质指标及特征污染物指标如表1 所示。由表1 可见,该场地地下水呈弱酸性,TDS、总硬度和耗氧量较高,主要有机污染物为石油烃、苯和氯乙烯。其中MW1 井有机污染最严重,另外3 个井的有机污染程度相对较轻。
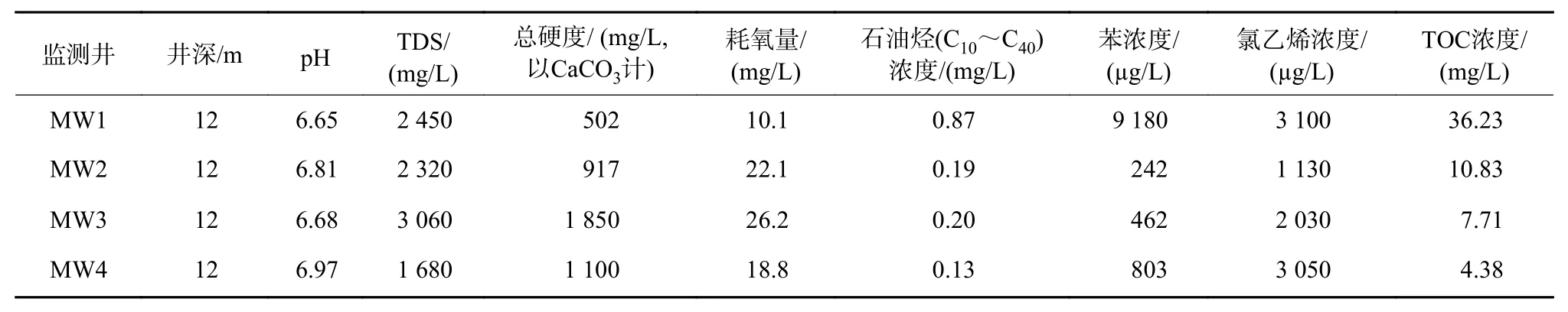
表1 各监测井地下水常规水质指标及特征污染物指标Table 1 Statistical information on the groundwater conventional quality indicators and characteristic pollutant indicators in various monitoring wells
2.2 地下水DOM 的组成特征
为了评估该场地地下水受到有机污染后的微生物作用,对该场地4 个监测井的地下水样品进行同步荧光光谱测试及傅里叶红外光谱测试,研究其DOM 组成特征(图2)。由图2 可知,4 个监测井水样均在波长245~310 nm 存在1 个尖峰,代表类蛋白(酪氨酸)物质;MW1 和MW2 井还在波长200~245 nm 存在1 个尖峰,代表类蛋白(色氨酸)物质。研究表明,随着污染羽在地下环境中的扩散,有机污染降解伴随的氧化还原反应会按序列顺序相继发生[15]。微生物降解过程中,脂肪类等物质会优先被消耗,生成酪氨酸、色氨酸等代谢副产物,但该类物质具有较强的生化性,很容易被微生物利用,在相应微生物和酶的作用下,木质素类等物质会水解并与氨基酸类物质发生缩合形成类腐殖质物质[16]。故而外源有机污染物的输入可造成地下水中酪氨酸、色氨酸物质与类腐殖质物质的增加[17],这解释了同步荧光光谱中存在代表类蛋白物质尖峰的原因。考虑到沉积物会有向地下水中输入类蛋白物质与类腐殖质物质的可能,本研究对相应监测井的含水层沉积物进行了DOM 提取和荧光分析,结果发现沉积物DOM 与地下水DOM 所呈现的光谱信息重合度不高,由此可以判定该场地地下水所呈现的DOM 特征主要源于地下水中有机污染物的降解反应。因此,该场地地下水在有机污染的刺激下,可能存在微生物降解作用生成的酪氨酸、色氨酸等代谢副产物。
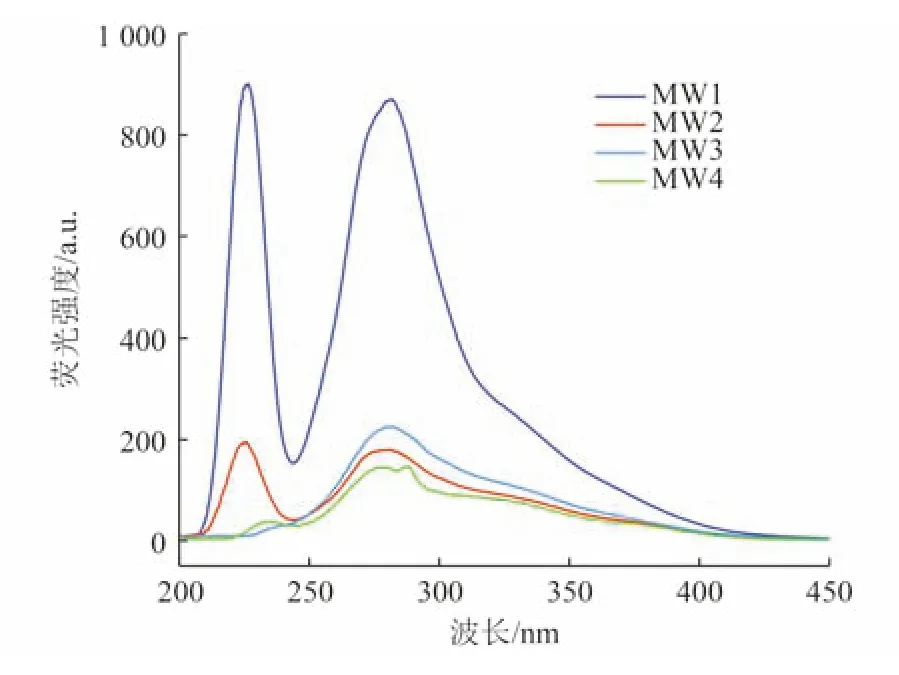
图2 各监测井地下水样同步荧光光谱Fig.2 Synchronized fluorescence spectra of groundwater samples from various monitoring wells
各监测井地下水样品DOM 的傅里叶红外光谱图如图3 所示。4 个监测井DOM 样品的透射峰位置基本一致,分别位于3 258、2 361、2 160、2 029、1 976、1 635 cm-1附近。其中在3 258 cm-1附近出现的宽峰为羟基中的O—H 或氨基中的N—H 伸缩振动[18],在2 361、2 160、2 029、1 976 cm-1附近出现的峰为C≡C 和C= C、C= N 累积双键的伸缩振动,在1 635 cm-1附近的峰为芳香烃的C—C 伸缩振动或N—H 的弯曲振动[19-20]。上述结果表明,该场地地下水在有机污染的刺激下,微生物活动不仅富集了酪氨酸、色氨酸等代谢副产物,还含有大量的腐殖质物质,具有复杂的芳香特性。

图3 各监测井地下水样DOM 红外光谱Fig.3 FTIR spectra of DOM of groundwater samples from various monitoring wells
因该场地地下水涉及的主要有机物包括苯系物和石油烃等属于荧光物质[21-22],故可以通过荧光峰的分布及强度分析有机污染物及降解产物的情况。对4 个监测井的地下水样品进行三维荧光光谱测试,结果如图4 所示。光谱中主要涉及3 个荧光峰,其中心分别位于Ex/Em 为200~230/275~315 nm(C1)、225~250/330~400 nm(C2)和230~260/350~450 nm(C3)处。
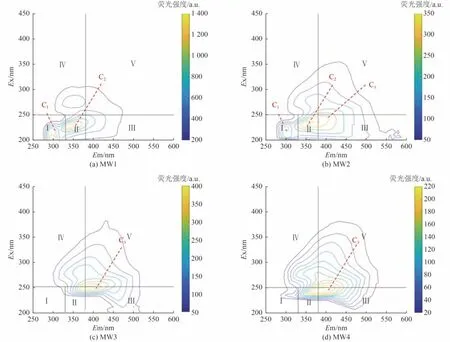
图4 各监测井地下水样三维荧光光谱Fig.4 Three-dimensional fluorescence spectrum of groundwater samples from various monitoring wells
表2 总结了本研究所涉及的有机污染物及降解产物在已有研究中的三维荧光光谱信息。由表2 可知,位于C1处的荧光峰与石油烃及其降解产物有关,位于C2处的荧光峰与石油烃、苯系物和多环芳烃及其降解产物有关,位于C3处的荧光峰与微生物降解作用有关的类腐殖质物质有关。本研究C1和C2处荧光峰的存在说明了地下水在有机污染物的刺激下,发生了微生物降解作用。Mendoza 等[23]研究发现,C3处类腐殖质物质随微生物降解活动的增强而增加,这间接地说明了MW3 和MW4 井同样存在相应的微生物降解作用。

表2 已有研究中部分常见有机污染物及相关降解产物三维荧光光谱信息Table 2 Three-dimensional fluorescence spectral information of some common organic pollutants and related products of degradation in previous researches
相比于其他3 个监测井,有机污染程度严重的MW1 井水样不仅具有较高的荧光强度,荧光峰也主要集中在C1和C2处。MW2~MW4 监测井水样中,MW2 井水样荧光峰除存在于C1和C2处外,还存在于C3处;MW3 和MW4 井水样荧光峰较为集中,主要存在于C3处。这说明在有机污染物的刺激下,微生物降解强度的差异会造成地下水DOM 组成的不同,MW1 井降解有机污染物的作用最强烈,MW3 和MW4 井降解有机污染物的作用相对较弱。
对于有机污染较为严重的MW1 井,C1和C2处代表的污染物及代谢副产物的积累远多于C3处代表的类腐殖质物质的积累。对有机污染程度相对较轻的3 个监测井,MW2 井中污染物及代谢副产物的积累现象均可以观察得到,而MW3 和MW4 井只能观察到C3处代表的类腐殖质物质的积累。这可能是由于C1和C2处代表的物质被进一步转化,且转化速率相比于有机污染物降解产生的代谢副产物的积累速率更高,因此只体现为有机污染物降解作用下的类腐殖质物质的积累。
2.3 地下水DOM 来源及腐殖化程度的荧光参数表征
FI、BIX、HIX 和β∶α是分别用来表征DOM 来源、自生源相对贡献率、腐殖化程度和新生DOM 所占比例的指标。研究区各监测井地下水的FI、BIX、HIX 和β∶α如表3 所示。由表3 可知,各监测井地下水FI、BIX 和β∶α差异较小,FI>1.8,BIX>1,说明各监测井地下水自生源特征较为明显,且有机质为新近产生,生物可利用度较高;HIX<4,说明该地下水属于弱腐殖化特征,MW1 井水样相比于其他3 个监测井水样的DOM 来源则更偏向于微生物活动产生。综上,该场地地下水DOM 主要源自生物作用。
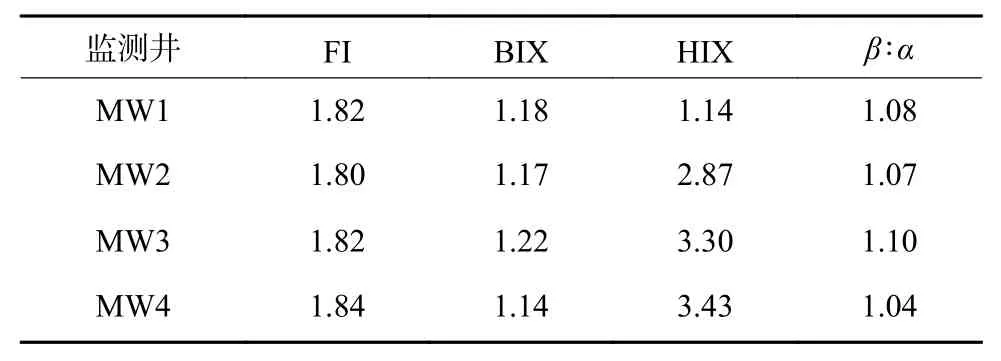
表3 各监测井地下水的FI、BIX、HIX、β∶α 指数描述统计Table 3 Descriptive statistics of FI, BIX, HIX, (β∶α) of groundwater in various monitoring wells
为了进一步评估该场地地下水受有机污染后生物作用下的生物转化程度和腐殖化程度,对该场地4 个监测井地下水样品进行荧光区域积分分析(FRI),结果见表4。根据FRI 法对DOM 荧光区域的划分:Ⅰ、Ⅱ区代表的类蛋白物质可能是微生物代谢产物,也可能是微生物容易利用的小分子有机物;Ⅴ区代表的类腐殖质物质可能是来源于沉积物的溶出及有机物的重组,组成较为复杂,难被微生物所利用[14,29-31]。由表4 可知,4 个监测井水样的荧光分区Ⅲ和Ⅳ所占比例(PⅢ、PⅣ)相差不大,为10.74%~18.68%。荧光分区Ⅰ、Ⅱ、Ⅴ所占比例(PⅠ、PⅡ、PⅤ)有所差异。对微生物降解作用强烈的MW1 井水样而言,PⅠ、PⅡ较高,分别为17.44%和22.42%,PⅤ最低,为29.43%;对微生物降解作用较弱的MW3、MW4 井水样而言,DOM 呈弱腐殖化,PⅠ、PⅡ均较小,分别为0.58%、1.13% 和5.33%、6.91%,PⅤ较大,分别为63.87%、61.54%;而对于微生物降解作用稍弱的MW2 井水样,其PⅠ、PⅡ不及MW1 井水样、PⅤ不及MW3、MW4 井水样。结合2.2 节可知,在地下水有机污染持续存在和长期的微生物作用下,类腐殖质物质总体占比很高,地下水的生物化学性质也相对稳定[32],但随着生物降解作用越来越强烈,以酪氨酸、色氨酸等为代表的类蛋白物质的生成速率会大于转化速率,造成DOM 中类蛋白物质所占比例越来越高。

表4 地下水DOM 三维荧光光谱区域积分结果Table 4 Volume integration results of DOM in different regions of three-dimensional fluorescence spectrum of groundwater
2.4 地下水DOM 对自然衰减能力指示作用
生物降解作用已经被认为是自然衰减过程中相对重要的环节。而微生物作用所导致的地下水DOM 的转换可以在荧光图谱上被直观地表征出来。因此荧光图谱的DOM 信息可以指示地下水中有机污染自然衰减进程。为了进一步明确二者之间的联系,利用水文地球化学指标分析方法与微生物学分析方法辅助判断该场地4 个监测井地下水的自然衰减程度。
2.4.1 水文地球化学指标分析方法评估
地下水中可利用的电子受体包括O2、、Fe3+、和CO2等,而相应的还原产物Fe2+、Mn2+、硫化物和CH4等浓度增加则可以说明发生了污染物的氧化还原降解反应[33],电子受体的消耗及相应还原产物的生成越多,说明污染物自然衰减反应程度越强。一般可关注的水化学指标有、、Fe2+、Mn2+等[34-35]。
本研究中背景值的选取参照前人研究中该区域的水文地质调查资料,背景点位于本研究区地下水上游[36]。根据地下水各监测井水化学指标浓度(表5)分析可知,该场地受有机污染的地下水均处于厌氧微还原环境。相较背景值,4 个监测井地下水的电子受体也处于被消耗的阶段,MW1 井水样的反硝化反应尤其明显。通过水文地球化学指标分析方法辅助判断的各监测井地下水的自然衰减程度应为MW1>MW2、MW3>MW4。
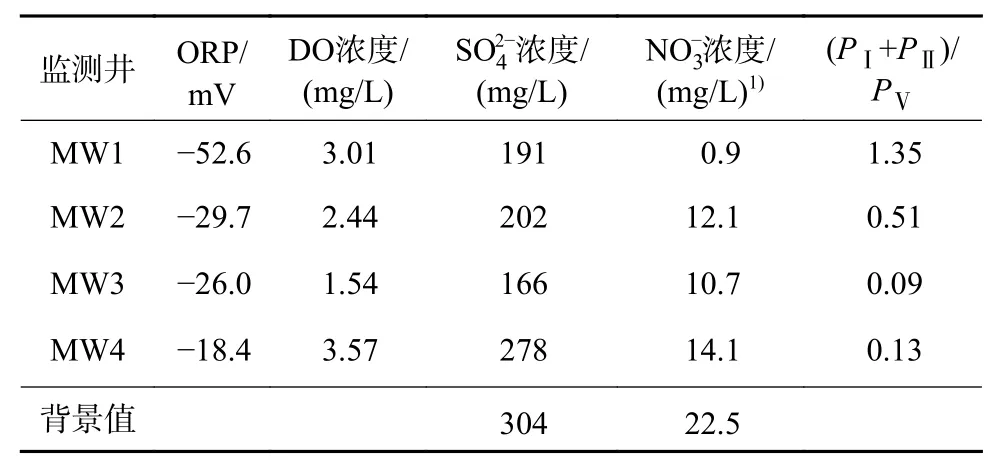
表5 各监测井地下水水化学指标Table 5 Hydrochemistry indexes of groundwater in various monitoring wells
2.4.2 微生物学分析方法评估
土著微生物会视有机污染物为碳源或辅助代谢物而产生定向响应,进而不断消耗输入到地下水中的有机污染物。对于相对厌氧低温的地下环境来说,有机污染物的氧化还原过程依次包括反硝化过程、铁还原过程、脱硫酸过程和产甲烷过程。每一过程均有典型的关键酶存在,微生物相关过程的酶丰度越高,说明污染物自然衰减反应程度越强。根据相关过程的关键酶研究[37-40],挑选出该场地地下水中存在的主要酶,如CoB-CoM 异质二硫化物还原酶(CoB-CoM heterodisulfide reductase)是甲烷生成最后步骤中具有电子传递功能的蛋白复合物;亚硫酸盐还原酶(sulfite reductase)是硫酸盐还原过程中最为关键的功能蛋白之一,可作为用于追踪硫循环的关键分子标志物;硝酸盐还原酶(nitrate reductase)可以催化硝酸盐还原过程的第一步。关键酶丰度情况如图5 所示。
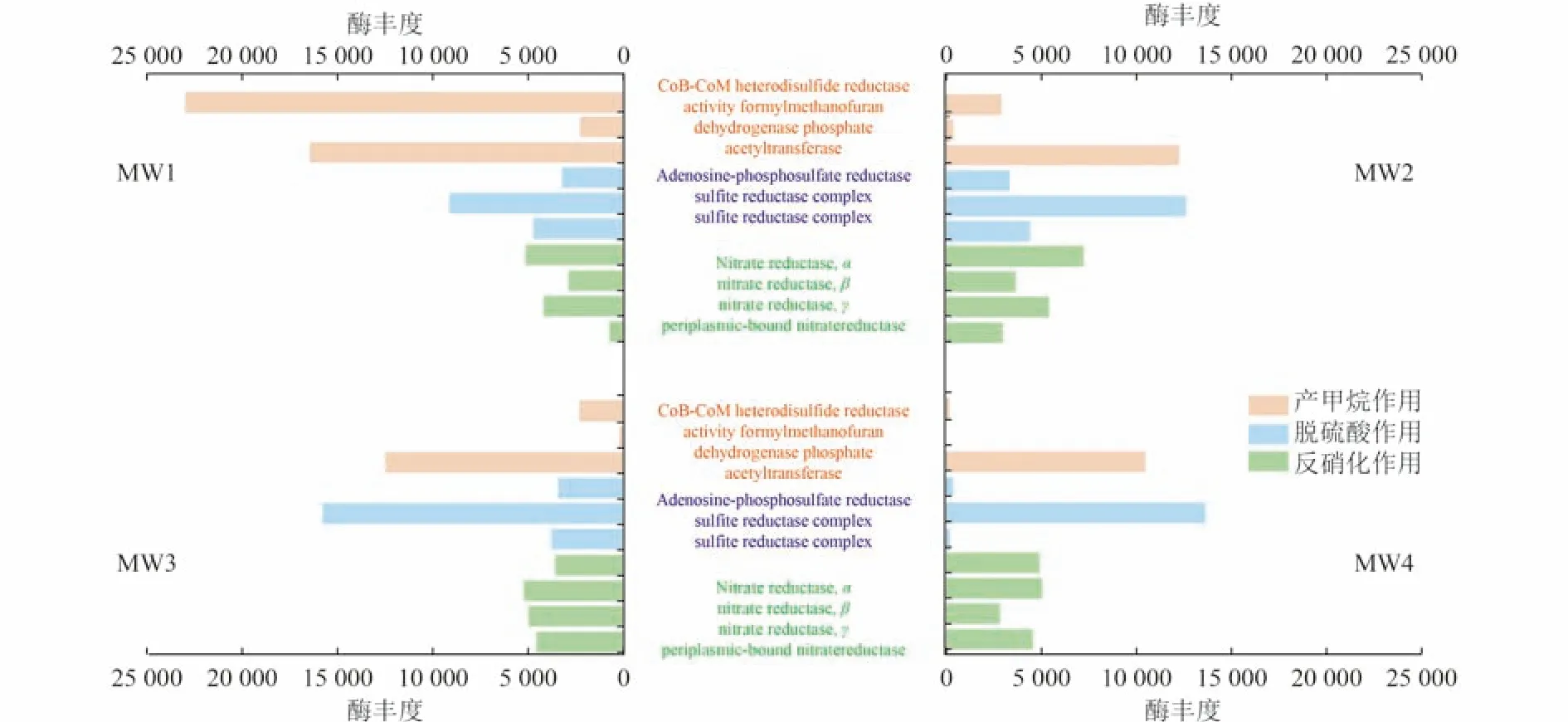
图5 各监测井地下水微生物代谢过程关键酶丰度Fig.5 Abundance of major enzymes in the microbial metabolism process of groundwater in various monitoring wells
由图5 可知,该场地存在3 种地下水氧化还原的主要作用,即反硝化作用、脱硫酸作用和产甲烷作用,且各作用程度有所差异。MW1 井相比于其他3 个监测井产甲烷作用更明显,反硝化作用稍弱,说明MW1 井已完成了以反硝化为主的氧化还原阶段,MW1 井的自然衰减程度最强烈,这与2.4.1 节的分析一致。MW2 和MW3 井相比于MW4 井产甲烷和脱硫酸作用更明显,说明MW2 和MW3 井氧化还原阶段比MW4 井更深入,MW4 井的氧化还原作用仅以反硝化作用为主。通过微生物学分析方法辅助判断的各监测井地下水的自然衰减程度同样为MW1>MW2、MW3>MW4。
基于FRI 分区理论并结合上述水文地球化学指标分析方法与微生物学分析方法的佐证,提出可根据地下水中DOM 于Ⅰ、Ⅱ、Ⅴ区的荧光信息来评价受有机污染的地下水在自然衰减过程中已发生的生物降解作用程度。基于2.3 节中提到的地下水受有机污染后,不同程度生物降解作用下的地下水DOM 于Ⅲ、Ⅳ区的荧光体积积分所占比例(PⅢ、PⅣ)相差不大,于Ⅴ区的荧光体积积分占比(PⅤ)总体很高,于Ⅰ、Ⅱ区的荧光体积积分占比(PⅠ+PⅡ)因生物降解作用的增强而增大,故而可将DOM 于Ⅰ、Ⅱ、Ⅴ区相对含量的比值〔P(Ⅰ+Ⅱ)/PⅤ〕用于评价地下水有机污染自然衰减生物作用效果,结果见表5,即P(Ⅰ+Ⅱ)/PⅤ越大,表明自然衰减生物作用越强。
3 结论
(1)通过探究山东某污染场地地下水DOM 结构组成的变化规律发现,生物降解的作用主要涉及到DOM 中类腐殖质和酪氨酸、色氨酸物质的组分变化,在地下水有机污染持续存在和长期的微生物作用下,DOM 中类腐殖质物质占比相对较高,但随着生物降解作用越来越强烈,以酪氨酸、色氨酸等为代表物质的生成速率会大于转化速率,造成DOM 中类蛋白物质所占比例逐渐升高。
(2)基于FRI 分区理论结合本研究结果,提出可用特定荧光分区相对含量比〔P(Ⅰ+Ⅱ)/PⅤ〕来推断地下水受到有机污染后生物降解的程度,并结合水文地球化学指标分析方法与微生物学分析方法加以论证。P(Ⅰ+Ⅱ)/PⅤ的提出说明可将类蛋白物质与类腐殖质物质的相对含量比作为一种替代指标用于评价地下水有机污染的自然衰减能力。

