Fe0 去除地下水Cr(Ⅵ)过程中的钝化作用及电化学解钝参数优化
彭月,冯艳平,兰伟伟,刘建
西南交通大学地球科学与环境工程学院
Cr 及其化合物被广泛应用于现代工业中,如冶金、制革、化工、电镀等行业领域[1]。含Cr 废物及废水不规范处理带来了环境污染问题,对地下水环境的影响尤为突出[2-4]。如辽宁锦州市某工厂将含Cr(Ⅵ)废水直接外排,造成其下游村落近30%的井水被污染且15%的井水中Cr(Ⅵ)浓度超20 mg/L[5];2011年云南曲靖发生的铬渣非法倾倒事件,对该地区地下水和土壤造成不同程度的污染[6]。《2018 中国生态环境状况公报》[7]显示,全国10 168 个国家级地下水水质监测点中,部分点位Pb 和Cr(Ⅵ)等重金属超标。水体中Cr 主要以Cr(Ⅲ)和Cr(Ⅵ)形式存在,其中Cr(Ⅵ)不仅活泼性和迁移性强于Cr(Ⅲ),毒性也比Cr(Ⅲ)高出约100 倍,进入周围环境会对人体健康构成严重威胁[8]。目前,对于Cr 污染地下水的处理方法,可按原理分为物理处理法、化学处理法、电化学法和生物处理法4 类[9-10]。
零价铁(Fe0)具有来源广泛、价格低廉、生态风险小和还原性强(E0=-0.44 V)等特点,常作为可渗透反应墙(PRB)中的活性介质,用以处理铬污染地下水。但使用Fe0-PRB 修复Cr 污染地下水的过程中,因Fe0活性表面易被氧化形成氧化膜,或被修复过程中产生的沉淀层覆盖从而产生钝化,极大降低了其修复效率,限制了Fe0技术在地下水修复领域的应用[11-12]。为了延缓或解除Fe0在修复污染地下水中发生的钝化现象,国内外学者进行了大量解钝方面的尝试,如酸洗[13]、超声处理[14]、弱磁场[15]、双金属体系[16-17]等,但这些处理技术存在费用较高、工作量大、原位修复可操作性不强等问题[18]。电化学方法流程简单、具备原位解钝Fe0的优势,成为近年来的研究热点[19]。万龙等[12]通过对Fe0-PRB 柱两端直接施加低直流电压的方法,提高了Fe0去除Cr(Ⅵ)的能力,在一定程度上解决了Fe0钝化问题;卢欣[18]引入连续多次电化学解钝操作,将Fe0-PRB 系统对Cr(Ⅵ)的去除率恢复至未钝化前的100.4%~131.3%,使用寿命延长了55.4%~118.3%。
综上可知,电化学方法显示出了良好的解钝潜力,但目前研究尚存在内部解钝不彻底和解钝操作的适宜条件尚未探明等问题。为此,笔者将铁屑作为电极以提高Fe0内部的解钝效果,设置不同电解电压、电解时间和电极距对比试验,探讨适宜的操作参数,以期为优化解钝工艺、提高Fe0利用率提供参考。
1 材料与方法
1.1 试验材料
试验试剂:工业铁屑(粒径2~3 mm,巩义市龙鑫净水材料厂),盐酸(分析纯),1 000 mg/L 单元素国家标准溶液(Fe、Cr),重铬酸钾(优级纯),丙酮(优级纯),二苯碳酰二肼(优级纯),高锰酸钾(优级纯)。
试验设备:恒温培养振荡器(HNY-100D,天津市欧诺仪器仪表有限公司);原子吸收分光光度计(SP-3803AA,上海光谱仪器有限公司);紫外可见分光光度计(UV-1800,日本津岛公司);电子天平(XB622,上海精科天美贸易有限公司);真空冷冻干燥机(FD-1A-80,江苏天翔仪器有限公司);X 射线衍射仪(X’PertPRO,荷兰帕纳科公司);X 射线光电子能谱仪(Thermo Scientific K-Alpha+,赛默飞世尔科技公司);直流稳压电源(MS305D,迈豪电子科技有限公司)。
1.2 试验方案
Fe0经预处理后与Cr(Ⅵ)进行反应,使Fe0表面发生钝化;之后采用电化学法对其进行解钝;然后用解钝后的Fe0再次进行Cr(Ⅵ)去除试验,研究钝化的Fe0经电化学解钝后对Cr(Ⅵ)去除效果的恢复情况。试验流程见图1。

图1 电化学解钝作用试验流程Fig.1 Test flow chart of electrochemical depassivation action
1.2.1 Fe0的预处理
称取一定量的铁屑,用0.1 mol/L 的稀盐酸浸泡2 h 后,用丙酮洗涤以除去铁屑表面氧化层、油污、可能吸附的有机物及其他杂质,再用去离子水充分洗涤至中性,备用。
1.2.2 Fe0的钝化
用重铬酸钾配制1 000 mg/L 的Cr(Ⅵ)溶液。将配制好的Cr(Ⅵ)溶液稀释至10 mg/L,量取100 mL,加入预处理后的铁屑(1.0 g),在振荡速度为200 r/min 的振荡器中进行反应,单次反应时长为8 h,反应过程中每间隔一定时间,取反应液上清液2.5 mL 测定Cr(Ⅵ)浓度,并计算其去除率。Cr(Ⅵ)的去除率(Re)计算公式下:
式中:Ct为t时刻溶液中Cr(Ⅵ)浓度,mg/L;C0为溶液初始的Cr(Ⅵ)浓度,mg/L。
Fe0在上述Cr(Ⅵ)溶液中反应8 h 后,取反应后的Fe0重新加入到100 mL 浓度为10 mg/L 的Cr(Ⅵ)溶液中再次进行反应,重复此操作直至获得需要的钝化铁屑(P-Fe):当Cr(Ⅵ)的去除率为75%±3%时获得的为低钝化程度铁屑,记为LP-Fe;当Cr(Ⅵ)的去除率为45%±3%时获得的为高钝化程度铁屑,记为HP-Fe。
1.2.3 电化学解钝之电极影响试验
将P-Fe 放入16 目圆柱形的筛网中,以石墨棒作为单侧电极,另一侧电源则直接施加在铁屑上进行解钝试验,解钝后的铁屑记为EP-Fe。为了探讨P-Fe 作为不同电极时的解钝效果,共设置3 组试验,分别将P-Fe 作为阳极、阴极和交叉电极(表1)。

表1 电极影响试验分组Table 1 Experimental grouping of electrode influence
1.2.4 电化学解钝之参数优化试验
先采用单因素试验分析各因素的关注区间,再利用正交试验获取最优条件参数。
单因素试验:Na2SO4是一种强电解质,同时又具有较好的稳定性,常在电化学试验中作为电解质溶液。张金梦[20]在使用电化学法强化Fe0还原地下水中Cr 的研究表明,当水样中添加0.8 g/L 的Na2SO4时,进行电化学所消耗的能量较少。因此,本文确定以0.8 g/L 的Na2SO4作为电解质溶液,设置电解电压、电极距、电解时间的单因素试验,其中电解电压取5、10、20、30 V,电极距取2、4、6、8 cm,电解时间取5、10、30、60 min。
正交试验:基于单因素试验结果,设置L9(34)正交试验以进一步获取最优参数,其中电解电压取5、10、20 V 3 个水平,电极距取2、4、6 cm 3 个水平、电解时间取10、30、60 min 3 个水平(表2)。
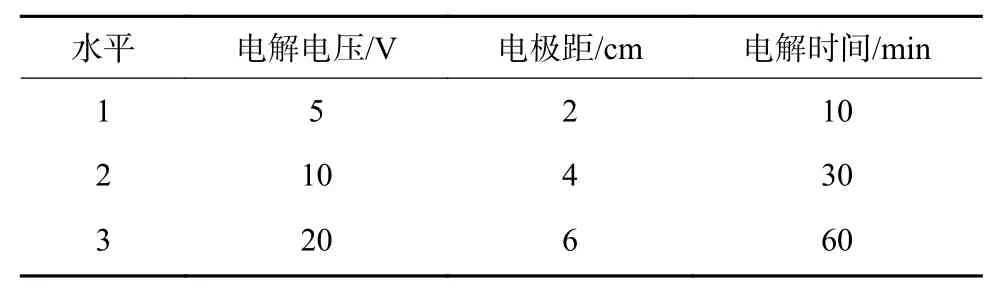
表2 正交试验因素水平Table 2 Factor level table of orthogonal test
为考察加入电场解钝的同时是否会导致Cr 和Fe 重新释放而引入新的污染问题,以正交试验获取的最优条件对P-Fe 进行解钝,测定P-Fe 在有无加入电场解钝的过程中电解液的Cr 和Fe 浓度。以未加入电场解钝为对照组,加入电场解钝为试验组。
1.3 分析及表征方法
溶液中Cr(Ⅵ)浓度〔CCr(Ⅵ)〕采用二苯碳酰二肼分光光度法测定,总Cr 浓度(CTCr)采用高锰酸钾氧化-二苯碳酰二肼分光光度法测定,总Fe 浓度(CTFe)采用原子吸收分光光度法测定。溶液中Cr(Ⅲ)浓度〔CCr(Ⅲ)〕为CTCr与CCr(Ⅵ)的浓度之差。
Fe0晶体结构、元素价态及形貌测定:采用X 射线衍射仪(XRD)分析固相的晶体结构,采用X 射线光电子能谱仪(XPS)分析固相中元素价态,采用扫描电子显微镜(SEM)分析固相的形貌特征。
2 结果与讨论
2.1 Fe0 去除Cr(Ⅵ)过程中的钝化作用
为获得不同钝化程度的P-Fe,用Fe0对Cr(Ⅵ)进行连续重复去除试验(单次反应时间为8 h),Fe0去除Cr(Ⅵ)的过程中去除率随反应时间的变化如图2 所示。随着反应的进行,Fe0对Cr(Ⅵ)的去除率不断降低。首次反应后Cr(Ⅵ)的去除率为98.9%;当重复至第3 次时,去除率为75.5%,此时得到LPFe;当重复至第6 次时,去除率为45.2%,此时得到HP-Fe。Fe0对Cr(Ⅵ)的去除主要为还原和吸附共沉淀作用。在Cr(Ⅵ)还原为Cr(Ⅲ)过程中,Fe0被氧化生成Fe(Ⅱ)和Fe(Ⅲ),溶液中的铁离子和Cr(Ⅲ)可单独反应形成氢氧化物沉淀,或共同作用形成铁铬水合物、铁铬氧化水合物共沉淀,相关反应见式(2)~式(6)[21-22]。这些沉淀吸附在Fe0表面形成钝化层阻碍Cr(Ⅵ)与Fe0的接触,导致去除率逐步下降。
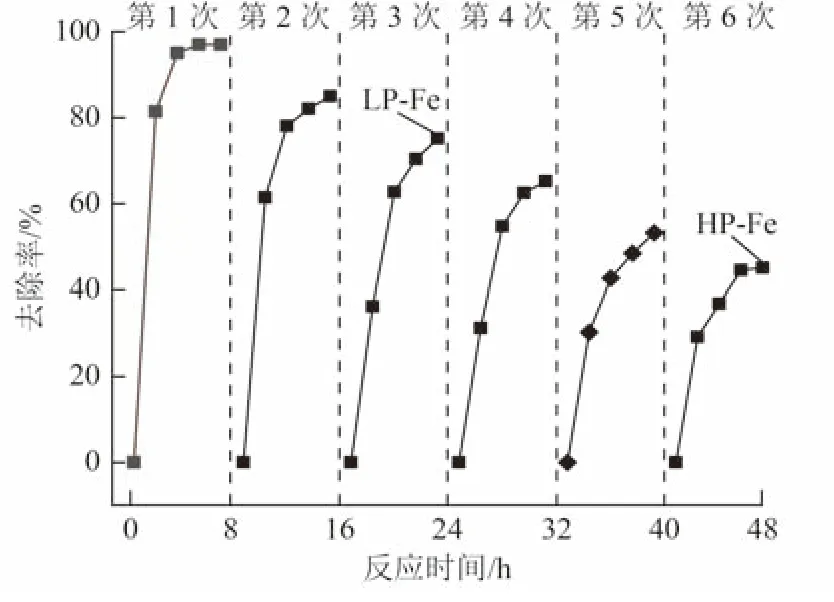
图2 Fe0 去除Cr(Ⅵ)的过程中去除率随反应时间的变化Fig.2 Variation of removal rate of Fe0 to remove Cr(Ⅵ) with reaction time
2.2 电极设置对P-Fe 解钝效果的影响
以P-Fe 为不同电极对解钝效果的影响如图3 所示。以P-Fe 分别作为阳极、阴极、交叉电极进行电化学解钝,Fe0的活性都得到了一定程度的恢复,其中以P-Fe 作阳极时所产生的效果最佳,其解钝效果相比作阴极时提高了13%。阳极金属失去电子产生铁离子,导致铁电极微孔的出现及加深,改变了铁表面性质,增加Fe0表面的活性位点,同时铁离子的溶出使得覆盖在Fe0表面的钝化层部分或全部脱落。当P-Fe 作阴极时,铁材料附近表面会产生H2,气泡的析出对Fe0表面的钝化层具有一定的剥落作用〔式(7)和式(8)[18,20]〕。Melitas 等[23]研究发现,铁表面活性位点的数量和活性不是固定的,取决于铁材料的特征和溶液电位,而将Fe0作为阳极时改变了溶液电位,增加了Fe0表面的活性位点。
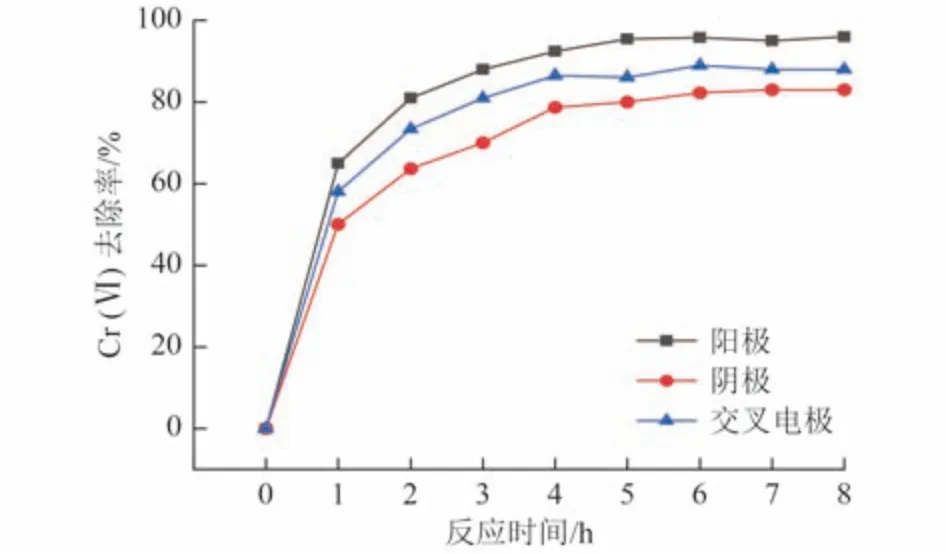
图3 P-Fe 作为不同电极对解钝效果的影响Fig.3 Influence of P-Fe as different electrodes on the depassivation effect
2.3 电化学解钝机理探讨
对预处理铁屑、P-Fe 和EP-Fe 进行XRD、SEM和能谱(EDS)表征分析,结果如图4 和图5 所示。从图4 可知,预处理铁屑只有Fe0的衍射峰;P-Fe 中出现了Cr2O3、Fe3O4和FeO 的衍射峰,表明此时铁屑表面已经被氧化且有含Cr 晶体沉积;上述氧化物或沉积物在经解钝处理后获得的EP-Fe 中衍射波峰变弱或者消失,表明铁屑表面的氧化物或沉积物已与铁屑主体基本剥离。但EP-Fe 显示仍存在铁氧化物的衍射峰,可能是含铁氧化物未完全脱落所致,这对后续Cr(Ⅵ)的去除会产生一定影响。图5 显示,预处理后的Fe0表面粗糙呈沟壑状;P-Fe 出现了一些非晶态絮状物,部分沟壑被丝状的铁铬氧化物所占据;EP-Fe 相对于P-Fe 表面沉淀更少、更加粗糙,从而更具有反应活性。EDS 分析表明,P-Fe 中富含Fe(45.48% ) 、O (37.64% ) 、Cr (16.88% ) 元素,EP-Fe 中含有Fe(78.60%)、O(21.27%)元素及少量的Cr(0.13%)元素,印证了通过电化学解钝后的P-Fe 表面沉淀得到了大部分去除的结论。
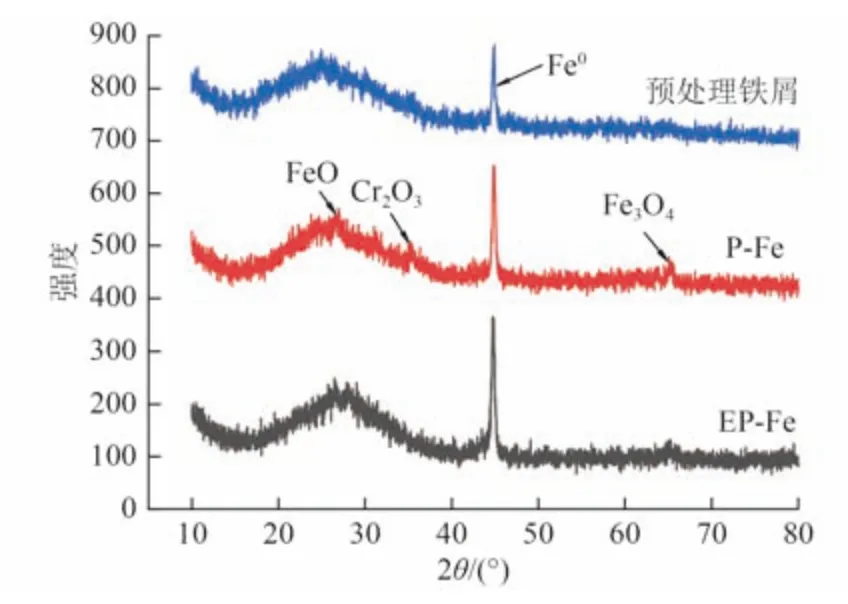
图4 Fe0 的XRD 图Fig.4 XRD pattern of Fe0

图5 Fe0 的SEM-EDS 谱图(10 000 倍)Fig.5 SEM-EDS spectrum of Fe0(10 000 times)
2.4 电化学解钝参数优化
2.4.1 单因素试验
2.4.1.1 电解电压的影响
不同钝化程度的P-Fe 在不同电解电压下解钝后对Cr(Ⅵ)的去除率变化如图6 所示。LP-Fe 与HP-Fe经不同电压解钝后其活性均得到了一定的恢复,其中HP- Fe 恢复效果更佳。以电极距为2 cm、电解时间为30 min、电解电压为10 V 为例,LP-Fe 解钝后8 h 内对Cr(Ⅵ)去除率由未解钝前的75.5% 提升至92.5%,而HP-Fe 解钝后对Cr(Ⅵ)的去除率由未解钝前的45.2%提升至85.2%,这表明电化学对Fe0钝化部分具有较好的解钝效果。
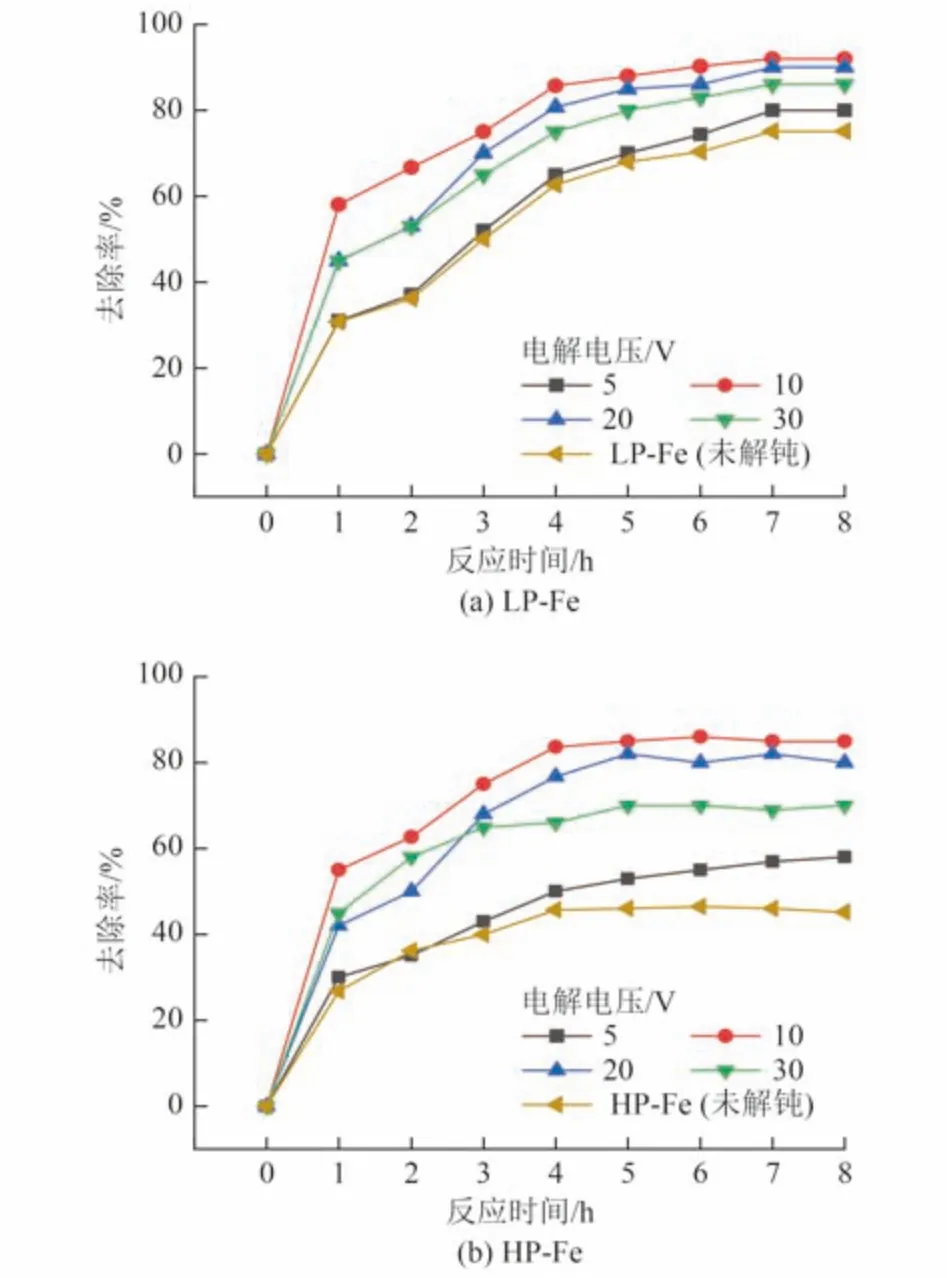
图6 不同钝化程度的P-Fe 在不同电解电压下解钝后对Cr(Ⅵ)的去除率Fig.6 Cr(Ⅵ) removal rate of P-Fe with different degrees of passivation after depassivation at different electrolytic voltages
以HP-Fe 为例,在电极距为2 cm、电解时间为30 min 时,电解电压从5 V 提升到10 V,EP-Fe 在8 h 内对Cr(Ⅵ)的去除率从58.2% 提升至85.2%;然而,当电解电压进一步增大为30 V 时,EP-Fe 对Cr(Ⅵ)的去除率下降了15.2%。这表明在未到达某个合适的电解电压前,解钝效果随电解电压增大而上升;在达到合适电压后,解钝效果随电解电压增大而降低。
同时,在电化学解钝的过程中,随着电解电压的增大,阳极附近可观察到少量的气泡产生,可能是因为在电解过程中,阳极附近发生了如式(9)所示的化学反应,产生的O2使阳极的Fe0发生氧化[24],进而抑制了EP-Fe 对Cr(Ⅵ)的去除效果,这与陈亮[25]在用电化学对Fe0去除三氯乙烯时所观察到的现象一致。此外,当电解电压过高时可能会导致Fe0电解过度,从而导致Fe0的大量消耗,不利于Fe0对Cr(Ⅵ)的高效去除。基于上述结果,选取电解电压为5~20 V 进行正交试验。
2.4.1.2 电极距的影响
不同钝化程度的P-Fe 在不同电极距下解钝后对Cr(Ⅵ)的去除率变化如图7 所示。P-Fe 的解钝效果随电极距增大而降低,但LP-Fe 与HP-Fe 的解钝效果受电极距的影响都不大。以HP-Fe 为例,在电解电压为10 V、电解时间为30 min 时,电极距从2 cm 增至8 cm 时,EP-Fe 在8 h 内对Cr(Ⅵ)的去除率从85.2% 下降至78.3%,这是因为较大的极板距离会导致较高的电阻产生,从而影响电化学解钝的效果。张金梦[20]用电化学法强化Fe0去除地下水中的Cr(Ⅵ)试验中,当电极距从8 mm 增加到15 mm 时,去除效率下降了4.58%,与本研究结论一致。基于上述结果,选取电极距为2~6 cm 进行正交试验。
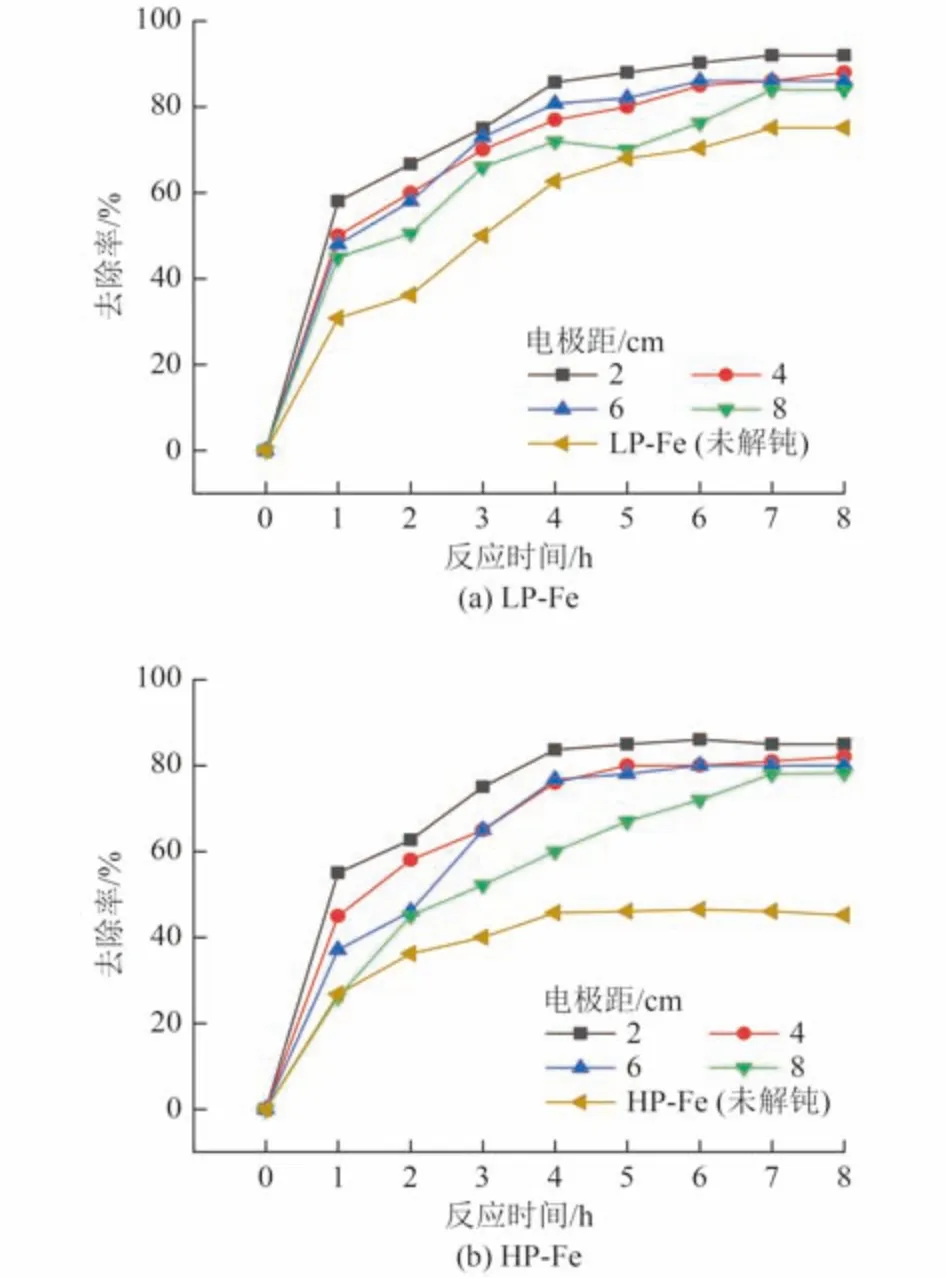
图7 不同钝化程度的P-Fe 在不同电极距下解钝后对Cr(Ⅵ)的去除率Fig.7 Cr(Ⅵ) removal rate of P-Fe with different degrees of passivation after depassivation at different electrode distances
2.4.1.3 电解时间的影响
不同钝化程度的P-Fe 在不同电解时间下解钝后对Cr(Ⅵ)的去除率变化如图8 所示。P-Fe 的解钝效果随电解时间增大而上升,电解时间对LP-Fe 的解钝效果影响较小,对HP-Fe 的解钝效果影响较大。以HP-Fe 为例,在电解电压为10 V、电极距为2 cm 时,电解时间从5 min 增至60 min 时,EP-Fe 在8 h 内对Cr(Ⅵ)的去除率从52.0%提升至93.2%,其恢复后的去除效果达到了未钝化前的90%以上。这是由于通电时间增加,会加大铁离子的溶出,使铁表面的沉淀进一步脱落,同时促进铁表面微孔的出现及加深。基于上述结果,选取电解时间为10~60 min作为正交试验。
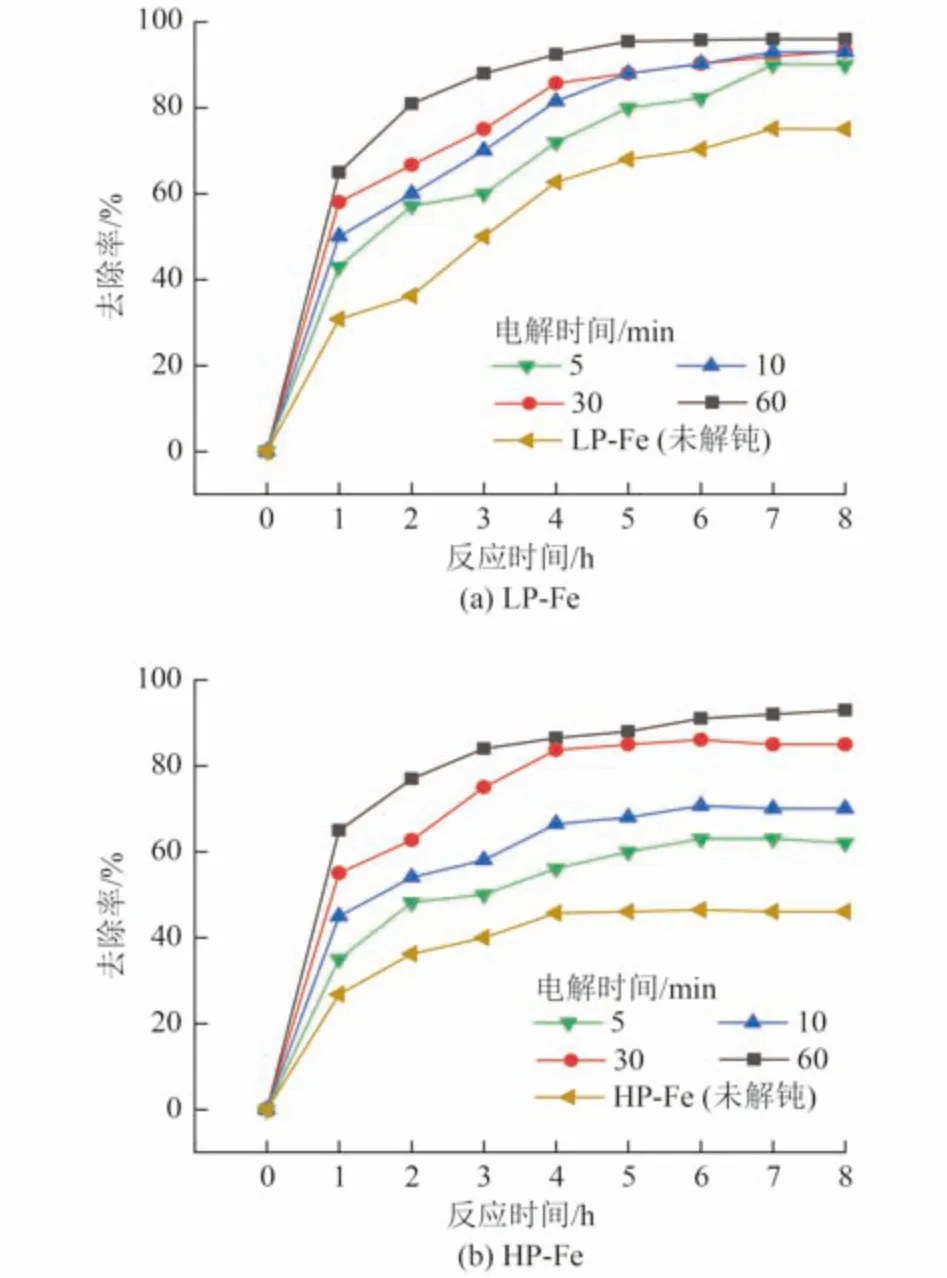
图8 不同钝化程度的P-Fe 在不同电解时间下解钝后对Cr(Ⅵ)的去除率Fig.8 Cr(Ⅵ) removal rate of P-Fe with different degrees of passivation after depassivation at different electrolysis times
2.4.2 正交试验
依据单因素试验结果,以HP-Fe 经过电化学法得到的EP-Fe 对Cr(Ⅵ)的去除率为指标,选取电解电压、电极距和电解时间3 个因素,设计正交试验(表3),研究电化学法解钝作用与电解电压(A)、电极距(B)、电解时间(C)的关系。
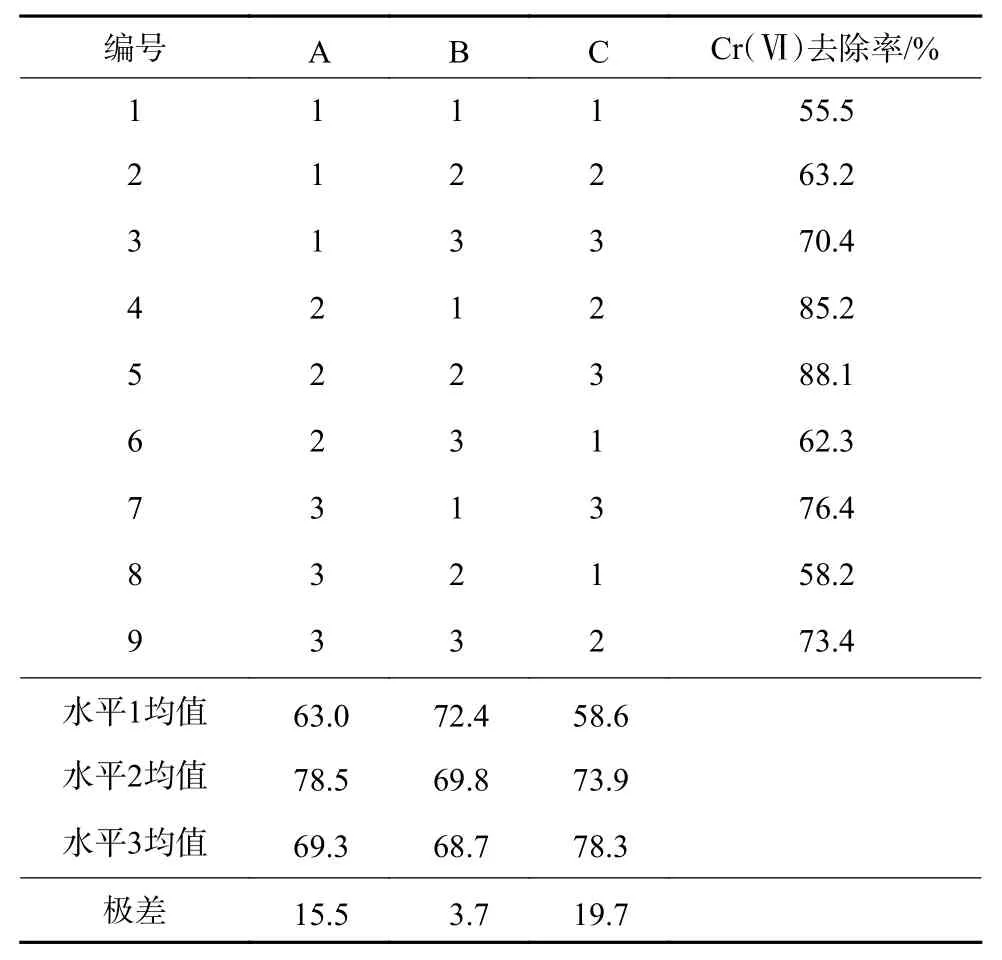
表3 正交试验设计及结果Table 3 Orthogonal test design and result table
由表3 极差数据可知,对于电化学法解钝效果的影响程度大小表现为电解时间>电解电压>电极距。根据每一因素试验结果的均值可以判断因素的最优水平,由表3 可知A2B1C3为解钝的最优试验条件,即电解电压为10 V,电极距为2 cm,电解时间为60 min。由表4 可知,电解电压和电解时间对解钝效果影响显著(P<0.05),电极距对解钝效果影响不显著,电解时间对解钝效果的影响强于电解电压。

表4 方差分析结果Table 4 Results of variance analysis
2.4.3 电化学解钝过程中电解液的总Cr、Cr(Ⅵ)、总Fe 浓度变化
以正交试验获取的最优条件对P-Fe 进行解钝,P-Fe 解钝过程中电解液的CTCr、CCr(Ⅵ)及CTFe变化如图9 所示。从图9 可以看出,溶液中CTCr和CCr(Ⅵ)有无电场的加入其变化趋势均相同,表现为前期先随着时间的增加而增大,后期变化不大;此外,CTCr和CCr(Ⅵ)在电解液中相差不大,这表明解钝过程不会促使P-Fe 表面的Cr(Ⅲ)沉淀溶解,而Cr(Ⅵ)的检出可能是因为铁屑表面吸附的Cr(Ⅵ)部分扩散至溶液中所致。CTFe随电解时间增加而上升,这是因为P-Fe 作为阳极的反应会促进铁离子的溶出,时间越长溶出的铁离子越多。根据计算,本试验解钝过程中Fe 的消耗量为0.03 mg,损失率低于0.1%,但值得注意的是解钝完成时溶液中CTFe达到GB/T 14848—2017《地下水质量标准》中Ⅲ类标准限值(0.3 mg/L),是否会产生新的环境污染问题还有待在实践中进一步论证。
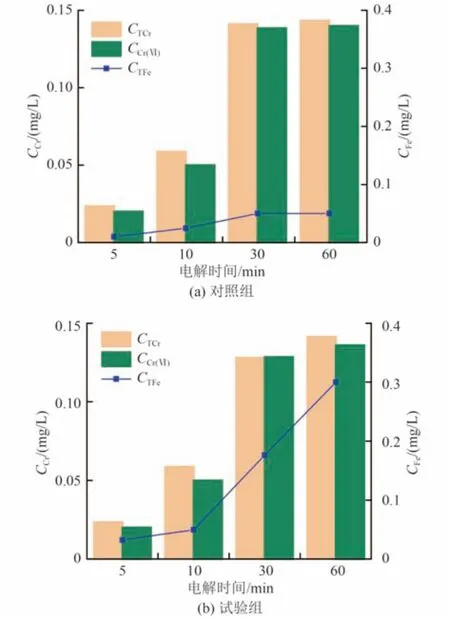
图9 P-Fe 解钝过程中电解液的CTCr、CCr(Ⅵ)及CTFe变化Fig.9 Variations of CTCr, CCr(Ⅵ)and CTFein the electrolyte during the process of P-Fe depassivation
对P-Fe 解钝时产生的沉淀进行XPS 分析,结果如图10 所示。通过XPS 全谱图〔图10(a)〕可知,产生的沉淀中含有C、O、Fe、Cr 4 种元素。由Fe2p 的分峰〔图10(b)〕可知,结合能在710.80 和723.60 eV 分别对应着Fe2O3和Fe3O4,由Cr2p 的分峰〔图10(c)〕可知,结合能在576.34 eV 对应着Cr(Ⅲ),这说明在电化学的作用下,P-Fe 表面形成的沉淀脱落,从而使Fe0活性得到了有效恢复。

图10 P-Fe 电化学解钝所产生沉淀的XPS 分析Fig.10 Analysis of precipitated XPS resulting from electrochemical depassivation of P-Fe
3 结论
(1)Fe0通过氧化还原反应及吸附共沉淀作用去除水体中Cr(Ⅵ),在此过程中,由于生成的铁氧化物及Fe、Cr 沉淀覆盖在Fe0表面,使Fe0反应活性降低,发生钝化效应。试验条件下,预处理后的Fe0与Cr(Ⅵ)反应,在反应时间为8 h 内,首次去除率可达90%以上,随着反应次数的增加,Cr(Ⅵ)去除率逐步降低,到第6 次时去除率只有45%左右。
(2)电极的影响试验结果显示,P-Fe 作为阳极时解钝效果最佳;XRD、SEM 和EDS 的分析表明,P-Fe 在电化学作用下因表面沉淀脱落使得其活性得到有效恢复。通过单因素试验和正交试验可知,解钝效果先随电解电压增大而上升,达到合适电压后,随电解电压增大而降低;解钝效果随电极距增大而降低,随电解时间增加而上升。3 个因素对Fe0解钝效果的影响程度为电解时间>电解电压>电极距。解钝最优条件:P-Fe 为阳极,电解电压为10 V,电解时间为60 min,电极距为2 cm。在此条件下对Cr(Ⅵ)的去除效果可恢复至未钝化前的90%以上。
(3)解钝过程中电解液的Cr 和Fe 浓度变化及产生的沉淀分析表明,运用电化学对P-Fe 进行解钝的过程中,不会促使钝化层中的Cr(Ⅲ)沉淀溶解,但会促使水体中CTFe上升,且CTFe随电解时间增大而上升。在合适的工况下,运用电化学方法对P-Fe 进行解钝,可以使其在重新获得较好活性的同时又不会损失大量的Fe。

