血清BNP、CysC水平与急性脑梗死患者溶栓治疗预后的关系分析
杜会丽
(许昌市人民医院急诊重症医学科,河南 许昌 461000)
急性脑梗死(Acute cerebral infarction,ACI)是脑血管疾病中最常见的一种类型,约占全部脑血管疾病的70%。据流行病学调查研究显示,ACI多发于中老年群体,且近年来由于中国社会老龄化程度加剧,中国ACI发病率也日益升高,严重威胁患者的生命安全[7]。静脉溶栓是临床治疗ACI较为常用的手段,主要通过注射溶栓、抗凝药物达到血管再通的目的。但由于ACI发病机制复杂,复发率、致残率较高,导致部分患者经静脉溶栓治疗后预后不甚理想。研究指出,机体发生ACI后,多种细胞因子产生,监测这些细胞因子水平变化可能对疾病预后具有重要意义[1]。因此,积极寻找相关指标为有效的评估预后至关重要。脑钠肽(Brain natriuretic peptide,BNP)多由心室肌细胞分泌,主要分布于人体大脑、心肺组织,有调节血容量及血压的作用,能参与机体多种生理反应。胱抑素C(Cystatin C,CysC)是一种半胱氨酸蛋白酶抑制剂,参与血栓形成、炎症反应过程。有研究指出,BNP联合CysC在急性心肌梗死介入治疗后短期预后中具有较好的预测价值[2]。
鉴于此,本研究旨在探讨血清BNP、CysC水平与ACI患者静脉溶栓治疗预后的相关性,从而为临床改善ACI患者预后提供指导。
1 资料与方法
1.1 一般资料
本研究经许昌市人民医院医学伦理委员会批准,选取医院2018年6月-2020年6月收治的70例ACI患者,患者家属已签署知情同意书。(1)纳入标准:①符合《中国急性缺血性脑卒中诊治指南2014》[3]中ACI诊断标准,且为首次发病;②均行阿替普酶静脉溶栓治疗;③美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)[4]<15分;④均抢救成功。(2)排除标准:①合并出血性疾病,如脑出血、消化道出血等;②肝肾功能障碍;③合并感染性、血液性疾病;④严重营养不良。70例ACI患者中,男42例,女28例;年龄48-72岁,平均年龄(60.12±3.86)岁;发病至入院时间1-6h,平均时间(2.63±0.74)h。
1.2 方法
1.2.1 预后评估方法及分组
于治疗后6 m,根据改良Barthel指数评定量表(Barthel Index,BI)[5]、改良Rankin量表(Modified rankin scale,mRS)[6]评估ACI患者预后情况。①BI指数共10项内容,包含洗澡、进食等,共100分,分值越高说明日常生活能力越好。②mRS量表共6级,记为0-5分,0分无症状;1分有症状,但无明显功能障碍;2分轻度残疾,但无需帮助可以照料自己日常生活;3分中度残疾,需部分帮助,但患者可以自行行走;4分中重度残疾,无法完成日常生活,无法独立行走;5分重度残疾,大小便失禁,完全依赖他人生活。
将患者中BI指数>60分、mRS评分≤2分判定为预后良好,纳入预后良好组;反之纳入预后不良组。
1.2.2 基线资料调查方法
由研究人员设计患者基线资料调查表,记录患者相关资料,包括年龄、性别(男、女)、发病至入院时间、溶栓前血压水平[采用动态血压监测仪(上海伊沐医疗器械有限公司,型号:ACF-D1)检测收缩压(Systolic blood pressure,SBP)、舒张压(Diastolic blood pressure,DBP)水平]。
1.2.3 实验室指标
于治疗前取患者空腹静脉血5 mL,以3000 r·min-1进行离心处理,以10 cm为离心半径,10 min后分离血清,采用免疫荧光定量法检测血清CysC水平,试剂盒购自基蛋生物科技股份有限公司;采用酶联免疫吸附法检测血清BNP水平,试剂盒购自上海莼试生物技术有限公司。
1.3 观察指标
(1)ACI患者静脉溶栓治疗的预后情况;(2)预后不良组和预后良好组的基线资料对比;(3)血清BNP、CysC水平与ACI患者静脉溶栓治疗预后关系分析。
1.4 统计学方法
2 结果
2.1 预后情况
70例ACI患者经静脉溶栓治疗后经评估,预后不良18例,占比为25.71%(18/70);预后良好52例,占比为74.29%(52/70)。
2.2 两组一般资料及实验室指标
预后不良组血清BNP、CysC水平高于预后良好组,差异有统计学意义(P<0.05);组间其他资料对比,差异无统计学意义(P>0.05)。见表1。
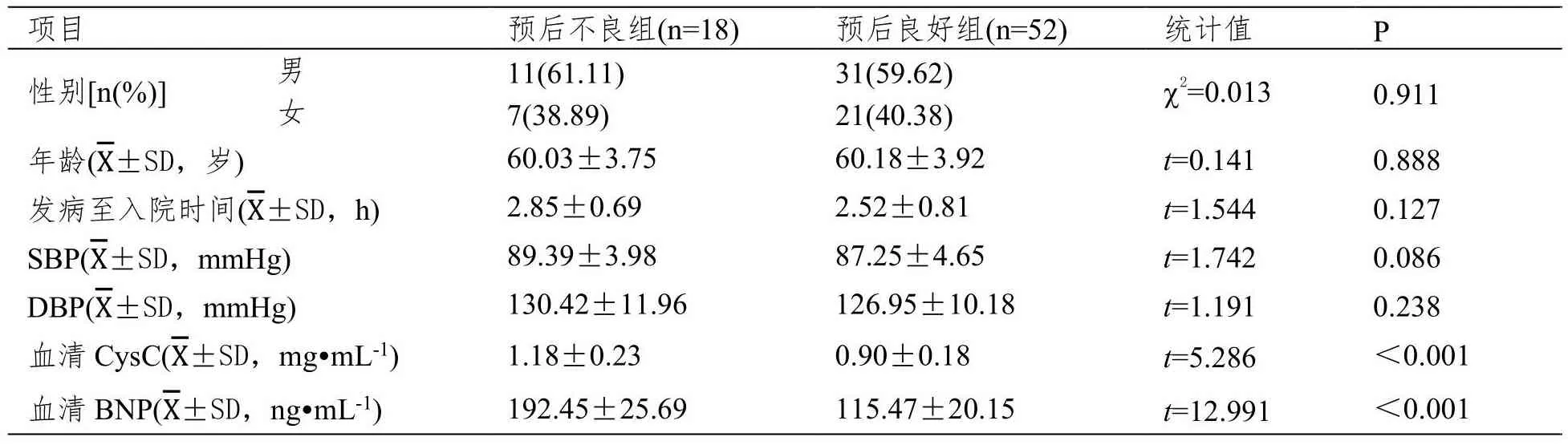
表1 两组一般资料及实验室指标比较
2.3 血清BNP、CysC水平与ACI患者静脉溶栓治疗预后关系的Logistic回归分析
将表1中经比较有明显差异的血清BNP、CysC水平作为自变量,ACI患者静脉溶栓治疗预后情况作为因变量(1=预后不良,0=预后良好),经Logistics回归分析结果显示,血清BNP、CysC水平高表达与ACI患者静脉溶栓治疗预后不良相关(OR>1,P<0.05)。见表2。

表2 血清BNP、CysC水平与ACI患者静脉溶栓治疗预后关系的Logistic回归分析
3 讨论
ACI是脑血管疾病中最常见的一种类型,多发于中老年群体,且近年来由于中国社会老龄化程度加剧,中国ACI发病率也日益升高,严重威胁患者的生命安全[7]。临床治疗ACI常采用静脉溶栓,静脉溶栓虽可再通血管,缓解ACI患者脑部缺血、缺氧症状,挽救患者生命,但患者会出现不同程度的后遗症,预后较差。本研究结果显示,70例ACI患者静脉溶栓后6 m预后不良发生率为25.71%,说明ACI患者静脉溶栓治疗后短期预后不良风险偏高。因此,需探寻有效的评估指标,以为制定针对性措施提供依据。BNP是利钠肽家族一员,可以参与机体调解血压、血容量等过程,还能降低体循环阻力,抑制交感神经兴奋。相关研究表明,BNP参与了ACI病理生理的演变过程,可能与神经内分泌的激活有关[8]。CysC是一种非糖基化碱性蛋白,由核细胞以恒定速度产生,可以抑制内源性蛋白半胱氨酸的活性。相关研究指出,CysC一方面能损伤血管内膜,促使血管壁基质重构,加重脑血管动脉粥样硬化,诱发ACI;另一方面,CysC会通过影响中性粒细胞迁移参与机体的炎症反应,损伤患者的神经细胞,造成神经系统功能受损,引发ACI[9]。由此推测,血清BNP、CysC水平可能与ACI患者静脉溶栓预后有一定的关系。本研究结果显示,预后不良组血清BNP、CysC水平高于预后良好组,且经Logistics回归分析结果显示,血清BNP、CysC水平高表达与ACI患者静脉溶栓治疗预后不良相关。原因在于,BNP能够抑制内皮素和血管内皮生长因子诱导的血管增值,导致血管阻力和血压降低;同时BNP分泌增多可引起机体水电解质紊乱,降低机体脑血流量,限制血液清除血栓能力,导致患者经静脉溶栓治疗后早期血管再通率降低,从而影响预后。CysC通过维持细胞外基质生成、降解,影响中性粒细胞生理活动,调节机体炎症反应,损伤脑神经细胞,加重神经系统损伤;同时CysC可损伤血管内膜,参与脑动脉粥样硬化过程,促进疾病进展,斑块脱落,形成血栓,引起脑动脉狭窄,损伤脑组织,导致预后不良[10]。故临床可通过检测溶栓前的血清BNP、CysC水平预测ACI患者静脉溶栓的预后情况,未来临床可针对预后不良风险较高的患者制定有效的干预措施以改善患者预后。此外,本研究仍存在不足之处,如血清BNP、CysC水平容易受到多种因素影响,预后量表评分容易受到人为因素影响,得出的数据可能存在一定偏倚,同时本研究未能对ACI患者血清BNP、CysC水平变化进行连续地观察,无法进一步阐明二者水平在ACI患者静脉溶栓治疗后的作用机制,未来仍需深入探究,以为后续临床提供可靠的数据支持。
综上所述,ACI患者静脉溶栓治疗预后与血清 BNP、CysC 的水平有关,且血清 BNP、CysC水平高表达可能导致ACI患者静脉溶栓治疗预后不良。

